Дані аналізу результатів комплексного лікування за різними алгоритмами 2158 хворих зі злоякісними пухлинами яєчника. Аналіз 5-річної виживаності пацієнток. Розмір залишкової пухлини після циторедуктивної операції як прогностичний чинник, що впливає на віддалені результати лікування.
В.С. Свінціцький, Л.І. Воробйова
Національний інститут раку МОЗ України, Київ, Україна
Резюме. Наведено аналіз результатів комплексного лікування за різними алгоритмами 2158 хворих зі злоякісними пухлинами яєчника. Аналіз 5-річної виживаності пацієнток показав, що найзначнішим прогностичним чинником, що впливає на віддалені результати лікування, є розмір залишкової пухлини після циторедуктивної операції.
Ключові слова: злоякісні пухлини яєчника, циторедуктивна операція, оптимальна циторедукція, комплексне лікування
ВСТУП
Злоякісні пухлини яєчника (ЗПЯ) належать до однієї з найважчих і невирішених проблем сучасної клінічної онкології. За даними Міжнародного агентства з вивчення раку питома вага ЗПЯ в онкологічній захворюваності жінок у всіх країнах світу приблизно однакова, але стандартизовані показники захворюваності різні: в Європі — 10 на 100 тис., в США — 8 (чорні) і 12 (білі) на 100 тис., в Росії — 10,2 на 100 тис. жіночого населення. За даними Національного канцер-реєстру в Україні показники захворюваності вищі — 14,5 на 100 тис. жіночого населення з тенденцією до зростання при стабільно високих показниках смертності — 8,1 на 100 тис.; > 2 тис. жінок помирає від ЗПЯ щорічно, в 2008 р. померла 2371 хвора. До 1 року після встановлення діагнозу помирає до 40% вперше виявлених хворих. Високі показники смертності пов’язані з тим, що ЗПЯ I–II ст. діагностуються лише у 20% вперше виявлених хворих. Сьогодні для лікування хворих з цією патологією широко застосовують хірургічне лікування, хіміотерапію (ХТ) та інші види лікування, а також їх різні комбінації [1–2].
Стандартне лікування хворих зі ЗПЯ сьогодні становлять: первинне циторедуктивне або проміжне циторедуктивне (після неоад’ювантної ХТ) втручання, 6 циклів платино- або платино-таксановмісної ХТ. Результати стандартного лікування: медіана до прогресування (МП) — 15–18 міс; медіана подовженості життя (МПЖ) — < 3 років; 5-річна виживаність: при I ст. — 85–90%; II ст. — 55–67%; III ст. — 11– 15%; IV ст. — 0–5% [3–4]. Комплексним лікуванням охоплюється в Україні тільки 65,7% хворих, його якість та віддалені результати ще далекі навіть до стандартного лікування, прийнятого в світі. Стандартні хірургічні втручання з приводу дисемінованих форм ЗПЯ дуже рідко приводять до бажаного результату, хоча таких операцій потребує значна кількість пацієнтів, а ефективність ХТ низька внаслідок розповсюдженості пухлинного процесу і хіміорезистентності значної кількості пухлин [5–6].
Зважаючи на те що основна маса хворих зі ЗПЯ — це занедбані стани, наше дослідження було спрямоване на вивчення ролі агресивних хірургічних втручань, неоад’ювантноїта ад’ювантноїХТ (НАХТ, АХТ), паліативного лікування та їх вливу на віддалені результати лікування [7–8].
Дослідження базується на ретроспективних і проспективних даних про 2158 хворих зі ЗПЯ, яких лікували у відділенні онкогінекології Національного інституту раку з 1998 по 2008 р.
Результати органозберігаючого лікування (ОЗЛ) хворих із початковими ЗПЯ.
З метою визначення критеріїв початкових ЗПЯ проведено аналіз симптомів клінічного перебігу та результатів лікування 189 пацієнток з ІА–ІВ ст. захворювання. Встановлено, що початкові ЗПЯ можуть бути ідентифіковані за наступних умов: обов’язкове адекватне хірургічне стадіювання з цитологічним дослідженням мазків-відбитків або гістологічним дослідженням біоптатів, одержаних з поверхні очеревини малого тазу і діафрагми, печінки, зачеревних лімфатичних вузлів; морфологічне (цито-, гістологічне) дослідження контрлатерального яєчника. Основою для визначення тактики лікування хворих із початковими ЗПЯ було хірургічне стадіювання. При хірургічному стадіюванні враховували всі можливі анатомічні зони метастазування.
Результатами дослідження встановлені чинники, які несприятливо впливають на клінічний перебіг ЗПЯ І ст.: це проростання і розрив капсули пухлини; асцит (р < 0,05); позитивні результати мазківвідбитків з поверхні очеревини малого тазу, діафрагми, печінки, заочеревних лімфатичних вузлів; з’єднання і зрощення з навколишніми тканинами і органами; розмір пухлини > 20 см, кістозносолідна і папілярна форма пухлини (р < 0,05).
ОЗЛ в об’ємі однобічної сальпінгоофоректомії та оментектомії було проведене 79 хворим юного та репродуктивного віку, що дозволило зберегти репродуктивну функцію, запобігти розвитку післякастраційного синдрому. Термін спостереження за хворими від 3 до 8 років без ознак рецидиву. На момент статистичної обробки данних дослідження (кінець 2008 р.) відомо, що 32 (40,5%) з цих пацієнток завагітніли, у 14 (17,7%) вагітність закінчилася пологами.
Роль первинних циторедуктивних операцій (ПЦРО).
Дослідженням встановлено, що у хворих із занедбаними формами ЗПЯ стандартні операції виконують майже у 60% і тільки у 1 з 10 пацієнток оптимально; комбіновані операції виконують у 24%, з яких оптимально більше ніж у 40%; розширені — у 5%, з яких оптимально у майже 60%. Загалом тільки 20% з усіх типів ПЦРО закінчуються оптимальним обсягом, майже 60% субоптимальним, > 20% неоптимальним. Оптимальні операції виконували в основному за рахунок стандартного обсягу та тазової перитонектомії (ТПЕ) (15% випадків) та комбінованих хірургічних втручань на товстому та тонкому кишечнику (17%). При розширених ПЦРО оптимальні циторедукції (ОЦР) в основному виконані за рахунок стандартної операції (33,3%) та тазової (18,5%), а у 7,4% селективної парааортальної лімфодисекції (ЛДС).
Встановлено, що агресивні комбіновані хірургічні втручання і ЛДС позитивно впливають на віддалені результати лікування: 5-річна виживаність хворих із занедбанимим формами ЗПЯ після виконання оптимальних ПЦРО — 41,4%, після субоптимальних та неоптимальних ПЦРО — відповідно 14,7 і 7,5% (р < 0,05). Основним чинником, що впливає на віддалені результати лікування пацієнтів із занедбаними ЗПЯ, є розмір залишкової пухлини після хірургічного втручання.
Ефективність ХТ у хворих після оптимальних ПЦРО висока незалежно від застосованих схем. Однак тривалість безрецидивного періоду різна залежно від схеми АХТ: 32 міс у хворих, що одержали ХТ за схемами СР/САР і 38 міс у хворих, що одержали платино-таксановмісну ХТ (р < 0,005).
Виявлено достовірний зв’язок між частотою виникнення рецидивів (Р) та радикальністю хірургічних втручань. Р виникають у 86% хворих після неоптимальних ПЦРО, у 47% після субоптимальних та у 26% після оптимальних впродовж перших 2 років після закінчення комплексного лікування (р < 0,05).
Видалення пухлини з резекцією сусідніх органів дозволяє виконати оптимальні операції у 41% хворих, що на 30% вище, ніж при виконанні стандартних операцій.
Відмова від виконання первинної ЦР через розповсюдженість пухлинного процесу в хворих зі ЗПЯ не є обґрунтованою. Використання методики ТПЕ І типу з ретроградною екстирпацією матки дозволяє зберегти цілісність товстого кишечнику, без зменшення принципів радикалізму в хворих із занедбаними ЗПЯ, збільшити кількість оптимальних операцій.
Роль проміжних циторедуктивних операцій (ПрЦРО).
Основна умова для успішного виконання первинної ЦР — це ретельність передопераційного обстеження хворих. Встановлені несприятливі чинники для проведення первинної ЦР, за наявності яких лікування розпочинали з НАХТ, після яких проводили ПрЦРО [9–10].
Пріоритетне значення для визначення ознак нерезектабельності пухлин при занедбаних ЗПЯ має променева діагностика (сонографія та комп’ютерна діагностика), що дає можливість не тільки встановити ці ознаки, а також за об’єктивними критеріями оцінити ефективність проведеної ХТ і таким чином визначити чутливість пухлини до цитостатиків [11–12]. Відносними протипоказаннями для ПЦРО є полісерозит, масивне пухлинне ураження очеревини і великого сальника з ознаками вростання в передню черевну стінку, множинні метастази (Мт) у парааортальних, паракавальних, клубових і пахових лімфатичних вузлах; Мт у паренхімах печінки і селезінки; інфільтративний характер зростання пухлини, про що свідчить зливна дисемінація по очеревині малого таза із зміною топографії органів малого таза; заочеревинна локалізація пухлин (з ознаками вростання в магістральні судини) [13–14].
Лікування у таких випадках починали з НАХТ після цитологічної верифікації діагнозу шляхом цитологічного дослідження пунктату із черевної порожнини. Проведення комбінованої НАХТ значно знижує темпи накопичення асциту і плевриту, збільшує резектабельність пухлини за рахунок її редукції, дає можливість частіше виконувати оптимальні хірургічні втручання у хворих із занедбаними ЗПЯ.
Сьогодні в онкогінекологічній літературі проходить активна дискусія про переваги та недоліки при лікуванні хворих зі ЗПЯ ендоабдомінального (е/а) способу введення хіміотерапевтичних засобів порівняно з внутрішньовенним (в/в). Основною перевагою е/а введення хіміопрепаратів у хворих із занедбаними ЗПЯ є зниження загального токсичного ефекту і суттєве підвищення концентрації (в 10 разів) цитостатиків у черевній порожнині [1]. Нами запроваджена методика комбінованої НАХТ (одночасне системне та е/а введення цитостатиків в стандартних дозах), ефективність якої підтверджено результатами морфометрії.
Лікувальний патоморфоз досліджений у 178 хворих із серозними епітеліальними ЗПЯ після різних методик НАХТ. Лікувальний патоморфоз, який визначено у 62,3% хворих свідчить про високу чутливість досліджених пухлин до застосованих цитостатиків. Значний лікувальний патоморфоз із розвитком девіталізаційних змін у пухлинах і зменшенням обсягу паренхіми найчастіше було зафіксовано у хворих, яким проводили комбіновану НАХТ (32,3% після застосування платиновмісних схем ХТ та 38,1% після платино-таксановмісних схем) порівняно з іншими способами введення (платиновмісні цитостатики в/в або е/а — 12,2 і 19,1% відповідно, р < 0,05).
Проведене дослідження підтверджує, що хворі, яким проведено НАХТ та ПрЦРО, незважаючи на досить несприятливий прогноз на початку лікування, після його закінчення мають перспективи щодо подальшого сприятливого перебігу хвороби.
Аналіз ролі ПрЦРО показав, що після НАХТ стандартні операції виконані майже у 55% хворих, у 19% з них оптимально, комбіновані операції — у 30%, з яких оптимально більше ніж у 48%; розширені — у 8,5%, з яких оптимально майже у 64%.
Оптимальні комбіновані хірургічні втручання після НАХТ виконані в основному за рахунок резекції ураженої пухлиною кишки та ТПЕ.
Загалом у 30% хворих ПрЦРО усіх типів закінчились оптимальним обсягом, що на 10% більше, ніж при ПЦРО.
Найбільш ефективними схемами НАХТ були платино-таксановмісні — у 46% хворих, які їх одержували, проведені оптимальні ПрЦРО; при платиновмісних схемах — у 35,5%, при інших схемах НАХТ — у 18,6% (р < 0,05). Показники 3-річної безрецидивної виживаності (БРВ) при використанні комбінованої НАХТ були значно вищими за такі у хворих контрольної та інших груп. Саме ці показники переконливо свідчать про переваги комбінованої НАХТ у хворих із розповсюдженими ЗПЯ.
Післяопераційні ускладнення були у 15,5% хворих: злукова кишкова непрохідність — у 6,3%, септичні — у 4,8%, тромбоемболія дрібних гілок легеневої артерії — у 0,8%, поліорганна недостатність — у 0,6%.
Ефективність АХТ хворих після оптимальних ПрЦРО була однаково високою незважаючи на застосування різних схем ХТ. Ефективність ХТ у хворих, яким проводили субоптимальні операції, була меншою (87–63%), а після неоптимальних операцій зменшувалася ще більше (73–54%). Однак тривалість БРВ і медіана виживаності (МВ) хворих були різними навіть при 100% ефективності АХТ. Так, у хворих, яким призначали ХТ за схемами СР/САР і таксановмісними схемами, ці показники були найвищими: тривалість БРВ відповідно 32,4 Ѓ} 7,1 і 37,9 Ѓ} 7,6 міс, МВ — 22,6 Ѓ} 4,9 і 27,1 Ѓ} 4,7 міс. В інших групах хворих (ВЕР та інші схеми), яким проводили оптимальні операції, показники були нижчими: тривалість БРВ 29,3 Ѓ} 7,4 і 18,5 Ѓ} 7,9 міс, МВ – 17,8 Ѓ} 5,3 і 15,6 Ѓ} 5,9 міс. (різниця між показниками у хворих після СР/САР і таксановмісної ХТ та іншими достовірна — р < 0,05). Зниження вказаних показників виживаності зумовлене розвитком Р, частота яких майже однакова незалежно від типу операцій (стандартні, комбіновані, розширені), але значно підвищується після паліативних операцій.
Лікування хворих з Р занедбаних стадій ЗПЯ. Лікування хворих з Р занедбаних стадій ЗПЯ залишається однією з найскладніших проблем онкогінекології. Це зумовлено значним розповсюдженням пухлини, ускладненнями первинного лікування, наявністю пухлинної інтоксикації. Крім того, вибір методу лікування Р ЗПЯ є досить тяжким завданням, що залежить від значної кількості прогностичних чинників.
Результати хірургічного лікування проаналізовані у 108 хворих з Р ЗПЯ. Встановлено, що тільки у 18,5% хворих виконані оптимальні ЦРО (без залишкової пухлини), у 21,3% — субоптимальні і у 60,2% — неоптимальні. При цьому операції з резекцією сусідніх органів виконані у 30,1% пацієнток. Первинні реконструктивні операції проведені у 16,3% пацієнток, а формування колостоми — у 7,1%.
На жаль, доводиться констатувати, що лише у 1/5 хворих, оперованих з приводу Р ЗПЯ, вдалося виконати оптимальну ЦРО (у всіх цих хворих виконані оментектомія, резекція товстого або тонкого кишечнику ТПЕ). Привертає увагу той факт, що ускладнення при повторних оперативних втручаннях відзначені частіше, ніж при виконанні ПЦРО або ПрЦРО, через злукові процеси після первинного хірургічного лікування, а також чисельні курси ХТ тощо.
При аналізі результатів ХТ хворих з Р ЗПЯ встановлені достовірні відмінності за рівнем пухлинної відповіді на терапію залежно від стадії процесу. При Р у хворих зі ЗПЯ IV ст. повна регресія пухлини досягнута у 16,1%, часткова регресія — у 9,7%, стабілізація — у 19,4%, прогресування на фоні лікування — у 54,8% пацієнток. При Р у пацієнтів зі ЗПЯ III ст. рівні відповіді були значно вищими і становили відповідно 24,2; 27,6; 37,9; 10,3% хворих. Аналіз 5-річної виживаності після лікування з приводу Р ЗПЯ показав, що вона не відрізняється у хворих після комплексного лікування (8,1%) і після тільки ХТ (8,2%). Більш детальний аналіз віддалених результатів комплексного лікування хворих з Р занедбаних ЗПЯ встановив, що тільки 32,7% хворих після неоптимальних ЦР живуть > 1 року, тоді як після субоптимальних ЦР 1-річна виживаність була досить високою — 79,6%. Але показники 2-річної виживаності значно погіршуються — 29,5%. Після проведення оптимальних ЦР показники 5-річної виживаності значно переважають такі у хворих як після неоптимальних і суб оптимальних ЦР, так і після застосування тільки ХТ. Так, 1-річна виживаність хворих з Р ЗПЯ після оптимальних ЦР становила 95,1%, а після ХТ другої лінії — 50,1%; 5-річна виживаність — 37,1 і 8,2% (р = 0,006) відповідно. Наведені дані вказують на значення хірургічних втручань у хворих з Р пухлинного процесу.
Загальний аналіз результатів обстеження та лікування хворих з Р ЗПЯ встановив, що незалежними прогностичними чинниками загальної виживаності хворих є ступінь радикальності первинної операції, час виникнення Р після первинного лікування, наявність асциту, наявність віддалених Мт, клінічна відповідь пухлини на цитостатичну терапію при лікуванні з приводу Р та радикальність повторної ЦРО. На сьогодні не існує такого методу ХТ, який би міг компенсувати недоліки хірургічного втручання. Післярецидивна виживаність залежить не від обсягу хірургічного втручання, а від ступеня оптимальності ЦР.
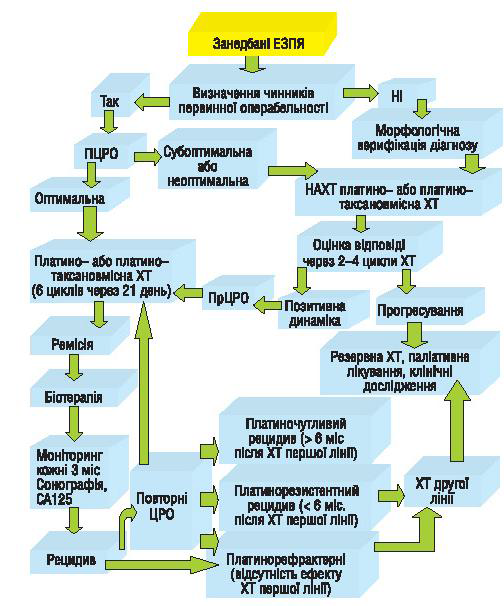
На підставі багаторічного досвіду лікування хворих із занедбаними ЗПЯ у відділенні онкогінекології Національного інституту раку, а також враховуючи результати проведеного дослідження запропонований алгоритм лікування цієї тяжкої категорії хворих (рис. 1), який може бути впроваджений в онкогінекологічні відділення онкологічних закладів України.
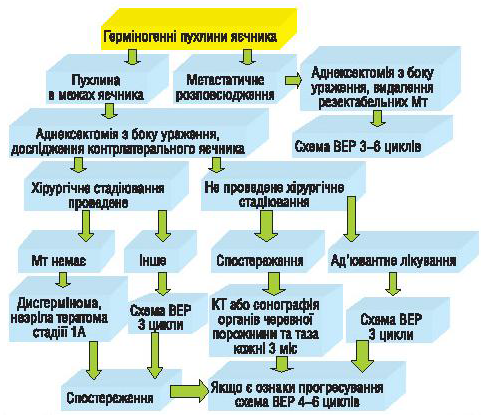
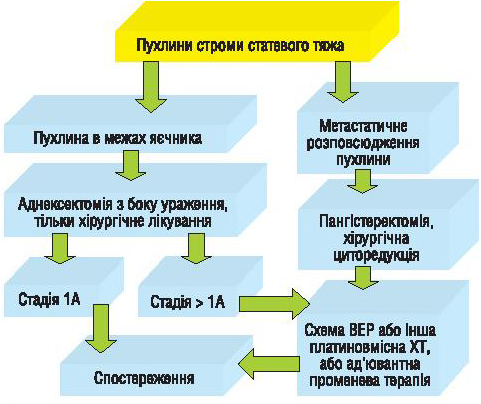
Нами проведено також аналіз віддалених результатів лікування хворих із неепітеліальними ЗПЯ, яких лікували у відділенні онкогінекології Національного інституту раку, та запропоновано алгоритми лікування пацієнтів із герміногенними ЗПЯ (рис. 2) і хворих із пухлинами строми статевого тяжа (рис. 3).
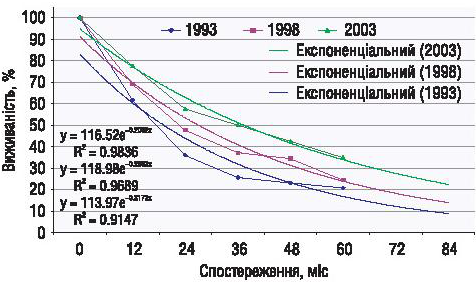
Ще одним доказом ефективності застосування нових технологій у лікуванні хворих із занедбаними ЗПЯ є показники виживаності хворих залежно від часу лікування. Так, 5-річна виживаність хворих із занедбаними ЗПЯ, які розпочали лікування в Національному інституті раку в 1993 р., становила 20,9%, у 1998 р. — 24,7%, у 2003 р. — 35,1% (p = 0,0015) (рис. 4).
ВИСНОВКИ
1. Діагностика початкових форм ЗПЯ ґрунтується на хірургічному стадіюванні, яке є базисним для встановлення ступеня розповсюдженості пухлинного процесу і визначення тактики лікування хворих. Критеріями початкових форм неопластичних процесів яєчника різного генезу є однобічне ураження яєчника, інтактна капсула яєчника, розміри яєчника у межах 10–20 см, відсутність пухлинних клітин в асцитній рідині або змивах з черевної порожнини. Це ґрунтується на результах 1-річної виживаності хворих, яка після органозберігаючих і стандартних операцій (пангістеректомія, надпіхвова ампутація матки з придатками) однакова і становить відповідно 98,1 Ѓ} 5,7 і 98,8 Ѓ} 5,1% (р > 0,05). 2–5-річна виживаність також не має достовірних відмінностей.
2. Показники виживаності хворих зі ЗПЯ залежать не лише від стадії процесу і гістологічного типу пухлини, а й від оптимальності циторедуктивної операції: після оптимальних (макроскопічно відсутня залишкова пухлина) ПЦРО > 5 років живуть 41,4% хворих, тоді як після неоптимальних операцій (при залишковій пухлині розмірами > 1 см ) лише 7,5%. Розмір залишкової пухлини після первинної операції є найважливішим фактором, що впливає на виживаність хворих із занедбаними формами ЗПЯ.
3. Методика комбінованої циторедуктивної операції (ретроперитонеальна пангістеректомія та ТПЕ І та ІІ типу), дає можливість видалити основну масу пухлини і матку єдиним блоком, що підвищує майже на 20% радикальність хірургічних втручань у хворих з розповсюдженими формами ЗПЯ. Мікроскопічні ознаки Мт-ураження сальника без його видимих макроскопічних змін у 15,8% хворих і наявність пухлинних клітин по лінії резекції сальника у 84,4% обґрунтовує необхідність оментектомії, що є однією з умов оптимальної ЦРО.
4. Комбінована АХТ (е/а + в/в введення цитостатиків) у хворих із занедбаними формами ЗПЯ ефективна після ЦРО незалежно від їх варіанту, що ґрунтується на достовірному збільшенні 5-річної виживаності хворих після запропонованого лікування (21,4 Ѓ} 4,2%) порівняно з такою після в/в АХТ (17,4 Ѓ} 4,9%), особливо при використанні платино-таксановмісної ХТ (p < 0,05).
ЛІТЕРАТУРА
1. Armstrong DK, Bundy B, Wenzel L, et al. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N Engl J Med 2006; 354: 34–43.
2. Ayhan A, Gultekin M, Taskiran C, et al. The role of secondary cytoreduction in the treatment of ovarian cancer: Hacettepe University experience. Am J Obstet Gynecol 2006; 194: 49–56.
3. Bristow RE, Tomacruz RS, Armstrong DK, et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a metaanalysis. J Clin Oncol 2002; 20: 1248–59.
4. Chambers SK. Systematic lymphadenectomy in advanced epithelial ovarian cancer: two decades of uncertainty resolved. J Natl Cancer Inst 2005; 97: 548–9.
5. Crawford SC, Vasey PA, Paul J, et al. Does aggressive surgery only benefit patients with less advanced ovarian cancer? Results from an international comparison within the SCOTROC-1 trial. J Clin Oncol 2005; 23: 8802–11.
6. Eisenkop SM, Friedman RL, Spirtos NM. The role of secondary cytoreductive surgery in the treatment of patients with recurrent epithelial ovarian carcinoma. Cancer 2000; 88: 144–53.
7. Hoskins WJ, McGuire WP, Brady MF, et al. The effect of diameter of largest residual disease on survival after primary cytoreductive surgery in patients with suboptimal residual epithelial ovarian carcinoma. Am J Obstet Gynecol 1994; 170: 974–80.
8. Morice P, Joulie F, Camatte S, et al. Lymph node involvement in epithelial ovarian cancer: Analysis of 276 pelvic and paraaortic lymphadenectomies and surgical implications. J Am Coll Surg 2003; 197 (2): 198–205.
9. Oksefjell H, Sandstad B, Trope C. The role of secondary cytoreduction in the management of the first relapse in epithelial ovarian cancer. Ann Oncol 2009; 20: 286–93.
10. Onda T, Matsumoto K, Shibata T, et al. Phase III trial of upfront debulking surgery versus neoadjuvant chemotherapy for stage III/IV ovarian, tubal and peritoneal cancers:
Japan Clinical Oncology Study JCOG00602. Jpn J Clin Oncol 2008; 38: 74–7.
11. Rose PG, Nerenstone S, Brady MF, et al. Secondary surgical cytoreduction for advanced ovarian carcinoma. N Engl J Med 2004; 351: 2489–97.
12. Winter WE, Maxwell GL, Tian C, et al. Tumor residual after surgical cytoreduction in prediction of clinical outcome in stage IV
epithelial ovarian cancer: A Gynecologic Oncology Group Study. J Clin Oncol 2008; 26: 83–9.
13. Блюменберг АГ. Диссеминированные формы рака яичников (лечение и факторы прогноза): [Дис . д-ра мед наук]. Москва, 2002.
14. Бохман ЯВ. Руководство по онкогинекологии. Санкт-Петербург: Фолиант, 2002. 540 с.











Комментировать