Детальное описание редкого случая лечения железисто-плоскоклеточного рака поперечной ободочной кишки, пошаговая документализация применяемых принципов лечения, подтвержденная фотографиями раковых клеток.
Шелыгин Ю.А., Ачкасов С.И., Рыбаков Е.Г., Майновская О.А., Сушков О.И., Запольский А.Г., ФГБУ ГНЦ колопроктологии Минздрава России
Плоскоклеточный (ПКР) и аденоплоскоклеточный (АПКР) рак толстой кишки встречаются крайне редко. Первые публикации, посвященные этим редким опухолям толстой кишки, относятся к 1907 и 1919 годам, причем в работе Herxheimer G. описана опухоль, состоящая из компонентов аденокарциномы и ПКР, а Schmidtmann M. Впервые описал ПКР толстой кишки в чистом виде [1,2].
Всего в литературе нам встретились описания чуть более 100 случаев, включая рак ободочной и прямой кишок. В основном, это единичные описания клинических случаев, либо небольшой серии пациентов за длительный срок наблюдения [3-7].
В ФГБУ «ГНЦ колопроктологии» за период с 1965 года зафиксировано всего 2 случая плоскоклеточного рака толстой кишки (1 случай – в сигмовидной кишке, 1 случай – в прямой кишке) и 2 случая аденоплоскоклеточного рака, локализованного в прямой кишке. Всем пациентам была выполнена радикальная операция, а в случае плоскоклеточного рака сигмовидной кишки лечение было дополнено проведением 6 курсов адъювантной химиотерапии. К сожалению, спустя 6 месяцев после операции все пациенты выпали из-под наблюдения.
Известно, что наиболее часто плоскоклеточный рак встречается либо в анальном канале, либо на перианальной коже. Частота встречаемости ПКР не превышает 0,25% среди всех злокачественных новообразований толстой кишки [8,9]. По мнению некоторых авторов, в патогенезе ПКР и АПКР большую роль играет вирус паппиломы человека (ВПЧ), в основном 16 и 18 типов [10,11]. В то же время Audeau A. и соавт. (2002) считают, что наличие ВПЧ не является причиной развития ПКР и АПКР, поскольку ВПЧ не выявлялся при исследовании первичной опухоли [12]. Ряд авторов описывает наличие плоскоклеточной метаплазии аденом толстой кишки, что, в свою очередь, может приводить к развитию ПКР и АПКР [13-16]. Описаны также случаи развития ПКР из ворсинчатой опухоли [17] и аденокарциномы [18]. Также возможно возникновение ПКР и АПКР на фоне хронического воспалительного процесса, хотя такие наблюдения остаются крайне редкими. Известно несколько случаев развития ПКР и АПКР на фоне язвенного колита [19,20] и даже в дивертикуле сигмовидной кишки [21].
Диагностика и лечение ПКР и АПКР толстой кишки не отличаются от диагностики и лечения аденокарцином. Основным методом лечения остается хирургический, если это касается ободочной кишки, и комбинированный, включающий химиолучевую терапию и операцию в зависимости от стадии опухоли, если поражена прямая кишка [22-24]. Эффективность адъювантной химиотерапии четко не определена, равно как и оценка отдаленных результатов лечения, учитывая редкий характер наблюдений. Проведенный анализ__литературы показывает высокий индекс метастатической активности ПКР и АПКР и более худший прогноз по сравнению с аденокарциномами. Мы представляем вашему вниманию редкое клиническое наблюдение аденоплоскоклеточного рака поперечной ободочной кишки, развившегося из ворсинчатой аденомы, с метастазами в печень.
Пациентка К., 47 лет поступила в ФГБУ «ГНЦ колопроктологии» МЗ РФ в июне 2014 года. Из анамнеза известно, что при колоноскопии была выявлена стенозирующая опухоль поперечной ободочной кишки на уровне средней её трети. Остаточный просвет кишки составлял 0,5 см. Гистологическое исследование биопсийного материала оказалось неинформативным.
При поступлении в ГНЦК состояние больной было удовлетворительное. Живот мягкий, безболезненный при пальпации. Стул регулярный, без патологических примесей, оформленный. При пальцевом исследовании прямой кишки, а также при ректоскопии до 18 см патологических изменений не выявлено. В лабораторных анализах крови и мочи изменений также выявлено не было.
Больной было проведено комплексное клинико-инструментальное обследование. При эзофагогастродуоденоскопии патологических изменений выявлено не было. При компьютерной томографии (КТ) грудной клетки патологических изменений также не было. При КТ органов брюшной полости и забрюшинного пространства в печени были выявлены следующие очаговые образования: в S2 – 1,2 см в диаметре, в S3 – 6×4,6 см, в S4a – два сливающихся узла 2,3 и 0,9 см и в S4b – 0,6 см. Кроме того, определялись слабо гиподенсивные образования 0,4-0,5 см в S2, S4, S1 у нижней полой вены.
В S2 киста 0,4 см. Других очаговых образований в печени не было. Опухоль средней трети поперечной ободочной кишки имела протяженность 5 см, суживала просвет до 0,9 см без признаков расширения проксимальных отделов. Лимфатические узлы не увеличены.
На основании данных клинико-инструментального обследования был установлен диагноз: рак средней трети поперечной ободочной кишки T3NxM1a.
9 июня 2014 года пациентка была в плановом порядке оперирована. При ревизии брюшной полости опухоль размерами 3×4 см располагалась в средней трети поперечной ободочной кишки, визуально не прорастала серозную оболочку.
Признаков нарушения кишечной проходимости, а также распространения опухолевого процесса по брюшине не было. Данные интраоперационного УЗИ печени не отличались от данных предоперационной КТ. Остальные органы, доступные ревизии, патологических изменений не содержали.
Лимфатические узлы не увеличены. Была выполнена комбинированная резекция поперечной ободочной кишки с формированием асцендо-десцендоанастомоза, холецистэктомия, левосторонняя гемигепатэктомия. Также, учитывая распространенность опухолевого процесса, операция была дополнена лимфаденэктомией из ворот печени.
Послеоперационный период протекал без осложнений. Пациентка была выписана на 15-е сутки в удовлетворительном состоянии.
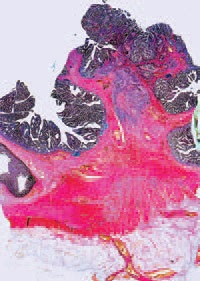
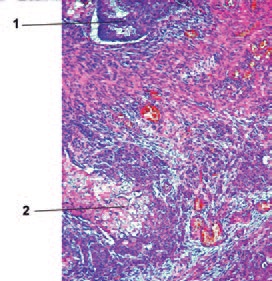
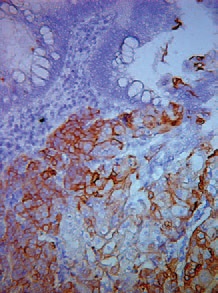
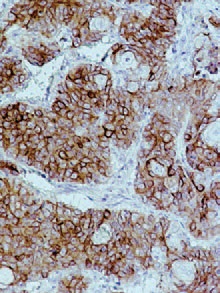
При гистологическом исследовании удаленного препарата, в толстой кишке определялась тубуло-виллезная аденома с очагами плоскоклеточной метаплазии, тяжелой дисплазии эпителия и карциномы in situ, крупным участком аденоплоскоклеточного рака с преобладанием солидного умеренно дифференцированного плоскоклеточного компонента. Опухоль врастала в подслизистый слой (pT1, sm3) с выраженной сосудистой инвазией, наличием опухолевых эмболов в венах брыжейки.
Края резекции кишки интактны. В пяти из 17 лимфатических узлов брыжейки ободочной кишки, а также в 4-х лимфатических узлах, удаленных из области чревного ствола, из 6-ти исследованных, обнаружены метастазы рака кишки с частичным замещением лимфоидной ткани, представленные плоскоклеточным компонентом. В печени во всех опухолевых узлах – метастазы рака кишки, преимущественно представленные плоскоклеточным компонентом, с врастанием в капсулу печени, крупные и мелкие портальные тракты, инвазией сосудов, периневральным ростом, множественными опухолевыми эмболами в сосудах портальных трактов и синусоидах, опухолевыми микроочагами в паренхиме печени, окружающей метастатические узлы.
В большом сальнике элементов опухолевого роста выявлено не было.
Пациентка была консультирована онкологом-химиотерапевтом. Учитывая агрессивный рост опухоли, рекомендовано проведение 1-й линии химиотерапии комплексом препаратов Платины в комбинации с блокаторами опухолевого ангиогенеза. Был начат курс химиотерапии.
Представленное клиническое наблюдение демонстрирует редкий случай аденоплоскоклеточного рака ободочной кишки, развившегося из ворсинчатой аденомы, агрессивность его течения и высокий индекс метастазирования опухоли такого гистологического строения.
ЛИТЕРАТУРА
- Herxheimer G. Ober heterologue cancriode. Pathol. Anat. – 1907. – 41:348-412.
- Schmidtmann M. Zur Kenntnis seltener Krebsformen. Arch. Pathol. – 1919. – 226:100-118.
- Frizelle F.A., Hobday K.S., Batts K.P. et al. Adenosquamous and squamous carcinoma of the colon and upper rectum: a clinical and histopathologic study. Colon Rectum. – 2001. – Mar;44(3):341-346.
- Gelas T., Peyrat P., Francois Y. et al. Primary squamous-cell carcinoma of the rectum: report of six cases and review of the literature. Colon Rectum. – 2002. – Nov;45(11):1535-1540.
- Yoshida J., Tohma H., Nagata T. et al. Squamous cell carcinoma of the splenic flexure of the colon: report of a case. Today. – 1994. – 24(1):75-79.
- Berkelhammer C.H., Baker A.L., Block G.E. et al. Humoral hypercalcemia complicating adenosquamous carcinoma of the proximal colon. Dig Dis Sci. – 1989. – Jan;34(1):142-147.
- Burgess P.A., Lupton E.W., Talbot I.C. Squamouscell carcinoma of the proximal colon: report of a case and review of the literature. Colon Rectum. – 1979. – May-Jun;22(4):241-244.
- Kang H., O’Connell J.B., Leonardi M.J. et al. Rare tumors of the colon and rectum: a national review. Int J. Colorectal Dis. – 2007. – Feb;22(2):183-189.
- Michelassi F., Mishlove L.A., Stipa F. et al. Squamous-cell carcinoma of the colon. Experience at the University of Chicago, review of the literature, report of two cases. Colon Rectum. – 1988. – Mar;31(3):228-235.
- Kong C.S., Welton M.L., Longacre T.A. Role of human papillomavirus in squamous cell metaplasiadysplasiacarcinoma of the rectum. J. Surg. Pathol. – 2007. – Jun;31(6):919-925.
- Bognar G., Istvan G., Ledniczky G. et al. Detection of human papilloma virus type 16 in squamous cell carcinoma of colon and its lymph node metastases. Magy Seb. – 2008. – Aug;61(4):225-229.
- Audeau A., Han H.W., Johnston M.J. et al. Does human papilloma virus have a role in squamous cell carcinoma of the colon and upper rectum? J. Surg. Oncol. – 2002. – Sep;28(6):657-660.
- Hayashi I., Katsuda Y., Muto Y. et al. Tubular adenoma with squamous metaplasia of the sigmoid colon: a case report. Surg. Oncol. – 1984. – Jun;26(2):130-134.
- Forouhar F. Neoplastic colonic polyp with extensive squamous metaplasia. Case report. Tumori. – 1984. – Feb;29;70(1):99-103.
- Kontozoglou T. Squamous metaplasia in colonic adenomata: report of two cases. Surg. Oncol. – 1985. – May;29(1):31-34.
- Cramer S.F., Velasco M.E., Whitlatch S.P. et al. Squamous differentiation in colorectal adenomas. Literature review, histogenesis, and clinical significance. Dis. Colon Rectum. – 1986. – Feb;29(2):87-91.
- Lundquest D.E., Marcus J.N., Thorson A.G. et al. Primary squamous cell carcinoma of the colon arising in a villous adenoma. Pathol. – 1988. – Mar;19(3):362-364.
- Fahim F., Al-Salamah S.M., Alam M.K. et al. Squamous cell carcinoma of colon and rectum. Saudi Med. J. – 2006. – Jun;27(6):874-877.
- Michelassi F., Montag A.G., Block G.E. Adenosquamous-cell carcinoma in ulcerative colitis. Report of a case. Dis. Colon Rectum. – 1988. – Apr;31(4):323-326.
- Suzuki T., Suzuki T., Shinoda M. et al. An autopsy case of colon cancer associated ulcerative colitis complicated focal squamous cell carcinoma. Nihon Shokakibyo Gakkai Zasshi. – 2007. – May;104(5):684-689.
- Blessing H., Baltisser I. Squamous epithelial carcinoma in a sigmoid diverticulum. Case report and review of the literature. Chirurg. – 1982. – Jun;53(6):377-381.
- Brammer R.D., Taniere P., Radley S. Metachronous squamous-cell carcinoma of the colon and treatment of rectal squamous carcinoma with chemoradiotherapy. Colorectal Dis. – 2009. – Feb;11(2):219-220.
- Tronconi M.C., Carnaghi C., Bignardi M. et al. Rectal squamous cell carcinoma treated with chemoradiotherapy: report of six cases. J. Colorectal Dis. – 2010. – Dec;25(12):1435-1439.
- Rasheed S., Yap T., Zia A. et al. Chemoradiotherapy: an alternative to surgery for squamous cell carcinoma of the rectum-report of six patients and literature review. Colorectal Dis. – 2007. – Feb;11(2):191-197.








Комментировать