Альтернативний метод гемотрансфузії донорської крові -гостра нормоволемічна гемодилюція, метод заготівлі автокрові безпосередньо перед хірургічним втручанням.
Поталов С.О., Воротинцев С.І., Голдовський Б.М., Серіков К.В., Курочкін Ю.Ф., Кафедра медицини невідкладних станів Запорізької медичної академії післядипломної освіти
Резюме
Оскільки трансфузія алогенної крові сполучена з високим ризиком імунних й інфекційних ускладнень, значними матеріальними витратами, у сучасній анестезіології широкий розвиток одержали кровозберігаючі технології. Одним з альтернативних методів гемотрансфузії донорської крові є гостра нормоволемічна гемодилюція — метод заготівлі автокрові безпосередньо перед хірургічним втручанням.
Ключові слова
Збереження крові, операції, крововтрата.
Вступ
Під час хірургічних втручань на органах черевної порожнини, що супроводжуються великою крововтратою, проблема заощадження крові завжди актуальна [1]. Оскільки трансфузія алогенної крові сполучена з високим ризиком імунних й інфекційних ускладнень, значними матеріальними витратами, у сучасній анестезіології широкий розвиток одержали кровозберігаючі технології [2]. Одним з альтернативних методів гемотрансфузії донорської крові є гостра нормоволемічна гемодилюція (ГНГ) — метод заготівлі автокрові безпосередньо перед хірургічним втручанням. Зниження ризику алогенних гемотрансфузій у результаті ГНГ при операціях із великою крововтратою піддається сумніву [3]. Невивчений вплив ГНГ на необхідність у гемотрансфузіях у найближчому післяопераційному періоді.
Резекція печінки, незважаючи на вдосконалення хірургічної техніки й анестезіологічного забезпечення, супроводжується високим ризиком масивної крововтрати (від 1500 до 10 000 мл) і потреби (від 30 до 60 %) у трансфузії більших обсягів донорської крові. Застосування ГНГ дозволяє зменшити потребу в алогенних гемотрансфузіях до 10 % [4].
Як метод заощадження крові ГНГ має унікальні переваги, що стосуються вартості, простоти, практичності. Безпечність методу ГНГ забезпечується кваліфікованим дотриманням технології й обліком протипоказань. Будь-яка супутня патологія, що обмежує функціональні резерви системи транспорту кисню, служить протипоказанням для використання ГНГ. Тому використання анестезіологічних технологій, що пригнічують гемодинамічні компенсаторні механізми, може обмежувати показання для ГНГ та її ефективність.
ГНГ приводить до збільшення серцевого індексу (^) і зменшення системного судинного опору (SVR). У результаті збільшення ^ не відбувається зменшення доставки кисню до тканин, пропорційного зменшення вмісту кисню в артеріальній крові [5]. Вплив методів тотальної внутрішньовенної анестезії (ТВВА) із застосуванням нових гіпнотиків (пропофолу, мідазоламу) й анальгетиків (суфентанілу, реміфентанілу й ін.) на компенсаторні механізми при ГНГ вивчено недостатньо.
Використання епідуральної анестезії (ЕА) як компонента анестезіологічного забезпечення розширених і травматичних операцій на органах грудної та черевної порожнини дозволяє підвищити ефективність антистресорного захисту під час операції, зменшити або виключити катаболічну фазу післяопераційного періоду, забезпечити ранню реконвалесценцію й реабілітацію. Однак зменшення симпатичного тонусу, відносна гіповолемія, що супроводжують ЕА, є причиною стриманого ставлення до цього методу при використанні ГНГ з метою заощадження крові.
Мета дослідження — оцінити вплив ГНГ на необхідність в алогенних гемотрансфузіях при операціях на органах черевної порожнини, що супроводжуються крововтратою понад 20 % об’єму циркулюючої крові (ОЦК). Оцінити вплив ТВВА та ЕА у сполученні з поверхневим внутрішньовенним наркозом на продуктивність серцево-судинної системи, кисневий режим при ГНГ у пацієнтів під час розширених резекцій печінки.
Матеріал та методи дослідження
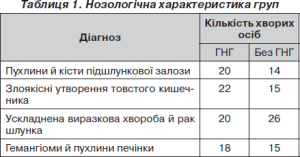
Ретроспективне нерандомізоване дослідження проведене на підставі оцінки у використанні алогенних гемотрансфузій у 150 хірургічних пацієнтів (79 чоловіків і 71 жінка) в інтраопераційному періоді й у найближчі три післяопераційні доби. Всім хворим виконувалися розширені хірургічні втручання з приводу пухлин шлунка, підшлункової залози, товстої кишки, під час яких зазначалась крововтрата більше 20 % ОЦК. Усі операції виконані в умовах спінально-епідуральної анестезії у сполученні з тотальною внутрішньовенною анестезією і штучною вентиляцією легень (ШВЛ). У дослідження не включали пацієнтів із доопераційним рівнем НЬ менше ніж 110 г/л. Залежно від використання ГНГ хворі були ретроспективно розділені на дві групи: основну (з ГНГ) групу (п = 80) і групу порівняння (п = 70) без ГНГ.
Протокол ГНГ
Перед індукцією анестезії здійснювали преінфузію кристалоїдних (1,5%-вий розчин натрію хлориду об’ємом 400 мл) і колоїдних (500 мл 4%-вого модифікованого желатину (гелофузин) або 6%-вого розчину гідроксіетилкрохмалю (рефортан)) плазмозамінників. Після індукції анестезії й початку ШВЛ із кубітальної вени ексфузували в пластикатні контейнери «Гемакон-500» 750-1500 мл крові хворого, проводячи одночасне відшкодування обсягу, що видаляється, 0,9%-вим розчином натрію хлориду в заздалегідь катетеризовану центральну вену під контролем центрального венозного тиску (ЦВТ). Обсяг ексфузії визначався цільовим гематокритом 26-28 % і в середньому становив 1050 ± 93 мл. Заповнення здійснювали кристалоїдами й плазмокоректорами у співвідношенні 1 : 1. Загальний обсяг гемодилюентів перевищував обсяг ексфузії в 1,5-2 рази й у середньому становив 1900 ± 308 мл. Протягом ГНГ і операції здійснювалася активна інфузійна підтримка ОЦК підігрітими до температури 37 °С сольовими й колоїдними плазмозамінниками з об’ємною швидкістю вливання, що забезпечує постійний рівень ЦВТ.
Об’єм крововтрати оцінювали гравіметричним методом. Контроль концентрації НЬ й Ж здійснювався кожні 15-20 хвилин, показники для відшкодування еритроцитарного обсягу в обох групах установлював лікар-анестезіолог, що проводив анестезію, керуючись як концентраційними показниками, так і критеріями тканинної гіпоксії, для усунення яких було необхідно відновлення глобулярного об’єму (ГО). Загальним правилом для реінфузії автокрові, заготовленої при ГНГ, було або зменшення гематокриту менше ніж 20 % на будьякому етапі операції або початок реінфузії збігався з остаточним хірургічним гемостазом. Показання для гемотрансфузії в післяопераційному періоді встановлювалися лікарями відділення інтенсивної терапії. Реєстрували частоту використання й обсяг алогенних гемотрансфузій під час операції й протягом перших трьох післяопераційних діб. Статистична обробка результатів проведена з використанням критерію І Відмінності при Р < 0,01 вважали вірогідними. Розраховували частоту використання алогенних гемотрансфузій в основній і контрольній групах, відносний ризик (ВР) і зниження відносного ризику (ЗВР) алогенної трансфузії. Вірогідність відмінностей якісних показників у групах оцінювали за допомогою критерію х2 (хі-квадрат).
Результати дослідження
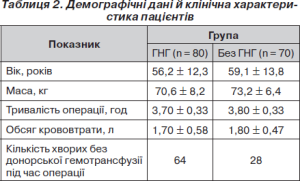
За віком, антропометричними даними, тривалістю оперативного втручання й обсягу крововтрати вірогідних розходжень між групами порівняння виявлено не було. Демографічні дані й клінічна характеристика пацієнтів наведені в табл. 2.
Обсяги крововтрати й інтраопераційної інфузійно-трансфузійної підтримки між групами практично не відрізнялися. У групі контролю для усунення дефіциту ГО 42 пацієнтам треба було переливання об’ємом від 200 до 1800 мл (у середньому 412 ± 120 мл) донорської еритроцитарної маси, а в інших 28 хворих концентрація гемоглобіну (НЬ) й гематокриту (Ж) при закінченні операції перевищували граничний критичний рівень. В основній групі у 64 пацієнтів для ліквідації небезпечного дефіциту ГО було достатньо трансфузії власної крові. Додаткові алогенні гемотрансфузії знадобилися 16 пацієнтам основної групи, тому що у зв’язку з триваючою крововтратою трансфузії автокрові не могли повністю ліквідувати дефіцит ГО. Середній обсяг алогенної гемотрансфузії протягом операції в цих хворих становив 275 ± 98 мл (від 200 до 950 мл). Розбіжності в середньому обсязі інтраопераційної алогенної гемотрансфузії між групами були вірогідні (Р < 0,01). Застосування ГНГ забезпечило зменшення потреби в донорських еритроцитах. Відносний ризик гомологічної гемотрансфузії становив 1,2, зниження відносного ризику 0,2 (х2 = 25,19; Р = 0,01). Кількість хворих, які одержали донорську еритроцитарну масу в післяопераційному періоді з метою корекції дефіциту ГО, також була меншою в основній групі, ніж у контрольній — 27 і 43, відповідно, ВР дорівнював 1,06, ЗВР був 0,06 (х2 = 10,41; Р = 0,01).
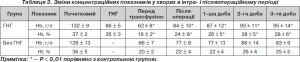
Як видно з табл. 3, початкові значення досліджуваних показників у групах вірогідно не відрізнялися між собою. Після проведення ГНГ в основній групі концентрації НЬ, Ж виявлялися в рамках цільових значень. На основному етапі операції й на висоті крововтрати у хворих основної групи ступінь анемізації був вірогідно більшим порівняно з контрольною групою. Після заповнення ГО автокров’ю й частково алогенними еритроцитами (у 20 % хворих) в основній групі концентрації НЬ й Ж вірогідно перевищували післяопераційні показники у хворих контрольної групи в середньому на 9 %. У хворих основної групи після інтраопераційного заповнення дефіциту ГО автокров’ю протягом перших трьох післяопераційних діб відзначалося прогресивне підвищення концентрації НЬ й Ж, при тому що в цій групі додаткові трансфузії донорської еритроцитної маси були проведені у 37 % хворих. У контрольній групі усунення анемії, незважаючи на більшу кількість хворих, які отримали алогенні гемотрансфузії (61 %), відбувалося уповільнено.
При аналізі не встановлено робіжностей у частоті післяопераційних кровотеч і повторних операцій між групами. Тривалість вазоактивної підтримки, швидкість діурезу й гідробаланс вірогідно не відрізнялися між групами. Однак тривалість післяопераційної ШВЛ була різною: у хворих контрольної групи тривалість ШВЛ становила в середньому 13,5 ± 2,6 години, що було тривалішим у середньому на 4 години порівняно з основною групою (9,50 ± 1,02 години; Р = 0,01).
При аналізі післяопераційної летальності й ускладнень вірогідних робіжностей у летальності між групами не встановлено. Відзначено невірогідне зменшення тривалості перебування хворих основної групи у стаціонарі (17 ± 3 дня) порівняно з контрольною групою (18 ± 4 дня).
Обговорення результатів
Гемодилюція при ГНГ дозволяє зменшити абсолютну кількість НЬ і формених елементів, що втрачаються під час хірургічної крововтрати. У нашому дослідженні це було підтверджено тим, що при більш низькому рівні НЬ після ГНГ на висоті кровотечі під час операції при однакових обсягах крововтрати концентрація НЬ між групами практично не відрізнялася. Дискусія з приводу впливу кровозберігаючих технологій на частоту або ризик алогенної гемотрансфузії триває на сторінках медичних видань багато років. Оцінюючи фактори, пов’язані з гомологічною гемотрансфузією при операціях на колінному суглобі, A. Lienhart і співавтори (2002) дійшли висновку, що тільки передопераційна донація крові зменшує потребу в донорських еритроцитах. Інші технології ГНГ, автотрансфузія крові за допомогою селл-сейвера не справляли істотного впливу на скорочення гомологічних трансфузій. В іншому рандомізованому дослідженні, що порівнює ГНГ і передопераційну донацію крові, установлена рівна ефективність порівнюваних стратегій за зниженням ризику гомологічної трансфузії при артропластиках при значно меншій (у 4,5 раза) вартості ГНГ. У нашому дослідженні встановлено, що повернення автокрові після остаточного хірургічного гемостазу дозволяло відновити ефективний ГО в більшості хворих основної групи і зменшити відносний ризик інтраопераційної алогенної трансфузії на 20 % порівняно з контрольною групою.
Підвищення потреби в післяопераційних гемотрансфузіях у порівняльних групах можна пояснити двома причинами: 1) триваючим депонуванням і розпадом алогенних еритроцитів, перелитих під час операції; 2) консервативним підходом до визначення показань до гемотрансфузії, тобто прагненням лікарів підвищити концентрацію Hb у хворого понад 80-100 г/л. Проте протягом перших трьох післяопераційних діб потреба в трансфузії алогенних еритроцитів в основній групі була меншою в 1,3 раза порівняно з контрольною групою.
Додатковим позитивним ефектом застосування ГНГ ми вважаємо скорочення тривалості післяопераційної ШВЛ, що можна пов’язати із кращою компенсацією анемії й підтримкою транспорту кисню в основній групі.
Висновки
- Проведення ГНГ при планових операціях на органах черевної порожнини, що супроводжуються великою крововтратою, зменшує відносний ризик трансфузій алогенної еритроцитарної маси під час операції й у ранньому післяопераційному періоді.
- Застосування ГНГ дозволяє зменшити обсяг інтраопераційної гомологічної гемотрансфузії.
Литература
- Goodnough L.T., Brecher M.E., Katner M.H. et al. Transfusion medicine: First of two parts. Blood transfusion // N. Engl. J. Med. — 1999. — Vol. 340. — P. 438-447.
- Hebert P.C., Wells G., Blajchman M.A. et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care: Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trial Group // N. Engl. J. Med. — 1999. — Vol. 340. — P. 409417.
- Vincent J.L., Baron J.F., Reinhart K. et al. Anemia and blood transfusion in critically ill patients // JAMA. — 2000. — Vol. 288. — Р. 1499-1507.
- Spahn D.R., Casutt M. Eliminating blood transfusion: New aspects and perspectives // Anesthesiology. — 2000. — Vol. 93. — Р. 242-255.
- Lienhart A., Pequignot F., Auroy Y. еtal. Facteurs associes a la strategie transfusionnelle au cours des anesthesies programmees pour arthroplastie de hanche ou de genou en France // Апп. Гг. АпевШ. Реапіт. — 2002. — Уоі. 21 (1). — Р. 4-13.





Комментировать