Заболевания щитовидной железы у детей. Этиология, патогенез, клиническая картина, диагностика и лечение.
Тиреотоксична криза
МКХ-10: е05.5
Общая информация
Найнебезпечіше для життя хворого ускладнення ДТЗ – тиреотоксична криза.
Етіологія
Тиреотоксична криза може бути викликана різними причинами, найчастішими з яких є проведення резекції ЩЗ на тлі некомпенсованого ДТЗ або якщо в доі післяопераційному періоді не користуються глюкокортикоїдами. Причинами кризи можуть бути відміна або неадекватне проведення антитиреоїдної терапії, інфекційні захворювання, психічна травма, тяжке фізичне навантаження, оперативне втручання поза щитовидною залозою.
Патогенез
В основі патогенезу тиреотоксичної кризи лежить різке підвищення виділення в кров тиреоїдних гормонів. На цьому тлі збільшуються прояви відносної надниркової недостатності, тому що тиреоїдні гормони підсилюють метаболізм кортизолу. На фоні кризи зростає потреба периферичних тканин у глюкокортикоїдах, що підсилює відносну надниркову недостатність.
Клиническая картина
Криза, як правило, розвивається протягом кількох годин, рідше – поступово, протягом декількох днів. Наростає збудженість, тахікардія, з’являється аритмія, підвищується температура, систолічний АТ підвищується, а діастолічний – знижується, наростають в подальшому ознаки серцевої недостатності. У хворих відзначаються безсоння, блювання, пітливість, відчуття страху, різкий головний біль, гіперемія обличчя, олігурія, часте дихання, задуха, рухлива неспокійність, яка змінюється адинамією, апатією, аж до коматозного стану.
Лечение
Лікування тиреотоксичної кризи грунтується на гальмуванні синтезу і периферійної конверсії тиреоїдних гормонів, а також – на пригніченні адренергічних реакцій, спричинених тиреоїдними гормонами. При виборі антитиреоїдних препаратів перевагу віддають пропилтіоурацилу, тому що він гальмує периферійне перетворення Т4 в Т3. Тиреостатики вводяться перорально через зонд: пропіціл – в дозі 300-400 мг; тіамазол – в дозі 30-40 мг кожні 4-6 години. Одночасно проводять інфузійну терапію глюкозосольовими розчинами з розрахунку 1500 мл/м2 поверхні тіла + 60 мл/кг для дітей до 10 років і 1500 мл/м2 поверхні тіла + 50 мл/кг для дітей, старших 10 років. Після введення антитиреоїдних препаратів починають введення йодидів з метою блокування виходу тиреоїдних гормонів з щитоподібної залози в кров: 15-30 крапель 1% розчину Люголя вводять кожні 6 годин. Обов’язкове використання глюкокортикоїдів: гідрокортизон вводять в дозі 2 мг/кг кожні 6 год. З метою зменшення адренергічних ефектів тиреоїдних гормонів використовують β-адреноблокатори (анаприлін) з розрахунку 1 мг/кг на добу перорально.
Аутоімунний тиреоїдит
МКХ-10: е06.3
Общая информация
Аутоімунний тиреоїдит (АІТ) (зоб Хашимото, лімфоцитарний тиреоїдит) – захворювання, в основі якого лежить аутоімунний процес, що призводить до зменшення функціонуючої тканини щитоподібної залози.
Вперше це захворювання було описане в 1912 році Х. Хашимото.
Аутоімунний тиреоїдит є найчастішим із усіх захворювань щитоподібної залози. Його поширеність, за даними різних авторів, серед дитячого населення складає від 0,1 до 1,2%.
Захворювання частіше трапляється в дівчаток у період статевого дозрівання. Вкрай рідко маніфестація захворювання спостерігається у віці до 4 років. Серед дітей, які страждають на цукровий діабет 1 типу, аутоімунний тиреоїдит виявляють у 30-40% хворих.
Етіологія
Аутоімунний тиреоїдит може розвинутися внаслідок вірусної інфекції, травми, інтоксикації, дії радіоактивного йоду, тиреотоксикозу, операції на щитоподібній залозі, а також генетичної неповноцінності базальних мембран клітин.
Захворювання може розвиватися на тлі генетично детермінованого дефекту імунної відповіді, яка призводить до Т-лімфоцитарної агресії проти власних тиреоцитів, що закінчується їх руйнуванням. Генетична зумовленість появи АІТ підтверджується асоціацією його з антигенами системи HLA класу ІІ, розташованими на 6 хромосомі, такими як HLA-В8, HLA-DR3 і HLA-DR5.
АІТ має тенденцію проявлятися у вигляді сімейних форм. Крім того, спостерігається поєднання АІТ в межах однієї сім’ї з іншими аутоімунними захворюваннями – з інсулінозалежним цукровим діабетом, вітіліго, ревматоїдним артритом, аутоімунним гепатитом. АІТ часто поєднується з аутоімунними і полігландулярними синдромами.
Патогенез
В основі патогенезу захворювання лежать аутоімунні, імунологічні порушення.
Доведено, що Т-лімфоцити у пацієнтів з АІТ сенсибілізовані відносно антигенів на мембрані тиреоцитів. Теорії патогенезу передбачають наявність органоспецифічних мутацій в генах, що відповідають за імунорегуляцію. Порушення відноситься як до клітинного, так і до гуморального імунітету.
В нормі мутантні аутоагресивні клони Т-лімфоцитів розпізнаються імунною системою і знищуються. Імунні порушення призводять до аутоімунної агресії і неадекватної реакції на інфекцію, що призводить до органоспецифічного запалення.
Патогенетичне значення різних антитиреоїдних антитіл неоднакове. Антитіла до тиреоглобуліну мають найменше значення в порушенні структури щитоподібної залози і рідко проявляють цитотоксичність. Антитіла до тиреоїдної пероксидази здатні викликати цитотоксичні зміни в структурних елементах фолікулів щитоподібної залози.
Поряд з утворенням вищезазначених аутоантитіл проходить активування утворення антитіл до рецептору ТТГ. Утворюються як тиреоїдстимулюючі антитіла, так і ТТГ-блокуючі антитіла. Такі антитіла призводять до розвитку атрофічного АІТ і гіпотиреозу. Ці антитіла стимулюють і пригнічують ріст щитоподібної залози. Так, у хворих з гіпертрофічною формою АІТ виявлені імуноглобуліни, що стимулюють збільшення щитоподібної залози. При атрофічній формі АІТ – антитіла, що пригнічують ріст щитоподібної залози.
Клиническая картина
Перебіг хвороби тривалий, у фазі еутиреозу – безсимптомний. У дітей в більшості випадків спостерігається збільшення щитоподібної залози за відсутності клінічних проявів порушень її функції. При гіпертрофічній формі визначається зоб.
При пальпації залоза м’яка або еластичної консистенції із зернистою поверхнею. На пізніх стадіях тканина залози стає компактною (щільною), поверхня – бугристою. Іноді можна пальпувати кілька вузлових утворень. У деяких хворих з АІТ в дебюті захворювання можлива наявність тиреотоксикозу. Як правило, проявляється субклінічним тиреотоксикозом (ізольоване зниження рівня ТТГ при нормальному Т4 і Т3). Хворі скаржаться на слабкість, нездужання, дратівливість. Дуже рідко захворювання в початковій стадії проявляється дисфагією, біллю у горлі, захриплістю, відчуттям тиску в ділянці шиї.
При атрофічній формі АІТ щитоподібна залоза при пальпації не збільшена або пальпується у вигляді щільного, невеликого за об’ємом утворення.
Классификая и примеры формулировки диагноза
Загальноприйняте виділення наступних клінікоморфологічних варіантів хронічних тиреоїдитів:
- гіпертрофічний тиреоїдит (зоб Хашимото);
- атрофічний тиреоїдит або первинна мікседема;
- фіброзно-інвазивний тиреоїдит (зоб Ріделя);
- післяпологовий тиреоїдит.
На підставі морфологічних досліджень тканини ЩЗ виділяють три основні морфологічні варіанти аутоімунного тиреоїдиту:
- класичний (зоб Хашимото);
- хронічний лімфоматозний тиреоїдит – значна лімфоїдна інфільтрація;
- хронічний лімфоматозний струміт – лімфоїдна інфільтрація на тлі тиреоїдної тканини, зміненої зобом.
Патоморфологи виділяють дифузну, осередкову, перитуморальну та ювенільну форми аутоімунного тиреоїдиту.
Приклад формулювання діагнозу
Аутоімунний тиреоїдит, гіпертрофічна форма, дифузний зоб ІІ ст., гіпотиреоз легкого ступеня тяжкості у стані компенсації.
Диагностика
В основному, діагноз аутоімунного тиреоїдиту базується на клінічній картині, даних лабораторних досліджень, ультразвуковій діагностиці, тонкоголковій пункційній біопсії.
Лабораторна діагностика аутоімунного тиреоїдиту включає визначення тиреоїдних гормонів (Т3 вільного і Т4 вільного) та рівня ТТГ в сироватці крові.
Підвищення рівня ТТГ в сироватці крові є найбільш ранньою ознакою гіпотиреозу, коли ще відсутні його клінічні симптоми й ознаки. Наявність клінічних ознак, підвищення рівня ТТГ при зниженій концентрації Т4 вільного говорить про маніфестний або клінічний гіпотиреоз.
Лабораторними маркерами АІТ є антитіла до щитоподібної залози (антитіла до тиреоїдної пероксидази, антитіла до тиреоглобуліну, антитіла до мікросомальної фракції епітелію щитоподібної залози). Наявність високих титрів антитіл в крові є важливою ознакою розвитку аутоімунного тиреоїдиту. В діагностиці АІТ цінним є УЗД ЩЗ. УЗД дозволяє визначити збільшення або зменшення розмірів (об’єм) залози, неоднорідність структури, зниження ехогенності, наявність вузлоутворень.
Як допоміжний метод діагностики виконують тонкоголкову аспіраційну біопсію. При цитологічному дослідженні аспірату при тонкоголковій аспіраційній біопсії в пунктаті виявляють велику кількість лімфоїдних елементів різного ступеня зрілості, плазматичні клітини, мікрофаги, а також характерна наявність гігантських еозинофільних клітин.
Критерії діагностики захворювання
Діагностичними критеріями АІТ у дітей і підлітків слід вважати сукупність наступних ознак:
- збільшення об’єму щитоподібної залози більше 97 перцентілі нормативних значень для даного віку і статі (за нормативом ВООЗ 2001 р. – з розрахунку на площу поверхні тіла);
- наявність антитіл до тиреоїдної пероксидази або макросомальної фракції;
- характерні ультразвукові зміни структури щитоподібної залози.
Зниження функції щитоподібної залози у дітей і підлітків з АІТ не є основним симптомом захворювання і не може слугувати його основним діагностичним критерієм. Проте наявність набутого первинного гіпотиреозу у дітей слід розцінювати як результат АІТ (атрофічної або гіпертрофічної форми).
Диференційна діагностика
Аутоімунний тиреоїдит необхідно диференціювати з дифузним токсичним зобом, карциномою щитоподібної залози, фіброзним тиреоїдитом Ріделя.
Також потрібно пам’ятати, що АІТ часто поєднується з ЦД 1 типу, хронічною наднирковою недостатністю, ідіопатичним гіпотиреозом, вітіліго, ревматоїдним артритом, хронічним активним гепатитом, синдромом Шерешевського-Тернера, синдромом Дауна.
Лечение
Специфічної терапії аутоімунного тиреоїдиту не існує. При явищах гіпотиреозу рекомендують препарати гормонів щитоподібної залози (L-тироксин). Мета лікування – усунення гіпотиреозу і зменшення зобу великих розмірів.
Доза тироксину у дітей становить 3-4 мкг/кг маси тіла на добу. При адекватній замісній терапії, поряд зі зменшенням розмірів щитоподібної залози та нормалізацією рівня ТТГ, відбувається зниження титру антитиреоїдних антитіл (до тиреоглобуліну і тиреоїдної пероксидази).
Включення до комплексного лікування аутоімунного тиреоїдиту альфа-ліпоєвої кислоти суттєво знижує рівень антитиреоїдних антитіл. Хворим з АІТ, що супроводжується синдромом гіпотиреозу, доцільно призначати препарати берлітіон, тіогамма у дозі 600 мг/добу протягом 3-4 міс. перорально. Окрім того, призначаються імуномодулятори у вікових дозах. В комплекс лікувальних заходів також включають гепатопротекторні препарати (есенціале, енерлів) по 1 капсулі 3 рази на день. Тривалість курсу – 3 місяці.
Критерій ефективності лікування – досягнення нормального рівня ТТГ.
Хірургічне лікування показано тільки при великих розмірах зобу із стисканням і зміщенням органів шиї, обструкції дихальних шляхів, у разі підозри на злоякісне новоутворення ЩЗ.
Рекомендації
Всім дітям із встановленим діагнозом або вірогідним діагнозом АІТ необхідно перебувати під постійним диспансерним наглядом.
Гормональне дослідження (Т4 вільного і ТТГ) слід проводити 1 раз на 6 міс. у пацієнтів, які не отримують терапію L-тироксином. У пацієнтів, які отримують терапію, слід контролювати лише рівень ТТГ 1 раз на 6 міс.
Контрольне ультразвукове дослідження ЩЗ слід проводити 1 раз на 12 міс. У дітей з вірогідним діагнозом АІТ за відсутності антитіл при первинному обстеженні показано повторне їх визначення протягом першого і другого року спостереження.
Юридические аспекты
Перед проведенням конкретних діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Вузлові форми зобу
МКХ-10: е04.1, е04.2
Общая информация
Вузловий і багатовузловий зоб – збірне клінічне поняття, яке об’єднує всі утворення щитоподібної залози (ЩЗ), що мають різні морфологічні характеристики.
Серед дитячого населення вузли у ЩЗ спостерігаються в 4-6% випадків патології щитоподібної залози. На долю вузлового колоїдного зобу припадає 60-75% всіх вузлових утворень у щитоподібній залозі.
Етіологія
В етіології цього захворювання можуть лежати наступні причини: нестача йоду, порушення всмоктування йоду в кишечнику, однотипове харчування з переважанням вживання в їжу продуктів із зобогенним ефектом, застосування медикаментів і діагностичних препаратів із зобогенним ефектом, дефекти ферментів, що беруть участь в синтезі й метаболізмі тиреоїдних гормонів, та вплив радіації.
Патогенез
Головною ланкою патогенезу вузлового зобу є відносна нестача тиреоїдних гормонів, що спостерігається на тлі йодного дефіциту; вона призводить до гіперпродукції ТТГ гіпофізом із наступною проліферацією тиреоцитів та накопиченням колоїду.
З іншого боку, формування багатовузлового зобу в регіонах із помірним йодним дефіцитом відбувається на тлі нормального рівня ТТГ. В цих областях найважливішим патогенетичним чинником, мабуть, є інтратиреоїдне порушення йодного обміну.
Клиническая картина
Скарги дітей з вузловими утвореннями в ЩЗ мають неспецифічний характер. Пацієнти з вузловим зобом невеликих розмірів взагалі не скаржаться. Найчастіше діти з вузловим зобом скаржаться на відчуття слабкості, втомлюваності, головний біль. При великих розмірах вузлів з’являються симптоми компресії органів шиї, що проявляються скаргами на відчуття стиснення в ділянці шиї, передусім у лежачому положенні, утруднене дихання, порушення при ковтанні.
Классификая и примеры формулировки диагноза
Класифікація
Класифікація вузлових форм захворювань щитоподібної залози (ВООЗ, 1988)
1. Епітеліальні пухлини:
а) доброякісні: фолікулярна аденома (ембріональна аденома, мікрофолікулярна аденома, фетальна аденома); папілярна цистаденома;
Варіанти: оксифільноклітинна аденома (із клітин Гюртле-Ашкеназі), світлоклітинна аденома, аденома, що функціонує (хвороба Пламера) тощо;
б) злоякісні: фолікулярний рак, папілярний рак, С-клітинний (медулярний) рак, недиференційований (анапластичний) рак, інші.
2. Незначні пухлини: доброякісні, злоякісні.
3. Змішані пухлини.
4. Вторинні пухлини.
5. Пухлини, що не класифікуються.
6. Пухлиноподібні ураження.
Крім того, вузли розрізняють за кількістю (поодинокі, множинні вузли (багатовузловий зоб)); за розмірами (вузол, що пальпується; величина вузла, що пальпується, розміщеного в передніх відділах ЩЗ, як правило, перевищує 1,0 см) і вузли, що не пальпуються (вузли менших розмірів або розміщені в задніх відділах)); за УЗструктурою (солідні (тканинні), солідно-кістозні (вузол має кістозний компонент поряд з тканинним), кістозні).
Приклад формування діагнозу
Багатовузловий зоб. Еутиреоїдна форма.
Диагностика
Першим етапом діагностики вузлового зобу є пальпаторне виявлення вузлового утворення в ЩЗ. Для уточнення діагнозу використовують лабораторні та інструментальні дослідження.
Лабораторно-інструментальні методи обстеження
1. Доопераційні:
а) основні: УЗД щитоподібної залози, тонкоголкова пункційна біопсія, визначення рівня тиреоїдних гормонів і ТТГ;
б) додаткові: визначення титру антитиреоїдних антитіл, радіоізотопне сканування, рентгенографія грудної клітки з контрастуванням стравоходу барієм, комп’ютерна томографія й магнітно-ядерний резонанс.
2. Інтраопераційні: інтраопераційне УЗД щитоподібної залози, термінове (експрес) гістологічне дослідження тканин пухлини ЩЗ (при підозрі на аденокарциному ЩЗ).
3. Післяопераційні:
а) основні: гістологічне дослідження тканини щитоподібної залози;
б) додаткові: імуногістохімічне дослідження тканини пухлини (визначення пухлинних маркерів).
Диференційна діагностика
Диференційну діагностику слід проводити з хронічним лімфоцитарним тиреоїдитом, підгострим тиреоїдитом.
Інструментальні методи обстеження
УЗД дозволяє підтвердити або спростувати наявність у дитини вузлового або дифузного зобу. За допомогою УЗД неможливо визначити морфологічну характеристику досліджуваного утворення ЩЗ, але можна виявити непрямі ознаки того чи іншого вузлового захворювання. УЗД дозволяє отримати об’єктивну інформацію щодо розмірів, об’єму, структури вузла, розмірів ЩЗ.
Радіоізотопне дослідження (радіонуклідне сканування, сцинтиграфія). Радіонуклідне сканування і сцинтиграфія – методи отримання гамматопографічного двомірного відображення ЩЗ, яке віддзеркалює розподіл в ній радіонукліду-133-йоду або 99Тс-пертехнетату.
Сканування дозволяє робити висновок про локалізацію ЩЗ, форму, розміри, контури. Розподіл та інтенсивність накопичення радіонукліду вказують на дифузне або вогнищеве ураження, функціональну активність вузлових утворень. Сканування виконується за окремими показаннями:
1. Підозрюється аутоімунний вузол (вузли) ЩЗ (токсична аденома, вузловий або багатовузловий токсичний зоб).
2. Рецидив зобу або тиреотоксикозу після операції на ЩЗ.
3. Підозрюється незвичайна локалізація тиреоїдної тканини або аномалія розвитку ЩЗ: загрудинний зоб (дослідження проводять за допомогою 131-йоду для отримання чіткішого зображення); дистопія ЩЗ, в тому числі зоб кореня язика; геміагенезія або агенезія ЩЗ; функціонуючі метастази диференційованого раку ЩЗ (візуалізація метастазів за допомогою 131-йоду можлива за відсутності нормально функціонуючої ЩЗ, при наявності її застосовують 99Тс).
4. Наявність пухлини на шиї, підозра на пухлину ЩЗ.
5. Стан після операції на ЩЗ з приводу раку для висновку щодо радикальності операції (виявлення кількості та функції, що залишилася після операції тиреоїдної тканини).
Рентгенологічне дослідження. При вузловому зобі застосовують і рентгенологічний метод дослідження, який в певних випадках дозволяє детальніше обстежити хворого. В тому випадку, якщо він доповнений непрямою лімфографією ЩЗ, стає можливим визначити ступінь ураження лімфатичних вузлів.
Неуражені лімфовузли добре контрастують на знімках, а у випадках метастазування спостерігається їх блокада, повна або часткова.
Рентгенологічне дослідження грудної клітки з контрастуванням стравоходу барієм. В тому випадку, коли необхідно виявити наявність звуження або зміщення трахеї й стравоходу у хворого з вузловим утворенням в ЩЗ, а також діагностувати загрудинний зоб, проводиться рентгенологічне дослідження грудної клітки з контрастуванням стравоходу барієм.
Комп’ютерна і магнітно-резонансна томографія ЩЗ. Комп’ютерна і магнітно-резонансна томографія ЩЗ – це високоінформативні неінвазивні методи, за допомогою яких візуалізується ЩЗ. Комп’ютерна томографія дозволяє визначити денситометричну щільність утворень ЩЗ. Комп’ютерна і магнітно-резонансна томографія використовуються для діагностики загрудинного зобу.
Лабораторні методи дослідження
Визначають тиреоїдні гормони вільний тироксин (Т4 вільн.) і вільний трийодтиронін (Т3 вільн.). Рівень Т4 вільн. є основним аналітичним параметром, що дає чітке уявлення про функціональний стан ЩЗ. Рівень Т3 вільн. має не таке велике діагностичне значення, як рівень Т4 вільн. При вузлових формах зобу немає необхідності у визначенні цього показника. Визначення рівня ТТГ є основним методом для діагностики захворювань ЩЗ. Якщо концентрація ТТГ знаходиться в межах від 0,1 до 0,3 або від 3,5 до 10 мМО/л, необхідно провести аналіз вільних фракцій тиреоїдних гормонів. Патологічний рівень ТТГ (нижче 0,1 або вище 10 мМО/л) паралельно з підвищеними рівнями Т4 і /або Т3 у сироватці крові мають місце при гіпотиреозі, знижений рівень Т4 підтверджує наявність гіпотиреозу. Дослідження рівня ТТГ і тиреоїдних гормонів показано всім хворим із вузловим зобом.
Гуморальні маркери тиреоїдної патології
Дослідження рівнів тиреоглобуліну (ТГ) має найбільше значення при карциномі ЩЗ. При диференційованій карциномі ЩЗ рівень ТГ дуже підвищується. Рівні ТГ в нормі < 60 нг/мл. Діагностичне значення ТГ дуже важливе після операції з приводу дифереційованого раку ЩЗ: при прогресуванні захворювання після нерадикальної операції, рецидиві й метастазуванні вміст ТГ у крові підвищується. Якщо після радикальної операції при лікуванні тиреоїдними гормонами досягнуто супресії ТТГ, рівень ТГ не повинен визначатися. Визначення кальцитоніну також має діагностичне значення. Кальцитонін є продуктом секреції С-клітин. В нормі його вміст у крові не перевищує 10 нг/мл. Високий рівень Кт у крові (більше 200 нг/мл) – найважливіший діагностичний критерій медулярного раку ЩЗ. Після радикального лікування з приводу медулярного раку проводять повторне дослідження Кт для своєчасного виявлення рецидиву захворювання. Визначення антитіл при вузловому зобі включає:
1) антитіла до тиреоглобуліну; 2) антитіла до мікросомального антигену або тиреоїдної пероксидази; 3) антитіла до рецептору ТТГ.
Тонкоголкова пункційна біопсія ЩЗ і цитологічне дослідження
Метод тонкоголкової пункційної біопсії є обов’язковим компонентом верифікації природи вузлових утворень ЩЗ. Показання до ТПБ – будь-які вузлові (багатовузлові) форми захворювань ЩЗ, при яких технічно можливе проведення ТПБ.
Метою цитологічного дослідження отриманих пунктатів є виявлення характерних ознак того чи іншого вузлового утворення ЩЗ.
Цитологічні особливості вузлового колоїдного зобу:
1. Наявність груп тиреоцитів з ознаками дистрофії.
2. Різний ступінь проліферації тиреоцитів.
3. Наявність колоїду.
4. Наявність кістозно-геморагічної рідини.
5. Макрофаги (без гемосидерину та з ним – сидеробласти та сидерофаги).
6. Лімфоїдні клітини з вузла і долі.
Лечение
Консервативне лікування виправдане тільки за наявності у хворого вузлового колоїдного зобу невеликих розмірів (вузол не > 2 см). Основне завдання лікування – запобігти або уповільнити подальший ріст вузла. Терапію препаратами тиреоїдних гормонів починають за відсутності у хворого чинників ризику та клінічних і цитологічних ознак пухлини ЩЗ. Після обов’язкового дослідження рівня тиреоїдних гормонів проводиться терапія левотироксином. Тривалість лікування тироксином повинна складати не менше року, а після його відміни слід призначати препарати йоду. При лікуванні вузлового зобу доза левотироксину повинна бути такою, щоб рівень ТТГ у пацієнта знаходився на нижній межі норми.
Показання для призначення левотироксину: розмір вузла – 10-20 мм; слабко виражена проліферативна активність тиреоцитів, отриманих при ТПБ із вузла, або відсутність проліферативної активності; рецидив вузлового колоїдного зобу впродовж перших трьох років від моменту оперативного лікування. Якщо на тлі лікування відзначається подальший ріст вузла, то лікування тироксином припиняється, проводиться повторна пункційна біопсія та вирішується питання щодо хірургічного лікування.
Якщо ж вузол на тлі терапії не росте або зменшується, то лікування левотироксином призупиняють на 6 місяців і відновлюють тільки у випадку повторного збільшення розмірів вузла. Терапія левотироксином при багатовузловому зобі рекомендована тільки тим хворим, у яких початковий базальний рівень ТТГ не нижчий 1 мОД/мл.
Якщо на тлі лікування відбувається зменшення розмірів зобу або стабілізація його росту, то лікування левотироксином продовжують, періодично контролюючи рівень ТТГ в крові.
Для лікування вузлів ЩЗ із початковим розміром до 1 см призначають препарати йоду (йодомарин, калій йодид) в профілактичних дозах і через 12 місяців повторюють УЗД після їх прийому.
Якщо у хворого аутоімунний тиреоїдит і в ЩЗ методом УЗД виявляється вузлове утворення з чіткою капсулою, а при цитологічному дослідженні з цього утворення отриманий матеріал, характерний для вузлового колоїдного проліферативного зобу, то лікування такого пацієнта буде відбуватися відповідно до вищевказаних принципів. Поєднання вузлового колоїдного зобу і дифузного токсичного зобу є показанням для оперативного лікування, незалежно від розмірів вузлового утворення.
Показання до оперативного лікування при вузловому зобі й пухлинах ЩЗ
Показання до оперативного лікування в екстреному порядку: рак щитоподібної залози, підозра на рак при вузловому зобі, фолікулярна аденома щитоподібної залози.
Показання до оперативного лікування в плановому порядку: хворі з вузлом у щитоподібній залозі з його початковим розміром більше 2 см, хворі з вузловим зобом з негативною динамікою за період консервативного лікування (ріст вузла), хворі з багатовузловим токсичним зобом, хворі з великими кістами (більше 3 см), що мають фіброзну капсулу і стабільно накопичуючими рідину після будь-якого морфологічного типу, хворі з загрудинним вузловим зобом.
Профілактика рецидиву вузлового і багатовузлового зобу після операції
У хворих, яким була зроблена двобічна субтотальна резекція ЩЗ, розвивається гіпотиреоз, тому їм в подальшому потрібна замісна терапія тиреоїдними гормонами. У хворих з однобічною резекцією долі призначення тироксину грунтується на необхідності запобігання рецидивів вузлового зобу в залишковій тканині залози. Після видалення однієї долі прийом тироксину рекомендується тим хворим, у яких рівень ТТГ через 2 місяці після операції перевищує верхню межу норми (>3,5 мОД/мл). Хворим з еутиреоїдним станом функції щитоподібної залози слід проводити регулярне (1 раз на 6 місяців протягом першого року після операції, потім – щорічно) клінічне й ультразвукове визначення об’єму ЩЗ і рівня ТТГ в крові. При тенденції до росту ТТГ доцільне призначення тироксину в адекватних дозах.
Гіпотиреоз
МКХ-10 е03.0, е03.1
Общая информация
Гіпотиреоз – синдром, що розвивається в результаті патологічного зниження функціональної активності щитоподібної залози. При цьому спостерігається різке зниження рівня тиреоїдних гормонів та підвищення рівня тиреотропіну в сироватці крові.
Гіпотиреоз відноситься до найпоширенішої патології щитоподібної залози у дітей. Гіпотиреоз у дітей може бути вродженим і набутим. Вроджений гіпотиреоз (ВГ) належить до числа доволі поширених і найтяжчих захворювань ЩЗ, що спостерігаються в педіатричній ендокринології. Середня частота ВГ – 1 на 3-4 тис. новонароджених. В 2006 р. в Україні було зареєстровано 1398 дітей віком від 0 до 14 років (20,7 на 100 тис. населення), а кількість вперше виявлених пацієнтів склало 308 (4,6 на 100 тис. населення). Внаслідок незначних клінічних проявів у перші місяці життя ця хвороба нерідко своєчасно не діагностується, а спричинені нею порушення, насамперед розумового розвитку, є найчастіше незворотними. ВГ є однією з основних причин кретинізму, тобто незворотних змін у нервовій та кістковій системі, й затримки росту дитини. ВГ є гетерогенним синдромом і в його етіопатогенезі беруть участь багато різних механізмів, гіпотиреоз може бути як постійним, так і транзиторним.
Постійний гіпотиреоз: первинний гіпотиреоз (пов’язаний з тиреоїдною патологією); тиреоїдний дизгенез: аплазія, ектопія, гіпоплазія ЩЗ; вроджені порушення біосинтезу тиреоїдних гормонів, пов’язані з екстратиреоїдними аномаліями; периферична резистентність до тиреоїдних гормонів.
Транзиторний гіпотиреоз виникає внаслідок прийому йоду або антитиреоїдних препаратів вагітною матір’ю, проникнення крізь плаценту материнських антитіл, які блокують рецептори тиреотропного гормону плоду при аутоімунному тиреоїдиті, недоношеності дитини та дефіциті йоду.
Найчастішими причинами розвитку постійного ВГ є дизгенез (80-85%), дизгормоногенез (10-15%), гіпоталамогіпофізарні порушення (<5%) ЩЗ тощо. Етіологія тиреоїдного дизгенезу залишається невідомою. Наявність генетичного дефекту підтверджують такі чинники, як переважання жіночої статі над чоловічою серед дітей з ВГ, наявність інших тиреоїдних порушень у родині хворого на ВГ, поширеність серед близнят і близьких родичів, зв’язок між ВГ та високою частотою появи HLA типів Aw24 або Bw44. Гормональні порушення за різних форм ВГ відрізняються за ступенем тяжкості. Найбільший ступінь тиреоїдної недостатності спостерігається у разі дизембріогенезу ЩЗ, а саме – при її аплазії та дистопії, а також за таких варіантів дизгормоногенезу, як дефект синтезу тиреоїдного гормону. Найменш тяжкі гормональні порушення фіксуються у випадку дефектів тиреопероксидази і синтезу аномального тиреоїдного гормону. В етіології транзиторного порушення функції ЩЗ велике значення має кількість споживання йоду. Дефіцит його є найчастішою причиною ВГ і розумової відсталості.
Провідну роль у розвитку гіпофункції ЩЗ у дітей відіграють також чинники, не пов’язані із забезпеченням плоду і новонародженого йодом, зокрема вплив малих доз іонізуючої радіації, а також інші зобогенні чинники. Відзначено, що у районах з радіаційним забрудненням середня концентрація ТТГ у крові новонароджених вірогідно вища, ніж у дітей із «чистої» місцевості.
Тиреоїдні гормони на етапі внутрішньоутробного розвитку є важливими регуляторами формування і дозрівання головного мозку плода. У І триместрі вагітності повноцінне анатомо-морфологічне закладання ЦНС забезпечують гормони материнської щитоподібної залози, а наступний фетальний розвиток тканини мозку і мієлінізація компонентів міжнейрональних зв’язків залежить від активності щитоподібної залози плоду. Важливу роль у цих процесах відіграє достатнє забезпечення організму фізіологічними дозами йоду. Терміни диференціювання головного мозку чітко обмежені, тому навіть короткий період тиреоїдної недостатності негативно впливає на розвиток ЦНС, призводячи до змін у нервово-психічній сфері.
Крім впливу на закладання і розвиток нервової системи тиреоїдні гормони відіграють також важливу роль у регуляції гомеостазу в період новонародженості, різнобічно впливають на процеси метаболізму, забезпечують тривалу адаптацію до конкретних умов існування. Не менш важливою дією тиреоїдних гормонів у дитячому віці є їх анаболічний ефект. Йодотироніни регулюють не стільки лінійний ріст, скільки процеси диференціювання тканин.
При народженні та у перші 30 хв після пологів у новонароджених унаслідок фізіологічного стресу спостерігається значне зростання вмісту ТТГ у крові – до 70 мОД/л. До кінця 1-2 доби рівень ТТГ падає до початкового (10 мОД/л), а в наступні 3-6 діб життя фіксують поступове зниження концентрації ТТГ у крові й тенденцію до стабілізації його секреції. Якщо високий рівень ТТГ (50-100 мОД/л) зберігається впродовж першого тижня життя, це свідчить про можливий вроджений гіпотиреоз. Вміст вільного Т4 також підвищується у першу добу життя до максимуму, потім знижується на 3 добу, після чого впродовж перших 4 тижнів наростає. Остаточно співвідношення між гормонами ЩЗ встановлюється до 1,5-місячного віку.
Нетривале порушення адаптації гіпофізарнотиреоїдної системи в новонароджених у постнатальний період, що виявляється клінічними і біохімічними ознаками гіпотиреоїдного стану, розглядається як неонатальний транзиторний гіпотиреоз. Клінічні симптоми транзиторного гіпотиреозу неспецифічні: в’ялість, мармуровість, пастозність шкірних покривів, поганий апетит, зригування, схильність до закрепів, тривала жовтяниця, м’язова гіпотонія, анемія. При гормональному дослідженні виявляють зниження Т4 і/або Т3. Підвищення рівня ТТГ спостерігається не завжди і воно не таке значне, як при ВГ. При цьому рівні Т4 та ТТГ у пуповинній крові нормальні. Обстеження рекомендується проводити не раніше 5 доби життя у доношених і 7-14 доби у недоношених дітей. Поширення транзиторного гіпотиреозу у новонароджених коливається від 1 до 14%.
Встановлено, що перенесений у неонатальному періоді транзиторний гіпотиреоз несприятливо впливає на наступний фізичний, нервово-психічний, мовний розвиток дітей та стан їх здоров’я на першому році життя й у шкільному віці. У більшості новонароджених функція ЩЗ відновлюється до кінця першого місяця життя.
Етіологія
Вроджений гіпотиреоз виникає внаслідок різних причин. Найчастішими причинами виникнення вродженого гіпотиреозу є: порушення морфологічного розвитку щитоподібної залози (повна або часткова її відсутність, ектопія), внутрішньоутробне ушкодження щитоподібної залози, генетично зумовлене порушення біосинтезу тиреоїдних гормонів.
Порушення біосинтезу тиреоїдних гормонів призводить до підвищення виділення тиреотропіну (ТТГ) гіпофізом та збільшення щитоподібної залози.
Особлива форма дефекту перетворення неорганічного йоду на органічний – синдром Пендреда, що характеризується збільшенням щитоподібної залози, глухотою (або недочуванням) і розладами вестибулярної функції. Успадковування відбувається за аутосомнорецесивним типом.
Можливі причини розвитку набутого гіпотиреозу у дітей наступні: хірургічне втручання на щитоподібній залозі (повне або часткове її видалення); безконтрольне застосування протягом тривалого часу тиреостатичних препаратів або препаратів неорганічного йоду; запальні процеси та аутоімунні порушення в щитоподібній залозі; недостатнє надходження в організм дитини різних мікроелементів, передусім йоду, з водою та харчовими продуктами. Гіпотиреоз може розвинутися після впливу на щитоподібну залозу радіоактивного йоду.
Патогенез
В основі патогенезу всіх форм гіпотиреозу лежить зниження рівня тиреоїдних гормонів у крові.
Патогенез первинного гіпотиреозу визначається відсутністю, недорозвиненістю або ушкодженням власне тиреоїдної тканини, що не спроможна синтезувати достатню кількість тиреоїдних гормонів.
Розвиток вторинного гіпотиреозу спричинений недостатньою продукцією тиреотропіну в гіпофізі.
У патогенезі третинного гіпотиреозу провідне місце посідає порушення вироблення тиреоліберину гіпоталамусом.
Гіпотиреоз може розвиватися і внаслідок резистентності периферичних тканин до дії тиреоїдних гормонів. Дефіцит тиреоїдних гормонів призводить до значних порушень процесів обміну речовин в організмі.
Клиническая картина
Клінічні прояви гіпотиреозу у дітей залежать від віку, коли виникла недостатність функції щитоподібної залози, ступеня тиреоїдної недостатності й тривалості захворювання.
На відміну від дорослих, у дітей на перший план виходить затримка фізичного, розумового та статевого розвитку. Вроджений гіпотиреоз проявляється в перші дні та місяці життя дитини.
Захворювання запідозрюється за таких умов: переношена вагітність (понад 42 тижні), маса тіла під час народження більша за 4000 г, набряклість, здуття живота, схильність до закрепів, пупова грижа, пізнє відпадання пупового канатику, затяжна жовтяниця (тривалість якої може досягати 5-6 міс.). Дитина незвично спокійна, сонлива, рідко кричить, тембр голосу – низький. Шкіра суха, стопи й кисті холодні, язик не вміщається в роті. Часто спостерігаються різні респіраторні симптоми (шумне дихання, що нагадує стридор, утруднене носове дихання, схильність до респіраторних захворювань, напади ціанозу, можливий також типовий дихальний дистрес-синдром). Відзначається уповільнена реакція на больові подразники, гіпестезія, тривала гіпертонія м’язів, симптом Керніга.
Дуже характерні симптоми ураження ЦНС у вигляді сповільнення психічної діяльності, загальмованості, затримки розвитку головного мозку.
Якщо захворювання залишається нерозпізнаним, то через 5-6 міс. виявляють класичну картину гіпотиреозу: затримку психофізичного розвитку, функціональні зміни практично всіх внутрішніх органів, трофічні зміни шкіри та її придатків. Важливим симптомом є порушення термінів та порядку прорізування зубів (як молочних, так і постійних). Закриття великого тім’ячка затримується до 8-10-місячного віку. Ходити діти починають пізно. Згодом спостерігається відставання в рості, при цьому пропорції скелета залишаються інфантильними й наближаються до хондродистрофічних. Порушується розвиток скелету обличчя – перенісся широке, пласке, ніс короткий, очні ямки широко розставлені. Внаслідок браку тироксину, що впливає на процес скостеніння хряща, затримується поява ядер скостеніння скелету. Кістковий вік дитини різко відстає від паспортного. Для тиреоїдного нанізму характерно, що осифікація починається з численних неправильних фокусів, розкиданих по всій зоні зміненого хряща.
Постійний клінічний симптом гіпотиреозу – виражений слизовий набряк (мікседема). Внаслідок затримки води в організмі хвора дитина має надлишкову масу тіла. Шкіра суха, лущиться, бліда, із жовтуватим відтінком. Чоло та повіки набряклі, нависають, очні щілини вузькі, риси обличчя згладжені. Язик набряклий, не вміщається в роті. У надключичній ділянці, на тильному боці стоп і кистей утворюються підвищення у вигляді подушечок.
Основною причиною розвитку слизового набряку є порушення обміну глікопротеїдів, вуглеводні компоненти яких виявлені в набряковій речовині – муцині. Муцин виявляють і в інтерстиціальній тканині серця, м’язів, у нервовій системі, шкірі.
Волосся стає сухим, ламким, рідким. Потовиділення різко знижене. Часті симптоми гіпотиреозу – зміни функціонального стану скелетних м’язів (діти швидко втомлюються, стають млявими). З’являється м’язова гіпотонія, характерна постава з вираженим поперековим лордозом, виступаючими сідницями.
При гіпотиреозі страждають також інші органи й системи дитини. Порушується функція печінки (процес утворення вітаміну А з каротину, виділення білірубіну тощо); знижується рухова активність кишок, що призводить до стійких закрепів і метеоризму. Відзначається виражена брадикардія, кардіомегалія, глухість серцевих тонів, зниження АТ. Скорочувальна функція міокарду порушується за типом гіподинамії. Знижується фільтраційна та секреторна здатність ниркових канальців.
Виявляють анемію (найчастіше – залізодефіцитну) та еозинофілію. Зниження функції ЩЗ спричиняє затримку статевого розвитку; виникають гіпоплазія та дисфункція статевих залоз.
При гіпотиреозі фіксують рентгенологічні зміни черепа: у 50% дітей спостерігається брахіцефалія, гіпоплазія придаткових порожнин носа, пальцеві вдавлення, у 72% – гіперкальцифікація основи черепа. Ознаки підвищення внутрішньочерепного тиску виявляють переважно у випадках вторинного гіпотиреозу. При вродженому гіпотиреозі череп збільшений, кістки його стовщені.
На особливу увагу при гіпотиреозі заслуговує психічний розвиток дитини. У випадку недостатнього надходження тироксину в кров знижується швидкість окисновідновлювальних процесів та обмін речовин, що призводить до порушення живлення нервових клітин, зниження регулювальної дії кори великого мозку і судиннорухових центрів. Діти відстають у психічному розвитку від однолітків, загальмовані, пізно починають сідати, зводитися на ноги, ходити, говорити, не цікавляться іграшками, відстають у навчанні, їм важко контактувати з новими людьми.
Классификая и примеры формулировки диагноза
Етіологічна класифікація гіпотиреозу
Первинний гіпотиреоз:
А. Вроджений гіпотиреоз (кретинізм):
1. Ембріональна вада розвитку – відсутність щитоподібної залози або дефект її розвитку (спорадичний кретинізм).
2. Нездатність неорганічного йоду перетворюватися на тироксин (з утворенням зобу).
3. Відсутність або брак йоду – зоб чи атрофія щитоподібної залози (ендемічний кретинізм).
4. Вроджений зоб – результат дії під час внутрішньоутробного періоду зобогенних або інших чинників.
Б. Набутий (гіпотиреоз дитячого віку та юнацький):
1. Невідома причина – первинна атрофія щитоподібної залози.
2. Специфічна відсутність стимуляції тиреотропного гормону.
3. Оперативне видалення.
4. Інфекція або інфільтративний процес (тиреоїдит, зоб Хашімото).
Вторинний гіпотиреоз виникає при ураженні гіпофізу та зниженні секреції тиреотропіну:
ішемія аденогіпофізу;
пухлини головного мозку, гіпофізу;
аутоімунний гіпофізит.
Третинний гіпотиреоз виникає при ураженні гіпоталамуса та зниженні секреції тиреоліберину:
загальні процеси гіпоталамічної зони;
черепно-мозкові травми;
пухлини головного мозку.
За клінічною картиною виділяють легку, середньотяжку та тяжку (мікседема) форми гіпотиреозу.
Виділяють субклінічну та клінічну форми захворювання.
Субклінічний гіпотиреоз встановлюють у разі відсутності клінічної симптоматики, підвищення рівня тиреотропіну в крові й нормальних рівнів тиреоїдних гормонів. Клінічно явний гіпотиреоз діагностується за наявності клінічної симптоматики, підвищення рівня тиреотропіну та зниження вмісту тиреоїдних гормонів у крові.
Приклади формулювання діагнозу
Гіпотиреоз субклінічний (лабораторний).
Вроджений гіпотиреоз середнього ступеня тяжкості у стані декомпенсації.
Диагностика
Клінічні критерії: скарги пацієнта типові, виявляють брадикардію, зниження напов-нення пульсу, зміни з боку серцево-судинної системи, зниження сухожильних рефлексів, холодні кінцівки, виявлення набряків, зниження тембру голосу, сонливість, збільшення маси тіла, закрепи.
Лабораторні дослідження
При загальному аналізі крові – виявлення залізодефіцитної анемії, відносного лімфоцитозу, підвищення ШОЕ.
При біохімічному аналізі крові рівень холестерину підвищений, а лужний фосфат знижений. При гормональному обстеженні рівень тиреотропіну підвищений (що характерно для первинного гіпотиреозу), а рівень тиреоїдних гормонів – знижений. При вторинному та третинному гіпотиреозі рівні тиреотропіну й тиреоїдних гормонів знижені.
Для діагностики вторинного та третинного гіпотиреозу необхідно проводити пробу із внутрішньовенним уведенням 100 мкг тиреоліберину.
Так, при первинному гіпотиреозі спостерігається гіперергічна реакція на тироліберин, а при вторинному гіпотиреозі зменшується виділення тиреотропіну, при третинному гіпотиреозі реакція на тиреоліберин зберігається, але вона уповільнена.
Інструментальні методи дослідження
Ультразвукове дослідження щитоподібної залози. При УЗД розміри ЩЗ можуть бути нормальними, зменшеними (аплазія чи гіпоплазія) або збільшеними (вторинний гіпотиреоз при гіпертрофічній формі АІТ).
При електрокардіографічному дослідженні – брадикардія, амплітуда зубців R, P та комплексу QRS знижена, негативний зубець Т.
На ЕЕГ визначаються патологічні уповільнені хвилі та недостатня вираженість альфа-ритму.
Диференційна діагностика
Диференційна діагностика складна в період новонародженості, коли дитина ще перебуває на грудному вигодовуванні. У цей час уроджений гіпотиреоз слід диференціювати з хворобою Дауна (шляхом дослідження каріотипу), рахітом, фенілкетонурією, жовтяницею різного походження. У старшому віці диференціальну діагностику проводять із захворюваннями, що супроводжуються затримкою росту (хондродистрофія, гіпофізарний нанізм, дизгенезія статевих залоз, хвороба Пертеса, деформуючий остеохондрит). За наявності виражених набряків необхідно виключити хворобу нирок, вроджену ваду серця, ревматизм.
Гіпотиреоз слід диференціювати також із псевдогіпотиреозом, за якого порушення обміну трийодтироніну відбувається за умов збереження функції щитоподібної залози.
Лечение
Основним методом лікування гіпотиреозу є замісна терапія препаратами тиреоїдних гормонів (левотироксин).
Замісну терапію L-тироксином у разі вродженого гіпотиреозу проводять у початковій дозі 25-50 мкг/добу або 8-12 мкг/кг на добу.
При перерахунку на площу поверхні тіла доза препарату у новонароджених становить 150-200 мкг/м2, у дітей старшого віку – 100-150 мкг/м2. В подальшому дозу препарату визначають за рівнем ТТГ у крові.
Дозу левотироксину поступово зменшують з віком, але залишають однаковою на одиницю поверхні тіла –100 мкг/м2 на добу. У разі вторинного гіпотиреозу доза тироксину становить 2-2,5 мкг/кг добу.
Рівень Т4 нормалізується через 1-2 тижні після початку лікування, а рівень ТТГ – через 3-4 тижні після початку лікування.
В комплекс лікувальних заходів при гіпотиреозі слід включати симптоматичну терапію: антианемічну (препарати заліза, вітаміни В1 і В12, фолієву кислоту) за показаннями; ноотропні препарати (ноотропіл) у вікових дозах. Тривалість курсу лікування – 1-2 міс.; вітамінотерапія (аевіт) – по 1 таблетці на день, тривалість курсу лікування –1 міс.; триметабол дітям від 1 до 3 років – по 2,5 мл 3 рази на день; дітям від 3 до 6 років – по 5-10 мл 3 рази на день; гепатопротекторні препарати (есенціале, енерлів) – по 1 капсулі 3 рази на день. Тривалість курсу лікування – 3 місяці. Рекомендується ЛФК та масаж.
Контроль за лікуванням здійснюють за оцінкою клінічної картини динаміки росту, показників диференціювання скелету (рентген-вік), загального і психічного розвитку дитини, рівня Т4 вільного і ТТГ (на першому році життя – кожні 3 міс).
Рекомендації
При задовільній компенсації гіпотиреозу діти потребують диспансерного нагляду, проведення повного ендокринологічного обстеження, корекції лікування 2-3 рази на рік. Якщо є ускладнення з боку серцевосудинної та нервової систем і скелету, огляди потрібно проводити 1 раз на 3 міс.
Юридические аспекты
Перед проведенням діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Гострий тиреоїдит
МКХ-10: е06.0
Общая информация
Гострий тиреоїдит – гостре запалення щитоподібної залози. Гострий тиреоїдит складає 1-2% від усієї патології щитоподібної залози.
Етіологія
Захворювання виникає на тлі інфекції верхніх дихальних шляхів, яка поширюється як гематогенним, так і лімфатичним шляхом. Однією із найчастіших причин виникнення захворювання є бактеріальні інфекції, викликані стафілококом, стрептококом, пневмококом, кишковою паличкою.
Патогенез
Внаслідок проникнення патогенних мікроорганізмів у тканину щитоподібної залози в ній розвивається осередок запалення. На ранніх стадіях захворювання формується запальний інфільтрат, в подальшому з нього розвивається абсцес щитоподібної залози, що супроводжується пошкодженням фолікулів і порушенням гормоноутворення.
Клиническая картина
Захворювання у дітей починається з раптової появи болю і припухлості в ділянці щитоподібної залози, лихоманки, болю в горлі, захриплості голосу.
Часто біль вираженіший з одного боку й іррадіює в нижню щелепу, вухо чи потилицю. Згинання шиї призводить до зменшення болю, тоді як розгинання посилює больовий синдром і викликає дисфагію. Спостерігається підвищення температури до 38-400 С і збільшення частоти серцевих скорочень. Часто дитина не дозволяє провести пальпацію ділянки щитоподібної залози внаслідок сильного болю. Збільшення щитоподібної залози локальне, болюче, в подальшому може відзначатися флюктуація. Шкіра над залозою гаряча, гіперемована, спостерігається збільшення підключичних і шийних лімфатичних вузлів, відзначається набряк м’яких тканин шиї. Можливе проривання абсцесу щитоподібної залози в середостіння, в трахею, на передній поверхні шиї.
Классификая и примеры формулировки диагноза
Гострий тиреоїдит буває: а) гнійний; б) негнійний.
Приклад формулювання діагнозу
Гострий гнійний тиреоїдит, еутиреоз.
Диагностика
Основні критерії діагностики захворювання: клінічні прояви – больовий синдром з локальними ознаками запалення і абсцедування щитоподібної залози; підвищення температури тіла, лабораторні – лейкоцитоз, нейтрофільне зрушення вліво, підвищення СОЕ, виявлення гіпоехогенної ділянки запалення при УЗД щитоподібної залози.
При пункційній аспіраційній біопсії – гнійне виділення. Цитологічна діагностика грунтується на наявності в пунктаті епітеліальних клітин з різним ступенем пошкодження (дистрофія і некроз) й великої кількості поліморфно-ядерних лейкоцитів.
Гістологічне дослідження виявляє інфільтрацію тканини щитоподібної залози поліморфно-нуклеарними лейкоцитами і лімфоцитами, проявами осередкового чи дифузного ексудативного запалення.
Допоміжні критерії: рівень тиреоїдних гормонів незмінний.
Диференційна діагностика
Гострий тиреоїдит частіше диференціюють з підгострим тиреоїдитом де Кервена.
Лечение
Лікування гострого тиреоїдиту проводять в хірургічному відділенні. Відразу ж після встановлення діагнозу необхідне призначення інтенсивної антибіотикотерапії з урахуванням чутливості бактеріальної флори. Крім антибактеріальних препаратів слід призначати антигістамінні препарати. Хворим показана дезінтоксикаційна терапія. При прогресуванні запальних процесів і формуванні абсцесу показано хірургічне втручання з наступним дренуванням рани. Пізнє розкриття абсцесу ЩЗ може призвести до проривання його в середостіння.
Умови, в яких потрібно надавати медичну допомогу
Хворі з гострим тиреоїдитом повинні одержувати медичну допомогу тільки в умовах спеціалізованих відділень.
Характеристика кінцевого очікуваного результату лікування:
При своєчасній діагностиці і адекватному лікуванні протягом 6-8 тижнів наступає видужання.
Рекомендації щодо подальшого, у разі потреби, надання медичної допомоги хворому: кожні 6 міс. – контрольний огляд ендокринолога, УЗД ЩЗ – за показаннями, контроль рівня тиреоїдних гормонів і ТТГ у крові.
Профілактика
Санація первинних вогнищ інфекції.
Юридические аспекты
Перед проведенням діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Дифузний зоб
МКХ-10: е04.0
Общая информация
Дифузний зоб (простий нетоксичний зоб, спорадичний зоб) – дифузне збільшення щитоподібної залози (ЩЗ). Частота дифузного зобу серед дітей коливається від 15 до 50% (у дівчаток виникає у 3 рази частіше, порівняно з хлопчиками) і за наявності інших ендокринних захворювань, зокрема ЦД 1 типу, частота його зростає. Дифузний зоб частіше спостерігається у дітей віком 11-14 років.
Етіологія
Виникнення дифузного зобу пов’язують з можливим впливом однорідного і неповноцінного харчування. Особливе значення має недостатність білків та вітамінів у їжі, яка призводить до дефіциту амінокислоти тирозину як первинного субстрату для біосинтезу тиреоїдних гормонів, надлишок речовин, які пригнічують біосинтез тироксину, таких як пестициди, сірковуглецеві сполуки, оксид азоту, ціаніди. Розвитку зобу сприяють як період пубертації, так і хронічні хвороби й стресові ситуації, які супроводжуються підвищеною потребою в тиреоїдних гормонах, що призводить до збільшення розмірів ЩЗ і формування дифузного зобу.
Лікарські препарати, до складу яких входять перхлорати, літій, похідні тіоурацилу, при тривалому використанні можуть мати струмогенну дію.
Можливим чинником розвитку спорадичного зобу є генетична блокада синтезу тиреоїдних гормонів, а також аутоімунні механізми. Ця форма зобу часто зустрічається в членів однієї сім’ї.
Патогенез
Пусковим механізмом патогенезу є порушення біосинтезу тиреоїдних гормонів на різних етапах гормоноутворення – від поглинання йоду ЩЗ до синтезу тироксину й трийодтироніну. Велике значення в механізмі розвитку захворювання мають процеси конверсії тироксину в трийодтиронін, а також зв’язування тироксину білковими субстратами.
Зниження чутливості рецепторів клітин тиреоїдзалежних органів і тканин також складають суттєвий компонент патогенезу дифузного зобу.
Доведена роль ростостимулюючих імуноглобулінів, які відносяться до класу G, у виникненні дифузного зобу.
Зниження біосинтезу і секреції тироксину призводить до активації процесів утворення й підвищення тиреотропіну, в результаті чого збільшуються розміри ЩЗ.
Про генетичний вплив на патогенез дифузного зобу свідчать дослідження його поширеності серед нащадків хворих на зоб батьків. Захворювання частіше трапляється у тих дітей, обидва батьки яких хворіють на зоб, ніж у тих, у кого хвора лише мати.
Клиническая картина
Клінічна картина, в першу чергу, характеризується збільшенням ЩЗ та зміною її функціональної активності. В цілому клініка захворювання також залежить від ступеня порушення функції щитоподібної залози при зниженні синтезу тиреоїдних гормонів (клінічний або субклінічний гіпотиреоз), спостерігається слабкість, підвищена втомлюваність, головний біль, збільшення маси тіла, сухість шкіри, біль в ділянці серця. Але в більшості випадків спостерігається нормальна функція ЩЗ. У підлітків ДЗ в 30% супроводжується субклінічним (лабораторним) гіпотиреозом.
При об’єктивному огляді відзначається збільшення розмірів ЩЗ та відсутність локальних ущільнень при пальпації. Пальпація не супроводжується відчуттям болю. Шкіра над проекцією ЩЗ не змінена.
При прогресуючому рості дифузного зобу бувають відчуття стороннього тіла під час ковтання, утруднення при повороті та нахилі голови. У положенні лежачи на спині може бути утруднене дихання.
У дітей пубертатного віку з дифузним зобом уповільнення пубертату спостерігається частіше, ніж у їхніх здорових однолітків. У хлопчиків віком 14-17 років відзначається виражене відставання у статевому розвитку.
Классификая и примеры формулировки диагноза
За класифікацією ВООЗ (2001) виділяють такі ступені зобу: 0 ступінь – зобу немає; 1 ступінь – зоб (розміри часток не перевищують розміри дистальної фаланги великого пальця обстежуваної особи), пальпується і видно його при нахиленій назад голові; 2 ступінь – зоб видно при звичайному положенні шиї.
Приклад формулювання діагнозу
Дифузний зоб II ступеня. Гіпотиреоз субклінічний (лабораторний), середнього ступеня тяжкості, в стадії медикаментозної компенсації.
При формулюванні клінічного діагнозу потрібно вказувати дифузний зоб, потім функціональну активність ЩЗ – еутиреоз або гіпотиреоз (його форму – субклінічний, клінічно явний).
Диагностика
Дифузний зоб у дітей діагностують на основі пальпації та ультразвукового дослідження (визначається ступінь збільшення об’єму, ехогенність, ехоструктура ЩЗ). Функціональний стан ЩЗ визначають на підставі клінічної симптоматики та дослідження у крові рівнів вільного та загального тироксину, трийодтироніну, тиреотропіну. Визначають також екскрецію йоду із сечею, особливо якщо дитина мешкає в йододефіцитному регіоні.
Диференційна діагностика
Диференційну діагностику дифузного зобу проводять із аутоімунним тиреоїдитом, дифузним токсичним зобом, ендемічним зобом. При аутоімунному тиреоїдиті виявляється помірна щільність ЩЗ, високий титр аутоантитіл, що не характерно для дифузного зобу. На відміну від дифузного зобу, при дифузному токсичному зобі характерне підвищення рівня тиреоїдних гормонів, очні симптоми й стабільна тахікардія.
Лечение
Лікування дифузного зобу повинно бути комплексним. Повноцінне харчування з достатнім вмістом білків у раціоні харчування (1,5 г/кг в дитячому віці), виключення струмогенних продуктів із раціону (ріпа, бруква, редька, арахіс, квасоля, редис, кольорова капуста). Медикаментозна терапія гормонами щитоподібної залози (препаратами левотироксину) може призначатися у випадках наявності лабораторного або явного гіпотиреозу. Тиреоїдні гормони призначаються з розрахунку 1,5-1,8 мг/кг маси тіла хворого. При лікуванні контролюють показники Т3, Т4 і ТТГ у крові, виконують УЗД ЩЗ, на основі чого проводять корекцію дози препарату.
Якщо протягом 2-4 тижнів рівні Т3, Т4 і ТТГ не нормалізувалися, дозу L-тироксину збільшують на 12,5-25 мкг/ добу кожні 2-4 тижні до зникнення клінічних ознак гіпотиреозу і нормалізації рівнів Т4 та ТТГ. Адекватній дозі відповідає стійке утримання рівня ТТГ в інтервалі 0,5-3,5 мМО/л. Дітям, які отримують підібрану дозу L-тироксину, рекомендовано щорічно досліджувати рівень ТТГ і Т4 вільного.
Тривалість лікування визначається отриманням ефекту: зменшення розмірів зобу та збереження клінікогормонального еутиреозу за відміни препарату.
Перелік і обсяг обов’язкових медичних послуг
Огляд ендокринолога, УЗД ЩЗ, визначення тироксину вільного або загального, тиреотропіну.
Перелік і обсяг додаткових медичних послуг
УЗД ЩЗ із доплерографією, рентгенографія позастернального простору з контрастуванням стравоходу, консультація хірурга.
Профілактика
Профілактика грунтується на усуненні струмогенних чинників середовища (пестициди, нітрати, бензол) та обережному використанні лікарських препаратів із вмістом тіоурацилу, перхлоратів, тіоціонатів. Використання продуктів з підвищеним вмістом йоду (морепродукти).
Юридические аспекты
Перед проведенням конкретних діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Дифузний токсичний зоб
МКХ-10: е05.0
Общая информация
Дифузний токсичний зоб (ДТЗ) (тиреотоксикоз, Базедова хвороба) – системний мультиорганний аутоімунний розлад, зумовлений підвищеним вмістом тиреоїдних гормонів (вільного тироксину та трийодтироніну) у крові та дифузним збільшенням щитоподібної залози.
Захворювання зустрічається у середньому в 0,2-0,5% населення. Дуже висока його частота припадає на період пубертату – на вік 10-15 років. При цьому на підлітковий вік припадає до 25% дифузного токсичного зобу.
Етіологія
Етіологія хвороби точно не встановлена. Є підстави вважати, що аутоімунний процес проти компонентів тиреоцитних рецепторів ТТГ проявляється у генетично схильних суб’єктів внаслідок провокації перехресної імунної реактивності.
У частини хворих захворювання виникає на фоні поліендокринного аутоімунного синдрому Шмідта, який включає аутоалергічні ураження паращитоподібних залоз, острівців Лангерганса, імунопатологічний орхіт, оофорит, гіпокортицизм, а також аутоімунний атрофічний гастрит.
Розвитку дифузного токсичного зобу досить часто передують інфекції та стреси. Вирішальними чинниками можуть виступати черепно-мозкові травми, гіперінсоляція, лікарські препарати (кордарон).
Встановлено, що і гіпертиреоз, і збільшення щитоподібної залози, і багато інших симптомів при Базедовій хворобі мають аутоімунне походження. Спадкова схильність також призводить до виникнення патології щитоподібної залози. Характер спадкування ДТЗ визначається багатьома генами, пов’язаними з головним комплексом гістосумісності.
Патогенез
Центральну роль в патогенезі ДТЗ відіграють порушення в Т-клітинній ланці імунітету. В нормі Т-супресори перешкоджають розвитку аутоімунних захворювань взагалі й щитоподібної залози зокрема. При ДТЗ Т-лімфоцити сенсибілізовані або до окремих тиреоїдних антитіл, або до тиреоцитів.
Активація цих клітин зумовлена, очевидно, первинним порушенням функції Т-супресорів. Визначальною ланкою патогенезу є зниження функції антигенспецифічних Т-супресорів. Активовані Т-хелпери виділяють гама-інтерферон, який індукує експресію HLA класу ІІ, що перетворюють тиреоцити в антигенпрезентуючі клітини. Крім того, провокуючі чинники (стрес, інфекції, травми, лікарські засоби) знижують активність неспецифічних Т-супресорів, тим самим посилюючи дисфункцію органоспецифічних Т-супресорів.
Активовані Т-хелпери прямо впливають на тиреоцити, продукуючи цитокіни, а також утворюють комплекс із цитотоксичними клітинами, що призводить до пошкодження тиреоїдної тканини. До цитотоксичних клітин відносять сенсибілізовані ефекторні Т-клітини, антитілозалежні кілерні К-клітини. Т-хелпери також сприяють продукції специфічних аутоантитіл В-лімфоцитами. Тиреоїдоблокуючі антитіла, зв’язуючись із рецепторами ТТГ, знижують стимулюючий ефект ТТГ на рецептор.
Тиреоїдостимулюючі антитіла активують рецептор ТТГ, призводять до надлишкової секреції й синтезу тиреоїдних гормонів. Підвищення секреторної функції тиреоцитів реалізується через активацію аденілатциклазної системи та збільшення кількості внутрішньоклітинного цАМФ на цитоплазмовій мембрані. Дифузний токсичний зоб неаутоімунного генезу виникає внаслідок мутації гена рецептора ТТГ. Рецептор ТТГ відноситься до сімейства G-протеїнозв’язаних трансмембранних рецепторів. Виявлено 3 активуючі мутації гена рецептора ТТГ. Мутації призводять до заміни тирозину на цистеїн в сьомій трансмембранній ділянці, а також до заміни лейцину на феніналанін в шостій трансмембранній ділянці. Виявлені мутації зумовлюють зміни в трансмембранних ділянках рецептора, що призводить до активації рецептора за відсутності впливу ТТГ. Ці зміни ініціюють внутрішньоклітинний синтез цАМФ, який шляхом активації внутрішньоклітинних механізмів активує синтез тиреоїдних гормонів тиреоцитами. Механізм спонтанної внутрішньоклітинної активації призводить також до гіперплазії та гіпертрофії тиреоцитів, а, отже, до появи зобу.
Клиническая картина
Початок дифузного токсичного зобу поступовий, з періодами загострення та ремісії. Картині хвороби часто передують нервово-психічні розлади підлітків: дратівливість, плаксивість з будь-якого приводу, образливість, швидка зміна настрою, схильність до агресивності. Порушується концентрація уваги. Знижується успішність у школі.
Привертають увагу надмірна діяльність підлітка («вічний рух»), метушливість, іноді – надмірна говірливість, схуднення при гарному апетиті, пітливість та непереносимість спеки.
З’являється майже патогномонічна ознака дифузного токсичного зобу (особливо у підлітків) – втрата маси, від помірної до значної. Однак підвищення обміну речовин може призводити до булімії, а рідко – до збільшення маси тіла.
Також постійна ознака – збільшення щитоподібної залози до І, рідше до – ІІ ступеня (при тяжкій формі). Права доля зазвичай більша за ліву. У дівчаток щитоподібна залоза збільшується більше. При пальпації залоза м’яка, без вузлів, при аускультації – з судинними шумами («шум вовчка»).
Як правило, внаслідок підвищеного обміну речовин і перегрівання організму у підлітка вечорами спостерігається субфебрильна температура – непоодинокий привід звернення до фтизіатра. Завжди спостерігається постійна цілодобова пітливість без ознак дегідратації.
Фізичний розвиток і кістковий вік у дітей прискорені. Вважають, що ріст прискорюється в результаті швидкого розвитку епіфізів, що в подальшому призводить до зупинки росту. При дифузному токсичному зобі у дітей передчасний фізичний розвиток поєднується із затримкою статевого розвитку: пізно зявляються вторинні статеві ознаки, затримується початок менструації у дівчаток, а якщо тиреотоксикоз розвивається після статевого дозрівання, то менструації порушуються або зникають. Вираженість розладів статевого розвитку прямо залежить від тяжкості й тривалості захворювання.
Хворих завжди турбує збільшення розміру шиї, в ній з’являється тиск, підлітки не носять одягу з вузьким і тугим коміром, не застібають верхні гудзики на сорочках.
Важливе значення мають очні симптоми (ендокринна офтальмопатія). Розвивається яскравий блиск очей (сиптом Краузе) і вирячкуватість (екзофтальм), тобто випинання очних яблук вперед, зазвичай симетричне і дуже рідко – асиметричне. Екзофтальм з’являється рано. У підлітків він зазвичай помірно виражений. Тяжкий екзофтальм з протрузією очних яблук, виворотом вік, фіброзом окуломоторних м’язів зустрічається тільки у дорослих хворих. Погляд нерідко здається зляканим, пильним, наче закляклим, з нечастим миганням (симптом Штельвага). Спостерігаються характерна припухлість вік та гіперемія кон’юнктив. Часті сльозотеча, відчуття «пилинок» або «піску» в очах, світлобоязнь. Диплопія по горизонталі чи вертикалі зустрічається рідко, в основному – при асиметричному екзофтальмі. Однак найважливіше діагностичне значення при тиреотоксикозі будь-якої етіології має симптом Мебіуса (порушення конвергенції очей, тобто неспроможність довго фіксувати очі в зведеному стані), який рано з’являється і може швидко зникнути при проведенні тиреостатичної терапії, що слугує важливим орієнтиром в оцінці її ефекту.
Серед інших симптомів можна назвати симптоми Дельримпля (широкі очні щілини), Грефе чи симптом сонця, що заходить (відставання верхньої повіки від райдужної оболонки при погляді вниз), Кохера (оголення дільниці склери при погляді вгору), хреста Стасинського (проростання дрібних кровоносних судин у скловидне тіло обох очей у вигляді хреста при тяжкому екзофтальмі), Жоффруа (нездатність наморщити лоба), Єллінека (гіперпігментація вік), Брейтмана (відхитування пацієнта при швидкому наближенні предметів до його очей).
Типовими є вологі й гарячі долоні. Часто з’являється сверблячка шкіри. Рідше у підлітків спостерігається аутоімунна претібіальна мікседема (потовщення і набряклість шкіри передньої поверхні гомілок за типом «апельсинової шкірочки» із сверблячкою та навіть еритемою). При цьому неможливо зібрати шкіру в складку.
Спостерігається тремор пальців рук (симптом Шарко-Марі), а також висунутого язика і зімкнутих повік (симптом Розенбаха).
Часто з’являється спрага, що може бути обумовлено великими втратами води при постійній пітливості, а в деяких випадках – гіперглікемією в результаті розвитку симптоматичного цукрового діабету. При цьому внаслідок підвищеної моторної функції шлунково-кишкового тракту випорожнення частішають до кількох разів на добу.
Клініка ураження серця при ДТЗ багатосимптомна. При цьому у підлітків межі серця частіше нормальні при вираженій (100-160 уд/хв) тахікардії та різних функціональних серцевих шумах. Характерно, що тахікардія не зникає навіть під час сну, ступінь тахікардії відповідає тяжкості захворювання. Звучність тонів серця підсилюється. При вимірюванні тиску крові визначається підвищений систолічний тиск і виражене зниження діастолічного – «нескінченний» ІІ тон. На полікардіограмі виявляють синдром фазової гіпердинамії.
Класифікація та приклади формулювання діагнозу
Дифузний токсичний зоб класифікується за ступенем збільшення щитоподібної залози і за тяжкістю перебігу захворювання (легкий, середньої тяжкості й тяжкий).
За класифікацією ВООЗ (2001) виділяють такі ступені зобу:
0 ступінь – зобу немає (об’єм кожної долі не перевищує об’єму дистальної фаланги великого пальця руки обтежуваного);
1 ступінь – зоб пальпується і його видно при закинутій голові;
2 ступінь – зоб видно при звичайному положенні шиї.
Критерії тяжкості тиреотоксикозу – втрата маси тіла, тахікардія (при оцінці пульсу у підлітків потрібно враховувати його вікові норми), а також вираженість офтальмопатії.
При легкому ступені тяжкості пульс – до 100 уд/хв, втрата маси – до 20% від початкової, офтальмопатії немає.
При середньому ступені тяжкості спостерігається збільшення пульсу до 130 уд/хв, втрата маси досягає 30%, виражені очні симптоми та ознаки офтальмопатії.
При тяжкому ступені всі показники максимально виражені.
Приклад формулювання діагнозу
Дифузний токсичний зоб І ступеня, середньої тяжкості, в стані медичної компенсації.
Диагностика
Розпізнати типовий дифузний токсичний зоб не складно, але легкі й стерті його форми потребують спеціальної діагностики.
При цьому захворюванні рівні Т3 і Т4 підвищені, особливо Т4, а ТТГ – знижені. У крові зазвичай виявляється помірно підвищена кількість антитиреоїдних (тиреостимулюючих) аутоантитіл до тиреоглобуліну, й у більшості хворих на ДТЗ дітей і підлітків – також антитіла до мікросомальної фракції тиреоцитів (до пероксидази тиреоцитів) в незначних титрах.
Точно оцінити розміри щитоподібної залози, її щільність та наявність в ній вузлів чи кіст дозволяє ультрасонографія (УЗД).
Термографія при дифузному токсичному зобі виявляє в проекції залози однорідну гіперемію аж до верхньої третини шиї з перевищенням фонової температури на 1,5-30 С.
УЗД серця при Базедовій хворобі підлітків нерідко виявляє пролапс мітрального клапану.
На ЕКГ, крім тахікардії та аритмії, виявляють зниження вольтажу, згладженість і інверсію зубця Т, двогорбість і розтягнення зубця Р без перевантаження шлуночків. За фазового аналізу серцевого циклу визначають синдром гіпердинамії.
Холестерин крові внаслідок дії тиреоїдних гормонів падає зазвичай до 3,5-30 мМ/л (при нормальних значеннях у здорових підлітків – 4,85 ± 0,3 мМ/л).
На ранніх стадіях хвороби можуть бути гіпоальбумінемія і підвищення рівнів β1і β2-глобулінів, що при помірній лейкопенії та лімфоцитозі вказує на імунну природу захворювання. Рідко спостерігається анемія і навіть панцитопенія (слід пам’ятати про можливий токсичний вплив на кровотворення антитиреоїдних препаратів –6-метилтіоурацилу, пропілтіоурацилу, тіамазолу, тирозолу та їх аналогів).
У частини підлітків з ДТЗ можна виявити гіперглікемію, особливо при пробі з навантаженням глюкозою.
Диференційна діагностика
Дифузний токсичний зоб диференціюють з еутиреоїдним зобом підлітків, нейроциркуляторною дистонією, аутоімунним тиреоїдитом, підгострим тиреоїдитом де Кервена, міокардитом. Іноді з’являється необхідність виключення туберкульозу.
Загальними ознаками, притаманними для ДТЗ та туберкульозу, є субфебрильна температура, слабкість, пітливість, схуднення, тахікардія. На відміну від туберкульозної інтоксикації, при ДТЗ спостерігається стабільність тахікардії, збільшення розмірів ЩЗ і підвищення її функції. Загальними ознаками нейроциркуляторної дистонії та дифузного токсичного зобу є лабільність, пітливість, тахікардія. Відмінність дифузного токсичного зобу від нейроциркуляторної дистонії полягає у прогресуючому схудненні, стабільності тахікардії навіть у стані спокою, під час сну, наявність очних симптомів та збільшення щитоподібної залози.
Загальними ознаками міокардиту й ДТЗ є субфебрильна температура тіла, серцебиття, загальна слабкість, біль в ділянці серця. Відмінністю ДТЗ від міокардиту є стабільна тахікардія, прогресуюче схуднення, наявність очних симптомів й збільшення щитоподібної залози.
Лечение
Лікування визначається віком пацієнта, тяжкістю хвороби і розмірами зобу, а також наявністю ускладнень.
Підлітки, хворі на дифузний токсичний зоб, спеціальної дієти не потребують, проте з дієти виключають каву, гострі та пряні страви, продукти, багаті йодом (морська риба, кальмари, морська капуста, фейхоа), обмежують продукти, багаті тироніном (сир, шоколад).
Хворі на ДТЗ потребують повного спокою, ліжкового режиму. Їм рекомендують теплий душ, сольово-хвойні ванни, обтирання теплою водою, легку ранкову гімнастику, звільнення від екзаменів, запобігання стресам.
Легкі форми захворювання можна лікувати амбулаторно, але інші – тільки в умовах ендокринологічного стаціонару.
Терапія – консервативна і хірургічна.
Основою консервативної терапії є нормалізація рівнів Т3 і Т4 тиреостатиками й імунодепресивний вплив на тканину щитоподібної залози.
Для медикаментозної терапії ДТЗ використовують тиреостатичні препарати (карбімазол, тіамазол), починаючи з 30 мг на добу і поступово знижуючи дозу під контролем пульсу, ваги, рівня холестерину і показників Т3 і Т4. Таку дозу препарату застосовують протягом 2-3 тижнів.
З моменту досягнення еутиреоїдного стану доза поступово знижується: спочатку на 1/3 від початкової дози, а потім – на 5 мг кожні 14 днів до підтримуючих доз, які складають 2,5-5 мг на добу. Прийом підтримуючих доз антитиреоїдних препаратів продовжується до 12-18 місяців, іноді – до 2 років. На стадії еутиреозу до терапії приєднують L-тироксин в дозі 25-50 мкг для попередження медикаментозного гіпотиреозу і струмогенного ефекту тиреостатиків.
При лікуванні необхідний обов’язковий контроль за периферійною кров’ю, тому що всі антитиреоїдні засоби – цитостатичні, й у частини підлітків вони можуть викликати серйозні лейкопенії, тромбоцитопенії, рідше
– анемії. Якщо число лейкоцитів падає нижче 2,5х109/л, лікування цими препаратами взагалі припиняють. При лейкопенії паралельно призначають лейкоген, пентоксил, метацил, полівітаміни. При тяжкій панцитопенії показано призначення глюкокортикоїдів (преднізолону). Зобогенний ефект тиреостатиків (збільшення розмірів і ущільнення щитоподібної залози) знижують одночасним призначенням левотироксину, особливо при прогресуванні офтальмопатії. При ДТЗ обов’язково залучають до комплексу симптоматичного лікування симпатолітики, β-адреноблокатори, седативні препарати, за показаннями – серцеві засоби та глюкокортикоїди.
При офтальмопатії, що спричиняє підлітку неприємні відчуття в очах (різі, біль, світлобоязнь, відчуття «піску», почервоніння кон’юнктиви і склери), можна використовувати очні краплі з дексаметазоном або гідрокортизоном. Дуже корисний ефект дає носіння темних сонцезахисних окулярів.
Якщо офтальмопатія прогресує, то використовують цитостатики, а також імунодепресанти (глюкокортикоїди), плазмосорбцію, при показаннях – струмектомію.
Для зняття симпатикотонічних ефектів призначають β-адреноблокатори (анаприлін, пропранолол, атенолол, метопролол) в дозі 1-3 мг/кг/добу під контролем частоти серцевих скорочень. Через 3-4 тижні β-адреноблокатори відміняють. В легких випадках дифузний токсичний зоб можна навіть лікувати лише одними β-адреноблокаторами, які, сприяючи перетворенню тироксину в неактивну форму трийодтироніну (в реверсивний Т3), знижують титр тиреостимулюючих автоантитіл й підви-щують кількість Т-супресорів (CD8позитивних лімфоцитів), знижують токсичний ефект трийодтироніну на серце.
Хірургічне лікування показано в таких випадках: 1) зоб великий, розташований загрудинно, має вузли; 2) виник рецидив тиреотоксикозу або є непереносимість тиреостатиків; 3) зоб тисне на оточуючі органи (стравохід, трахея, поворотний нерв з афонією); 4) безуспішне консервативне лікування протягом 2 років; 5) швидке збільшення розмірів ЩЗ під час лікування. Йому обов’язково повинна передувати тиреостатична терапія до досягнення стану еутиреозу.
Ефективність лікування
Об’єктивним контролем ефективності проведеного лікування (крім клінічної картини) є визначення рівня Т3, Т4, ТТГ й тиреоїдстимулюючих антитіл у сироватці крові.
Якщо, не дивлячись на замісну антитиреоїдну терапію (1-1,5 року), рівень тиреоїдстимулюючих антитіл в сироватці крові не знижується, подальше продовження консервативної терапії можна вважати безперспективним. В таких випадках необхідно рекомендувати хірургічне лікування.
Перед операцією проводять підготовку розчином Люголя (по 15 крапель на молоці 3 рази на день протягом 10 днів) з метою зменшення кровонаповнення щитоподібної залози і профілактики можливих ускладнень під час хірургічного втручання (кровотеча, тиреотоксичний криз через випадкове потрапляння в кров великої кількості тиреоїдних гормонів із зони операції).
Операція вибору – субтотальна резекція щитоподібної залози.
Профілактика
Своєчасне лікування інфекцій, санація осередків латентної інфекції. Важливе раннє виявлення ювенільного зобу й за необхідності його лікування левотироксином.
Слід з обережністю призначати аміодарон (кордарон) та інші препарати, що містять йод. Доведено, що в осіб, які лікувалися від серцевих аритмій кордароном, що містить в одній таблетці річну фізіологічну потребу в йоді, одним із типових наслідків такого лікування був аутоімунний тиреоїдит.
Умови, в яких потрібно надавати медичну допомогу: поліклінічні відділення, в яких проводять під наглядом ендокринолога діагностику, профілактику і лікування ДТЗ. Хірургічне лікування проводять у відповідних спеціалізованих відділеннях.
Перелік і обсяг обов’язкових медичних послуг: огляд ендокринолога, визначення вільного Т4, Т3 (1 раз на місяць), ТТГ, антитіл до тиреоїдної пероксидази, тиреоглобуліну (1 раз на 3 місяці), загальний аналіз крові (1 раз на тиждень в перший місяць тиреостатичної терапії та 1 раз на місяць при переході на підтримуючі дози), біохімічний аніліз крові, ЕКГ, ПКГ, УЗД ЩЗ, огляд окуліста, невролога.
Юридические аспекты
Перед проведенням конкретних діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Доброякісні пухлини щитоподібної залози
МКХ-10: D34
Общая информация
Протягом останніх років спостерігається тенденція до зростання показників захворюваності на новоутворення щитоподібної залози серед дітей та підлітків.
За характером росту та клінічного перебігу виділяють доброякісні та злоякісні пухлини.
Фолікулярна аденома щитоподібної залози – доброякісна пухлина щитоподібної залози, що розвивається з фолікулярного епітелію. Це доволі поширене захворювання. За даними деяких авторів, виявляється у 3-4% населення. В структурі доброякісної хірургічної тиреоїдної патології у дітей та підлітків фолікулярна аденома щитоподібної залози займає друге місце після вузлового зобу, що складає 30% випадків. У дівчаток вона зустрічається частіше, ніж у хлопчиків.
Токсична аденома щитоподібної залози – доброякісна пухлина, що продукує надмірну кількість тиреоїдних гормонів і подібна за своїм перебігом до клініки тиреотоксикозу. Токсична аденома у дітей та підлітків зустрічається рідко.
Етіологія
Причини розвитку токсичної аденоми щитоподібної залози вивчені недостатньо. Токсичні аденоми з’являються частіше у мешканців йододефіцитного регіону.
Патогенез
Токсична аденома щитоподібної залози характеризується автономною надлишковою секрецією тиреоїдних гормонів (переважно – трийодтироніну, Т3), незалежно від секреції ТТГ, що призводить до розвитку тиреотоксикозу.
Центральний вплив на утворення гормонів у щитоподібній залозі за цього захворювання відсутній, що підтверджується нормальним чи зниженим рівнем тиреотропіну. Надлишкова автономна продукція аденомою тиреоїдних гормонів призводить до пригнічення продукції тиреотропіну гіпофізом. Це супроводжується зниженням активності тканини ЩЗ, що оточує аденому.
Загальновизнаним є той факт, що для розвитку тиреотоксичної аденоми та її автономної діяльності потрібно від 3 до 8 років.
Клиническая картина
На передній поверхні шиї в ділянці щитоподібної залози виявляють вузол округлої форми з чіткими контурами та гладенькою поверхнею, рухливий при ковтанні.
Виділяють функціонально неактивну та функціонально активну (токсичну) аденому щитоподібної залози. Токсична аденома зазвичай має фолікулярну будову і продукує велику кількість тиреоїдних гормонів, що призводить до виникнення ознак тиреотоксикозу. Надмірна секреція цих гормонів призводить до пригнічення секреції ТТГ та гіпоплазії тканини залози (поза вузлом).
При функціонально неактивних аденомах, які не поглинають радіоактивний йод, на сканограмі виявляють «холодні» вузли. Клінічно спостерігається стан еутиреозу. У деяких випадках можливий крововилив в аденому, що супроводжується різким збільшенням її розмірів і болем у щитоподібній залозі. Необхідно пам’ятати про можливість наявності злоякісних елементів в аденомі, особливо якщо на сканограмі виявлено «холодний» вузол.
Доброякісні аденоми щитоподібної залози – це невеликі за розміром вузли, зазвичай поодинокі. Аденоми обов’язково інкапсульовані й не інфільтрують оточуючу тиреоїдну тканину. Ці аденоми щитоподібної залози ростуть повільно. Токсична аденома локалізується частіше в одній долі, рідше – у перешийку.
Діти та підлітки з активною токсичною аденомою скаржаться на загальну і м’язову слабкість, відчуття жару, серцебиття. Тиреотоксикоз при токсичній аденомі ЩЗ може бути різним – від легкого до вираженого. При вираженому тиреотоксикозі у хворих спостерігається помітне схуднення, тахікардія, тремор пальців рук, м’язова слабкість, підвищене потовиділення, плаксивість, субфебрильна температура. Ніколи не буває екзофтальму, але може бути порушення конвергенції очей – симптом Мебіуса, а іноді – симптом Грефе.
Клініка токсичної аденоми нагадує клінічну картину нейроциркуляторної дистонії.
Классификая и примеры формулировки диагноза
Класифікація фолікулярної аденоми
За гістологічною будовою розрізняють:
• нормофолікулярну;
• макрофолікулярну;
• мікрофолікулярну;
• трабекулярну і солідну.
Класифікація токсичної аденоми:
• тиреотоксична (типова);
• асимптоматична (латентна).
Диагностика
Першочерговим у діагностиці є пальпаторне виявлення вузлового утворення в ЩЗ. У подальшому для уточнення діагнозу використовують УЗД ЩЗ. Обов’язковим є виконання тонкоголкової пункційної біопсії та дослідження пунктату. Визначають у крові рівні вільного тироксину, тиреотропіну та тиреоїдстимулюючі антитіла.
Приклад формулювання діагнозу
Токсична аденома щитоподібної залози.
Диференційна діагностика
Диференційну діагностику потрібно виконувати із злоякісними пухлинами ЩЗ (фолікулярною карциномою та фолікулярним варіантом папілярної карциноми), кістами, тиреотоксикозом.
Лечение
При фолікулярній аденомі застосовують тиреоїдні препарати з диференціально-діагностичною метою. При фолікулярній аденомі ЩЗ не спостерігається помітного зменшення вузлів.
При токсичній аденомі ЩЗ призначають тиреостатичні препарати (тіамазол). Комплексна терапія складається з призначення тиреостатиків та β-адреноблокаторів (анаприлін, атенолол), які нормалізують вегетативні порушення. Тривале лікування тиреотоксичної аденоми не проводять, оскільки це може стимулювати ріст пухлини.
Показаннями до оперативного лікування є:
• токсична аденома;
• функціонуюча аденома.
Профілактика
Важливою є профілактика вірусних інфекцій. За можливості слід уникати впливу на організм хімічних мутагенів (формаліну, нітратів, нітритів, цитостатиків).
Рекомендації щодо подальшого, у разі потреби, надання медичної допомоги хворому
Після хірургічного видалення аденоми дитина або підліток потребує диспансерного нагляду ендокринолога 1 раз на місяць протягом 6 місяців, в подальшому – 2 рази на рік.
При цьому вимірюють АТ, пульс, температуру, виконують клінічні аналізи крові, сечі, визначають рівень трийодтироніну, вільного тироксину, тиреотропіну.
Юридические аспекты
Перед проведенням діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Злоякісні пухлини щитоподібної залози
МКХ-10: С73
Общая информация
Рак щитоподібної залози – злоякісне новоутворення щитоподібної залози епітеліального походження.
Починаючи з 1990 р. серед осіб дитячого і підліткового віку, які проживають в радіаційно забруднених регіонах України, відзначено ріст частоти папілярного раку щитоподібної залози. За останні 10-15 років кількість пацієнтів збільшилася у 14 разів порівняно з доаварійним періодом. Мінімальний латентний період розвитку пухлинного процесу в щитоподібній залозі склав 4 роки від моменту аварії.
Ріст захворюваності злоякісними новоутвореннями щитоподібної залози відбувався, в основному, за рахунок хворих, які постраждали внаслідок впливу іонізуючого випромінення у віці 0-4 роки. При спостереженні за різними групами дітей з поодинокими вузлами ознаки злоякісного процесу зустрічалися частіше серед дівчаток, а несприятливий перебіг характерніший для хлопчиків.
Поширеність раку щитоподібної залози в Україні у дітей впродовж 2006-2007 рр. становила 26 випадків на 100 тис населення. Захворюваність на 100 тис населення у дітей – 0,09.
Етіологія
Причина раку чітко не встановлена. Проте відомі деякі чинники, що сприяють злоякісній трансформації тиреоїдного епітелію. До них належать іонізуюче випромінювання, йодна недостатність, різні порушення гормональної кореляції та генетична схильність.
Рак щитоподібної залози може розвиватися на тлі попередніх доброякісних аденом (фолікулярні аденоми з колоїдною, ембріональною, макрофолікулярною структурою чи із структурою оксифільних клітин Гюртля).
Багаточисельні спостереження показують, що опромінення голови і ділянки шиї дозою 200-700 рад. (з приводу тимомегалії або патології ЛОР-органів) у дітей збільшує частоту раку ЩЗ. Збільшення частоти злоякісного переродження ЩЗ у дітей в регіонах, які зазнали радіонуклідного забруднення внаслідок аварії на Чорнобильській АЕС, підтверджує взаємозв’язок опромінення і раку ЩЗ.
Патогенез
Іонізуюча радіація впливає на злоякісне переродження залози двома шляхами: первинне порушення ДНК, що сприяє злоякісному росту тканин; зниження внаслідок опромінення ЩЗ її функціональної активності, розвиток різного ступеня її недостатності й хронічна стимуляція ТТГ призводить до автономної гіперплазії, утворення вузла і його трансформації в рак. В останні роки з’явились дані щодо участі онкогенів і пухлинносупресивних генів у механізмах розвитку раку. Онкогени є частиною геному, але зазвичай вони знаходяться в «репресивному», неактивному стані. Їх активація може відбуватися під впливом мутації, делеції чи хромосомної транслокації. Такий стан трансформує клітини в стан неконтрольованого росту.
Клиническая картина
Рак щитоподібної залози являє собою поодинокий безбольовий вузол із тенденцією до швидкого росту; набуває щільної консистенції й викликає відчуття стиснення в ділянці щитоподібної залози. При дослідженні виявляється збільшення регіонарних лімфовузлів. Функціональний стан ЩЗ залишається, як правило, в межах норми.
Анамнез хвороби при раку щитоподібної залози у підлітків коротший, ніж у дорослих, але перебіг повільний, особливо при диференційній формі раку. Часто нерозпізнаний за життя рак щитоподібної залози – знахідка при аутопсії.
Клінічні симптоми, характерні для раку щитоподібної залози: швидкий ріcт та щільна консистенція вузла, збільшення регіонарних лімфатичних вузлів, випадки медулярного раку в сім’ї, парез голосових зв’язок.
Нерідко вузол знаходять при профоглядах, на медичних комісіях у райвійськкоматах. Скарг зазвичай нема, якщо пухлина не тисне на сусідні органи. Загальні симптоми (слабкість, стомлюваність, зниження маси тіла, підвищення температури тіла), в основному, можуть спостерігатись при розпаді пухлини.
Папілярний рак є найпоширенішою злоякісною пухлиною ЩЗ. Папілярні карциноми складають 50-80% всіх злоякісних пухлин щитоподібної залози. Важливим чинником у розвитку даної патології є радіація. Відомо, що 85% радіоіндукованих злоякісних пухлин є папілярними. Папілярний рак характеризується повільним ростом, при радіоізотопному дослідженні являє собою холодний вузол і нерідко супроводжується збільшенням шийних лімфатичних вузлів. Віддалені метастази, головним чином, у легені, виявляються у 5-7% хворих. Описано декілька варіантів папілярної карциноми. Фолікулярний варіант складається переважно або виключно із фолікулярних структур, однак клітини та їхні ядра характеризуються типовими ознаками папілярного раку. Виділений також і більш агресивний дифузно-склерозуючий варіант, який найчастіше відзначається у дітей. Нерідко він супроводжується появою регіонарних і віддалених метастазів, головним чином, в легені. Цей варіант характеризується великою кількістю псамомних тілець, ділянками сквамозної метаплазії та лімфоїдною інфільтрацією.
Папілярні мікрокарциноми являють собою пухлини діаметром до 1 см. Ці пухлини, як правило, без клінічних проявів і виявляються випадково в біоптатах щитоподібної залози, видаленої з приводу інших захворювань. Першим можливим проявом мікрокарцином можуть бути метастатичні ураження шийних лімфатичних вузлів або, в рідкісних випадках, поява віддалених метастазів.
Макроскопічно папілярна карцинома найчастіше являє собою неінкапсульоване щільне утворення, розміри якого широко варіюють. Пухлина характеризується багатофокусним ростом, інфільтрує оточуючу тканину щитоподібної залози, капсулу залози, а іноді й прилеглі м’які тканини, легені. В окремих випадках папілярна карцинома може бути повністю або частково інкапсульованою. Мікроскопічно папілярна карцинома зазвичай являє собою пухлину з ознаками проростання у фіброзну строму, часто визначається судинна інвазія. Ядра клітин неправильної форми, як правило, містять внутрішньоядерні цитоплазматичні включення та борідки.
Метастазування найчастіше відбувається в шийні лімфовузли, а також у легені та кістки. При багатовузловому зобі часто один із вузлів – із щільнішою консистенцією (порівняно з іншими ділянками і вузлами ЩЗ) й перевищує їх за розміром, є папілярним раком.
Фолікулярний рак у дітей зустрічається рідко. При обстеженні виявляють аденому, яку важко відрізнити від фолікулярної аденоми. Фолікулярні карциноми, за даними літератури, складають 10-40% злоякісних пухлин щитоподібної залози. Фолікулярні карциноми найчастіше зустрічається у мешканців йододефіцитних територій.
Фолікулярний рак характеризується агресивнішим перебігом і повільним ростом. Частіше дає метастази в лімфатичні вузли шиї. Найважливішою прогностичною особливістю фолікулярного раку є ступінь інвазії: 1) інкапсульована пухлина з мінімальною інвазією; 2) рак із обширною інвазією; в останньому випадку слід враховувати здатність розповсюдження по кровоносному руслу, тобто першим проявом може бути віддалений метастаз, особливо в кістки і легені.
Медулярний рак є доволі рідкісною пухлиною, що розвивається із парафолікулярних С-клітин. Розрізняють спонтанну і спадкову форми медулярної карциноми. Медулярна карцинома часто поєднується з множинними ендокринними неоплазіями (MEN-синдроми). При синдромі MEN-2А, який є сімейним, у хворих, крім медулярної карциноми, можуть бути виявлені феохромоцитома й гіперплазія паращитовидних залоз із супутньою С-клітинною гіперплазією та гіперплазією мозкової речовини наднирників. При синдромі MEN-2В медулярна карцинома розвивається в результаті спонтанних мутацій. При синдромі MEN-2В медулярна карцинома також поєднується із С-клітинною гіперплазією, феохромоцитомою та гіперплазією мозкової речовини наднирників. Крім того, у хворих можуть спостерігатися багаточисельні невроми слизових оболонок, гангліоневроми травного тракту, порушення з боку шлунково-кишкового тракту (діарея), які інколи проявляються задовго до розвитку медулярної карциноми. Метастази в регіонарні лімфатичні вузли визначаються у 50% хворих вже в період діагностики захворювання. Віддалені метастази в легені, кістки, печінку прослідковуються в 15% випадків.
Недиференційований (анапластичний) рак – пухлина, що складається з веретеноподібних та гіганських клітин, так званих клітин карциносаркоми і епідермального раку.
Недиференційована (анапластична) карцинома складає до 15% всіх злоякісних новоутворень щитоподібної залози.
В генезі цього захворювання певну роль відіграють зовнішнє опромінення і мутації ras онкогену. Клінічні симптоми такі: пацієнт часто скаржиться на швидкий ріст утворення та біль в ділянці шиї, збільшення шийних лімфатичних вузлів і локальні симптоми здавлення. Нерідко відзначаються ознаки метастатичних уражень лімфовузлів та зниження маси тіла.
Процеси деструкції, що швидко розвиваються в паренхімі пухлини, можуть призвести до появи симптомів тиреоїдиту або гіпертиреозу, що зумовлено, мабуть, виділенням гормонів із зруйнованих фолікулів. Недиференційовані або анапластичні пухлини зазвичай інфільтрують одну або обидві долі щитоподібної залози та прилеглі структури шиї.
Часто спостерігаються ділянки геморагій, некрозів, кальцифікати, а також додаткові вузлові утворення. Відзначається одноабо двобічне ураження шийних лімфатичних вузлів.
Як правило, такій пухлині передує вузловий зоб, який виникає за кілька років до діагностики раку. Частіше такі пухлини виявляються в регіонах зобної епідемії. Клінічні симптоми: скарги на швидкий ріст утворення в ділянці шиї, збільшення шийних лімфатичних вузлів і локальні симптоми стиснення. Нерідко відзначається зниження маси тіла, ознаки проростання пухлини в трахею і стравохід, наявність метастазів у регіонарні лімфатичні вузли. Віддалені метастази можуть бути виявлені в легенях, органах травлення і наднирниках. Найчастіше хворі з апластичною карциномою знаходяться в еутиреоїдному стані. Прогноз захворювання вкрай несприятливий, з летальним наслідком протягом року у більшості випадків.
Классификая и примеры формулировки диагноза
Класифікація
Для визначення поширеності патологічного процесу застосовують Міжнародну клінічну класифікацію TNM, де Т – характеристика первинної пухлини, N – регіонарні лімфатичні вузли, М – віддалені метастази. Схема дозволяє визначити стан хворого, обрати оптимальні режими лікування, оцінити їх результати.
Класифікація поширеності раку щитоподібної залози за системою TNM
Первинна пухлина (Т):
Tx – недостатньо даних для оцінки,
Tо – немає доказів наявності первинного осередку,
T1 – пухлина до 1,0 см, в межах тканини залози,
T2 – пухлина до 4,0 см, в межах тканини залози,
T3 – пухлина завбільшки 4,0 см, в межах тканини залози,
T4 – пухлина будь-якого розміру, розповсюджується за межі капсули залози.
Регіонарні лімфатичні вузли (N):
Nх – недостатньо даних для оцінки регіонарних лімфатичних вузлів,
Nо – немає ознак ураження регіонарних лімфатичних вузлів,
N1 – наявне ураження лімфатичних вузлів на боці пухлини,
N2 – наявне двобічне ураження регіонарних лімфатичних вузлів.
Віддалені метастази (М):
Мо – немає віддалених метастазів,
М1 – наявні віддалені метастази.
Диагностика
Важливий анамнез попереднього опромінювання ділянки голови та шиї (в таких випадках ризик раку щитоподібної залози в 2 рази вищий, якщо опромінення відбулося до 18-річного віку). Пальпаторно рак ЩЗ яввляє собою одинокий безбольовий вузол.
Виявлення поєднаного ураження щитоподібної залози й лімфовузлів дуже підозріле на рак щитоподібної залози.
Для встановлення діагнозу і визначення стадії захворювання обов’язковими є ультразвукове дослідження ЩЗ, рентгенографія легенів, тонкоголкова аспіраційна пункційна біопсія (ТАПБ) ЩЗ із цитологічним дослідженням одержаних зразків. Пункція виконується під контролем УЗД. Для визначення функціонального стану ЩЗ проводять дослідження тиреоїдних гормонів: Т4 вільного, Т3, ТТГ.
Найбільш ранніми ультрасонографічними ознаками злоякісного переродження тканини щитоподібної залози є вогнищеві зміни її ехогенності. При ультразвуковому дослідженні в паренхімі залози візуалізуються гіпоехогенні ділянки, розміри яких відповідають площі злоякісно зміненої тканини. Характерною є відсутність чітких меж між ділянками із зміненою ехоструктурою і оточуючою їх паренхімою. В цих випадках раковий вузол зазвичай візуалізується як гіпоехогенна ділянка різної (як правило, неправильної) форми без чітких контурів та нерівними межами. Типовим ультразвуковим симптомом при раку ЩЗ є порушення цілосності капсули щитоподібної залози. В процесі росту злоякісної пухлини в раковій тканині розвиваються вторинні зміни (найчастіше – декальцинація ракового вузла). Ділянки декальцинації візуалізуються у вигляді гіперехогенних локусів різних розмірів і форми, що розташовуються в центрі та по периферії ракового вузла.
Поява гіперехогенних кальцинатів на тлі гіпоехогенного вузла характерніша для злоякісних пухлин великого розміру. Поряд з одинокими раковими вузлами, на ультрасонограмах можуть чітко візуалізуватися й множинні вузли раку ЩЗ.
У хворих з підозрою на рак ЩЗ ультрасонографія може бути використана як метод, що дозволяє розпізнати локальні зміни тиреоїдної паренхіми.
Для постановки остаточного діагнозу і, головним чином, для підтвердження або спростування ознак злоякісності в усіх випадках необхідно виконувати тонкоголкову аспіраційну пунційну біопсію (ТАПБ). Папілярні карциноми діагностуються на основі виявлення папілярних структур, пластів клітин, що нашаровуються, ядерних включень, псамомних тілець.
Для фолікулярних неоплазій характерні мікрофолікулярні структури.
Для медулярного раку типові поодинокі дрібнозернисті клітини або їх скупчення.
Анапластичний рак характеризується поліморфізмом клітин (веретеноподібні, полігональні, гіганські, розміщені розрізнено) та великою кількістю метастазів.
При імуноморфологічному та молекулярно-біологічному дослідженні транслокація ret-онкогену (рецептор звязаний з тирозинкіназою) спостерігається при папілярних карциномах і, як правило, не характерний для злоякісних новоутворень інших органів. Пацієнти з папілярними карциномами щитоподібної залози, в яких виявляються перебудови ret-онкогену, мають більшу вірогідність розвитку віддалених метастазів.
Специфічніші для папілярної (аніж для фолікулярної) карциноми експресії високомолекулярних цитокератинів (епідермальний прекератин) і низькомолекулярного кератину-19.
Точкові мутації ras-генів частіше відзначаються при фолікулярних, аніж при папілярних карциномах. Майже 50% фолікулярних аденом пов’язані з мутацією ras-генів.
Мутації гена р53 визначаються виключно в анапластичних карциномах. Найспецифічнішим імуногістохімічним маркером медулярних карцином є кальцитонін. Рівень кальцитоніну буде підвищеним за наявності медулярної карциноми (> 100 пг/мл).
Рівень тиреоглобуліну є високоінформативним показником післяопераційного стану хворих з диференційованими формами раку щитоподібної залози (визначення рівня тиреоглобуліну перед видаленням новоутворення не має діагностичного значення).
Показання для визначення: раннє виявлення рецидивів і метастазів високодиференційованого раку щитоподібної залози у оперованих пацієнтів, оцінка ефективності радіойодтерапії метастазів раку щитоподібної залози.
Морфологічна характеристика злоякісних пухлин у дітей та підлітків
Папілярні карциноми макроскопічно являють собою щільні білуваті утворення без чітких меж, нерідко – з хрящеподібним центром, що розміщуються (локалізуються) в різних ділянках однієї чи обох долей. Розмір пухлин зазвичай більший 1 см в діаметрі, в середньому –1,5-2 см. Типовий папілярний варіант характеризується наявністю багаточисельних папул, які утворюють специфічні деревоподібні розгалуження.
Особливістю папілярної карциноми є наявність різко просвітлених ядер овальної або округлої форми з хроматином по його периферії.
При фолікулярному варіанті папілярної карциноми спостерігаються просвітлені ядра з краєвим розміщенням хроматину.
У випадку солідного варіанту папілярної карциноми переважали пухлини альвеолярно-солідної будови, коли ділянки пухлини розділені сполучно-тканинними прошарками на острівці. При дифузно-склерозуючому варіанті відзначаються ознаки дифузного розповсюдження вогнищ пухлини по залозі без наявності локалізованого утворення.
Фолікулярні карциноми являють собою солітарні інкапсульовані вузли (2,5-3,5 см в діаметрі), переважно мікрофолікулярної будови, з ділянками солідного росту. Ядра, на відміну від папілярних карцином, щільні, без вираженої порізаності контурів, з локальними ознаками атипії. Фолікулярні карциноми проявляють інтенсивно позитивну реакцію на тиреоглобулін при імуногістохімічних дослідженнях.
Медулярні карциноми являють собою неінкапсульовані пухлини з ознаками інфільтрації капсули залози, внутрішньозалозистого розповсюдження та інвазією пухлинних клітин в лімфатичні й кровоносні судини. Для заключної постановки діагнозу використовують імуногістохімічний метод із застосуванням антитіл до кальцитоніну. Реакція при медулярній карциномі позитивна. Пухлинні клітини проявляють ознаки інтенсивної інвазії в кровоносні судини капсули і пухлини.
Диференційна діагностика
Рак ЩЗ диференціюють з вузловим колоїдним зобом, токсичною аденомою ЩЗ, інфекційними захворюваннями (туберкульозом), ВІЛ-інфекцією, первинним гіпопаратиреозом. Диференційний діагноз базується на клінічних ознаках, результатах інструментального дослідження (УЗД, ТАПБ, визначенні пухлинних маркерів).
Лечение
Лікування раку ЩЗ включає хірургічне втручання, радіойодотерапію, променеву терапію, супресивну терапію тиреоїдними гормонами. Вибір методів лікування залежить від типу раку та стадії процесу. Незалежно від форми раку, операцією вибору є тиреоїдектомія. За наявності регіонарних метастазів виконують одноабо двобічну дисекцію лімфовузлів шиї. Хворим після тиреоїдектомії з приводу папілярного та фолікулярного раку через 6 тижнів призначається лікування радіоактивним йодом (І131) для знищення залишкової тканини залози і метастазів, якщо вони є. До призначення радіойоду хворі не повинні отримувати тиреоїдні гормони. Діагностичне сканування з І131 проводять кожні 6 місяців протягом 3 років і, за наявним накопиченням ізотопу (залишкова тканина, метастази), призначають лікувальну дозу радіоактивного йоду.
Після тиреоїдектомії з приводу медулярного й анапластичного раку призначається дистанційна променева терапія. Хворі, оперовані з приводу диференційованих форм раку ЩЗ, отримують постійно супресивну терапію тиреоїдними гормонами (2,2-2,5 мкг/кг на добу) під контролем рівня ТТГ у крові, який не повинен перевищувати 0,1-0,2 ОД/мл.
Після операцій з приводу медулярного й анапластичного раку проводиться замісна терапія тиреоїдними гормонами.
При папілярному раку після досягнення повної ремісії кожні 6 місяців хворий повинен бути обстежений. Проводиться огляд ендокринолога, загальний та біохімічний аналіз крові (з обовязковим визначенням кальцію), визначення вільного тироксину, трийодтироніну, тиреотропіну, а також тиреоглобуліну 1 раз на рік.
При фолікулярному раку, окрім вищезазначених показників, кожні 2 роки проводять рентгенографію легенів.
При медулярному раку контроль рівня кальцитоніну проводять 1 раз на рік для виявлення рецидивів і метастазів. Діагностика раку ЩЗ може проводитися амбулаторно або в стаціонарі лікувального закладу.
Профілактика
Обмеження використання у дітей та підлітків променевих методів діагностики й лікування, особливо тих, що зачіпають ділянку щитоподібної залози.
У лікарів повинна бути особлива онкообережність до підлітків з виявленими вузлами і кістами в щитоподібній залозі, а також до постраждалих від впливу іонізованої радіації.
Будь-яка патологія щитоподібної залози підлітків потребує запобіганню будь-яких іонізуючих випромінювань. Небажане тривале перебування біля телевізорів і моніторів, забороняються електрофізіота теплові процедури на ділянку шиї. Шийна лімфоаденопатія у підлітків завжди повинна насторожувати щодо можливості раку щитоподібної залози.
Рекомендована збалансована дієта з використанням білків, жирів, вуглеводів, вітамінів, обмеження струмогенних продуктів.
Юридические аспекты
Перед проведенням діагностичних та лікувальних процедур потрібно отримати згоду пацієнта, його батьків або опікуна.
Йододефіцитні захворювання
МКХ-10: е01.1
Общая информация
Йододефіцитні захворювання (ЙДЗ) включають патологічні стани, пов’язані з порушенням функції щитоподібної залози (ЩЗ), обумовленим зниженням вживання йоду.
Згідно даних ВООЗ (1990), 1570 млн. осіб (30% населення світу) мають ризик розвитку ЙДЗ, в тому числі більше 500 млн. мешкають у регіонах з тяжким дефіцитом йоду.
Концепція ЙДЗ сформувалася біля 15-20 років тому. До цього йодний дефіцит асоціювався виключно з ендемічним зобом – видимою і відносно нетяжкою патологією, що достатньо легко коригується за допомогою препаратів йоду і/або тиреоїдних гормонів. Значно більшою проблемою ЙДЗ є порушення розвитку центральної нервової системи, що проявляється зниженням рівня інтелектуального розвитку з наслідками не лише для однієї людини, але і суспільства в цілому.
Нині, крім ендемічного зобу, виділяють цілу низку захворювань, зумовлених йодною недостатністю, а зоб залишається одним із найбільш ранніх проявів ЙДЗ. Спектр клінічних проявів дефіциту йоду в організмі достатньо широкий і залежить від віку, в якому виникла недостатність йоду (таблиця 1).
За даними деяких авторів, 68% новонароджених від матерів з патологією ЩЗ страждають перинатальною енцефалопатією, 28% – анемією, 23% – внутрішньоутробною гіпотрофією. Частота аномалій розвитку плоду при цьому складає 18-20%. Найчастіше вражаються центральна нервова (гідроцефалія, мікроцефалія, хвороба Дауна, функціональні порушення) і ендокринна (вроджений гіпотиреоз, тиреотоксикоз) системи. В Україні спостерігаються вогнища (осередки) зобної ендемії у Закарпатській, Рівненській, Прикарпатській, Чернігівській, Київській областях, як правило, в сільських регіонах.
Після народження дитини вплив тиреоїдних гормонів на розвиток його головного мозку і становлення пізнавальних функцій не тільки не зникає, а активно проявляється, особливо щодо диференціювання нейронів, росту аксонів і дендритів, формування синапсів, гліогенезу, зрілості гіпокампу та мозочку (протягом всього першого року життя), а також стимулюється мієліногенез і мієлінізація відростків нейроцитів (впродовж двох років постнатального етапу розвитку). В результаті виникаючої з причини йоддефіциту гіпотироксинемії (частіше – відносної) у мозку, що розвивається, спостерігається дизонтогенез вищих психічних функцій.
Патологічний ефект дефіциту йоду на мозок дитини опосередкований порушенням дозрівання й міграції нервових клітин, послабленням мієлінізації та гальмуванням формування відростків нейроцитів і синаптогенезу, зниженням синтезу фактору росту нервів, нейромедіаторів і нейропептидів. Ці відхилення є предиктором для порушення процесів становлення когнітивних функцій людини.
Порушення в формуванні мозку дитини на тлі недостатності йоду можуть проявлятися в широкому діапазоні – від зниження інтелекту легкого ступеня до тяжких форм ендемічного кретинізму. В деяких випадках ці відхилення не виявляються в період новонароджуваності та проявляються тільки в період статевого дозрівання.
Проживання в районах із дефіцитом йоду може викликати зниження слуху, погіршення зорової пам’яті, іншої психічної діяльності, а також адаптаційних можливостей ЦНС.
Не дивлячись на те, що функції ЩЗ матері та плоду пов’язані не дуже тісно, нормалізація ендокринного статусу матері все ж є однією із умов нормального функціонування фетальної ЩЗ.
Етіологія
Основна роль в етіології йододефіцитних захворювань відводиться йодній недостатності.
Проте важливе значення мають й інші чинники (умови життя, соціальний рівень, кількість мікроелементів, що вживаються з їжею). Різні бактерії вміщують прогойтрин, який під впливом різних ферментів (мірозиназа) конвертується в активний фермент – гойтрин, який є активним інгібітором організації йоду в ЩЗ. Деякі бактерії здатні продукувати білки з тиреоїдостимулюючою активністю. Струмогени (тіоціанати, флавоноїди, тіооксизолідони) знаходяться в різних видах овочів (соя, арахіс, кольорова капуста, турнепс). Кишкова паличка в процесі своєї життєдіяльності продукує білки і ферменти, які знижують спроможність ЩЗ до захвату йоду.
Недостатнє харчування, особливо зниження в їжі вітаміну А, призводить до порушення структури тиреоглобуліну і, відповідно, синтезу тиреоїдних гормонів.
Підсиленню йодної недостатності організму сприяє зниження вмісту таких мікроелементів, як кобальт, мідь, цинк, молібден.
Патогенез
Патогенез збільшення щитоподібної залози досить складний. За своєю суттю формування зобу є компенсаторною реакцією, спрямованою на підтримку постійної концентрації тиреоїдних гормонів в організмі за умов йодної недостатності.
Зниження вмісту йоду в тканині щитоподібної залози викликає посилену продукцію місцевих тканинних ростових факторів. Найбільше значення з них мають інсуліноподібний фактор росту 1 типу (ІФР-1), епідермальний ростовий фактор (ЕРФ), основний фактор зростання вмісту фібробластів (ФРФ) та трансформуючий ростовий фактор β (ТРФ-β). Доведено, що ріст ізольованих фолікулів щитоподібної залози, які містять достатню кількість йоду, не вдається простимулювати введенням ТТГ. Крім того, виявилося, що при блокаді рецепторів ІРФ-1 специфічними антитілами ТТГ не спроможний викликати трофічні впливи на тиреоцити.
Йод, потрапляючи в тиреоцит, утворює сполуки з ліпідами (йодолактони). Йодовані ліпіди є потужними інгібіторами продукції ІРФ-1 та інших ростових факторів. За відсутності цієї блокади ростові фактори запускають проліферативні процеси, результатом яких є гіперплазія тиреоцитів. Крім того, йодовані ліпіди пригнічують у тиреоциті цАМФ-залежні процеси, що й запобігає стимульованим ефектам ТТГ за умов достатнього інтратиреоїдного вмісту йоду.
Клиническая картина
Клінічна картина йоддефіцитного збільшення ЩЗ – це помірне дифузне збільшення щитоподібної залози у дитячому віці, яке частіше зустрічається у дівчаток в період пубертату.
Йоддефіцитний зоб часто має перебіг з явищами гіпотиреозу.
Клінічні прояви різкого зниження функції щитоподібної залози (гіпотиреозу) у дитини залежать від віку, в якому виникло захворювання, його тривалості й ступеня тиреоїдної недостатності. Уроджений гіпотиреоз проявляється в перші дні життя дитини. Запідозрити наявність гіпотиреозу у новонародженого дозволяють наступні ознаки: переношена вагітність, маса тіла при народженні більша за 4 кг, наявність набряків, послаблене ссання, здуття живота, закрепи, пупкова грижа, жовтяниця, що затягнулася. Дитина, як правило, спокійна, сонлива, рідко кричить, тембр голосу низький, язик не вміщується в роті, шкіра суха, ступні й кисті холодні. Часто спостерігається утруднення носового дихання, приступи ціанозу. Спостерігаються ознаки ураження ЦНС – затримка психічного розвитку, загальмованість, затримка розвитку мозку. Діти з гіпотиреозом починають пізно ходити, говорити, порушуються строки і порядок прорізання зубів, велике тім’ячко довго залишається відкритим. Волосся сухе, ламке, печінка збільшена в розмірах.
Класифікація та приклади формулювання діагнозу
За класифікацією ВООЗ (2001), виділяють такі ступені зобу: 0 ступінь – зобу немає; 1 ступінь – зоб (розміри часток не перевищують розміри дистальної фаланги великого пальця обстежуваної особи) пальпується і видно його при закинутій голові; 2 ступінь – зоб видно при звичайному положенні шиї.
Приклад формулювання діагнозу
Дифузний ендемічний зоб І ст. Еутиреоз.
Диагностика
Найпростішим методом діагностики є пальпація ЩЗ. Вона дає можливість виявити зоб, оцінити його величину (ступінь вираженості), а також знайти вузлові утворення й визначити їх розмір.
УЗД ЩЗ дозволяє визначити її об’єм, оцінити структуру тканини, знайти вузлові утворення й визначити їх розміри.
Функціональний стан ЩЗ визначають за рівнем Т3 вільного, Т4 вільного і ТТГ в сироватці крові. Недостатність надходження йоду в організм визначають за допомогою визначення екскреції йоду з сечею.
Для оцінки тяжкості зобної ендемії використовуються клінічні індикатори (екскреція йоду з сечею, рівень тиреотропного гормону гіпофізу і гормонів щитоподібної залози в крові). Для оцінки тяжкості зобної ендемії необхідно оцінити як мінімум два параметри – поширеність зобу в популяції і концентрація йоду в сечі. Раннє виявлення вродженого гіпотиреозу (скринінг) необхідно проводити всім новонародженим дітям уже в пологовому будинку (визначення рівня тиреотропного гормону в 6-8 краплях крові, взятих із п’ятки новонародженого і нанесених на спеціальну діагностичну смужку).
Оцінка ступеня йодного дефіциту проводиться відповідно до рекомендацій ВООЗ та міжнародного центру з боротьби із йододефіцитними захворюваннями (таблиця 2).
Вміст йоду в сечі зазвичай визначають церійарсенітним методом за методикою R. Gute-Kunst в модифікації Dunn (1993). Трактують одержані результати відповідно до світових критеріїв: йодурія менше 20 мкг/л відповідає тяжкій формі йододефіциту, 20-49 мкг/л – середньому ступеню йододефіциту, 50-99 мкг/л – легкій формі йододефіциту. Рівень екскреції, що перевищує 100 мкг/л, розцінюється як нормальний.
Доведена наявність зворотного зв’язку між об’ємом щитоподібної залози у дітей і екскрецією йоду з сечею. Розвиток зобу спостерігається у випадках, коли вміст йоду в сечі не досягає нижньої відмітки норми (100 мкг/л).
У підлітків із регіонів йодного дефіциту, які зазнали впливу несприятливих чинників внаслідок аварії на ЧАЕС, спостерігається тяжкий перебіг захворювання зі схильністю до розвитку гіпотиреозу.
Диференційна діагностика
Диференційну діагностику проводять із дифузним токсичним зобом, дифузним нетоксичним зобом, аутоімунним тиреоїдитом.
Лечение
При йододефіцитному зобі лікування спрямоване на нормалізацію забезпечення організму хворого йодом. Для цього використовують йодовані продукти харчування (морепродукти, йодовану сіль, харчові йодовані добавки, препарати, що містять йод).
Добова потреба в йоді становить у дітей дошкільного віку 90 мкг/добу, віком від 6 до 12 років – 120 мкг/ добу, старших 12 років – 150 мкг/добу. Добова доза не повинна перевищувати 200 мкг. Препаратами вибору є калій йодид, йодомарин. Ефективність лікування – зменшення розмірів зобу. Терапію йодидами при позитивному ефекті продовжують до 1,5-2 років.
Терапія препаратами левотироксину призначається хворим у випадках наявності лабораторного (субклінічного) або явного гіпотиреозу.
Ефективність лікування оцінюють через 6 місяців. При досягненні нормального об’єму ЩЗ левотироксин відміняють і знову призначають препарати йоду, контролюючи на їх тлі об’єм ЩЗ.
Профілактика
На сьогодні загальновизнаними є три види йодної профілактики: масовий, груповий, індивідуальний. Для масової профілактики у загальнодержавному масштабі збагачують йодом основні продукти харчування. У більшості країн світу, зокрема й в Україні, таким продуктом є йодована сіль. Її отримують шляхом додавання йодату калію із забезпеченням рівня йодування 40 мг йоду в 1 кг солі. Таким чином, в 1 г йодованої солі міститься в середньому 40 мкг йоду. Середньодобове споживання солі складає 5-10 г. Отже, потрапляння йоду в організм із сіллю з урахуванням 50% втрат при збергіанні й кулінарній обробці становить 100-200 мкг на добу. Додаткове надходження такої дози йоду в цілому дозволяє забезпечити фізіологічні потреби організму в ньому.
Групова профілактика передбачає застосування препаратів йоду в організованих колективах (дитячих садках, школах, спеціалізованих навчальних закладах). Прикладом такої профілактики у минулому було використання антиструміну.
Індивідуальну профілактику проводять серед неорганізованого населення та за спеціальними медичними показаннями. Найефективнішим засобом індивідуальної йодної профілактики є прийом препаратів йоду (йодомарин, калію йодид, йодобаланс).
Юридические аспекты
Перед проведенням конкретних діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Підгострий тиреоїдит
МКХ-10: е06.1
Общая информация
Підгострий тиреоїдит (тиреоїдит де Кервена) – загальне захворювання щитоподібної залози (ЩЗ) вірусної природи, що супроводжується деструкцією тиреоцитів.
Підгострий тиреоїдит – відносно рідкісне захворювання, яке складає не більше 1-2% всіх захворювань ЩЗ. У дітей зустрічається рідко. Спостерігається чітка сезонність захворювання (осінь – зима).
Етіологія
Підгострий тиреоїдит де Кервена має вірусну етіологію. Припускається участь деяких серотипів вірусів кору і свинки, багато свідчень про провокуючу роль ентеровірусів Коксакі та ЕСНО, вірусу Епштейна-Барра, епізодично відзначається зв’язок із гострими респіраторними вірусними інфекціями (аденовірусною, грипозною й іншої етіології). Із бактерій до його появи може бути причетним збудник хвороби котячих подряпин – фелінозу (від латинського felis – кіт).
Патогенез
Підгострий тиреоїдит розвивається через 2-3 тижні після вірусних інфекцій (грип, аденовіруси), після подряпин кішки (хламідії).
Внаслідок запальних реакцій виникає деструкція фолікулів щитоподібної залози із вивільненням їх вмісту в кров. У крові збільшується рівень тироксину, трийодтироніну, інших йодованих компонентів і тиреоглобуліну, в результаті чого блокується секреція тиреотропіну. Клінічно розгортаються прояви тиреотоксикозу. Функціональна активність ЩЗ зменшується, про що свідчить низьке поглинання радіоактивного йоду. Наведені зміни спричиняють так звану тиреотоксичну фазу підгострого тиреоїдиту.
Із зменшенням наявних у колоїді запасів тиреоїдних гормонів виникає транзиторний гіпотиреоз, що отримало в клініці назву гіпотиреоїдної фази підгострого тиреоїдиту. При частих рецидивах підгострого тиреоїдиту деструкція і фіброз можуть захопити значну частину залози й призвести до розвитку стійкого гіпотиреозу.
Клиническая картина
Захворювання починається із загальної реакції запалення, локального болю, припухлості й болю при пальпації в щитоподібній залозі, нездужанням, субфебрильною температурою. Інколи спостерігаються явища тиреотоксикозу. Біль в ділянці щитоподібної залози посилюється при розгинанні шиї або ковтанні. Відзначається інтенсивне потовиділення, серцебиття, безсоння, плаксивість, втрата маси тіла. Тривалість перебігу захворювання коливається від декількох тижнів до декількох місяців. Виділяють дві фази: гостру фазу і фазу відновлення. Гостра фаза триває від 2 до 6 тижнів і характеризується підвищенням рівня тиреоїдних гормонів, зниженням рівня ТТГ. При цьому спостерігаються клінічні прояви гіпертиреозу, біль при пальпації ЩЗ. У фазі відновлення може спостерігатися лабораторна картина гіпотиреозу з підвищенням рівня ТТГ і зниженням рівня Т4. Гіпотиреоз може зберігатися від 2 до 7 місяців, тоді як розміри і консистенція залози нормалізуються. Через декілька тижнів після дебюту захворювання може визначатися високий рівень мікросомальних антитіл і антитіл до тиреопероксидази, проте антитіла зникають до кінця відновлювального періоду. Транзиторне підвищення рівня антитіл пояснюється руйнуванням тиреоглобулінів з виходом їх в кров’яне русло.
Классификая и примеры формулировки диагноза
Класифікація (I. Heriman, 1980). Тиреоїдит підгострий:
а) де Кервена; б) вірусний.
Приклад формулювання діагнозу
Підгострий тиреоїдит, еутиреоїдна стадія.
Диагностика
Основні критерії діагностики: 1) анамнестичні дані – перенесена вірусна інфекція; 2) збільшення й болі в ЩЗ, підвищення температури тіла, прискорена ШОЕ; 3) цитологічне дослідження – наявність детритного фону (десквамовані тиреоцити з деструкцією і некрозом), скупчення гістіоцитів, наявність гігантських багатоядерних клітин.
Допоміжні критерії: підвищений рівень тиреоїдних гормонів та знижений рівень тиреотропіну. При УЗД щитоподібної залози – ізоехогенність тканини ЩЗ, неоднорідність структури залози, пальпаторно – тверда залоза з неправильними контурами.
Диференційна діагностика
Диференційну діагностику підгострого тиреоїдиту необхідно проводити з: гострим гнійним тиреоїдитом, гострим негнійним тиреоїдитом, ДТЗ, аутоімунним тиреоїдитом, раком ЩЗ (недиференційованим) та з деякими неендокринними захворюваннями: міозитом, фарингітом, отитом, флегмоною шиї, езофагітом, вегетосудинною дистонією.
Лечение
У дітей підгострий тиреоїдит характеризується м’яким перебігом із спонтанним зворотнім розвитком, тому рекомендується проводити симптоматичну терапію.
Використовуються нестероїдні протизапальні препарати (німесіл, напроксен). В разі неефективності можливе використання глюкокортикоїдів в дозі 0,5-1 мг на добу. Дозу зменшують кожні 7 днів (за умови нормалізації ШОЕ, зменшення або зникнення болю в ЩЗ). Для усунення симптомів тиреотоксикозу використовують препарати β-адреноблокаторів (анаприлін), селективні β-адреноблокатори (корвітол, локрен), які призначають по 10-30 мг на добу.
У разі появи гіпотиреозу хворим призначають L-тироксин протягом 3-6 міс. з поступовим зниженням і в подальшому з повною відміною. Як правило, адекватна доза у дітей дошкільного віку складає 25-50 мкг/добу й у дітей шкільного віку – 50-100 мкг на добу. Використання препаратів антибактеріальної дії не є доцільним.
Умови, за яких потрібно надавати медичну допомогу
Хворі з підгострим тиреоїдитом повинні отримувати медичну допомогу тільки за умов спеціалізованих ендокринних відділень.
Характеристика кінцевого очікуваного результату лікування
Одужання пацієнта. Нормалізація функціональної активності ЩЗ.
Рекомендації щодо надання медичної допомоги хворому
Кожні 6 міс:
• контрольний огляд ендокринолога;
• УЗД ЩЗ;
• контроль рівня тиреоїдних гормонів і ТТГ у крові. Вимоги до дієтичних призначень і обмежень:
Повноцінне збалансоване харчування, необхідна кількість вітамінів і мінералів у раціоні. Важливо уникати контактів з вірусними інфекціями, застуд і переохолоджень, а також нервово-психічних навантажень.
Юридические аспекты
Перед проведенням конкретних діагностичних та лікувальних процедур потрібно отримати згоду батьків або офіційного опікуна дитини.
Тиреотоксична криза
МКХ-10: е05.5
Общая информация
Найнебезпечніше для життя хворого ускладнення ДТЗ – тиреотоксична криза.
Етіологія
Тиреотоксична криза може бути викликана різними причинами, найчастішими з яких є проведення резекції ЩЗ на тлі некомпенсованого ДТЗ або якщо в доі післяопераційному періоді не користуються глюкокортикоїдами. Причинами кризи можуть бути відміна або неадекватне проведення антитиреоїдної терапії, інфекційні захворювання, психічна травма, тяжке фізичне навантаження, оперативне втручання поза щитовидною залозою.
Патогенез
В основі патогенезу тиреотоксичної кризи лежить різке підвищення виділення в кров тиреоїдних гормонів. На цьому тлі збільшуються прояви відносної надниркової недостатності, тому що тиреоїдні гормони підсилюють метаболізм кортизолу. На фоні кризи зростає потреба периферичних тканин у глюкокортикоїдах, що підсилює відносну надниркову недостатність.
Клиническая картина
Криза, як правило, розвивається протягом кількох годин, рідше – поступово, протягом декількох днів. Наростає збудженість, тахікардія, з’являється аритмія, підвищується температура, систолічний АТ підвищується, а діастолічний – знижується, наростають в подальшому ознаки серцевої недостатності. У хворих відзначаються безсоння, блювання, пітливість, відчуття страху, різкий головний біль, гіперемія обличчя, олігурія, часте дихання, задуха, рухлива неспокійність, яка змінюється адинамією, апатією, аж до коматозного стану.
Диагностика
Лечение
Лікування тиреотоксичної кризи грунтується на гальмуванні синтезу і периферійної конверсії тиреоїдних гормонів, а також – на пригніченні адренергічних реакцій, спричинених тиреоїдними гормонами. При виборі антитиреоїдних препаратів перевагу віддають пропилтіоурацилу, тому що він гальмує периферійне перетворення Т4 в Т3. Тиреостатики вводяться перорально через зонд: пропіціл – в дозі 300-400 мг; тіамазол – в дозі 30-40 мг кожні 4-6 години. Одночасно проводять інфузійну терапію глюкозосольовими розчинами з розрахунку 1500 мл/м2 поверхні тіла + 60 мл/кг для дітей до 10 років і 1500 мл/м2 поверхні тіла + 50 мл/кг для дітей, старших 10 років. Після введення антитиреоїдних препаратів починають введення йодидів з метою блокування виходу тиреоїдних гормонів з щитоподібної залози в кров: 15-30 крапель 1% розчину Люголя вводять кожні 6 годин. Обов’язкове використання глюкокортикоїдів: гідрокортизон вводять в дозі 2 мг/кг кожні 6 год. З метою зменшення адренергічних ефектів тиреоїдних гормонів використовують β-адреноблокатори (анаприлін) з розрахунку 1 мг/кг на добу перорально.



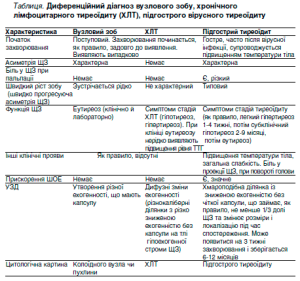
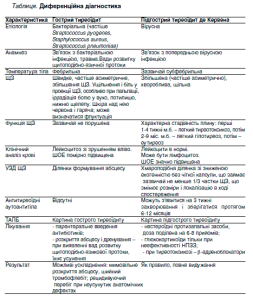
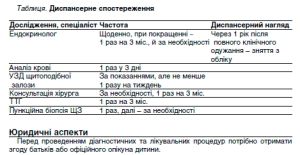
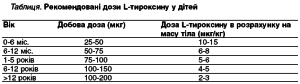
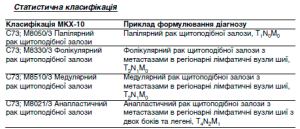
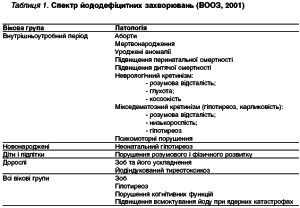
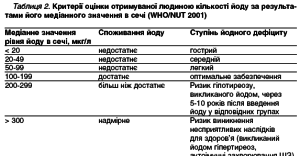







Комментировать