Результаты хирургического лечения пациентов с опухолями зрительного бугра различных топографических типов за период 1985—2010 гг.
Представлены результаты хирургического лечения пациентов с опухолями зрительного бугра различных топографических типов за период 1985—2010 гг. Оперированы 127 пациентов, которым осуществлено 147 прямых хирургических вмешательств. Повторно оперированы пациенты в связи с частичным удалением опухоли или ее рецидивом.
В большинстве наблюдений резекция опухоли производилась через транскаллезный (48%) и затылочный межполушарный доступы (29%). Реже применялись транскортикальные доступы (лобный, височный, теменной) (14%), птериональный доступ через латеральные и базальные отделы сильвиевой щели (6%) и субтенториальный супрацеребеллярный доступ (3%). Выбор каждого из доступов диктуется топографическими особенностями опухоли в пределах зрительного бугра и направлением ее роста, отношением ее к смежным структурам (внутренняя капсула, ствол мозга, гипоталамус, желудочковая система). Каждый из доступов к опухолям зрительного бугра имеет преимущества и недостатки, которые описываются в статье.
Опухоли зрительного бугра относятся к группе глубинно расположенных супратенториальных опухолей, частота встречаемости которых составляет 1% всех интракраниальных опухолей, и 2—5% всех внутричерепных опухолей в детской популяции [5, 9, 12, 16, 19, 25, 26].
Опухоли данной локализации считаются прогностически неблагоприятными. Это связано с их инфильтративным ростом в большинстве случаев и глубинным расположением, когда попытки их удаления связаны с большим риском усугубления неврологической симптоматики вследствие повреждения функционально значимых смежных структур головного мозга (внутренней капсулы, подкорковых ядер, ствола мозга, магистральных сосудов) [4, 6, 8—10, 12, 14, 15, 18, 19, 24].
До начала 70-х годов прошлого столетия попытки удаления опухолей зрительного бугра приводили к большому количеству послеоперационных осложнений, тяжелой инвалидизации больного. Смертность после этих вмешательств достигала 30—50% [4, 9, 15, 19, 24]. Поэтому нейрохирурги того времени придерживались консервативного подхода к лечению данной патологии. Часть авторов [9, 24] придерживались тактики проведения лучевой терапии без гистологической верификации. Оперативная деятельность у них сводилась только к ликворошунтирующим операциям.
Появление в 70—80-х годах XX века высокоинформативных средств диагностики — компьютерной (КТ) и магнитно-резонансной томографии (МРТ) позволило проводить раннюю диагностику глубинных опухолей, детально рассматривать топографические и морфологические особенности опухолей головного мозга и, что очень ценно, опухолей глубинной локализации. Данные этих исследований в настоящее время являются основополагающими в определении тактики лечения опухолей зрительного бугра.
Травматичность хирургических доступов до появления КТ и МРТ была обусловлена трудностью определения точной локализации и размеров опухоли и вследствие этого неадекватного выбора доступа к опухоли. Появление КТ и МРТ сделало возможным детально представлять локализацию опухоли, определять ее морфологические особенности. Опухоли зрительного бугра стали разделять на опухоли передних отделов и опухоли подушки [11, 17, 20, 23].
Доступы стали избирательными и определялись топографией опухоли. В большинстве случаев применялись транскортикальные (лобный, теменной, височный) доступы [13, 17, 21, 23].
Начиная с 1985 г. в публикациях разных авторов [2, 3, 6, 12, 13, 17, 21—23] прослеживается тенденция отказа от консервативной тактики лечения опухолей зрительного бугра в пользу их хирургического удаления. При этом отмечено существенное снижение послеоперационной летальности и осложнений.
Развитие микронейрохирургии обусловило разработку малотравматичных доступов к глубинным структурам головного мозга, предполагающих минимальное рассечение мозгового вещества или сохранение его анатомической целостности. Широкое применение получили транскаллезный, затылочный межполушарный доступы к глубинным опухолям. Эти доступы стали использовать и при удалении опухоли зрительного бугра [2, 3, 7, 20, 22]. Несмотря на существенное улучшение результатов хирургического лечения, остается проблема систематизации хирургических доступов в зависимости от топографии опухоли в пределах таламуса и ее преимущественного распространения, что и стало задачей исследования.
Материал и методы
С 1985 по 2010 г. в НИИ нейрохирургии им. акад. Н.Н. Бурденко были оперированы 127 пациентов с опухолью зрительного бугра с различными топографическими и морфологическими свойствами, которым произведено 147 оперативных вмешательств. Повторные операции производились в связи с частичным удалением и рецидивом опухоли.
Анализ результатов оперативных вмешательств проводился на основании интраоперационных наблюдений, протоколов операций, динамики неврологического статуса пациентов после операции, данных КТ и МРТ, проводившихся в раннем послеоперационном периоде.
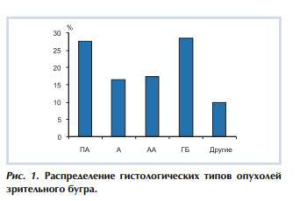
Возраст пациентов составлял от 2 до 50 лет. Детей было 76 (60%), взрослых — 51 (40%). Средний возраст детей — 11 лет, взрослых —32 года. Пациенты мужского пола составили 69 (54%), женского — 58 (46%). Опухоль располагалась слева у 59 (46%) больных, справа — у 68 (44%). Основными гистологическими типами опухолей зрительного бугра были глиомы различной степени злокачественности — пилоидные астроцитомы (ПА), астроцитомы (А), анапластические астроцитомы (АА), глиобластомы (ГБ) (90%) (рис. 1).
Результаты
В соответствии с разработанной нами топографической классификацией опухолей зрительного бугра [1] последние разделяются на опухоли:
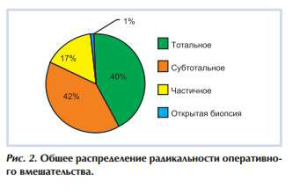
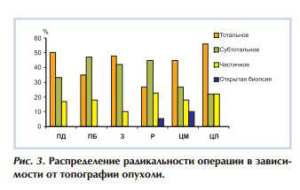
— передних отделов с преимущественно дорсальным распространением (ПД) и с преимущественно базальным распространением (ПБ); — задних отделов (опухоли подушки) (З), опухоли подушки зрительного бугра и среднего мозга (ЗС); — центральных отделов с преимущественно медиальным распространением (ЦМ) и с преимущественно латеральным распространением (ЦЛ); — распространенные (Р) — больших размеров опухоли, замещавшие весь зрительный бугор и деформировавшие все прилежащие структуры. Нами выделены три группы радикальности оперативных вмешательств: тотальное, субтотальное, частичное удаление (рис. 2).
Частота тотального удаления опухоли была выше при опухолях с переднедорсальным ростом, опухолях подушки, опухолях центральных отделов таламуса с медиальным и латеральным ростом. Большее число субтотальных удалений было осуществлено при опухолях с переднебазальным ростом, при распространенных опухолях и при опухолях подушки. Показатели частичного удаления были выше в группах пациентов с распространенными опухолями и опухолями с латеральным направлением роста. В 1% случаев оперативное вмешательство ограничилось открытой биопсией опухоли (в группах Р и ЦМ) (рис. 3).
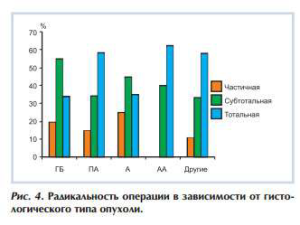
Показатели радикальности оперативного вмешательства в зависимости от гистологического типа опухоли отражены на рис. 4. Статистически значимых различий соотношения радикальности и гистологического варианта опухоли не выявлено. Тем не менее частота тотального удаления превалировала >50% при пилоидных астроцитомах, анапластических астроцитомах. Субтотальные и частичные удаления преобладали при глиобластомах (52 и 20%) и астроцитомах (42,86 и 23,81%) (см. рис. 4).
Динамика состояния пациентов в послеоперационном периоде была следующей: улучшение общего состояния к моменту выписки из стационара отмечено у 65% пациентов, ухудшение — у 16%. Состояние осталось прежним у 14% больных. В раннем послеоперационном периоде умерли 6 (5%) пациентов. 5 из умерших пациентов были дети с распространенными опухолями таламуса.
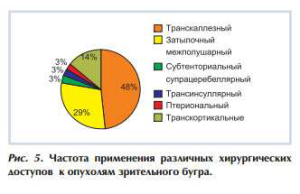
В большинстве наших наблюдений резекция опухоли производилась через транскаллезный (48%) и затылочный межполушарный доступы (29%), реже применялись транскортикальные доступы (лобный, височный, теменной) (14%), птериональный доступ через латеральные и базальные отделы сильвиевой щели (6%) и субтенториальный супрацеребеллярный доступ (3%) (рис. 5).
Разнообразие применявшихся доступов было обусловлено различным исходным местом роста опухоли в пределах зрительного бугра и разнонаправленностью ее роста, а также клинической картины заболевания (наличия окклюзии ликворных путей и гидроцефального расширения желудочковой системы, характера и выраженности очаговой неврологической симптоматики).
Транскаллезный доступ
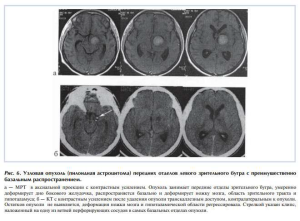
Транскаллезным доступом в нашем исследовании была осуществлена 71 операция. Удалялись опухоли всех топографических вариантов (ПД, ПБ, ЦЛ, ЦМ, Р), за исключением опухолей задних отделов зрительного бугра. Все краниотомии при транскаллезном доступе мы осуществляли с правой стороны. Контралатеральным считался доступ, когда опухоль располагалась с левой стороны. Наиболее «удобными» для резекции были опухоли передних отделов зрительного бугра (ПД, ПБ) и опухоли его центральных отделов с преимущественно медиальным ростом, когда отмечалась значительная деформация дна бокового и III желудочка, а угол операционного поля позволял визуализировать все участки опухоли. Частота тотальных удалений в этих топографических группах была выше (рис. 6).
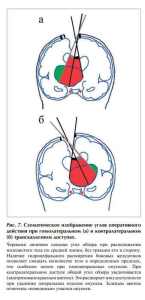
Радикальность операции при транскаллезном доступе была ниже при опухолях с латеральным направлением роста и распространенных опухолях, когда визуальный контроль был ограничен, и повышался риск повреждения функционально значимых структур. При контралатеральном транскаллезном доступе угол операционного действия увеличивается (рис. 7).
Это способствует большему визуальному контролю во время операции и, соответственно, позволяет добиться большей радикальности операции при отграниченных опухолях. При анализе удаления пилоидных астроцитом транскаллезным доступом нами выявлено, что процент тотальных и субтотальных удалений при применении контралатерального доступа был выше, чем при гомолатеральном (92 и 80% соответственно).
Преимуществами транскаллезного доступа являются его малая травматичность, наличие в поле зрения анатомических ориентиров и возможность подхода к опухоли без гидроцефального расширения желудочков. Основным недостатком этого доступа являются глубина раны и ограниченность операционного поля.
Затылочный межполушарный доступ
Затылочным межполушарным доступом в нашем исследовании осуществлены 42 операции. Он использован в основном при удалении опухолей задних отделов таламуса (З, ЗС), а также при распространенных опухолях. Краниотомия и доступ осуществлялись со стороны опухоли. Большинство операций (>90%) закончилось тотальным или субтотальным удалением. Частота радикальных удалений была выше при доброкачественных глиальных опухолях.
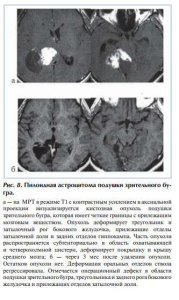
Наиболее адекватным при использовании этого доступа было удаление опухоли зрительного бугра, которая занимает задние его отделы (подушку) и распространяется в медиально-базальном направлении в область охватывающей цистерны (рис. 8). Доступ ограничен при значительном дорсолатеральном распространении опухоли (треугольник бокового желудочка и прилежащие отделы теменной доли).
Преимущество затылочного межполушарного доступа — минимальное рассечение мозга при подходе к опухоли, возможность визуализации анатомических структур и частей опухоли, расположенных супраи субтенториально. Основной недостаток — ограничение поля зрения при удалении латеральных отделов опухоли (в области треугольника бокового желудочка), риск повреждения глубоких вен мозга и медиальных отделов затылочной доли.
Инфратенториальный супрацеребеллярный доступ
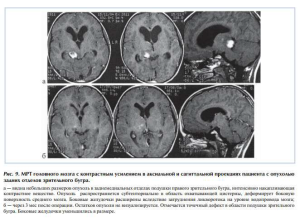
В 5 операциях при наличии опухоли подушки зрительного бугра был использован инфратенториальный супрацеребеллярный доступ. Выполнялась срединная субокципитальная краниотомия с обнажением краев поперечных синусов. Подход к опухоли осуществлялся латеральнее средней линии, над гемисферой мозжечка. Выбор данного подхода был обусловлен наличием опухоли задних отделов таламуса, основная масса которой локализовалась субтенториально (рис. 9).
В 2 случаях опухоли была удалена тотально. По 1 наблюдению было частичное и субтотальное удаление. Удобством данного доступа является то, что имеется возможность осуществить подход к опухоли без нарушения целостности мозгового вещества. Глубокие вены мозга при таком подходе расположены кверху от зоны хирургических манипуляций. Недостатком доступа является невозможность удаления опухоли подушки со значительным супратенториальным ростом.
Птериональный доступ
Резекция новообразования птериональным доступом через латеральные отделы сильвиевой щели, осуществленная нами в 4 операциях, была оправдана в связи со значительным латеральным распространением опухоли и ее близостью к островку. Медиальные отделы зрительного бугра при этом были сохранными, а гидроцефалия отсутствовала.
Для подхода к латеральной поверхности опухоли в этом случае была осуществлена препаровка сильвиевой щели и разрез коры островка в месте его наибольшей деформации. Аргументом в пользу данного доступа было также наличие грубого гемипареза у пациентов, обусловленного повреждением внутренней капсулы. Этот доступ является менее травматичным в сравнении с доступом через вещество височной доли, когда мозговая ткань рассекается на большем протяжении.
В части наблюдений опухолей зрительного бугра с преимущественно базальным распространением был использован доступ через базальные отделы сильвиевой щели (4 операции). Выбор данного доступа был обусловлен значительным базальным распространением опухоли передних отделов зрительного бугра с грубой деформацией гипоталамуса, зрительных путей и ствола мозга. Деформация дна бокового желудочка отсутствовала или была незначительной, гидроцефалия отсутствовала. Преимущество базального доступа — возможность визуального контроля структур основания мозга (зрительный тракт, ножка мозга) и расположенных в этой области артерий (ВСА, ЗСА, ЗМА, передней ворсинчатой артерии). Недостаток доступа — узость операционного поля, ограничивающая возможность визуализации и удаления верхних отделов опухоли.
Транскортикальные доступы
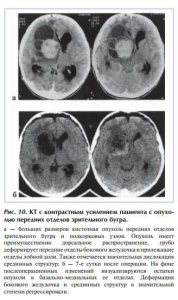
Транскортикальными доступами (лобным, теменным, височным) проведена 21 операция. Обоснованность применения этих доступов определялась значительным дорсолатеральным распространением опухоли с грубой деформацией прилежащих отделов лобной, теменной и височной долей (рис. 10).
Преимуществом этих доступов в сравнении с подходами через срединную щель мозга является отсутствие риска повреждения вен, впадающих в сагиттальный синус. Основной недостаток — более трудная ориентировка в ране.
Обсуждение
Анализ данных литературы [4, 9, 15, 19, 24] показал, что до появления КТ и МРТ (до 70-х годов прошлого века) хирургическая резекция опухолей зрительного бугра в большинстве случаев заканчивалась усугублением неврологического статуса или летальным исходом. Основным методом лечения глубинных опухолей была лучевая терапия, в ряде случаев улучшавшая прогноз. Появление МРТ, совершенствование микрохирургической техники и методов интенсивной терапии расширили показания к удалению новообразований зрительного бугра.
Количество публикаций по хирургии опухолей таламуса (начиная с середины 1980-х годов) увеличилось. Ввиду редкости патологии авторами [2, 3, 6, 12, 13, 17, 18, 20, 22, 23, 26] приводится анализ небольших групп пациентов. В них отмечается существенное уменьшение осложнений и летальных исходов после таких операций. Это обусловлено наличием четкого топического диагноза — опухоли зрительного бугра, а также совершенствованием микрохирургической техники, разработкой малотравматичных доступов. По мнению всех этих авторов, обоснованным является удаление отграниченных опухолей — пилоидных астроцитом. В публикациях также приводятся данные об удалении и инфильтративных глиом таламуса.
Большая часть современных авторов отмечают, что доступ к опухоли таламуса зависит от места ее исходного роста и преимущественного распространения. При этом одни хирурги применяют транскортикальные доступы, другие придерживаются тактики использования подходов через срединную щель. P.^Иу и соавт. [17] удаляют опухоли зрительного бугра транскортикальными доступами (лобный, теменной, височнозатылочный), выбор которых зависит от преимущественного расположения опухоли.
H.J. Stiger и соавт. [23], учитывая особенности топографического расположения таламуса, когда такие функционально значимые структуры, как внутренняя капсула, подкорковые узлы, ножка мозга, расположены кпереди и вентрально, считают, что опухоли таламуса удобнее удалять «сзади» посредством теменного транскортикального доступа и в некоторых случаях — субтенториального супрацеребеллярного доступа.
M. Ozek и соавт. [20] указывают на возможность радикального удаления узловых опухолей таламуса через затылочный межполушарный, транскаллезный и доступ через сильвиеву щель. Авторы предпочитают транскортикальным доступам вышеуказанные подходы [20]. Ryoji и соавт. [22] считают, что при опухолях подушки, помимо транскортикального теменно-затылочного доступа, необходимо широко использовать затылочный межполушарный доступ. Авторы также приводят случай радикального удаления опухоли подушки зрительного бугра с использованием комбинации теменного и затылочного межполушарного доступа.
A. Albright и соавт. [2] отмечают, что реальная оценка топографии опухоли позволяет в большинстве случаев пользоваться малотравматичными доступами через срединную щель.
Проанализировав эти работы и наши наблюдения, мы считаем, что большинство опухолей зрительного бугра могут быть удалены через транскаллезный и затылочный межполушарный доступы. В случаях, когда опухоль имеет преимущественно базальное направление роста или латеральное распространение, адекватным является применение доступа через базальные или латеральные отделы сильвиевой щели соответственно. При наличии небольших размеров опухоли подушки, располагающейся субтенториально, оптимально использование субтенториального супрацеребеллярного доступа. В определенных случаях, при наличии крупных опухолей зрительного бугра, с дорсолатеральным ростом и значительной деформацией прилежащих отделов лобной, теменной, височной долей наименее травматичным является использование транскортикальных подходов.
Разнообразие используемых доступов обусловлено различной топографией новообразований зрительного бугра и разнонаправленностью их роста. Каждый из доступов имеет свои преимущества и недостатки. Подход и удаление опухоли зрительного бугра проще осуществлять при широких боковых желудочках, так как выведение ликвора из них во время операции позволяет достаточно широко и менее травматично отводить полушарие мозга при подходах к опухоли через срединную щель (транскаллезный и межполушарный затылочный доступы) и соответственно иметь больший угол оперативного действия хирурга.
Вывод
Большинство опухолей зрительного бугра могут быть резецированы через транскаллезный и затылочный межполушарный доступы. В отдельных случаях адекватным является использование транскортикальных доступов, птерионального доступа через базальные и латеральные отделы сильвиевой щели и субтенториального супрацеребеллярного доступа. Выбор каждого из доступов диктуется топографическими особенностями опухоли в пределах зрительного бугра и направлением ее роста. Каждый из доступов к опухолям зрительного бугра имеет преимущества и недостатки.
Комментарий
Данное исследование представляет большую серию с охватом 127 больных (как взрослых, так и детей), оперированных по поводу опухолей таламуса в НИИ нейрохирургии им. Н.Н. Бурденко в период с 1985 по 2010 г. Учитывая редкость нозологии, представленная серия является значительной. Сложность рассматриваемого вопроса заключается в том, что опухоли таламуса относятся к группе глубинно расположенных опухолей, большой процент которых представлен злокачественными новообразованиями (глиомы gradeIII и gradeIV).
Удаление этих опухолей связано с высоким риском нарастания неврологического дефицита вследствие повреждения рядом расположенных функционально значимых образований (внутренняя капсула, подкорковые ядра, ствол мозга, магистральные сосуды). Вместе с этим радикальность хирургического вмешательства является значимым фактором в исходе комплексного лечения данных опухолей.
Поэтому использование оптимальных нейрохирургических подходов является чрезвычайно важной задачей, хотя говорить именно о радикальном удалении глиальных опухолей, особенно такой локализации, не представляется возможным. С биологической точки зрения тотально глиальную опухоль убрать нельзя, можно говорить только о тотальном удалении солитарного узла.
В настоящем исследовании рассматриваются практически все возможные на сегодняшний день хирургические доступы к опухолям зрительного бугра. Авторами проведено подразделение опухолей представленной локализации в зависимости от их топографоанатомических особенностей, что, безусловно, является определяющим при выборе того или иного подхода. В статье освещены возможности различных хирургических доступов, рассмотрены преимущества и недостатки каждого из них. Проведено сравнение личного опыта с данными зарубежных авторов. С учетом собственного опыта и опыта различных хирургов, авторы пришли к заключению, что наиболее оптимальными доступами к опухолям таламуса, позволяющими достаточно радикально производить резекцию этих новообразований, являются транскаллезный и затылочный межполушарный доступы (использовались в 48 и 29% операций соответственно). Также рассмотрены ситуации, при которых обоснованным является использование транскортикальных доступов, птерионального доступа через базальные и латеральные отделы сильвиевой щели и субтенториального супрацеребеллярного доступа. С учетом того, что больные оперированы на протяжении 25 лет, была бы очень интересной оценка катамнеза: зависел ли он каким-то образом от выбранного доступа. В целом представленная статья посвящена рассмотрению, безусловно, актуального вопроса — выбору оптимальных доступов к опухолям зрительного бугра, что является определяющим в достижении максимальной полноты вмешательства. Статья соответствует всем требованиям, предъявляемым к работам такого рода, будет очень полезна нейрохирургам и специалистам смежных специальностей.
О.Н. Древаль (Москва)
Литература
- Кадыров Ш.У., Коновалов А.Н., Озерова В.И. и др. Нейрорентгенологическая диагностика опухолей зрительного бугра. Вопр нейрохирургии 2007;3:3—10.
- Albright A.L. Feasibility and advisability of resections of thalamic tumors in pediatric patients. J Neurosurg Spine 2004; 100:5:468—472.
- Albright A.L., Sclabassi R.J. Use of the Cavitron ultrasonic surgical aspirator and evoked potentials for the treatment of thalamic and brain stem tumors in children. Neurosurgery 1985;17:564—568.
- Arseni C. Tumors of the basal ganglia. Their surgical treatment. Arch Neurol Psychiatry 1958;80:18—24.
- Beks J.W., Bouma G.J., Journee H.L. Tumors of the thalamic region. A retrospective study of 27 cases. Acta Neurochir (Wien) 1987;85:125—127.
- Bernstein M., Hoffman H.J., Holliday W.C. et. al. Thalamic tumors in children. J Neurosurg 1984;61:649—656.
- Belloti C., Pappada G., Sani R. The transcallosal approach for lesions affecting the lateral and third ventricle: Surgical considerations and results of 42 cases. Acta Neurochir (Wien) 1991;111:103—107.
- Cappabianca P., Spaziante R., de Divitiis E. Thalamic cavernous malformations. Comment J Neurosurg 1991;75:169.
- Cheek W.R., Taveras J. Thalamic tumors. J Neurosurg 1966;24:505—513.
- Cohen M.E., Duffner P.K. Brain tumors in children. Raven Press. New York 1994.
- Colosimo C., di Leila G.M., Tartaglione T. et al. Neuroimaging of thalamic tumors in children. Childs Nerv Syst 2002; 18:8:426—439.
- Cuccia V., Monges J. Thalamic tumors in children. Childs Nerv Syst 1997;13:514—52I.
- Drake J.M., Joy M., Goldenberg A. et al. Computerand robot-assisted resection of thalamic astrocytomas in children. Neurosurgery 1991;29:27—33.
- Fransini A., Leocato F., Cajola L. et al. Low-grade glial tumors in basal ganglia and thalamus: natural history and biological reappraisal. Neurosurgery 1994;35:817—821.
- Greenwood J.Jr. Radical surgery of tumors of the thalamus, hypothalamus and third ventricle area. Surg Neurol 1973;1:29—83.
- Hirose G., Lombroso С.Т., Eisenberg H. Thalamic tumors in childhood. Arch Neurol 1975;32:740—744.
- Kelly P.J. Stereotactic biopsy and resection of thalamic astrocytomas. Neurosurgery 1989;25:185—195.
- Krouwer H., Prados M. Infiltrative astrocytomas of the thalamus. J Neurosurg 1995;82:548—557.
- McKissock W., Paine K.W.E. Primary tumors of the thalamus. Brain 1958;81:41—63.
- Ozek M.M., Ture U. Surgical approach to thalamic tumors. Child’s Nerv Syst 2002;18:450—456.
- Prakash B. Surgical approach to large thalamic gliomas. Acta Neurochir (Wien) 1985;74:100—104.
- Ryoji Ishii, Yasuo S., Akira W. et al. Gross total removal of gliomas in the pulvinar and correlative microsurgical anatomy. Neurol Med Chir (Tokyo) 2002;42:536—546.
- Steiger H.J., Gotz C., Schmid-Elsaesser R. et al. Thalamic astrocytomas: surgical anatomy and results of a pilot series using maximum microsurgical removal. Acta Neurochir (Wien) 2000;142:1327—1337.
- Tovi D., Schisano G., Liljeqvist B. Primary tumors of the region of the thalamus. J Neurosurg 1961;18:730—740.
- Villarejo F., Amaya C., Perez Diaz C. Radical surgery of thalamic tumors in children. Childs Nerv Syst 1994;10:111—114.
- Yasargil M.G. Microneurosurgery. Thieme (Stuttgart) 1996;4B:29—91, 252—312, 291—342.





Комментировать