Виявлення та оцінка факторів, що впливають на перебіг серцевої недостатності у хворих, які перенесли протезування клапанів серця. Спроба визначення чинників, які впливають на відновлення структури та функції серця у післяопераційний період.
В.И. Целуйко, А.В. Жадан, О.А. РоманенкоХарківська медична академія післядипломної освітиКлючові cлова: набуті вади серця, ремоделювання серця
Незважаючи на наявність ефективних методів лікування хронічної ревматичної хвороби серця в Україні, зберігається велика кількість хворих з набутими вадами серця [1]. Окрім ревматизму, до розвитку набутих вад серця призводять інфекційний ендокардит, атеросклероз, сепсис, сифіліс, вроджена аномалія аортального клапана (АК) – двостулковий АК та вади, які формуються на тлі захворювань сполучної тканини. За даними [1, 2], на сьогодні поширеність набутих вад серця у світі – 2,5 %, що становить близько 20 % усіх органічних уражень серця. Клінічний перебіг захворювання значною мірою залежить від порушень гемодинаміки, зумовлених вадою серця. Основні механізми компенсації – гіпертрофія та дилатація перевантажених відділів серця. При стійких або прогресуючих гемодинамічних розладах компенсаторні резерви вичерпуються, настає міогенна дилатація, при якій механізм Франка – Старлінга (посилення скорочень серця у відповідь на додаткове розтягнення міокарда) не працює, виникає серцева недостатність [3, 4]. Тому надзвичайно важливою є своєчасна корекція вади, яка забезпечує зменшення клінічних проявів та прогресування серцевої недостатності. Значною мірою прогноз хворих, яким проведено оперативне втручання, залежить від ремоделювання серця [5, 6, 10], яке, на жаль, спостерігають не у всіх хворих. Тому актуальним є визначення чинників, які впливають на відновлення структури та функції серця у післяопераційний період.
Мета дослідження – виявити та оцінити фактори, що впливають на перебіг серцевої недостатності у хворих, які перенесли протезування клапанів серця.
Матеріал і методи
Обстежено 47 хворих (30 чоловіків та 17 жінок) віком 23–72 років (у середньому (54,7±12,0) року), яким проведено хірургічне лікування набутих вад серця – протезування клапана серця. Пацієнтів з двома протезованими клапанами у дослідження не включали. Також не залучали хворих з ураженням клапана, яке не підлягало хірургічній корекції, та хворих із супутньою патологією, що могла б істотно вплинути на прогноз захворювання. Група була досить гетерогенною, найбільше було обстежених із вадою АК: з аортальним стенозом (АС) – 15 (32 %) осіб, недостатністю АК – 13 (28 %). У 19 (40 %) пацієнтів провели втручання на мітральному клапані (МК), серед яких мітральний стеноз (МС) був у 10 (21 %) осіб, а недостатність мітрального клапана (НМК) – у 9 (19 %). В 11 (25 %) хворих на момент призначення операції відзначали ознаки легеневої гіпертензії (ЛГ): тиск у легеневій артерії – 50 мм рт. ст. і більше. Пацієнти, що взяли участь у дослідженні, мали вади серця ІІ–ІІІ стадій.
За етіологією хворі були розподілені так: 17 (36 %) обстежених мали ревматичне ураження клапана, у 4 (9 %) – вада виникла внаслідок інфекційного ендокардиту; дегенеративну природу формування вади мали 19 (41 %) осіб, ішемічна хвороба серця призвела до ураження клапанного апарату в 3 (6 %) пацієнтів, у 3 (6 %) – вада серця сформувалася на тлі природженої аномалії двостулкового АК, в одного (2 %) пацієнта вада серця – недостатність АК – сформувалася внаслідок сифілітичного процесу. У жінок частіше відзначали МС ревматичного походження (n=9), у чоловіків – НМК, яка сформувалася внаслідок ішемічної хвороби серця або артеріальної гіпертензії (n=9), недостатність
АК унаслідок інфекційного ендокардиту спостерігали у чоловіків (n=3), дегенеративні вади клапанів серця – також переважно у чоловіків.
У 17 (36 %) хворих зареєстровано есенціальну гіпертензію, у 3 (6 %) – ішемічну хворобу серця, у 5 (11 %) – цукровий діабет (ЦД), у 2 (4 %) – хронічне обструктивне захворювання легенів, у 3 (6 %) – захворювання органів травлення.
Перебіг хвороби ускладнився розвитком серцевої недостатності, при цьому більшість становили хворі ІІ функціонального класу (ФК) за NYНA – 26 (55 %) пацієнтів, ІІІ ФК – 18 (38 %), ІV ФК – 3 (6 %). У 17 (36 %) пацієнтів реєстрували миготливу аритмію, серед яких у 9 була постійна форма, а у 8 – персистуюча.
У комплекс обстеження поряд із загальноклінічними дослідженнями увійшли ехокардіографія, тест із 6-хвилинною ходьбою, ЕКГ спокою.
Обстеження хворих було проведено безпосередньо перед хірургічним втручанням, через 1 міс та через 6 міс після хірургічного лікування. Статистичну обробку проводили за допомогою статистичного пакета Statistica 6.0.
Результати та їх обговорення
При обстеженні хворих перед операцією встановлено, що найчастішою скаргою була задишка (у 60 %), запаморочення реєстрували у 53 % осіб, порушення ритму серця – у 36 %, болі в ділянці серця – у 30 %. Порівняльна оцінка скарг хворих залежно від ураження клапана свідчить, що при ураженні МК клінічні прояви захворювання більш виражені. Так, у разі вади МК задишку фіксували в 38 % осіб, запаморочення – у 32 %, порушення ритму – у 21 %, а у разі ураження АК – відповідно у 21; 21 та 15 % (табл. 1).
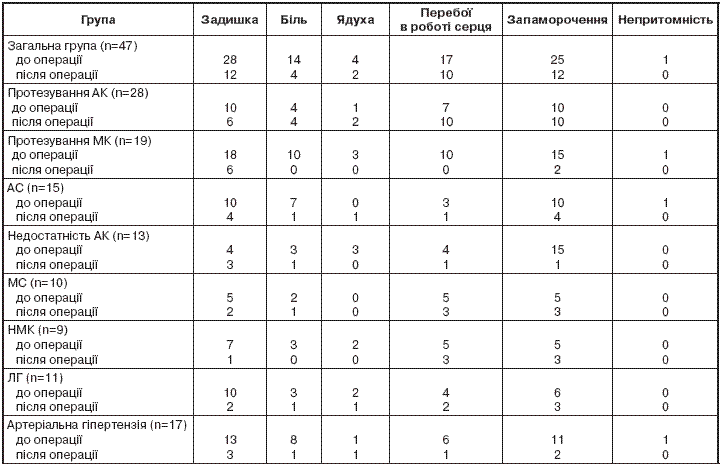
Проведення операції сприяло поліпшенню стану як безпосередньо після втручання, так і більшою мірою через 6 міс потому. Якщо до операції 28 хворих відзначали задишку, то на етапі реабілітації – 12 пацієнтів, а через півроку – 8. Запаморочення реєстрували 12 хворих, порушення серцевого ритму – 10, болі в ділянці серця – 4. Суттєво зменшився відсоток хворих, які скаржилися на аритмію (36; 30 та 29 %) та болі в ділянці серця (30; 20 та 11 %) – відповідно до операції, через 1 міс та через 6 міс після операції.
При цьому більш виражене поліпшення стану відзначали хворі з ураженням МК. Так, питома вага хворих, які скаржилися на задишку, зменшилася на 85 %, запаморочення – на 85 %, перебої та болі зникли зовсім. Це пояснюється тим, що порушення кровообігу в малому колі (ЛГ) має поліетіологічний характер. Якщо при стенозі мітрального отвору головною причиною ЛГ є порушення відтоку з малого круга кровообігу внаслідок звуження шляхів відтоку з лівого предсердя, то при інших вадах серця (НМК, аортальні пороки) ЛГ є першим проявом зниження скорочувальної функції лівого шлуночка (ЛШ) [3].
У той же час у хворих з ураженням АК скарги мали більш стійкий характер. Так, поліпшення стану спостерігали лише у 40 %, у той час як позитивної динаміки інших скарг не відзначали. Таку закономірність відзначали як у хворих з недостатністю АК, так і з АС.
Результати тесту з 6-хвилинною ходьбою, проведеного до хірургічного втручання, свідчать про наявність серцевої недостатності із зменшенням дистанції до (293±89) м у цілому по групі і до (262±88) м у підгрупі хворих з ЛГ. При проведенні тесту через 6 міс реєстрували збільшення цього показника в цілому по групі до (347±84) м (Р<0,01) та до (301±82) м (Р<0,01) у групі з ЛГ.
Також слід підкреслити, що в обох групах зменшився ФК серцевої недостатності. Так, у загальній групі до операції ІІ ФК за NYHA мали 55 % пацієнтів, ІІІ ФК – 38 %, IV ФК – 6 %, а через 6 міс після операції – відповідно 57; 43 і 0 %. У групі пацієнтів з ЛГ до оперативного лікування ІІ ФК за NYHA мали 36 % пацієнтів, ІІІ ФК – 55 %, IV ФК – 9 %, а через 6 міс після операції – відповідно 56; 44 і 0 %.
Аналіз даних ехокардіографії свідчить, що хірургічне лікування сприяє поліпшенню кардіогемодинаміки.
Найбільш суттєве зменшення розміру лівого передсердя спостерігали в осіб з ЛГ у доопераційний період. Так, до хірургічного лікування діаметр лівого передсердя у цих хворих дорівнював (59,4±8,5) мм, після – (52,2±8,1) мм (Р<0,01). У цих хворих відзначено достовірне (Р<0,05) зменшення кінцеводіастолічного розміру (КДР) та маси міокарда (ММ) ЛШ (табл. 2).
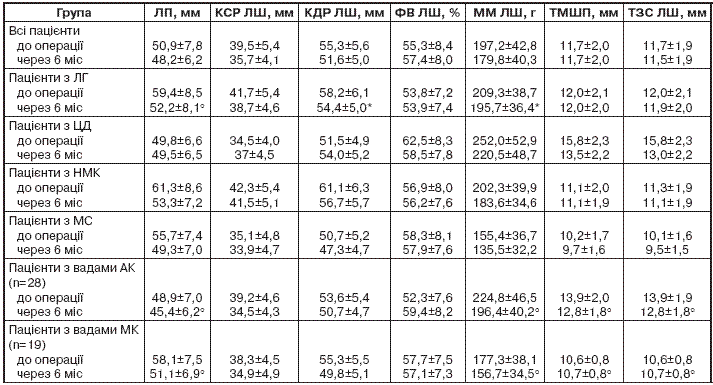
Примітка. Різниця показників достовірна порівняно з такими у хворих відповідної групи до операції: * – Р<0,05; ° – Р<0,01. ЛП – ліве передсердя; КСР – кінцевосистолічний розмір; ФВ – фракція викиду; ТМШП – товщина міжшлуночкової перегородки; ТЗС – товщина задньої стінки.
Слід відзначити, що пацієнти з мітральними вадами серця мали більший розмір порожнини лівого передсердя порівняно з хворими з аортальними вадами: відповідно (58,1±7,5) та (48,9±7,0) мм (Р<0,01). Найбільший розмір лівого передсердя спостерігали при НМК – (61,3±8,6) мм. У обстежених з вадами АК були більшими, ніж у хворих з вадами МК, такі показники, як ММЛШ (Р<0,01) та товщина стінок ЛШ (див. табл. 2).
Серед обстежених 5 пацієнтів мали ЦД 2-го типу, і у них реєстрували гіпертрофію міокарда ЛШ (ММЛШ – (252,0±52,9) г, ТМШП – (15,8±2,3) мм, ТЗС ЛШ – (15,8±2,3) мм), а також артеріальну гіпертензію й аортальну ваду серця.
За результатами тесту зі 6-хвилинною ходьбою через 6 міс після оперативного лікування хворих розділили на дві групи: перша (n=28) – пацієнти з поліпшенням показників тесту, друга (n=7) – хворі, в яких поліпшення результатів тесту не відзначали. В другій групі кількість скарг порівняно з першою була значно більшою. Так, скарги на задишку у першій групі реєстрували в 25 % пацієнтів, у другій – у 71 %, болі в ділянці серця – у 7 та 29 %, перебої – у 21 та 57 %, запаморочення – 25 та 71 % відповідно. За вихідними клінічними показниками та динамікою даних ехокардіографії групи з різними результатами 6-хвилинного тесту суттєво не відрізнялися (табл. 3).
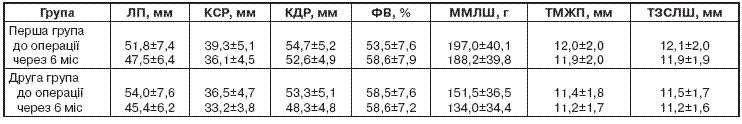
Група пацієнтів з фібриляцією передсердь відрізнялася від загальної групи більшим розміром порожнини лівого передсердя – відповідно (59,3±8,1) і (50,9±7,8) мм.
Проведення хірургічної корекції при вадах серця зумовлювало поліпшення клінічного стану пацієнтів як через 1, так і через 6 міс спостереження.
Зменшилася частота таких скарг, як задишка, запаморочення, перебої та болі в ділянці серця. Більш істотно поліпшився стан пацієнтів з ураженням МК. У дослідженні [8] після протезування АК клінічні прояви зменшилися у всіх пацієнтів з АС і лише у 43 % хворих з недостатністю АК. У дослідженнях [6, 7, 9] таких закономірностей не спостерігали. Зменшення клінічних проявів у перші 6 міс після протезування клапанів супроводжується об’єктивними ознаками – зменшенням ФК серцевої недостатності незалежно від наявності ЛГ.
Аналізуючи дані ехокардіографії, найбільш істотне зменшення розміру лівого передсердя спостерігали в осіб, які мали ЛГ у доопераційний період. Аналогічні результати були отримані в дослідженні [5]: 30 пацієнтів після протезування МК перебували під наглядом протягом (3,6±1,8) року; після протезування клапана вже через 3 міс спостерігали зменшення розмірів лівого передсердя та КДР ЛШ, що супроводжувалося поліпшенням ФК за NYHA. Навіть за наявності ЛГ можливе зменшення розмірів порожнин лівого передсердя та ЛШ, якщо ЛГ існує протягом нетривалого часу і має зворотний розвиток.
Висновки
- 1. Перебіг захворювання у хворих з неоперованими вадами мітрального клапана характеризується більш високим функціональним класом серцевої недостатності порівняно з таким у пацієнтів з аортальними вадами.2. Результати тесту з 6-хвилинною ходьбою свідчать про наявність серцевої недостатності зі зменшенням дистанції до (293±89) м, а у хворих з легеневою гіпертензією – до (262±88) м. Після операції ці показники достовірно збільшилися відповідно на 18 та 15 % (P<0,01).
3. Позитивна динаміка суб’єктивного стану хворих через 6 міс після оперативного лікування залежить від вади серця і більш виражена при пошкодженні мітрального клапана, у той час як при вадах аортального клапана частота скарг практично не змінилася.
4. Нормалізуючий вплив операції на розміри лівого передсердя найбільш відчутний у хворих з легеневою гіпертензією перед операцією (зменшення лівого передсердя з (59,4±8,5) до (52,2±8,1) мм), у той час як серед хворих без легеневої гіпертензії таких відчутних змін не спостерігали.
Література
1. Коваленко В.Н. Ревматизм и приобретенные пороки сердца: современная стратегия и тактика лечения // Здоровье Украины. – 2009. – № 17.
2. Коваленко В.Н., Несукай Е.Г. Приобретенные пороки сердца: механизмы развития и принципы лечения сердечной недостаточности // Укр. кардіол. журн. – 2001. – № 6. – С. 84-89.
3. Несукай Е.Г. Изменение функции левого и правого предсердий у больных после митральной комиссуротомии // Укр. ревматол. журн. – 2004. – № 3. – С. 71-73.
4. Несукай Е.Г. Изменение функции левого и правого предсердий у больных с недостаточностью аортального клапана // Укр. ревматол. журн. – 2005. – № 1. – С. 45-48.
5. Askin Ender Topal, Мehmet Nesimi Eren, Yusuf Celik. Left ventricle and left atrium remodeling after mitral valve replacement in case of mixed mitral valve disease of rheumatic origin // J. Cardiac Surgery. – Vol. 25. – Р. 367-372.
6. Antonini-Canterin F., Beladan C.C. Left atrial remodelling early after mitral valve repair for degenerative mitral regurgitation // Heart. – 2008. – Vol. 94 (6). – Р. 759-764.
7. Enache R., Antonini-Canterin F. et al. ME: long-term outcome in asymptomatic patients with severe aortic regurgitation, normal left ventricular ejection fraction, and severe left ventricular dilatation // Echocardiography. – 2010. – Vol. 27 (8). – Р. 915-922.
8. Lamb H.J., Beyerbacht H.P., van der Laarse A. et al. Left ventricular remodeling early after aortic valve replacement: differential effects on diastolic function in aortic valve stenosis and aortic regurgitation // Amer. Coll. Cardiol. – 2002. – Vol. 40. – P. 2182-2188.
9. Pflederer T., Flachskampf F.A. Echocardiographic follow-up after heart valve replacement // Heart. – 2010. – Vol. 96. – Р. 75-85.
10. Popescu B.A., Calin A. et al. Left ventricular torsional dynamics in aortic stenosis: relationship between left ventricular untwisting and filling pressures. A two-dimensional speckle tracking study // Eur. J. Echocardiogr. – 2010. – Vol. 11 (5). – Р. 406-413.










Комментировать