О. А. Аверина, Е. Н. Иомдина, А. А. Замятнин, М. В. Скулачев, И. И. Сенин
Ключевые слова: митохондрии, антиоксиданты, ретинопатии, катаракта, глаукома.
Окислительный стресс играет ведущую роль в развитии наиболее распространенных заболеваний глаз, характерных для пожилых людей: возрастной макулярной дегенерации, катаракты, глаукомы и синдрома сухого глаза. Недавно сотрудниками МГУ имени М.В.Ломоносова был создан митохондриально — адрессованный антиоксидант, обладающий принципиально новыми возможностями подавления окислительного повреждения. Проведенные исследования дают основания считать, что применение глазных лекарственных капель, созданных на основе этого антиоксиданта, откроет новые возможности в профилактике и лечении заболеваний глаз, связанных с возрастной патологией.
За последние 50 лет жители развитых стран мира вдвое чаще стали пересекать рубеж в 80 лет. В 1950 году вероятность дожить до 80 — 90 лет составляла в среднем 15% для женщин и 12% для мужчин. В 2002 году этот показатель вырос до 37% для женщин и 25% для мужчин [1]. Успехи в лечении онкологических заболеваний и болезней сердца позволили существенно увеличить продолжительность жизни, позволяя людям доживать до того возраста, когда начинают активно проявляться классические возрастные заболевания глаз (ВЗГ), связанные с процессами старения организма, такие как синдром сухого глаза, сенильная катаракта, возрастная макулярная дистрофия и глаукома [2]. Вследствие изменения демографической ситуации в сторону увеличения продолжительности жизни, ВЗГ становятся одной из серьезных проблем здравоохранения [3].
При всем разнообразии ВЗГ причины связанного со старением снижения зрения легче понять, если обратиться к анатомическому строению глаза человека и проследить весь путь, который проходит свет в тканях глаза (рис. 1).

Рисунок 1. Глаз человека.
В передней части глаза находится роговица, которая выступает в роли «окна», через которое свет проникает в глаз. Пройдя через роговицу свет попадает на хрусталик, который преломляет входящие лучи света таким образом, что световые пучки фокусируются на светочувствительной внутренней оболочке глаза — сетчатке. Собственно в сетчатке световой сигнал преобразуется в нервный импульс, который по зрительному нерву передается в мозг. Не удивительно, что ухудшение нашего зрения с возрастом – это чаще всего результат нарушений, которые происходят по крайней мере в одной из этих четырех структур глаза [2].
Целостность поверхности и прозрачность роговицы очень важны для получения четкого изображения: если ее поверхность будет повреждена, то мы будем видеть мир как через поцарапанное и мутное оконное стекло. Защита поверхности роговицы полностью лежит на тонком слое омывающей ее жидкости — слезы, постоянно вырабатывающейся слезными железами. Любое состояние, которое нарушает структуру слезной пленки, может привести к деструкции поверхности роговицы и, следовательно, к ухудшению изображения. С возрастом у людей слезопродукция снижается, качественный состав слезной жидкости изменяется, что приводит к ослаблению ее барьерной функции, уменьшению, а часто и к полному исчезновению защитного пленки. Если это состояние становится хроническим, то развивается синдром сухого глаза, который характеризуется высыханием поверхности роговицы с последующим ее разрушением [4].
Хрусталик также подвергается процессу старения, в результате чего развивается старческая дальнозоркость и катаракта. Когда мы рождаемся, наш хрусталик полностью прозрачен и обладает гибкостью, что позволяет ему изменять свою форму и тем самым настраивать оптическую систему глаза для получения четкого изображения предметов, расположенных на различном расстоянии. С возрастом хрусталик теряет свою прозрачность и становится более жестким. Помутнение хрусталика – катаракта — приводит к тому, что свет, перед тем как попасть на сетчатку, проходит через рассеивающую среду, мешающую формированию четкого изображения, что и снижает зрение (рис. 2а) [5]. Одновременно потеря гибкости хрусталика приводит к тому, что он утрачивает способность к изменению своей кривизны, теряет способность фокусироваться на предметах, расположенных вблизи, и остается сфокусированным только на удаленных предметах. Это состояние, – так называемая старческая дальнозоркость, или пресбиопия, развивается уже в среднем возрасте [6]. Первый признак развития пресбиопии — необходимость отодвинуть газету или книгу подальше от глаз, чтобы прочитать текст.

Рисунок 2. Как видят люди при катаракте и возрастной макулярной дистрофии:
а) при катаракте зрение затуманивается, и человек видит, как бы сквозь падающую воду или через запотевшее стекло: еще древние греки называли эту болезнь — kataraktes, что в переводе означает водопад;
б) как правило, при возрастной макулярной дистрофии человек не замечает момента, когда началось заболевание, так как развивается оно постепенно: сначала появляется повышенная чувствительность к свету, затем затуманивание зрения, нарушение очертаний окружающих предметов, со временем в центре поля зрения появляется пятно с размытым изображением, на поздних стадиях заболевания все, что человек видит, — это грубые контуры и контрасты освещенности, а впоследствии может наступить полная слепота.
К сожалению, время не щадит и сетчатку, как и зрительный нерв, приводя с возрастом к развитию макулярной дегенерации, т.е. к разрушению фоточувствительных клеток в центральной, наиболее важной части сетчатки (рис. 2б) и к потере ее функций, а также к глаукоме, при которой повреждаются волокна зрительного нерва из-за повышения внутриглазного давления [7,8]. Эти заболевания, занимают лидирующее положение в печальной статистике необратимой слепоты и слабовидения у людей старшего возраста [2].
Особая опасность ВЗГ заключается в их бессимптомном течении, что существенно усложняет раннюю диагностику этих заболеваний. Например, в случае глаукомы явная клиническая картина проявляется, когда уже свыше 20% нейронов зрительного нерва необратимо утеряны, а значит, полностью восстановить зрение уже нельзя [9]. И тогда основная цель лечения состоит в максимальном замедлении процесса гибели клеток сетчатки и зрительного нерва, чтобы как можно более дольше сохранить зрительные функции.
В настоящее время в специальной литературе можно найти множество гипотез относительно причин возникновения ВЗГ [10]. Каждая из существующих гипотез включает много спорных моментов, но есть и одна общая точка зрения на природу возникновения возрастных заболеваний глаз: возникновение и прогрессирование ВЗГ происходит на фоне повышенного образования активных форм кислорода (АФК), вызванного изменением функциональной активности митохондрий тканей глаза, подверженных возрастным патологическим изменениям (рис.3) [11].
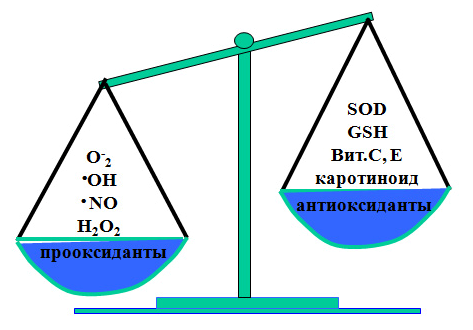
Рисунок 3. Прогрессирование возрастных заболеваний глаз происходит на фоне повышенного образования активных форм кислорода (проксиданты) и понижения антиоксидантной защиты (антиоксиданты), что приводит к хроническому окислительному стрессу в тканях глаз.
Митохондрии выполняют важнейшую для клетки функцию: синтез энергетической «валюты» организма – аденозинтрифосфата (АТФ) путем окисления кислородом поступающих органических соединений [12]. При синтезе АТФ кислород вступает в ряд химических реакций и, в конце концов, восстанавливается до воды путем присоединения к молекуле кислорода четырех электронов и четырех ионов водорода. Поскольку в получении АТФ задействован кислород, попутно небольшое количество кислорода (от 0.2 до 4%) превращается в активные формы кислорода (АФК), предшественником которых является супероксидный анион [12]. Синтезируемые митохондриями АФК выполняют ряд биологических функций, без которых полноценная жизнь невозможна [13,14]. Однако по своей химической природе АФК относятся к группе высоко реакционно-способных веществ и способны вступать в химические реакции с различными биологическими молекулами, приводя к их повреждению и потере способности выполнять свои функции. В норме в организме человека действует сложная система антиоксидантной защиты, которая, с одной стороны предотвращает повреждение биомолекул, а с другой — поддерживает содержание АФК на уровне, достаточном для выполнения физиологической функции [12].
Парадокс митохондрий заключается в том, они сами производят АФК и сами же принимают «первый удар» от образованных ими АФК [12]. С возрастом нарушается равновесие между антиоксидантной защитой митохондрий и образованием АФК в пользу последнего, что приводит к хроническому окислительному стрессу [12]. Одной из ключевых мишеней для АФК служит митохонриальная ДНК, повреждение которой происходит уже на ранних стадиях хронического окислительного стресса (митохондрии обладают собственным генетическим материалом, который закодирован в митохондриальной ДНК). Повреждение митохондриальной ДНК, например, приводит к потере способности митохондрии обеспечивать необходимую антиоксидантную защиту и к снижению выработки АТФ. Эти функциональные нарушения митохондрий вызывают повышение уровня АФК, что создает условия для развития хронического окислительного стресса. Кульминацией хронического окислительного стресса является «сжигание» мембран митохондрий — это прямой путь к гибели клеток [12].
В связи с ограниченным объемом обзора мы не будем останавливаться на детальном описании участия митохондриальных АФК в развитии всех ВЗГ, а остановимся в качестве примера на одном заболевании – первичной открытоугольной глаукоме (связь функциональных нарушений митохондрий с развитием других ВЗГ освещена, например, в обзоре [11]).
Глаукома — большая группа заболеваний, характеризующихся периодическим или постоянным повышением внутриглазного давления. Около 100 млн человек на планете страдают ею, и согласно прогнозу это количество может удвоиться до 2030 г., в результате чего рано или поздно около 30 млн больных могут стать слепыми на один глаз и порядка 10 млн ослепнут на оба [15].
Основное последствие повышения внутриглазного давления — нарушение кровообращения глаза и, как следствие, сокращение притока питательных веществ и кислорода. Однако различные структуры глазного яблока неодинаково реагируют на такие изменения. Большинство тканей могут поддерживать жизнедеятельность без кислорода в течение нескольких минут, но недостаточная доставка последнего к входящим в их состав нейронам приводит к остановке метаболических процессов в них буквально в считанные секунды. В связи с этим не удивительно, что при глаукоме в первую очередь страдают именно нейроны, а ведь значительная их часть входит в состав зрительного нерва [8].
У большинства пациентов быстрое прогрессирование недуга связано не просто с повышением внутриглазного давления, но и с его постоянным колебанием в течение суток. Причем даже незначительное изменение этого показателя (на 5-10 мм ртутного столба) способно существенно уменьшить кровоток в зрительном нерве. Чередование ограниченного доступа кислорода (из-за ишемии) с последующим восстановлением его притока (в результате реперфузии) к нейронам истощает их защитные свойства и приводит к необратимым деструктивным процессам [9].
При недостатке кислорода в условиях ишемии митохондриям приходится переходить на альтернативный путь синтеза АТФ, при котором его образование сокращается в несколько раз. Но при уменьшении содержания последнего в клетке активность всех метаболических процессов снижается. В этих условиях генерация митохондриями супероксиданиона существенно усиливается, а растущий недостаток АТФ в нейронах ведет к подавлению активности антиоксидантных систем из-за распада и торможения их синтеза, в итоге — к еще большему накоплению АФК [16].
Поскольку развитие глаукомы связано, как уже упоминалось, не просто с повышением внутриглазного давления, но и с его постоянными колебаниями в течение суток, то после периода кислородного голодания кровоток неизбежно восстанавливается, что вроде бы должно предотвратить патологический процесс и восстановить энергообеспечение нейронов. Однако на самом деле приток кислорода после ишемии усугубляет негативные процессы в клетках, ибо при реперфузии концентрация О2 в ткани резко возрастает, чем способствует дополнительной мощной генерации АФК в митохондриях. Именно этим объясняется быстрое прогрессирование глаукомы у больных с выраженными колебаниями внутриглазного давления.
Идея применения антиоксидантов для лечения ВЗГ появилась достаточно давно, однако клинические испытания выявили целый ряд недостатков, не позволяющих добиться необходимой эффективности антиоксидантной терапии [9]. Природные антиоксиданты, применяемые в настоящее время в клинической практике, эффективны лишь в очень высоких дозах. Поскольку они распределяются по всему организму, то только небольшая их часть способна, проникая внутрь клетки, достигнуть митохондрий и замедлить накопление АФК в этих органеллах. Следовательно, важной и актуальной задачей является разработка и применение лекарственных препаратов антиоксидантного действия, обладающих способностью и механизмом адресной доставки в митохондрии.
Несмотря на всю сложность проблемы, ее удалось решить и создать инновационный класс митохондриально — адрессованных антиоксидантов, в состав которых входят векторная молекула, способная транслоцироваться в митохондрии, и молекула антиоксиданта [17]. Синтезированный нами митохондриально-направленный антиоксидант SkQ1, представляющий собой липофильный катион трифенилфосфоний — ковалентносвязанную транспортную составляющую — и антиоксидант пластохинон, легко проникает через мембраны клеток и митохондрий и избирательно накапливается в митохондриях внутри живых клеток: по нашим расчетам концентрация SkQ1 внутри митохондрий превышает его концентрацию во внеклеточной среде в 2×108 раз, что дает возможность эффективно подавить процессы свободнорадикального окисления и достичь необходимого терапевтического эффекта при минимальных дозах (рис. 4) [17].
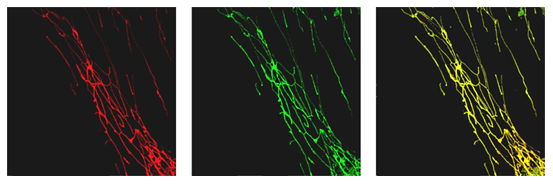
Рисунок 4. SkQ1 селективно накапливается в митохондриях фибробластов человека. На фотографии слева показано расположение SkQ1 (красный цвет), на фотографии в центре – митохондрий (зеленый цвет) в клетках фибробластов; рисунок справа – наложение фотографий друг на друга.
В 2005-2009 г.г. в ходе экспериментов с использованием модели глаукомы у кроликов мы показали высокую эффективность SkQ1 как средства профилактики и лечения глаукомы у экспериментальных животных. Оказалось, что уже в наномолярном диапазоне концентрации в составе глазных капель SkQ1 эффективно предотвращает патологические изменения зрительного нерва и сохраняет зрительные функции у животных [18]. Также были получены многообещающие результаты, касающиеся профилактики и лечения дистрофии сетчатки, катаракты, синдрома сухого глаза с помощью SkQ1 в модельных системах на экспериментальных животных [19]. Исходя из полученных результатов, разработана лекарственная форма на основе SkQ1 – глазные капли «Визомитин».
В настоящее время начаты комплексные клинические испытания новых глазных капель, содержащих этот перспективный митохондриально – адресованный антиоксидант. Результаты испытаний позволят точнее определить показания и алгоритм их применения, и можно надеяться, откроют новые возможности в профилактике и лечении многих заболеваний глаз, особенно связанных с возрастной патологией, помогут множеству пациентов сохранить хорошее зрение на долгие годы.
Список литературы
[1] Иванова А.Е., Кондракова Э.В. Обоснование прогноза продолжительности жизни населения в регионах России до 2025 г. // Социальные аспекты здоровья населения. 2008. 5. 1. C. 1-8.
[2] Klein R., Wang Q., Klein B.E. The relationship of age-related maculopathy, cataract, and glaucoma to visual-acuity. // Invest. Ophthalmol. Vis. Sci. 1995. 36. P. 182–191.
[3] Полунина Е. Г. 12 Октября 2006 года – Всемирный день защиты зрения. // Офтальмология. 2006. 3. 4. C. 86-87.
[4] Moss S.E., Klein R., Klein B.E.K. Prevalence of and risk factors for dry eye syndrome // Arch. Ophthalmol. 2000. 118. P. 1264-1268.
[5] Spector A. Oxidative stress-induced cataract: mechanism of action. // FASEB J. 1995. 9. P. 1173–1182.
[6] Fisher R.F. Presbyopia and the changes with age in the human crystalline lens. // J. Physiol. 1973. 228. P. 765 — 779.
[7] Beatty S., Koh H., Phil M., et al. The role of oxidative stress in the pathogenesis of age-related macular degeneration. // Surv. Ophthalmol. 2000. 45. P. 115–134.
[8] Osborne N.N., Melena J., Chidlow G., et al. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. // Br. J. Ophthalmol. 2001; 85:1252–1259.
[9] Сенин И.И., Еричев В.П., Скулачев В.П. Митоиженерия в офтальмологии. // Наука в России. 2011. 182. 2. С. 4-12.
[10] Rosenbloom A.A., Morgan M.W. Vision and aging. St. Louis: Elsevier Inc. (421)
[11] Barot M., Gokulgandhi M.R., Mitra A.K. Mitochondrial disfunction in retinal diseases.// Curr. Eye Res. 2011. 36. 12. P. 1069-1077.
[12] Skulachev V.P. Functions of mitochondria: from intracellular power stations to mediators of a senescence program. // Cell Mol. Life Sci. 2009. 66. P. 1785-1793.
[13] Tu B.P., Weissman J.S. Oxidative protein folding in eukaryotes: mechanisms and consequences. // J. Cell Biol. 2004. 164. P. 341–346.
[14] Chiarugi P., Giannoni E. Anchorage-dependent cell growth: tyrosine kinases and phosphatases meet redox regulation. // Antioxid. Redox. Signal. 2005. 7. P. 578–592.
[15] Корнилаева М.П. Малоинвазивная хирургия: нейропротекторный подход в лечении больных первичной глаукомой. // Глаукома. 2007. 2. C. 50-54.
[16] Plotnikov E.Y., Chupyrkina A.A., Jankauskas S.S., Pevzner I.B., Silachev D.V., Skulachev V.P., Zorov D.B. Mechanisms of nephroprotective effect of mitochondria-targeted antioxidants under rhabdomyolysis and ischemia/reperfusion. // Biochim. Biophys. Acta. 2011. 1812. 1. P. 77-86.
[17] Антоненко Ю.Н., Аветисян А.В., Бакеева Л.Е., Черняк Б.В., Чертков В.А., Домнина Л.В., Иванова О.Ю., Изюмов Д.С., Хайлова Л.С., Клишин С.С., Коршунова Г.А., Лямзаев К.Г., Мунтян М.С., Непряхина O.K., Пашковская А.А., Плетюшкина О.Ю., Пустовидко А.В., Рогинский В.А., Рокицкая Т.И., Рууге Э.К., Сапрунова В.Б., Северина И.И., Симонян Р.А., Скулачев И.В., Скулачев М. В., Сумбатян Н.В., Свиряева И.В., Ташлицкий В.Н., Васильев Ю. М., Высоких М.Ю., Ягужинский Л.С., Замятнин(мл.) А.А., Скулачев В.П. Производное пластохинона, адресованное в митохондрии, как средство, прерывающее программу старенияю 1. Катионные производные пластохинона: синтез и исследования in vitro. // Биохимия. 2008. 73. 12. С. 1589-1606.
[18] Нероев В.В., Архипова М.М., Бакеева Л.Е., Фурсова А.Ж., Григорян Э.Н., Гришанова А.Ю., Иомдина Е.Н., Иващенко Ж.Н., Катаргина Л.А., Хорошилова-Маслова И.П., Килина О.В., Колосова Н.Г., Копенкин Е.П., Коршунов С.С., Ковалева Н.А., Новикова Ю.П., Филиппов П.П., Пилипенко Д.И., Робустова О.В., Сапрунова В.Б., Сенин И.И., Скулачев М.В., Сотникова Л.Ф., Стефанова Н.А.,Тихомирова Н.К., Цапенко И.В., Щипанова А.И., Зиновкин Р.А., Скулачев В.П. Производное пластохинона, адресованное в митохондрии, как средство, прерывающее программу старения 4. Связанные с возрастом заболевания глаз SKQ1 возвращает зрение слепым животным. // Биохимия. 2008. 73. 12. С. 1641-1654.
[19] Skulachev V.P., Anisimov V.N., Antonenko Y.N., Bakeeva L.E., Chernyak B.V., Erichev V.P., Filenko O.F., Kalinina N.I., Kapelko V.I., Kolosova N.G., Kopnin B.P., Korshunova G.A., Lichinitser M.R., Obukhova L.A., Pasyukova E.G., Pisarenko O.I., Roginsky V.A., Ruuge E.K., Senin I.I., Severina I.I., Skulachev M.V., Spivak I.M., Tashlitsky V.N., Tkachuk V.A., Vyssokikh M.Y., Yaguzhinsky L.S., Zorov D.B. An attempt to prevent senescence: a mitochondrial approach. // Biochim. Biophys. Acta. 2009. 1787. 5. P. 437-461.








Комментировать