Результаты проведенных исследований.
Имамвердиев С.Б., Гасымов Э.Д., Эфендиев Э.Н., Азербайджанский медицинский университет, Баку
Резюме. Рак почки, составляющий 2–3% всех онкологических заболеваний и стоящий на 3-м месте в структуре заболеваний мочеполовой системы, находится на 1-м месте по уровню смертности. В 2007– 2012 гг. в урологических клиниках и отделениях находились на лечении 110 пациентов с раком почки, из них 67 мужчин (61%) и 43 женщины (39%). Размер опухоли варьировался от 2 до 12 см. У всех пациентов была выполнена трансабдоминальная ультрасонография, у 77 – компьютерная томография, у 21 – магнитно-резонансная томография. Диагноз, установленный после проведения ультрасонографии, практически не отличался от диагноза, установленного с помощью компьютерной томографии или магнитно-резонансной томографии. Но по сравнению с другими методами ультрасонография является наиболее эффективной.
Рак почки (РП), составляя 2–3% от всех онкологических заболеваний и находясь на 3-м месте в структуре заболеваний урогенитального тракта, по уровню смертности лидирует, занимая первое место [5, 6]. Научные исследования, проводимые в экономически развитых странах, выявили тенденцию роста заболеваемости РП среди населения этих стран [9]. РП встречается у мужчин в 4,13%, у женщин – в 2,87% случаев злокачественных заболеваний [3]. Ежегодно из всех регистрируемых в мире злокачественных заболеваний на долю РП выпадает 1,9% [10]. Несмотря на рост заболеваемости, ранняя диагностика и определение степени инвазии РП всё еще находятся на недостаточно высоком уровне и продолжают оставаться актуальным вопросом онкоурологии [7]. Невзирая на наличие большого количества различных методов диагностики, у 25–33% больных при установлении диагноза РП уже обнаруживаются метастазы в различных органах, а у 30–40 % после операции – местные рецидивы [1]. Внедрение в повседневную медицинскую практику дорогостоящих, но неинвазивных лучевых методов обследования, основанных на последних достижениях науки, открыло новые горизонты в уроонкологии [2]. Однако, несмотря на это, при установлении диагноза РП у 25% пациентов уже имелись регионарные метастазы [11]. Это, в свою очередь, отрицательно сказывается на выборе метода лечения и конечном результате. Поэтому пятилетняя послеоперационная выживаемость у таких больных оставляет желать лучшего и составляет 10% [4]. Наличие большого количества различных методов диагностики РП не позволяет применять их одновременно у одного пациента. Инвазивность и способность приводить к различным осложнениям одних методов и высокая стоимость других значительно ограничивают их практическое применение [8]. Данное исследование затрагивает некоторые клинические и гистологические особенности РП. К первым можно отнести медленный рост, скудность и неспецифичность клинической симптоматики с одной стороны и склонность к инвазии с другой. Ранняя диагностика РП и распространенности первичной опухоли, выбор оперативной тактики лечения, предотвращение осложнений продолжают оставаться нерешенной прблемой. Стремительное развитие методов диагностики, открытие и внедрение новых, технологичных модификаций лучевых и радиационных методов исследований открывают широкие возможности для ранней диагностики РП. Эти методы применяются не только для постановки диагноза, но и для выявления распространенности процесса, наличия регионарных метастазов и выбора оптимального метода лечения.
Цель исследования – оценка возможностей УЗИ и комплекса лучевых методов в ранней диагностике и определении степени инвазии РП.
Материалы и методы
В исследование вошли 110 пациентов с диагнозом РП, находившихся в 2007–2012 гг. на стационарном лечении на клинических базах кафедры уролологии Азербайджанского медицинского университета: Республиканской клинической больнице и Центральной больнице моряков. Возраст больных составлял от 21 до 82 лет (средний возраст – 60,6 лет). Мужчин было 67 (61%), женщин – 43 (39%). В алгоритм лабораторных исследований входили общий анализ крови, мочи, биохимический анализ крови, определение щелочной фосфатазы и Са крови. Проводимое исследование преследовало целью установление точной локализации опухоли в почке, определение ее размеров, выбор оптимального радикального метода лечения и получение его удовлетворительных результатов. В установлении диагноза РП лучевые методы исследования применялись как отдельно, так и в комплексе с другими методами. Принимая во внимание высокую информативность, неинвазивность и экономическую выгодность ультразвукового исследования (УЗИ), всем пациентам проводили трансабдоминальное УЗИ. Этот метод не требует какой-либо специальной подготовки больного, но проводится при заполненном мочевом пузыре и опорожненном кишечнике. Немаловажным является также профессионализм врача-сонолога и наличие у него определенных знаний урологии. УЗИ с большим уровнем точности давало ответы на стоящие перед хирургом вопросы: характер опухоли, анатомическое состояние другой почки, наличие инфильтративных изменений окружающих тканей, состояние нижней полой вены, наличие метастатических изменений лимфатических узлов и паренхиматозных органов. Получение столь обширной информации еще раз подтверждает большие возможности УЗИ не только в диагностике РП, но также в выборе оптимального метода лечения и в наблюдении за послеоперационным восстановлением пациента. Проведенное до операции всем вошедшим в исследование больным трансабдоминальное УЗИ позволило точно выявить размеры опухоли почки (табл. 1).
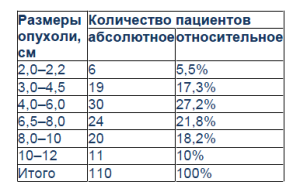
Размеры опухолей почки по результатам трансабдоминального УЗИ
Как следует из табл. 1, у большинства больных (30 человек) размеры опухоли были от 4 до 6 см, у 19 пациентов – 3–4,5 см, у 24 больных – 6,5–8 см, у 20 больных – 8–10 см, у 11 человек – 10–12 см. Опухоль локализовывалась в лоханке у 21 больного, в паренхиме почки – у 89. Проведенное исследование позволило выявить эхоструктуру опухолей. У 54 пациентов опухоли были гипоэхогенными, у 23 – гиперэхогенными, у 22 – гипогипер-эхогенными, у 11 – изоэхогенными. У 77 больных границы опухоли были неровными, у 33 – ровными. Некоторые пациенты поступили в клинику с установленным ранее диагнозом. Однако при проведении повторных исследований у 10 больных с установленным ранее диагнозом РП были выявлены солитарные кисты, абсцессы, гематомы или эхинококковые кисты почек.
Одна из составляющих правильности выбора тактики оперативного лечения пациентов с РП – определение степени инвазии опухоли. Установленные до операции стадии заболевания представлены в табл. 2.
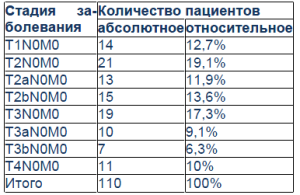
Установленные на основании УЗИ стадии РП
Большинство пациентов были в стадии Т2–Т3. В стадии Т1 – 14 человек, Т2 – 49 больных, Т3 – 36 пациентов, Т4 – 11 человек. Несмотря на обширные диагностические возможности УЗИ, подтвердить диагноз и определить степень инвазии опухоли некоторым больным не удалось. В этих случаях были применены экономически менее выгодные компьютерная (КТ) и магнитно-резонансная томография (МРТ). В некоторых случаях эти исследования применялись в комплексе. Из 110 пациентов 77 (70%) была проведена КТ, 21 (19,1%) – МРТ. Из 77 больных, которым была проведена КТ, для определения функционального состояния верхних мочевых путей, 47 КТ проведено с внутривенным контрастированием, 30 – нативно. КТ хоть и не является первичным методом диагностики, однако, обладая большими диагностическими возможностями, давала подробную информацию о локализации, степени инвазии РП, состоянии нижней полой вены (наличие или осутствие в ней тромбов) и была особенно информативной при опухолях лоханки почки. На основании проведенной до операции КТ у 6 пациентов обнаружены тромбы нижней полой вены, которые были удалены во время операции. МРТ была проведена 21 больному (10,1%). При проведении этого исследования не используются рентгеноконтрастные вещества и не требуется специальной подготовки больных. На основании данных КТ в стадии Т1 было 8 (10,1%) пациентов, Т2 – 29 (37,7%), Т3 – 31 (41,3%), Т4 – 9 (11,7%) больных. На основании данных МРТ в стадии Т1 было 2 (9,5%) пациента, Т2 – 9 (42,3%), Т3 – 6 (28,6%), Т4 – 4 (19,1%) больных. Всем пациентам было проведено оперативное лечение. В зависимости от размеров, локализации и степени инвазии опухоли 21 (19,1%) больному были проведены органосохраняющие операции, 89 (80,9%) – радикальная нефрэктомия. В качестве органосохраняющей операции 7 пациентам проведена энуклеация опухоли, 14 больным – резекция почки. Всем пациентам операции проведены под интубационным наркозом. В связи с тем, что большинство больных поступали на поздних стадиях заболевания, всем им произведена радикальная нефрэктомия. Из всех перенесших нефрэктомию пациентов у 20 опухоль локализовывалась в лоханке. Проведенное во всех случаях патогистологическое исследование макропрепарата выявило аденокарциному у 51 (46,4%) человека, светлоклеточный РП – у 35 (31,8%), инфильтративную карциному – у 11 (10%), базофильно-клеточный РП – у 8 (7,3%), ангиомиолипому – у 5 (4,6%) больных. Во время операции в 85–92% случаев размеры и локализация опухоли совпали с дооперационными. У 7 пациентов с опухолями больших размеров интраоперационно оказалось, что опухоль исходит не из верхнего полюса, как предполагалось ранее, а из среднего сегмента почки, у 4 больных с дооперационным диагнозом «опухоль среднего сегмента почки» в ходе операции оказалось, что опухоль локализована в лоханке почки. В большинстве наблюдений опухоль исходила из среднего сегмента почки, в значительной степени поражала паренхиму, что стало причиной радикальной нефрэктомии. Послеоперационная стадийность заболевания выявила следующее: стадия Т1 – у 6 пациентов (7,8%), Т2 – у 31 (40,3%), Т3 – у 30 (39%), Т4 – у 10 (13%). Таким образом, у 7 (9,1%) больных предоперационные показатели стадийности опухолевого процесса, установленные на основании данных КТ, не совпали с таковыми после операции.
На основании данных МРТ, проведенных до операции 21 больному, стадия Т1 установлена у 4 (19%) человек, Т2 – у 9 (42,9%), Т3 – у 6 (28,6%), Т4 – у 2 (9,5%) пациентов. Лишь у троих больных послеоперационные показатели стадийности не совпали с дооперационными. В остальных наблюдениях показатели полностью совпали. Сравнительная оценка достоверности проведенных пациентам лучевых методов диагностики представлена в табл. 3.
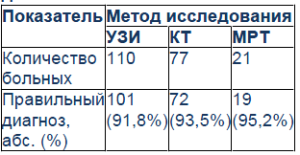
Результаты лучевых методов диагностики больных РП
Как следует из табл. 3, в установке диагноза и определении степени инвазии опухоли достоверность УЗИ составила 91,8%, КТ – 93,5%, МРТ – 95,2%.
Анализируя вышесказанное, можно прийти к выводу, что несмотря на доступность для пациентов, информативность, неинвазивность и экономическую выгодность УЗИ, в некоторых случаях лучевые методы диагностики целесообразно применять в комплексе.
Результаты и обсуждение
В ходе исследования применяемые методы не только позволяли диагностировать заболевание и степень инвазии опухоли, но и выявляли патологические изменения околопочечной клетчатки, лимфатических узлов, нижней полой вены и состояние другой почки. Всем вошедшим в исследование пациентам было проведено трансабдоминальное УЗИ, у большинства из них были выявлены стадии заболевания Т2–Т3. У 8 больных не удалось правильно оценить степень инвазии опухоли, из них у 5 человек в реальности она оказалась ниже, а у 3 – выше. Результатаы проведенной 77 пациентам КТ оказались верными в 72 случаях. У 5 больных в стадии Т1–Т2 они оказались неточными. Результаты МРТ оказались достоверными в 19 случаях из 21. В итоге 21 (19,1%) больному была прведена органосохраняющая операция, а 89 (80,9%) – радикальная нефрэктомия. В качестве органосохраняющей операции 7 пациентам проведена энуклеация опухоли, а 14 – резекция почки. По результатам проведенного после операции у всех больных патогистологического исследования макропрепарата в большинстве случаев была выявлена аденокарцинома и светлоклеточный РП. Самым эффективным методом установки диагноза РП, несмотря на его высокую стоимость, следует считать МРТ. КТ при всей своей информативности не всегда позволяла верно интерпретировать степень инвазии опухоли. По результатам нашего исследования достоверность постановки диагноза и степени инвазии РП методом трансабдоминального УЗИ составила 94%, КТ – 91%, а МРТ –95%.
Таким образом, на современном уровне развития медицины в постановке диагноза и определении степени инвазии РП УЗИ в совокупности с другими методами лучевой диагностики имеет большие возможности для получения лучших результатов.
Л И Т Е Р А Т У Р А
1. Аляев Ю.Г., Крапивин А.А., Альакбар Н.И. // Урология. 2002. – № 2. – С. 3–7.
2. Аляев Ю.Г., Крапивин А.А., Григорьев Н.А. и др. // Мед. визуал. журн. – 2003. – № 2. – С. 33–39.
3. Чисов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2007 году. – М., 2008. – С. 67.
4. Eisen T., Christmas T. Clinical progress in renal cancer. – London, 2007. – P. 47–61, 173–191.
5. Gofrit O.N., Shapiro A., Pizov G. et al. // J. Urol. – 2007. – Vol. 177. – P. 1682–1686.
6. Keane T., Gillatt D., Evans C.P., Tubaro A. // Eur. Urol. – 2007. – Vol. 6, Suppl.– P. 374–384.
7. Liungberg B., Hanbury D.C., Kuczuk M.A. et al. Guidelines on renal cell carcinoma. – Arnhem, The Netherlands: European Association of Urology, 2009. – 28 p.
8. Malley M.E., Hahn P.F., Loder I.C. // Clin. Radial. – 2003. – Vol. 57. – P. 294–300.
9. Pankim D.M., Bray F., Ferlay J., Pisami P. // J. Clin. – 2005. – Vol. 55. – P. 74–108.
10. Parton M., Gore M., Eisen T. // J. Clin. Oncol. – 2006. – Vol. 24. – P. 5584–5592.
11. Ravomal A., Debled M. // Grit. Rex. Oncol. Hematol. – 1999. – Vol. 31. – P. 77–78.







Комментировать