Пневмония у ребенка: общая характеристика и описание клинической картины. Выбор антибактериальных препаратов при пневмонии, Форма внебольной пневмонии как наиболее частая форма острого инфекционного воспаления легких у детей: варианты терапии.
РМЖ
Короид Н.В., Заплатников А.Л., Мингалимова Г.А., Глухарева Н.С.
Пневмония – острое инфекционное воспаление легочной паренхимы, диагностируемое на основании характерных клинических и рентгенографических признаков [1–4]. Пневмония является одним из наиболее серьезных заболеваний у детей, популяционная частота которого и прогноз напрямую связаны с социально– экономическими условиями [1,2,5–8]. Так, в странах с низким культурным и социально–экономическим уровнем, неустойчивой политической обстановкой и продолжающимися военными конфликтами заболеваемость пневмонией у детей первых 5 лет жизни превышает 100 случаев на 1000, а летальность достигает 10%. В то же время в экономически благополучных странах у детей указанной возрастной категории пневмония встречается значительно (практически в 10 раз!!!) реже, а уровень летальности не превышает 0,5–1%. Особо следует подчеркнуть, что в детской популяции России заболеваемость и летальность при пневмонии сопоставимы с показателями ведущих мировых держав [1–9].
Благоприятный прогноз при пневмонии определяется ранней диагностикой, своевременным лечением и адекватным выбором стартовой антибактериальной терапии. При этом своевременная диагностика основывается на результатах детального и последовательного анализа клинико–анамнестических и рентгенологических данных [1–4].
Основными клиническими проявлениями, позволяющими заподозрить у ребенка пневмонию, являются симптомы токсикоза (лихорадка, снижение аппетита, отказ от питья, снижение диуреза и др.) и дыхательной недостаточности (тахипное, одышка, цианоз), а также типичные физикальные данные. К последним относят укорочение перкуторного звука над участком поражения легких и локализованные здесь же аускультативные изменения (ослабление или усиление дыхания с последующим появлением крепитирующих или влажнопузырчатых хрипов). Следует, однако, отметить, что при пневмониях у детей раннего возраста нередко сложно выявить аускультативную асимметрию в легких. Это связано с тем, что у детей первых лет жизни воспаление легочной паренхимы редко бывает изолированным и, как правило, развивается на фоне бронхита. При этом на всем протяжении обоих легких могут выслушиваться сухие и/или разнокалиберные влажные хрипы, из–за чего типичная аускультативная картина пневмонии, особенно мелкоочаговой, может не улавливаться. Кроме того, при нарушении методики выслушивания легких у детей раннего возраста можно вообще не выявить аускультативных изменений.
В целом, если у лихорадящего ребенка, переносящего острую респираторную инфекцию, имеется хотя бы один из таких признаков, как токсикоз, одышка, цианоз и типичные физикальные данные, необходимо проводить рентгенологическое обследование органов грудной клетки. При этом обнаружение в легких гомогенных инфильтративных изменений очагового, очагово–сливного или сегментарного характера позволяет подтвердить клиническое предположение о развитии пневмонии, вызванной типичными возбудителями (пневмококк и др.). Мелкие негомогенные инфильтраты, имеющие двухстороннюю локализацию и выявленные на фоне усиленного сосудисто–интерстициального рисунка, как правило, свидетельствуют в пользу атипичной этиологии пневмонии (микоплазмоз, хламидиоз, пневмоцистоз). Рентгенологическое подтверждение пневмонии является обязательным критерием «золотого стандарта» диагностики данного заболевания [1–4].
При выявлении у ребенка пневмонии в первую очередь решают вопрос о необходимости госпитализации. Абсолютными критериями для экстренной госпитализации являются дыхательная и/или сердечно– сосудистая недостаточность, судорожный, гипертермический, геморрагический и другие патологические синдромы. Показаниями для стационарного лечения детей с пневмониями, кроме тяжелых форм заболевания, являются также неонатальный и младенческий возраст ребенка и отягощенный его преморбит (тяжелая врожденная или приобретенная патология органов дыхания, кровообращения, нервной, иммунной и других систем). Особо следует отметить, что к абсолютным показаниям для госпитализации относятся все случаи, когда пневмония развивается у детей из «группы социального риска». Таким образом, госпитализация детей с пневмонией показана во всех случаях, когда тяжесть состояния и характер течения заболевания требуют проведения интенсивной терапии или имеется высокий риск развития осложнений. Во всех остальных случаях лечение пневмонии может осуществляться на дому. Необходимо отметить особо, что независимо от того, где проводится лечение (в амбулаторных условиях или в стационаре), терапевтические мероприятия должны быть комплексными и включают адекватный уход за ребенком, правильный режим дня и питания, рациональное использование этиотропных и симптоматических средств. Ключевым звеном при этом является адекватная антибактериальная терапия.
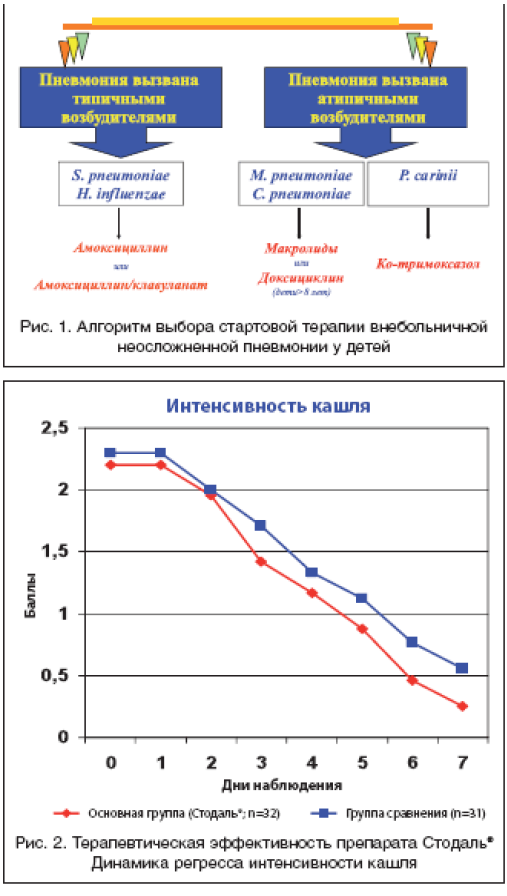
Выбор антибактериальных препаратов при пневмонии, как и при других инфекционно–воспалительных заболеваниях, должен определяться в первую очередь особенностями этиологии заболевания. Однако в подавляющем большинстве случаев корректное микробиологическое обследование детей с пневмонией не проводится, несмотря на то, что в соответствии с «Международной статистической классификацией болезней и проблем, связанных со здоровьем» 10–го пересмотра (МКБ–Х) [10] рубрикация пневмоний должна строиться строго по этиологическому принципу. Отсутствие данных об этиологии заболевания приводит к тому, что пневмонии, как правило, шифруют под кодом J18 («Пневмония без уточнения возбудителя»), а антибактериальную терапию, соответственно, проводят вслепую. В ряде случаев стартовый выбор антибиотиков может быть некорректен, что определяет отсутствие эффекта от проводимого лечения. Для уменьшения ошибок при проведении антибактериальной терапии пневмоний у детей в последние годы были разработаны рекомендации по эмпирическому выбору стартовых антибиотиков [1,8,9,11,12]. Принципиальным положением разработанных алгоритмов является выбор препаратов в зависимости от эпидемиологических условий и возраста заболевших, так как установлено, что этиология пневмонии напрямую зависит от этих факторов (рис. 1). При этом эпидемиологическая рубрикация пневмонии предусматривает выделение внебольничных, госпитальных и внутриутробных форм заболевания [3].
О внебольничной пневмонии говорят в тех случаях, когда инфицирование и заболевание ребенка не связано с его пребыванием в лечебном учреждении. Тем самым подчеркивается, что развитие пневмонии произошло в условиях обычного микробного окружения. Это позволяет с высокой долей вероятности предположить этиологию заболевания, поскольку было установлено, что основным возбудителем пневмонии при этом является Streptococcus pneumoniae. Реже внебольничную пневмонию вызывают Haemophilus influenzae, Мycoplasmae pneumoniaе, хламидии (Сhlamydia trachomatis – у детей первых месяцев жизни и Сhlamydia pneumoniaе – в последующие возрастные периоды) и респираторные вирусы. В тех случаях, когда инфицирование и развитие пневмонии произошло спустя 48–72 часов с момента поступления ребенка в больницу или в течение 48–72 часов после его выписки из стационара, то ее классифицируют, как внутрибольничную [3]. При этом этиология госпитальной пневмонии зависит от эпидемиологических условий, сложившихся в данном лечебном учреждении. Так, установлено, что нозокомиальные пневмонии могут быть вызваны различными, нередко полирезистентными представителями энтеробактерий, синегнойной палочкой, золотистым стафилококком и другими госпитальными микроорганизмами. К внутриутробным пневмониям относят такие варианты заболевания, при которых инфицирование произошло в анте– или интранатальный период, а реализация инфекционного воспаления – не позже первых 72 часов жизни ребенка. При этом потенциальными возбудителями внутриутробной пневмонии могут быть различные вирусы, а также Сhlamydia trachomatis, Streptococcus (гр. В), Staphylococcus aureus, Enterobacteriaceae (Klebsiella, Proteus, Escherihia) и др. микроорганизмы. Эпидемиологическая рубрикация пневмоний имеет четкую практическую направленность, так как учитывает особенности этиологии различных форм заболевания и позволяет эмпирически выбрать адекватную антибактериальную терапию сразу же после установления диагноза.
Наиболее частой формой острого инфекционного воспаления легких у детей является внебольничная пневмония. При этом необходимо обратить особое внимание на то, что внебольничная пневмония может характеризоваться различной степенью тяжести. При этом в ряде случаев заболевание может сопровождаться развитием как легочных (деструкция, абсцесс, пневмоторакс, пиопневмоторакс), так и внелегочных осложнений (инфекционно–токсический шок, ДВС–синдром, сердечно–легочная недостаточность и др.) [1,4,8,13]. Поэтому ошибочно считать, что внебольничные пневмонии – это нетяжелые формы заболевания, лечение которых всегда можно проводить в амбулаторных условиях. Таким образом, термин «внебольничная пневмония» должен применяться исключительно для ориентировочной характеристики этиологии заболевания, а не для оценки его тяжести и прогноза.
Для адекватного эмпирического выбора стартовой антибиотикотерапии, помимо эпидемиологической характеристики, необходим детальный анализ индивидуальных данных ребенка (возраст, фоновые состояния, сопутствующая патология) и клинических особенностей заболевания. При этом отмечено, что на этиологию пневмонии, кроме эпидемиологических факторов, существенное влияние оказывают возраст пациента и его преморбидное состояние. Так, частое использование антибиотиков у детей с хроническими инфекционно– воспалительными заболеваниями (пиелонефрит, тонзиллит, отит и др.) может привести к селекции резистентных штаммов микроорганизмов. В случае развития пневмонии у таких детей этиология заболевания может быть представлена антибиотико–устойчивыми возбудителями. Аналогичная ситуация может произойти и при возникновении пневмонии у детей с незаконченными курсами антибактериальной терапии или получавших антибиотики в неадекватно низких дозах. Наличие у ребенка синдрома срыгиваний создает предпосылки для аспирации и развития пневмонии, вызванной не только аэробными (стрептококки, энтеробактерии, стафилококки и др.), но и неспорообразующими анаэробными (бактероиды, фузобактерии, пептострептококки, пептококки и др.) бактериями. Приведенные примеры, которые являются лишь частью возможных клинических ситуаций, свидетельствуют о важности подробного уточнения анамнестических данных в каждом конкретном случае.
Стартовая этиотропная терапия внебольничной пневмонии у детей первых месяцев жизни. У пациентов данной возрастной группы этиология пневмонии может быть связана с очень широким спектром возбудителей (вирусы, хламидии, стрептококки, стафилококки, протей, клебсиелла, кишечная палочка и др.). Учитывая это, для адекватного выбора стартовой терапии вначале эмпирически определяют, чем вызвано заболевание: типичными или же атипичными микроорганизмами? Для этого оценивают клинико–анамнестические данные и анализируют результаты рентгенологического обследования. При этом такие симптомы, как лихорадка, токсикоз, четкие физикальные данные, а также очаговые и/или сливные рентгенологические изменения в легких, позволяют с большей достоверностью предполагать типичную бактериальную этиологию пневмонии. В этих случаях лечение начинают с антибиотиков широкого спектра действия, введение которых, учитывая высокий риск развития тяжелых форм заболевания, целесообразно осуществлять парентерально. В качестве стартовых препаратов используют аминопециллины и цефалоспорины, а при тяжелых вариантах пневмонии – их комбинацию с короткими курсами аминогликозидов. Такой выбор антибиотиков объясняется необходимостью воздействия на целый ряд грамположительных и грамотрицательных бактерий, которые могут быть причиной заболевания у детей данного возраста. Принимая во внимание высокий уровень β– лактамаза–продуцирующих штаммов среди потенциальных возбудителей, предпочтение должно отдаваться ингибитор–защищенным аминопенициллинам и цефалоспоринам 3–й генерации.
В тяжелых случаях необходимо использовать внутривенное введение антибиотиков. При этом амоксициллин/клавуланат применяется в дозе (по амоксициллину): 30–60 мг/кг/сут., а базовые цефалоспорины 3 поколения (производные цефтриаксона и цефотаксима) в дозе 50–100 мг/кг/сут. Цефалоспорины 3 поколения активны по отношению к бактериям, продуцирующим β–лактамазы широкого спектра действия, а также подавляют штаммы, антибиотикорезистентность которых обусловлена и другими механизмами [11,12].
Если пневмония развивается у ребенка, имеющего особенности анамнеза в виде генитального хламидиоза у матери, указаний на затяжной конъюнктивит у ребенка, который не купируется при использовании бета– лактамных антибиотиков, необходимо исключать возможность атипичной этиологии заболевания. При этом наличие сухого кашля с постепенным нарастанием интенсивности и частоты, медленное развитие других симптомов заболевания и преобладание интерстициальных изменений на рентгенограмме, заставляют подумать о возможной этиологической роли С. trachomatis. Верификация хламидийной пневмонии определяет необходимость назначения современных макролидных антибиотиков (мидекамицина ацетат, кларитромицин, рокситромицин или др.), так как использование эритромицина часто сопровождается развитием побочных эффектов. Терапию макролидами при этом (за исключением азитромицина) проводят в течение 14 дней. В тех же случаях, когда у иммунодефицитных пациентов, а также у недоношенных или соматически ослабленных детей на фоне неспецифических симптомов интоксикации отмечается постепенное нарастание тахипное, превышающее частоту пульса в разгар заболевания (!), а при рентгенологическом обследовании выявляют «ватное легкое», «крылья бабочки» (диффузное двухстороннее усиление интерстициального рисунка, неоднородные очаговые тени с нечеткими контурами, участки локализованного вздутия, мелкие ателектазы, реже – парциальный пневмоторакс) необходимо исключать пневмоцистную пневмонию. При этом препаратом выбора является ко–тримоксазол в дозе 6–8 мг/кг/сут. (по триметоприму). При тяжелых формах пневмоцистной пневмонии ко–тримоксазол должен вводиться внутривенно в дозе 15–20 мг/кг/сут. (по триметоприму) в два приема на протяжении 2–3 недель.
Стартовая этиотропная терапия внебольничной пневмонии у детей дошкольного возраста. Лечение детей данного возраста при нетяжелых пневмониях проводится, как правило, в амбулаторных условиях. При этом наиболее частым бактериальным возбудителем внебольничных пневмоний является S. pneumoniaе, реже заболевание вызывается H. influenzaе. Учитывая, что пневмококк и гемофильная палочка в последние годы все чаще проявляют устойчивость к природным пенициллинам, антибактериальную терапию рекомендуют начинать с аминопенициллинов (амоксициллин, амоксициллин/клавуланат). Поскольку для лечения легких и среднетяжелых форм пневмонии, как правило, не требуется парентеральное введение антибиотиков, предпочтение отдается оральным формам препаратов. В тех случаях, когда пневмония развивается у ребенка, не получавшего ранее пенициллины, препаратом выбора является амоксициллин. Обычно амоксициллин при этом назначается по 10–20 мг/кг на прием с интервалом 8 часов (суточная доза – 30–60 мг/кг/сут.). Установлено, что более низкие дозы препарата недостаточны для эрадикации основных возбудителей пневмонии и поэтому не должны использоваться. Следует также отметить, что в тех случаях, когда развитие заболевания связывают с пенициллиноустойчивым пневмококком, амоксициллин рекомендуется назначать в более высоких дозах (до 90 мг/кг/сут.) или использовать базовые цефалоспорины 3 поколения (цефтриаксон и цефотаксим) в обычных дозах. Противопоказанием для назначения аминопенициллинов являются анамнестические указания на аллергию к пенициллину. В этих случаях используются макролиды или цефалоспорины 2–3 поколения (риск перекрестной аллергии с пенициллином – 1–3%).
При подозрении на атипичную этиологию пневмонии (хламидии, микоплазмы) терапия проводится современными макролидными антибиотикам (джозамицин, спирамицин, мидекамицин, кларитромицин, рокситромицин или др.). Основанием для предположения об атипичной этиологии пневмонии у детей являются такие клинико–анамнестические данные, как наличие в окружении ребенка «длительно кашляющих» лиц, подострое начало заболевания, длительный субфебрилитет, постепенно нарастающий и длительно сохраняющийся кашель (нередко спастического характера), рецидивирующий бронхообструктивный синдром, а также двухсторонние изменения с мелкими негомогенными очагами и усиленным сосудисто–интерстициальным рисунком на рентгенограмме. В пользу хламидиоза может также свидетельствовать лимфаденопатия, сопутствующая основному заболеванию [7,15,16].
Стартовая антибактериальная терапия внебольничных пневмоний у детей школьного возраста. Основными возбудителями внебольничной пневмонии у детей данной возрастной категории являются пневмококк (S.pneumoniaе) и микоплазма (М. pneumoniaе). При этом установлено, что каждые 4–8 лет, во время эпидемических подъемов заболеваемости M. pneumoniae–инфекции частота микоплазменных пневмоний значительно возрастает (до 40–60% всех пневмоний у детей школьного возраста). Клинически микоплазменная пневмония характеризуется острым началом, нередко с фебрильной лихорадкой. Однако несмотря на гипертермию, симптомы интоксикации у ребенка при этом обычно слабо выражены, что является одним из немногих специфических признаков заболевания. Через несколько дней от начала заболевания появляется кашель – сухой, навязчивый, нередко приступообразный. Кашель может отмечаться в течение длительного времени, но постепенно он становится продуктивным. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы. При рентгенологическом обследовании в легких выявляют двухсторонние очаги негомогенной инфильтрации. Установлено, что у 10% детей с микоплазменной пневмонией отмечается преходящая макулопапулезная сыпь. В подавляющем большинстве случаев заболевание протекает нетяжело, характеризуется гладким течением и отсутствием дыхательной недостаточности или слабой ее выраженностью.
Поскольку микоплазмы, как и хламидии, обладают природной устойчивостью к бета–лактамным антибиотикам, но высокочувствительны к макролидам, то последние являются препаратами выбора в этих клинических ситуациях. Таким образом, принимая во внимание особенности этиологии внебольничной пневмонии у детей школьного возраста (сохранение ведущих позиций у S.pneumoniaе и существенное возрастание роли M.pneumoniae), в качестве стартовых антибиотиков могут быть использованы аминопенициллины (при заболеваниях, вызванных типичными пневмотропными возбудителями) и макролиды – преимущественно при атипичной этиологии пневмонии. В ряде случаев, когда имеются противопоказания для назначения макролидных антибиотиков, лечение микоплазменных и хламидийных пневмоний у детей старше 8 лет может быть проведено доксициклином [1,7,8,11,12].
Эффективность стартовой антибактериальной терапии оценивается в первую очередь по динамике температурной реакции и уменьшению проявлений интоксикации в течение первых 24–48 часов от начала лечения. При своевременном назначении и адекватном выборе стартового антибиотика, строгом соблюдении рекомендуемого режима дозирования улучшение, как правило, отмечается уже на 2–3–й день лечения. При этом ребенок становится более активным, у него улучшаются аппетит и самочувствие, а температура тела имеет тенденцию к нормализации. Если же в этот период положительная клиническая динамика отсутствует или отмечается ухудшение состояния, то следует проводить смену антибиотика. При этом если лечение начинали с амоксициллина, то решают следующие вопросы: возможно ли продолжать терапию другими бета– лактамными антибиотиками или же необходимо использовать макролиды. Если детальный анализ эпидемиологических, клинико–анамнестических и рентгенологических данных не дает оснований считать этиологию пневмонии атипичной, то лечение можно продолжить ингибитор–защищенными аминопенициллинами (амоксициллин/клавуланат, ампициллин/сульбактам) или цефалоспоринами 2–3 поколения. В тех случаях, когда стартовая терапия проводится макролидами, но клинического эффекта нет, вероятнее всего, этиология заболевания не связана с такими атипичными возбудителями. В этих ситуациях макролиды необходимо заменить на бета–лактамные антибиотики.
Критерием прекращения антибиотикотерапии при лечении легких и среднетяжелых форм пневмонии является клиническое выздоровление [1,8,9]. Так, если имеется полный и стойкий регресс клинических симптомов заболевания, то антибактериальные препараты должны быть отменены после окончания полного курса, даже в тех ситуациях, когда еще сохраняются остаточные рентгенологические изменения. При этом особо следует подчеркнуть, что при благоприятном течении пневмонии нет необходимости проводить так называемый «рентгенологический контроль» эффективности лечения. Следует при этом обратить особое внимание на недопустимость раннего (на 3–5–й день) прекращения терапии антибиотиками (кроме азитромицина), так как при этом не только не достигается полная эрадикация возбудителей, но и потенцируется развитие у них антибиотикорезистентности. В целом продолжительность курса антибактериальной терапии при легких и среднетяжелых формах пневмонии, как правило, составляет 7–10 дней. Необходимо отметить, что при лечении пневмоний атипичной (хламидийной, микоплазменной) этиологии может быть оправдан 14–дневный курс терапии макролидами, за исключением тех случаев, когда используется азитромицин.
Непременным условием эффективного лечения ребенка с пневмонией, наряду с проводимой антибактериальной терапией, является строгое соблюдение режима, рациональной диеты, адекватного ухода и рациональной симптоматической терапии. Симптоматическая терапия при пневмонии может быть использована для уменьшения тех клинических проявлений (лихорадка, кашель), которые нарушают самочувствие ребенка. При этом следует помнить, что при систематическом назначении жаропонижающих невозможно адекватно оценить эффективность проводимой антибактериальной терапии. В связи с этим при отсутствии у ребенка отягощающих факторов повышение аксиллярной температуры в пределах 38,5–39°С, как правило, не требует применения антипиретиков. В то же время у детей группы риска по развитию осложнений (возраст – первые 2 мес. жизни, тяжелые заболевания органов дыхания, кровообращения, ЦНС, наследственные метаболические нарушения, фебрильные судороги в анамнезе) жаропонижающие средства должны быть назначены даже при невысоком подъеме температуры тела (до 38,0°С). Препаратами выбора при этом являются парацетамол и ибупрофен (per os или per rectum). У детей раннего возраста парацетамол рекомендовано использовать в дозе 10–15 мг/кг массы тела на прием, ибупрофен – 5–10 мг/кг массы тела на прием. При выраженном токсикозе антипиретики должны вводиться парентерально (метамизол – 5 мг/кг на 1 введение у младенцев и 50–75 мг/год на 1 введение у детей в возрасте старше 1 года; парацетамол – 10–15 мг/кг на 1 введение).
Выбор лекарственных средств от кашля у детей при пневмонии должен проводиться на основе детального анализа клинических особенностей (частота, интенсивность, болезненность, наличие мокроты и ее характер и т.д.) [1,2,17]. При кашле с густой, вязкой, трудноотделяемой мокротой показано назначение муколитиков. В тех случаях, когда кашель редкий, мокрота не отличается высокой вязкостью, могут быть использованы отхаркивающие препараты. При этом у детей раннего возраста отхаркивающие препараты применять нужно с большой осторожностью, т.к. избыточная стимуляция рвотного и кашлевого центров может привести к аспирации, особенно если ребенок имеет поражение ЦНС. Назначение противокашлевых препаратов может быть оправдано, когда отмечается сухой, навязчивый, частый кашель.
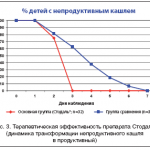
Целесообразно подчеркнуть, что при необходимости назначения антитуссивных средств предпочтение должно отдаваться ненаркотическим противокашлевым препаратам, не оказывающим угнетающего влияния на дыхательный центр и не вызывающим привыкания. При этом в качестве альтернативы ненаркотическим и кодеин–содержащим противокашлевым препаратам при лечении непродуктивного кашля может быть предложен комплексный гомеопатический препарат Стодаль®. Активными компонентами препарата являются Pulsatilla (пульсатилла) C6, Rumex crispus (румекс криспус) C6, Bryonia (бриония) C3, Ipeca (ипека) C3, Spongia tosta (спонгия тоста) C3, Sticta pulmonaria (стикта пульмонария) C3, Antimonium tartaricum (антимониум тартарикум) C6, Myocarde (миокардэ) C6, Coccus cacti (коккус какти) C3, Drosera (дрозера) MT (по Ганеману) [14]. Препарат Стодаль® зарекомендовал себя эффективным и безопасным лекарственным средством при лечении кашля у детей [18–20], что нашло подтверждение и в нашем исследовании. Так, результаты проведенного нами исследования у 61 ребенка в возрасте от 2 лет – до 5 лет 11 мес 29 дней с частым, интенсивным, непродуктивным кашлем на фоне острой инфекции органов дыхания показали, что клиническая эффективность изучаемого препарата не уступает кодеин–содержащему лекарственному средству (рис. 2 и 3). При этом нами установлено, что при использовании препарата Стодаль® (основная группа, n=32) динамика и темпы снижения интенсивности кашля не отличались от аналогичных показателей группы сравнения (n=31), в которой применяли комбинированный препарат, содержащий кодеин, а также экстракты отхаркивающих и противовоспалительных трав (рис. 2). В то же время было показано, что если в основной группе ночной кашель был купирован к концу 5–го дня терапии, то в группе сравнения – только на 7–е сутки. Более быстрое уменьшение эпизодов кашля в ночное время позволило быстрее нормализовать сон у детей, принимавших препарат Стодаль®. Кроме этого, кашель у детей основной группы значительно быстрее становился продуктивным, что также благоприятно влияло на течение заболевания (рис. 3). Особо следует отметить хорошую переносимость препарата Стодаль® – побочных реакций и нежелательных явлений отмечено не было, что также согласуется с результатами других авторов [18–20].
В заключение необходимо еще раз подчеркнуть, что определяющими для благоприятного течения и исхода пневмонии у детей являются ранняя диагностика заболевания и своевременно назначенная рациональная терапия, основные принципы которых изложены в настоящем сообщении.
Литература
- Таточенко В.К. Практическая пульмонология детского возраста. М. 2001; 268.
- Острые респираторные заболевания у детей: лечение и профилактика/ Научно–практическая программа Союза педиатров России. М.: Международный Фонд охраны здоровья матери и ребенка 2002; 69.
- Классификация клинических форм бронхолегочных заболеваний у детей. Рос. Вест. Перинатол. и Педиатр. 1996; 2: 52–56.
- Пневмонии у детей/ Под ред. С.Ю.Каганова, Ю.Е.Вельтищева. М.: Медицина 1995.
- Churgay C.A. The diagnosis and management of bacterial pneumonias infant and children. Primary Care. 1996;4: 822–835.
- Gendrel D. Pneumonies communautaires de I’enfant: etiologie et traitement. Arh. Pediatr., 2002, 9 (3): 278–288.
- Red Book: Report of the Committee on Infectious Diseases. 27h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
- Коровина Н.А., Заплатников А.Л., Захарова И.Н. Антибактериальная терапия пневмоний у детей. М.: Медпрактика 2006; 48.
- The Management of Community–Acquired Pneumonia in Infants and Children Older than 3 month of Age. Clin Infect Dis. 2011, 30 august.
- .Международная статистическая классификация болезней и проблем, связанных со здоровьем. 10 пересмотр. ВОЗ, 1994 (пер. на рус.) М.: Медицина; 1998.
- Антибактериальная терапия пневмонии у детей. Пособие для врачей. – Клиническая микробиология и антимикробная терапия у детей. 2000; 1: 77 – 87.
- Страчунский Л.С. Антибактериальная терапия пневмоний у детей. / Руководство по фармакотерапии в педиатрии и детской хирургии/ Под ред. С.Ю.Каганова. М.: Медпрактика–М 2002; Т.1: 65 – 103.
- Самсыгина Г.А., Дудина Т.А. Тяжелые внебольничные пневмонии у детей: особенности клиники и терапии. Consilium Medicum. 2002; 2: 12–16.
- Государственный реестр лекарственных средств: МЗиСР РФ, 2011.
- Block S., Hedrick J., Hamerschlag M.R. et al. Mycoplasma pneumoniae and Chlamydia pneumoniae in pediatric community–acquired pneumonia. Pediatr. Infect. Dis. J., 1995; 14: 471–477.
- Principi N., Esposito S., Blasi F., Allegra L. Role of Mycoplasma pneumoniae and Chlamydia pneumoniae in children with community–acquired lower respiratory tract infections. Clin. Infect. Dis., 2001, 32: 1281–1289.
- Коровина Н.А., Заплатников А.Л., Захарова И.Н., Овсянникова Е.М. Кашель у детей. Противокашлевые и отхаркивающие лекарственные средства в педиатрической практике. – М., 2000. – 53 с.
- Радциг Е.Ю. Кашель – защитный механизм и симптом инфекций дыхательных путей. Педиатрия. 2009, 5(87): 112–116.
- Радциг Е.Ю. Кашель у детей: дифференциальный диагноз и лечение. Consilium medicum (Приложение Педиатрия). 2009, 1: 66–69.
- Богомильский М.Р., Радциг Е.Ю. Симптоматическая терапия кашля с позиций оториноларинголога. Consilium medicum (Приложение Педиатрия). 2010, 1: 3–7














Комментировать