Данные собственного исследования, в котором изучались особенности циркадного ритма артериального давления у пациентов с артериальной гипертензией, перенесших ишемический инсульт, а также анализ динамики показателей суточного мониторирования артериального давления на фоне различных вариантов комбинированной антигипертензивной терапии.
Турна Э.Ю., Крючкова О.Н., Крымский государственный медицинский университет им. С.И. Георгиевского, Симферополь, Украина
Резюме. Приведены данные собственного исследования, в котором изучались особенности циркадного ритма артериального давления у пациентов с артериальной гипертензией, перенесших ишемический инсульт, а также анализ динамики показателей суточного мониторирования артериального давления на фоне различных вариантов комбинированной антигипертензивной терапии.
Ключевые слова: инсульт, артериальная гипертензия, суточное мониторирование артериального давления, лечение.
Summary. The paper presents the data of its own study, which examined features of the circadian rhythm of blood pressure in patients with hypertension and stroke in historyand the analysis of the dynamics of the ABP on the background of different options combined antihypertensive therapy.
Keywords: stroke, hypertension, blood pressure monitoring, treatment.
Артериальная гипертензия (АГ) является основным фактором риска инсульта и транзиторной ишемической атаки, риск которых возрастает с увеличением систолического артериального давления (АД) [5, 6, 9]. Доказано, что сердечно-сосудистый риск можно минимизировать стойкой коррекцией АД [7, 11]. Известно также, что антигипертензивная терапия уменьшает частоту повторных нарушений мозгового кровообращения вне зависимости от исходного АД [14].
В настоящее время недостаточно изучены проблемы особенностей течения АГ у больных, перенесших ишемический инсульт (ИИ), и связи показателей суточного мониторирования АД (СМАД) с риском развития повторного инсульта [8, 10].
По данным ряда авторов, АД у пациентов с АГ сопровождается значительной вариабельностью АД, отсутствием «отдыха от высокого АД» в ночное время [2, 3, 12], которые более тесно связаны с изменениями в органах-мишенях исходно и с наблюдаемой их динамикой в процессе лечения, что дает возможность более точно оценивать антигипертензивный эффект терапии [1].
В серии исследований было показано, что увеличенная вариабельность АД – важный и независимый фактор поражения органов-мишеней [4, 13]. Известно, что вариабельность АД во многом зависит от степени снижения АД в ночные часы и величины и скорости утреннего подъема АД. Также, по данным современных исследований, важным фактором сердечно-сосудистого риска, особенно у пожилых и больных с изолированной систолической АГ, является пульсовое АД (PsАД).
Однако несмотря на актуальность этой проблемы у пациентов с АГ, перенесших ИИ, недостаточно изучены особенности циркадного ритма АД, влияние на данные показатели различных антигипертензивных препаратов и их комбинаций, не разработаны методы дифференцированного подхода к антигипертензивной терапии с учетом выявленных маркеров дополнительного сердечнососудистого риска.
Цель исследования – изучение влияния различных вариантов комбинированной антигипертензивной терапии на циркадный ритм АД при СМАД у пациентов с АГ, перенесших ИИ.
Материалы и методы
Всего обследовано 145 человек. В основную группу вошли 75 пациентов с АГ 1-й и 2-й степени, перенесших ИИ и/или транзиторную ишемическую атаку >3 месяцев назад на момент включения в исследование, которые были рандомизированы на две группы: в группе А – 37 больных (средний возраст 60,76 ± 1,32 лет, мужчин – 21, женщин – 16), в группе В – 38 пациентов (средний возраст 60,76 ± 1,39 лет, мужчин – 22, женщин – 16). В группе А с целью контроля АГ назначалась комбинация олмесартана в дозе 10–20 мг/сут и гидрохлортиазида в дозе 12,5–25 мг/сут (олм + гхт). Пациентам группы В назначалась комбинация олмесартана в дозе 10–20 мг/сут и амлодипина в дозе 5–10 мг/сут (олм + амл).
Критерии исключения: АГ 3-й степени, сердечная недостаточность с фракцией выброса левого желудочка ≤35%, постоянная форма фибрилляции предсердий, инвалидизирующие последствия перенесенного ИИ, геморрагический инсульт в анамнезе, злокачественные новообразования.
В группу сравнения вошли 30 пациентов с АГ 1-й и 2-й степени без клинических поражений органовмишеней, средний возраст 59,32 ± 1,32 (р < 0,05), мужчин было 18, женщин – 12. Группу контроля составили 30 человек, сопоставимых по полу и возрасту, без сердечно-сосудистых заболеваний и факторов кардиоваскулярного риска.
Всем пациентам проводилось СМАД аппаратом холтеровского мониторирования АД и ЭКГ типа АВРМ-04 («Labtech», Венгрия). Измерения АД при суточном мониторировании проводились каждые 30 минут в период дневной активности и каждые 40 минут во время ночного сна. Проводили анализ средних значений систолического и диастолического АД (САД и ДАД), показатели «нагрузки давлением» (НД САД и НД ДАД), вариабельность систолического АД (ВАР САД), диастолического АД (ВАР ДАД), PsАД за сутки, в дневное и ночное время, а также рассчитывались скорость утреннего подъема систолического и диастолического АД (СУП САД и СУП ДАД).
Показатели периферического крово-обращения и СМАД в основной группе оценивались до начала лечения и через год на фоне антигипертензивной терапии.
Статистическая обработка данных проводилась с помощью вариационной статистики с применением пакета «Statistica 10». Использовались методы описательной статистики, определялось соответствие вида распределения признака закону нормального распределения. Сравнение групп по показателям проводилось с помощью непараметрического анализа на основе критериев Манна–Уитни и Уилкоксона.
Результаты и обсуждение
До назначения антигипертензивной терапии нами проанализированы показатели СМАД в основной группе, группе сравнения и группе контроля (табл. 1).
Таблица 1. Показатели СМАД до лечения
| СМАД, мм рт. ст. | Основная группа,n = 75 | Группа сравнения,n = 30 | Группа контроля,n = 30 |
| САД | 137,55 ± 1,59 * | 135 ± 1,89 * | 108,6 ± 1,33 |
| САДд | 138,5 ± 2,01 * | 138 ± 2,36 * | 111,2 ± 1,52 |
| САДн | 130,46 ± 2,01 * | 128,07 ± 1,65 * | 102,3 ± 1,34 |
| ДАД | 83,17 ± 1,46 * | 86,1 ± 1,3 * | 68,74 ± 0,92 |
| ДАДд | 86,17 ± 1,43 * | 88,77 ± 1,52 * | 71,32 ± 1,07 |
| ДАДн | 76,12 ± 1,7 * | 80,23 ± 1,36 * | 62,47 ± 0,71 |
| СрАД | 101,05 ± 1,39 * | 102,2 ± 1,22 * | 81,58 ± 0,88 |
| СрАДд | 104,28 ± 1,39 * | 105,13 ± 1,49 * | 84,32 ± 1,02 |
| СрАДн | 93,98 ± 1,65 * | 98 ± 1,69 * | 76 ± 0,91 |
| НД САД | 0,49 ± 0,03 * | 0,47 ± 0,06 * | 0 ± 0,004 |
| НД САДд | 0,44 ± 0,03 * | 0,42 ± 0,07 * | 0 ± 0,003 |
| НД САДн | 0,63 ± 0,05 * | 0,66 ± 0,09 * | 0 ± 0,01 |
| НД ДАД | 0,23 ± 0,04 * | 0,33 ± 0,05 * | 0 ± 0,005 |
| НД ДАДд | 0,21 ± 0,05 * | 0,25 ± 0,08 * | 0 ± 0,007 |
| НД ДАДн | 0,21 ± 0,05 * | 0,34 ± 0,06 * | 0 ± 0,007 |
| ВАР САД | 17,5 ± 0,59 * | 16 ± 1,64 * | 9 ± 0,8 |
| ВАР САДд | 16,5 ± 0,65 * | 16 ± 1,82 * | 9 ± 0,8 |
| ВАР САДн | 13,22 ± 0,83 * | 12,3 ± 1,45 * | 7,74 ± 0,59 |
| ВАР ДАД | 13,34 ± 0,54 * | 12 ± 1,3 * | 7,84 ± 0,43 |
| ВАР ДАДд | 12,84 ± 0,61 * | 11 ± 1,22 * | 7 ± 0,7 |
| ВАР ДАДн | 9,6 ± 0,59 * | 9 ± 1,69 * | 6,21 ± 0,47 |
| СИ САД | 0,07 ± 0,01 | 0,09 ± 0,02 | 0,07 ± 0,01 |
| СИ ДАД | 0,11 ± 0,01 | 0,13 ± 0,02 | 0,11 ± 0,01 |
* P < 0,05 по отношению к группе сравнения.
При анализе СМАД, нами выявлено статистически значимое увеличение среднесуточных показателей САД, ДАД и СрАД в группах пациентов с АГ по сравнению с группой контроля (р < 0,05). Нами были также выявлены высокая вариабельность показателей АД за сутки и достоверное повышение скорости утреннего подъема АД у больных АГ, что расценивается как фактор риска развития кардиоваскулярных катастроф и повреждения органов-мишеней. Так, у пациентов основной группы ВАР САД за сутки составила 17,5 ± 0,59 ед., в группе контроля – 9 ± 0,8 ед. (р < 0,01), а СУП САД у пациентов с АГ, перенесших ИИ, превышала более чем в 3 раза СУП САД в группе контроля (25,15 ± 3,1 мм рт. ст./ч в основной группе и 8,42 ± 0,9 мм рт. ст./ч в группе контроля, р < 0,01), СУП ДАД в основной группе исследования составил 18 ± 2,91 мм рт. ст./ч, в группе контроля – 7,92 ± 0,74 мм рт. ст./ч (р < 0,01). Также нами выявлено статистически значимое увеличение PsАД за сутки у пациентов с АГ: в основной группе среднесуточное PsАД составило 57,01 ± 1,07 мм рт. ст., в группе контроля – 39,32 ± 1,29 мм рт. ст. (р < 0,01).
Сравнительный анализ показателей СМАД в основной группе и группе сравнения позволил выявить особенности суточной динамики АД у пациентов с АГ, перенесших ИИ. Как видно из табл. 1, различия среднесуточных показателей САД, ДАД и СрАД, а также показателей нагрузки давлением и вариабельности САД и ДАД в группе пациентов с АГ, перенесших ИИ, и в группе сравнения были статистически незначимы (р > 0,05). При этом нами было выявлено достоверное повышение суточных показателей PsАД (рис. 1).
Средний показатель PsАД за сутки в основной группе исследования составил 57,01 ± 1,07 мм рт. ст., что достоверно выше, чем в группе сравнения, – 52,63 ± 1,1 мм рт. ст., р < 0,05. Также было выявлено достоверное превышение PsАД ночью у пациентов, перенесших ИИ, по сравнению с больными АГ без мозговых катастроф: в основной группе – 57 ± 1,6 мм рт. ст., в группе сравнения –50,5 ± 1,28 мм рт. ст., р < 0,05. Показатель PsАД в дневное время в основной группе также был выше 56,5 ± 1,35 мм рт. ст., но достоверно не отличался от группы сравнения – 53 ± 1,541 мм рт. ст., р > 0,05.
Особенностью суточной динамики АД у пациентов, перенесших ИИ, были также достоверно более высокие скоростные показатели утреннего подъема АД. СУП САД в основной группе составила 25,2 ± 3,1 мм рт. ст./ч, что в 1,5 раза выше, чем в группе сравнения, – 16,5 ± 2,0 мм рт. ст./ч., р < 0,05. Аналогично и СУП ДАД в группе больных, перенесших ИИ, превышала данный показатель в группе сравнения: 18 ± 2,9 мм рт. ст./ч и 13 ± 2,3 мм рт. ст./ч. соответственно, р < 0,05.
Нормальная скорость ночного снижения (СНС) АД (10–20%) отмечалась только у 15 (25%) пациентов основной группы, тогда как в группе сравнения достаточное ночное снижение АД отмечалось у 12 (37,5%) человек, р < 0,05. В обеих группах преобладали лица с недостаточной СНС АД (nondipper). В основной группе выявлено 28 (46,7%), в группе сравнения – 14 (43,8%) пациентов с недостаточной СНС АД, р > 0,05. Больные с ночным повышением АД (night-peacker) преобладали в основной группе (10 (16,7%) человек в группе с ИИ в анамнезе и 2 (6,3%) пациента в группе сравнения, р < 0,05). Количество лиц с чрезмерным ночным снижением АД (hiper-dipper) достоверно не отличалось в двух группах: в основной группе пациенты с «hiper-dipper» – 7 (11,7%) человек, в группе сравнения – 4 (12,5%), р > 0,05).
Нами также была проанализирована частота эпизодов гипотонии у пациентов с АГ. Так, в основной группе гипотонические состояния зарегистрированы у 10 (16,7%) человек, в том числе в активный период суток – у 7 (11,7%), в ночное время – у 6 (10%) больных. Длительность гипотонических состояний у пациентов с АГ, перенесших ИИ, составляла до 2 ч (4–5 измерений при СМАД). В группе больных АГ без клинического поражения органов-мишеней эпизоды гипотонии выявлены у 2 (6,7%) человек, у которых регистрировались кратковременные эпизоды гипотонии и в дневное и в ночное время (до 30 мин, 1 измерение при СМАД).
Через год на фоне терапии нами были оценены антигипертензивные эффекты исследуемых комбинаций препаратов.
При анализе данных СМАД через год на фоне различных вариантов комбинированной антигипертензивной терапии нами выявлено сопоставимое снижение среднесуточных САД и ДАД, СрАД и показателей нагрузки давлением в группе олм + гхт и олм + амл, что отражает их одинаковую антигипертензивную эффективность. Также изучаемые комбинации одинаково эффективно снижали СУП САД и ДАД. Так, в группе А СУП САД до лечения составила 27 ± 4,25 мм рт. ст./ч, на фоне терапии – 14,8 ± 3,02 мм рт. ст./ч.; аналогично СУП ДАД снизилась с 23,7 ± 2,48 мм рт. ст./ч до 10 ± 1,64 мм рт. ст. (р < 0,01). На фоне терапии в группе В отмечалось замедление скорости утреннего подъема: САД – с 24,5 ± 4,46 мм рт. ст./ч до 12,76 ± 1,08 мм рт. ст./ч; ДАД – с 23,3 ± 3,74 мм рт. ст./ч до 8 ± 2,89 мм рт. ст./ч (р < 0,01) (табл. 2).
Таблица 2. Показатели СМАД в группах А и В до лечения и на фоне комбинированной антигипертензивной терапии
| ПоказательСМАД | Группа А | Группа В | ||
| до лечения | на фоне терапии | до лечения | на фоне тера-пии | |
| САД | 137,44 ± 2,2 | 118,84 ± 1,23* | 137,22 ± 1,9 | 121,21 ± 1,28* |
| САДд | 137,5 ± 2,888 | 122,79 ± 1,58* | 140,14 ± 1,84 | 125,25 ± 1,38* |
| САДн | 129,12 ± 2,78 | 110,57 ± 2,05* | 131 ± 2,4 | 115,94 ± 1,87* |
| ДАД | 82,53 ± 1,67 | 74,95 ± 0,94* | 83,51 ± 2,07 | 72,16 ± 1,2* |
| ДАДд | 85,62 ± 1,68 | 78,75 ± 1,25* | 86,43 ± 1,97 | 75,25 ± 1,38* |
| ДАДн | 74,27 ± 1,85 | 67,61 ± 1,26* | 77,38 ± 2,48 | 66,34 ± 1,59* |
| СрАД | 100,18 ± 1,7 | 89,57 ± 1,23* | 101,05 ± 1,87 | 88,56 ± 1,18* |
| СрАДд | 103,64 ± 1,73 | 93 ± 1,28* | 104,24 ± 1,79 | 91,59 ± 1,21* |
| СрАДн | 91,66 ± 1,95 | 81,54 ± 1,44* | 95,08 ± 2,27 | 82,44 ± 1,43* |
| НД САД | 0,48 ± 0,04 | 0,13 ± 0,03* | 0,51 ± 0,04 | 0,15 ± 0,04* |
| НД САДд | 0,44 ± 0,05 | 0,09 0,03* | 0,43 ± 0,05 | 0,13 ± 0,03* |
| НД САДн | 0,58 ± 0,06 | 0,25 ± 0,05* | 0,67 ± 0,05 | 0,38 ± 0,04* |
| НД ДАД | 0,3 ± 0,05 | 0,08 ± 0,03* | 0,33 ± 0,05 | 0,05 ± 0,04* |
| НД ДАДд | 0,19 ± 0,06 | 0,1 ± 0,04* | 0,21 ± 0,06 | 0,04 ± 0,04* |
| НД ДАДн | 0,28 ± 0,06 | 0,09 ± 0,04* | 0,38 ± 0,06 | 0,08 ± 0,06* |
| ВАР САД | 17,64 ± 0,98 | 15,82 ± 0,75 | 17,38 ± 0,72 | 12,41 ± 0,53* |
| ВАР САДд | 17 ± 1,082 | 14,96 ± 0,82 | 16 ± 1,219 | 11,34 ± 0,57* |
| ВАР САДн | 13,9 ± 1,44 | 11,5 ± 1,141 | 12,65 ± 0,93 | 10,97 ± 0,85 |
| ВАР ДАД | 13,21 ± 0,67 | 11,5 ± 0,7275 | 13,46 ± 0,83 | 9,88 ± 0,52 |
| ВАР ДАДд | 12,33 ± 0,73 | 11,25 ± 0,74 | 13,3 ± 0,97 | 8,88 ± 0,66 |
| ВАР ДАДн | 9,94 ± 0,98 | 9,36 ± 0,77 | 9,32 ± 0,72 | 7,81 ± 0,58 |
* Р < 0,05 по отношению к показателям до лечения.
При анализе параметров циркадного ритма АД в двух группах до лечения и через год на фоне терапии нами получены данные о различном влиянии комбинации олм + гхт и олм + амл на ВАР САД и PsАД. Комбинация олм + амл вызывала статистически значимое снижение ВАР САД за сутки и в дневное время, лечение комбинацией олм + гхт не вызывало статистически значимых изменений этого показателя (рис. 2, 3).
Комбинация олм + амл снижала ВАР САД за сутки на 5 единиц (до лечения – 17,38 ± 0,72, на фоне терапии – 12,41 ± 0,53, р < 0,0005); на фоне терапии олм + гхт наблюдалось статистически незначимое снижение ВАР САД (до лечения в группе А – 17,64 ± 0,98, на фоне терапии – 15,82 ± 0,75,р > 0,05).
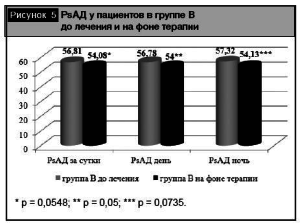
Важными представляются полученные нами данные о различном влиянии комбинаций олм + гхт и олм + амл на динамику PsАД как независимого фактора сердечно-сосудистых осложнений и маркера сосудистой жесткости (рис. 4, 5).
При сравнительной оценке эффективности назначеннной комбинированной антигипертензивной терапии в группах А и В (рис. 4, 5) отмечалось более выраженное (статистически значимое) снижение PsАД за сутки, в дневное и ночное время в группе А на фоне терапии олм + гхт (PsАД за сутки в группе А до лечения составило 57,24 ± 1,87 мм рт. ст., на фоне терапии – 42,61 ± 1,13 мм рт. ст., р < 0,01). В группе В не выявлено статистически значимого влияния комбинации олм+амл на динамику PsАД (до лечения Ps АД за сутки в группе В составило 56,81 ± 1,17 мм рт. ст., на фоне терапии – 54,08 ± 0,76, р = 0,0548).
Выводы:
1. У пациентов с АГ, перенесших ИИ, при СМАД выявлены статистически значимые повышение пульсового АД и скорости утреннего подъема АД.
2. Комбинированная антигипертензивная терапия олмесартаном и гидро-хлортиазидом и олмесартаном и амлодипином у пациентов с АГ, перенесших ИИ, обладали сопоставимой эффективностью по достижению целевого уровня АД, снижению нагрузки давлением и скорости утреннего подъема АД.
3. Комбинация олмесартана и амлодипина способствовала статистически значимому снижению вариабельности САД за сутки.
4. Применение комбинации олмесартана и гидрохлортиазида сопровождалось более выраженным снижением пульсового АД за сутки, днем и в ночное время, что отражает более выраженное влияние данной комбинации на жесткость крупных артерий эластического типа.
Л И Т Е Р А Т У Р А
1. Всероссийское медицинское общество по артериальной гипертонии (РМОАГ), Всероссийское научное общество кардиологов (ВНОК). Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр) // Системные гипертензии. – 2010. – № 3. – С. 5–26.
2. Симоненко В.Б., Широков Е.А., Овчинников Ю.В. // Клиническая медицина. – 2007. – № 9. – С. 45–49.
3. Шацкая Е.Г., Карпенко М.А., Солнцев В.Н. // Артериальная гипертензия. – 2009. – Т. 15, № 3. – С. 342–345.
4. Kikuya M., Hozava A., Ohokubo T. et al. // Hypertension. – 2000. – Vol. 36. – P. 901–906.
5. Law M.R., Morris J.K., Wald N.J. // BMJ. – 2009. – Vol. 338. – b1665.
6. Lewington S., Clarke R., Qizilbash N. et al. // Lancet. – 2002. – Vol. 360. – P. 1903.
7. Messerli F.H., Bangalore S. // J. Am. Coll. Cardiol. – 2011. – Vol. 57. – P. 114.
8. O’Brien E. // J. Hypertension. – 2003. – Vol. 21. – P. S11–S18.
9. Ovbiagele B., Diener H.C., Yusuf S. et al. // JAMA. – 2011. – Vol. 306. –P. 2137.
10. Pickering T.G., Shimbo D., Haas D. // N. Engl. J. Med. – 2006. – Vol. 354. – P. 2368–2374.
11. Rashid P., Leonardi-Bee J., Bath P. // Stroke. – 2003. – Vol. 34. – P. 2741.
12. Rothwell P., Howard S., Dolan E. et al. // Lancet. – 2010. – Vol. 375. – P. 895–905.
13. Sega R., Corrao G., Bombelli M. et al. // Hypertension. – 2002. – Vol. 39. – P. 710–714.
14. Thompson A.M., Hu T., Eshelbrenner C.L. et al. // JAMA. – 2011. – Vol. 305. – P. 913.
Медицинские новости. – 2013. – №6. – С. 94-98.











Комментировать