Органохлорины. Программа Организации Объединенных Наций по окружающей среде и группа из 16 соединений, на которые следует обращать первоочередное внимание при экологических исследованиях: описание.
С.В. Гуньков, к.м.н, Институт экогигиены и токсикологии им. Л.И. Медведя, г. Киев, Р.А. Моисеенко, к.м.н, МЗ Украины, г. Киев, Н.Г. Проданчук, член-кор. АМН України
Органические соединения, которые содержат в своей структуре атомы хлора, называют органохлоринами. К группе органохлоринов относят диоксины, бензофураны и бифенилы. Диоксины — это обобщенное название большой группы полихлорированных соединений ароматического ряда, а также полихлорированных бифенилов — близких родственников диоксинов и полиароматических углеводородов — сильнейших канцерогенов. Они являются порождением современной цивилизации и результатом хозяйственной деятельности человека в промышленно развитых странах. Диоксины не удалось выявить даже в следовых количествах ни в тканях эскимосов, которые замерзли 400 лет тому, ни в тканях мумий индейцев, найденных на территории Чили. В природе не существует естественных источников образования диоксинов.
За высокую токсичность органохлорины относят к особому классу загрязняющих веществ
— экотоксикантам или суперэкотоксикантам. Отнести полихлорированные дибензо-п-диоксины и дибензофураны к супертоксикантам позволяют следующие основные признаки:
-острая токсичность в чрезвычайно малых концентрациях — 1•10-9–1•10-15 г/г;
-распространённость в объектах окружающей среды и пищевых продуктах;
-устойчивость к воздействию естественных внешних факторов (окисление, гидролиз и др.);
-высокая способность растворяться и накапливаться в жировой ткани животных и человека, а также способность к миграции по пищевым цепям [1].
Программа Организации Объединенных Наций по окружающей среде выделяет группу из 16 соединений, на которые следует обращать первоочередное внимание при экологических исследованиях. Эта так называемая «грязная дюжина», включает в себя следующие вещества: альдрин, хлордан, диелдрин, ендрин, гептахлор, гексахлорбензол (ГХБ), мирекс, токсафен, ДДТ, полихлорированные бифенилы (ПХБ), полихлорированные дибензо-п-диоксины (ПХДД) и дибензофураны ПХДФ). Наибольшую токсичность имеют 17 изомеров ПХДД и ПХДФ, в которых атомы хлора находятся 2,3,7, 8-положениях бензольных колец.
Токсичность 2,3,7, 8-ТХДД превышает токсичность цианидов, стрихнина и кураре.
Теоретически возможно существование 209 изомеров (конгенеров) ПХБ. Однако в виде промышленных продуктов производится только 130 соединений. Наибольшей токсичностью обладают конгенеры ПХБ, не имеющие заместителя (атома хлора) в орто-положениях бензольных колец (самый токсичный конгенер — 3,3′,4,4′,5-ПХБ) и некоторые моно-орто-замещенные.
Стокгольмская конвенция о стойких органических загрязнителях (2001) определяет источники непреднамеренного производства и выбросов ПХДД, ПХДФ, ГХБ и ПХБ:
-открытое сжигание отходов, включая горение мусора на мусорных свалках;
-термические процессы на предприятиях металлургической промышленности;
-источники, связанные с процессами сжигания в домашних хозяйствах;
-сжигание ископаемых видов топлива в котлах коммунального хозяйства и в промышленных котлах;
-установки для сжигания древесины и других видов топлива из биомассы;
-крематории;
-транспортные средства и, прежде всего, работающие на этилированном бензине;
-уничтожение туш животных;
-покраска (с использованием хлоранилина) и отделка (при помощи экстрагирования щелочью) в текстильной и кожевенной промышленности;
- установки для переработки отслуживших свой срок автомобилей;
- обработка поливинилхлоридной изоляции медных кабелей тлеющим огнем;
-предприятия по регенерации отработанных масел.
Около 80–90 процентов диоксинов попадают в организм человека вместе с продуктами питания и водой через желудочно-кишечный тракт. Больше всего их содержится в животных жирах (молоко и молочная продукция, мясо, рыба). Свежая морская рыба, моллюски, и другая продукция морского происхождения — иногда могут содержать высокие концентрации диоксинов. Население, которое занимается рыбным промыслом и потребляет рыбные продукты в больших количествах, может подвергаться токсическому воздействию диоксинов [2]. Кроме того, диоксины могут попадать в организм человека через кожу и слизистые оболочки, ингаляционным путем через воздух (аэрозоль). Особую обеспокоенность вызывает трансплацентарний путь попадания диоксинов в организм плода. Последние исследования показали, что плацентарный барьер не защищает плод от диоксинов, т.е. диоксины начинают действовать на ребенка уже в утробе матери. Чем больше хлора в молекуле диоксина, тем он тяжелее проходит плацентарный барьер, таким образом, самые токсичные диоксины легче всего одолевают плацентарный барьер. Эти соединения были обнаружены в ткани эмбрионов и плодов человека. Именно с воздействием органохлоринов связывают возникновение аномалий развития плода или его гибель.
Диоксины имеют выраженную способность к кумуляции. Накапливаются они преимущественно в жировой ткани, коже и печени. Выяснилось, что если содержимое диоксинов в крови принять за единицу, то содержимое их в жировой ткани будет выше в 300 раз, в коже — 30 раз, в печени — 25 раз, в грудном молоке — 13 раз. Период полувыведения диоксинов из организма составляет от 5,8 до 32,5 лет, в среднем — 7,4 года.
Впервые негативные эффекты диоксинов на репродуктивную систему были выявлены в 70-х годах после применения во время войны во Вьетнаме «Оранжевого Агента», имевшего примеси диоксина. В районах поражения наблюдалось увеличение частоты пузырных заносов, выкидышей, внутриутробной гибели плода, аномалий развития плода и другие осложнения беременности. Начиная с этого периода, ученые всего мира начали активное изучение влияния диоксинов и диоксиноподобных соединений на репродуктивную функцию.
Установлено, что токсические эффекты диоксинов и диоксиноподобных соединений на репродуктивную систему, связаны, прежде всего, с гормональными эффектами: имитацией функции гормонов, изменениями рецепторного аппарата, изменениями секреции гормонов и их метаболизма как в печени, так и других органах. Поэтому их назвали эндокринными дисрапторами [3]. Кроме того, не исключено прямое токсическое действие дисрапторов на эндокринные железы. Скорее всего, эти эффекты реализуются на клеточном уровне путём активации факторов апоптоза.
Была предложена эпигенетическая теория возникновения заболеваний под влиянием неблагоприятных экологических факторов. Предполагается, что экологические агенты изменяют транскрипционную способность генов без изменения последовательности ДНК, вследствие чего происходят изменения, которые приводят к возникновению заболеваний. Высказано предположение, что модификации хроматина, связанные с воздействием экологических факторов в ходе индивидуального развития организма, могут передаваться по наследству. Это своеобразный экологический импринтинг. Эпигенетические изменения помогают объяснить, почему экспонирование экотоксикантами в ходе развития, может увеличить вероятность возникновения заболевания в более позднем периоде и, возможно, даже передаться следующим поколениям. Эта теория сегодня получила широкую поддержку у многих исследователей [4].
Сравнительно недавно началось детальное изучение механизмов повреждающего действия органохлоринов, однако уже накоплен огромный материал. Для лучшего понимания патологии, возникающей у человека, объяснения существующих противоречий и лучшего восприятия дальнейшего материала, мы кратко представим основные патогенетические механизмы, лежащие в основе повреждающего действия диоксинов.
Арил-углеводородные рецепторы (AhR).
Детальное изучение патогенетических механизмов, лежащих в основе реализации эффектов эндокринных дисрапторов, показало участие арил-углеводородных рецепторов в возникновении патологических процессов репродуктивной функции. Наиболее хорошо Ah-рецепторные взаимодействия изучены на примере диоксинов. AhR
— является частью семейства транскрипционных регуляторов, которые контролируют разнообразные эффекты эволюции и физиологии организма, включая нейрогенез, формирование трахеи, слюнных протоков, метаболизм токсинов, суточные ритмы, ответную реакцию на гипоксию, функцию гормональных рецепторов и др.
Гены, которые находятся под управлением AhR, принадлежат к двум основным функциональным группам:
1) Гены, программирующие энзимы, метаболизирующие лекарства (токсины). Индукция генов может изменить активность биотрансформации внутренних и внешних субстанций, что может вызывать как позитивные, так и повреждающие эффекты;
2) Аберрантно регулируемые гены, которые влияют на процессы пролиферации и дифференцировки клеток.
В последние годы произошёл существенный прогресс в пояснении молекулярных механизмов, отвечающих за токсические эффекты эндокринных дисрапторов. Известно, что структура Ah рецептора, включает домен (область) — PAS. Название происходит от названия протеинов — Per-AhR-Sim — Drosophila Per, человеческий ARNT и Drosophila Sim. PAS домен включает 260310 аминокислот. В структуре AhR встречаются две повторяющиеся высокостабильные гидрофобные области, названные PAS-A и PAS-B. В целом PAS домен не является стабильным по размеру и разнообразию последовательностей, может опосредовать множество разнообразных биохимических функций [3]. PAS играет важную регуляторную роль в ответных реакциях на внешние сигналы и органогенезе. Активация AhR экзогенными лигандами способствует возникновению дефектов в развития и дифференцировки различных тканей, таких как сердце, нёбо, почка и репродуктивные органы. Основываясь на большом количестве экспериментальных исследований, эндогенная роль AhR и ARNT в органогенезе была принята без доказательства. На примере ТХДД была показана модель активации AhR и взаимодействия с геномом клетки (рис. 1) [2, 3, 5].
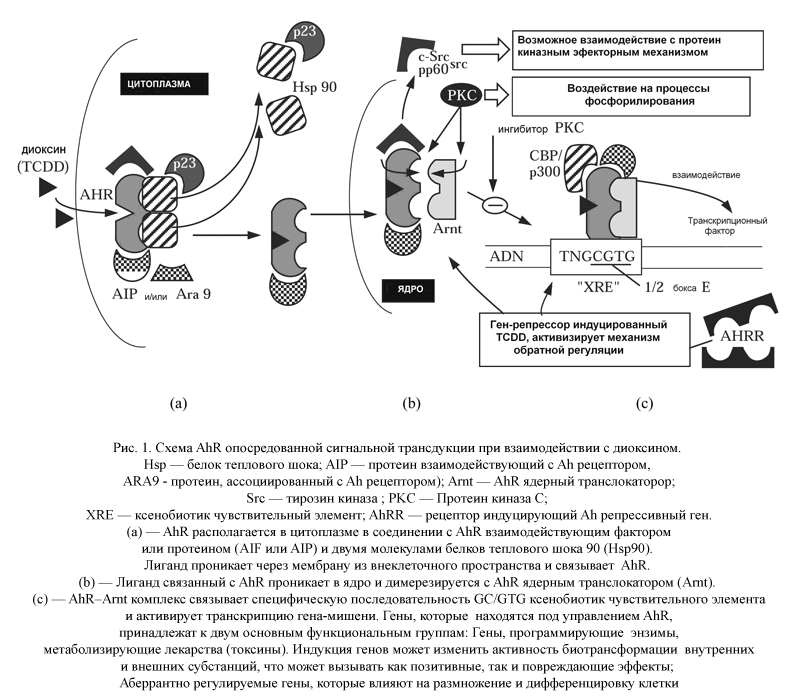
AhR, находящиеся в цитоплазме, связаны как минимум с двумя протеинами (белками теплового шока — Hsp90). Кроме Hsp90, в реализации эффектов AhR принимают участие и другие белки теплового шокового стресса: p23, AIP (взаимодействующий с Ah протеином), ARA9 (протеин, ассоциированный с Ah рецептором). Эти протеины поддерживают AhR в состоянии готовности к связыванию. При связывании лигандами (например, ТХДД), происходит их замещение. После чего AhR входит в ядро, где вступает в соединение с ядерным компонентом — AhR ядерным транслокатором (Arnt). Образованный гетеродимер приобретает способность связываться со специфическим ДНК энхансером (сигнальная последовательность нуклеотидов ДНК, усиливающая транскрипцию гена с данного промотора), более известным, как ксенобиотик чувствительный элемент (XRE). Ксенобиотик чувствительный элемент выполняет роль трансактиватора генов в различных тканях. Существует также механизм обратной регуляции.
В этом случае Ah рецептор индуцирует транскрипцию собственного репрессивного гена — AhRR, представляющего собой укороченную форму основного рецептора и конкурирует с естественным Ah рецептором. Вследствие этого активизация Arnt приводит к формированию транскрипционно неактивного димера.
Независимо от описанного транскрипционного пути и независимо от его ядерной локализации, AhR — лиганд, может реализовывать свои эффекты через второй путь, который локализован в цитоплазме. Предполагается, что под воздействием диоксинов происходит изменение активности тирозин киназы, это приводит к индукции каскадного белкового фосфорилирования [5]. В этом случае не связанный с диоксинами AhR в цитоплазме соединяется с HSP90, XAP2, p23 и тирозин киназой c-Src (pp60src). При связывании AhR лигандами диоксина происходит освобождение, активного c-Src, что приводит к стимуляции протеин киназы (РКС). Активный c-Src видимо фосфорилирует и активизирует стероидные рецепторы, такие как рецепторы эстрогенов, вызывая эстрогенные эффекты в отсутствии эстрогенов. Таким образом, пусковая протеин киназа, активированная AhR лигандом, может вызывать множественные и непредвиденные клеточные ответы.
Цитохром P450.
Одним из путей, которыми диоксины вызывают оксидативный стресс, является индукция цитохрома P450(CYP). Цитохром представляет собой — монооксигеназу. Он является первой фазой или дезинтоксицирующим энзимом, который метаболизирует ксенобиотики, в частности полициклические углеводороды. В процессе метаболизма при участии монооксигеназы образуются активные кислородные частицы, которые отвечают за оксидативный стресс.
Диоксин индуцирует экспрессию трёх цитохромов P450 1-го типа: CYP1A1, CYP1A2 и CYP1B1. Цитохромы P450, индуцированные диоксинами метаболизируют эстрадиол. CYP1A1 в большинстве случаев гидроксилирует позицию 2 в молекуле эстрадиола, таким образом формируя не токсические соединения. CYP1B1 в большинстве случаев гидроксилирует позицию 4 в молекуле эстрадиола, что приводит к образованию активного метаболита, способного формировать продукты присоединения к ДНК и следовательно, является потенциально генотоксичным [2].
Апоптоз.
Апоптоз играет критическую роль в процессах репродукции, развития, поддержания тканевого и органного гомеостаза. Многие токсиканты вызывают цитотоксический эффект посредством апоптоза. Эндокринные дисрапторы провоцируют нарушение клеточного развития, дифференцировки, оказывают влияние на гомеостаз и гормональный баланс, регулировку и выработку энзимов, факторов роста, гормонов и рецепторов этих гормонов [3]. На основе анализа многочисленных литературных данных показана ведущая роль AhR в регуляции клеточного цикла и апоптоза [5]. Представляют интерес исследования, посвящённые изучению баланса между энзимами Ah рецепторов и Ah рецепторами. Показано, что нарушение этого баланса является важным фактором, определяющим направленность изменений клетки в сторону апоптоза или продолжения клеточной пролиферации. Внутриутробное воздействие ТХДД индуцирует расщепление клитора и патологию развития влагалища. Под воздействием ТХДД не только нарушается продукция стероидов яичниками, а также происходит активизация процессов апоптоза в фолликулах граафовых пузырьков у человека, что является принципиальным механизмом, вызывающим истощение запаса ооцитов в яичниках.
Гипоталамо-гипофизарно-гонадная система.
При воздействии на Ah рецепторную систему могут происходить изменения в системе гипоталамус-гипофиз-гонады. В экспериментальных исследованиях было показано, что под воздействием ТХДД или схожих с ним AhR-лиганд, наблюдаются изменения предовуляторной секреции ФСГ и ЛГ [5]. Звенья AhR сигнального пути связаны с преоптической областью мозга (POA), которая принимает участие в регуляции репродуктивной функции. Схема распределения экспрессии AhR совпадает с зоной распределения декарбоксилазы глутаминовой кислоты (GAD) 67, которая, как известно, принимает участие в синтезе гамма-аминомаслянной кислоты (ГАМК). Примечательно, что ген GAD 67 содержит множество стандартных ксенобиотик чувствительных элементов (XRE). ГАМК-эргические нейроны передних отделов перивентрикулярной зоны принимают участие в процессах наступления половой зрелости и эстроген зависимом повышении секреции гонадотропинов в период овуляции. Внутриутробное воздействие ТХДД на самок крыс вызывает задержку наступления половой зрелости и повышает время необходимое для наступления беременности в случае непрерывного спаривания. Таким образом, секс-и регион специфическая супрессия синтеза ГАМК в ЦНС под влиянием ТХДД, в сочетании с множественными клеточными эффектами может оказывать повреждающее действие на функцию репродуктивной системы.
Диоксины могут вызывать и нарушение метаболических процессов в гипоталамусе. Показано, что пренатальное воздействие малых концентраций Арохлор 1254 и смеси эндокринных дисрапторов, изменяет соотношение метаболизирующих энзимов в гипоталамусе. Изменения затрагивали энзимы, участвующие в контроле половой дифференцировки и развитии мозга — ароматазу и 5 альфа-редутазу тип 1 и 2 [6].
Таким образом, под воздействием органохлоринов наблюдаются нарушения функции гипоталамо-гипофизарной системы. Выявленные изменения затрагивают механизмы регуляции секреции гонадотропинов. На уровне гипоталамуса, выявлены локальные изменения функции ГАМК-эргической системы и системы метаболизирующих энзимов. Указанные изменения связаны с нарушением генетических механизмов регуляции, что свидетельствует о глубоких нарушениях функции гипоталамуса.
Действие на яичники.
Яичники выполняют две важные функции: созревание гамет (ооцитов) и продукция яичниковых гормонов (эстрогенов, прогестерона, ингибина и др.). В серии исследований было показано, что овариальные фолликулы являются прямой мишенью для эндокринных дисрапторов [3, 4, 6]. В исследованиях in vitro была показана способность эндокринных дисрапторов оказывать влияние на развитие фолликулов. Обширная гибель ооцитов может вызывать повреждение овариальных фолликулов. Такие изменения способствуют нарушению продукции стероидных гормонов и могут привести к овариальной недостаточности. Гибель ооцитов приводит к нарушению эндокринного баланса в организме, вызывая снижение уровня эстрогенов и прогестерона, а также повышение секреции ФСГ и ЛГ. Стадия развития фолликулов, в которой происходит токсическое воздействие, определяет характер изменений в репродуктивной системе. Токсическое воздействие на ооциты, содержащиеся в приордиальных и первичных фолликулах, проявятся отсроченными эффектами в репродуктивной системе. Это связано с тем, что через некоторое время после гибели ооцитов, прекращается пополнение развивающихся и антральных фолликулов. С другой стороны, селективное повреждение больших растущих или антральных фолликулов вызывает временное нарушение репродуктивной функции. В этом случае функцию погибших фолликулов через некоторое время компенсируют фолликулы из большого пула примордиальных фолликулов. Следовательно, эти изменения носят обратимый характер, восстановление функции произойдёт вскоре после прекращения воздействия токсических соединений [6].
Предположения о том, что эндокринные дисрапторы нарушают функцию яичников, подтвердились после обнаружения ТХДД, ПХБ, ПХДД, ДДТ в фолликулярной жидкости, при этом концентрации были сопоставимы с содержанием этих веществ в плазме. Все эти данные убедительно указывают на то, что яичник может быть конечной точкой приложения токсического действия диоксинов и диоксиноподобных соединений.
Таким образом, органохлорины оказывают комплексное повреждающее действие на репродуктивную систему. Повреждения затрагивают все структуры системы гипоталамус-гипофиз-гонады. Для реализации эффектов органохлоринов необходимо участие Ah рецепторной системы. Наблюдаемые изменения сопровождаются нарушением баланса между процессами апоптоза и пролиферации, кроме того, отмечены нарушения метаболических процессов в клетке. Практически все наблюдаемые изменения связаны с повреждением генетических механизмов регуляции жизнедеятельности клетки.
Учёными многих стран накоплен большой экспериментальный и клинический материал о роли органохлоринов в возникновении патологии репродуктивной системы. Далее мы сопоставим имеющиеся эпидемиологические наблюдения с патогенезом возникновения некоторых заболеваний и патологическими процессами, вызванными воздействием органохлоринов на организм человека.
Лейомиома.
При воздействии эндокринных дисрапторов на организм наблюдается дисрегуляция репродуктивной функции. Подобные изменения способствуют активизации неопластических процессов в организме у человека и животных [4, 6]. Появление возможности определения этих соединений поставило вопрос о потенциальном участии этих соединений в патогенезе опухолевых заболеваний. Использование клеточных культур позволило более детально изучить действие органохлоринов с эстрогеноподобными свойствами на клетки лейомомы.
Существующие многочисленные исследования показывают роль токсических факторов в формировании лейомиомы матки [7]. Установлено, что в основе патогенеза развития лейомиомы, на ранних этапах лежит гиперэстрогения (абсолютная или относительная, не исключено, что и локальная) и локальный воспалительный процесс, часто сочетающийся с эндометриозом. В более позднем периоде развития заболевания имеет место гиперпродукция факторов роста (эпидермальный фактор роста (EGF), фактор роста фибробластов (bFGF), тромбоцитарный фактор роста (PDGF)), которые вызывают активацию пролиферативных процессов и формирование миоматозных узлов. В опытах in vivo/in vitro было проведено изучение активности эндокринных дисрапторов на маточный миометрий. Исследования в культуре клеток лейомиомы показали, что не все ксеноэстрогены вызывают активацию пролиферативных процессов. Установлено, что активизацию пролиферативных процессов в культуре опухолевых клеток лейомиомы, вызывают соединения, способные имитировать эффекты эстрогенов и действовать как агонисты рецепторов эстрогенов — пестициды-органохлорины, фитоэстрогены и фармакологические препараты.
Проведены исследования эффектов воздействия некоторых пестицидов органохлоринов на клетки лейомиомы крыс. Тестируемые смеси (ДДТ, токсафен, кепон, метоксихлор, диэлдрин, изомеры и эндосульфана) действовали, как агонисты на рецепторы эстрогенов. Часть тестированных органохлоринов стимулировала развитие клеток лейомиомы матки. Таким образом, было показано, что экспонирование пестицидами органохлоринами, может способствовать развитию фибромиомы матки у крыс [36]. Однако, не во всех случаях органохлорины способствуют возникновению лейомиомы. Установлено, что для активизации транскрипционной активности большинства эстроген чувствительных генов, требуется активизация доменов AF1 и AF2 в рецепторах эстрогенов — ER. Именно с активацией AF2 домена связываются пролиферативные изменения в клетке лейомиомы. Соединения, которые активируют AF1, но не активируют AF2 — это 4-OH тамоксифен, и два аналога ралоксифена, которые проявляют антагонистические свойства к клеткам миомы. Следовательно, активизацию пролиферативных процессов в матке могут вызвать не все органохлорины, а только те, которые активизируют домен AF2 в рецепторах эстрогенов. Избирательные эффекты органохлоринов были выявлены также в матке серых тюленей живущих в Балтийском Море, у которых в жировой клетчатке выявлены высокие концентрации ПХБ. Тестировали ПХБ 101 и два его метаболита 3′-MeSO2-CB 101 и 4′-MeSO2-CB 101, а также CB 118, и 4-OH-CB 107. Один из тестированных ПХБ — метаболитов (4’MeSO2-CB 101) показал ингибирование пролиферативной активности клеток миометрия. В то же время другое соединение (CB 101) проявляло противоположный эффект. Таким образом, ПХБ и их метаболиты, могут оказывать противоположные (эстрогенный или антиэстрогенный) эффекты на активацию пролиферативной активности миометрия. По мнению авторов, наблюдаемые эффекты были опосредованы через рецепторы эстрогенов или прогестерона, путём агонистического или антагонистического воздействия. Эти предположения были подтверждены и в исследованиях с клетками человека. Проведенные недавно эксперименты подтвердили антагонистические эффекты ПХБ CB 101, CB 118, 3′-MeSO2CB 101, 4’MeSO2-CB 101, 4-OH-CB 107 при культивировании клеток человека [9]. Однако, можно предположить, что существует и не рецепторный путь реализации эффектов эстрадиола, прогестерона и некоторых ПХБ. Активность AP-1 транскрипционного фактора связывают с процессами пролиферации, дифференцировки и гибели клеток. Показано, что ДДТ, ДДД и ДДЕ могут также стимулировать активность AP-1 транскрипционного фактора в эстроген резистентных зародышевых клетках. Эти данные показывают, что ДДТ и его производные могут реализовывать свои эффекты независимо от активности рецепторов эстрогена или. Одним из механизмов, стимуляции роста миоматозных узлов под воздействием ксеноэстрогенов могут быть аутокринные и интракринные процессы. В клетках лейомиомы человека наблюдается избыточная экспрессия ароматазы Р450. Избыточная ароматазная активность может способствовать локальному накоплению эстрогенов, что и приводит к активации пролиферативных процессов.
Таким образом, существующие экспериментальные исследования показали, что органохлорины могут способствовать активизации пролиферативных процессов посредством взаимодействия с рецепторами эстрогенов и прогестерона. Кроме того, может наблюдаться активация факторов пролиферации без участия рецепторов эстрогенов. Существует и метаболический путь стимуляции пролиферативных процессов эндометрия. В этом случае органохлорины, накапливаясь в тканях, вызывают нарушения метаболических процессов, что приводит к локальному накоплению эстрогенов, которые вызывают активизацию пролиферативных процессов.
Несмотря на накопленный обширный экспериментальный материал, имеется сравнительно мало клинических исследований, посвященных изучению влияния органохлоринов на возникновение лейомиомы у человека. Выполненные исследования показали, что содержание ДДТ в крови у женщин с лейомиомами значительно выше, чем у здоровых женщин. Было проведено определение концентрации p,p’-ДДТ, o,p’-ДДТ, p,p’-ДДЕ, и p,p’ДДД у женщин 36–55 лет в нормальной ткани и в ткани лейомиомы. Содержание ДДТ и его метаболитов было значительно выше в тканях лейомиомы [7]. Эти исследования фактически подтвердили предположение о том, что органохлорины могут быть причиной возникновения лейомиом.
В 1976 году в городе Севезо (Италия) произошла крупная авария с выбросом диоксинов. Население подверглось экспонированию диоксинами, в крови были выявлены высокие концентрации этого соединения. Длительное время наблюдали за состоянием здоровья жителей. Через 30 лет провели анализ заболеваемости. Авторы не выявили увеличения частоты лейомиом среди экспонированного населения. [9]. Более того, отмечено снижение риска возникновения лейомиомы у экспонированных женщин. Авторы связывают полученные результаты с антиэстрогенными свойствами диоксинов.
Имеются сообщения о негативном влиянии Диэтилстильбестрола (ДЭС) — синтетического аналога эстрогенов, который ранее широко применялся для профилактики невынашивания беременности. Выявлена позитивная ассоциация между внутриутробным экспонированием ДЭС и частотой возникновения лейомиомы. Кроме того, в эксперименте было показано, что внутриутробное экспонирование ДЭС вызывает программирование генов, это приводит к гиперэкспрессии эстроген чувствительных генов в ткани миометрия ещё до начала процессов туморогенеза. Однако в другом исследовании авторы не выявили такой взаимосвязи [4].
Таким образом, накоплен большой экспериментальный материал, который показывает, что органохлорины могут быть одной из причин возникновения пролиферативных процессов миометрия. Однако, эпидемиологические исследования, посвящённые этой проблеме, практически отсутствуют.
Эндометриоз.
Эндометриоз — это заболевание, сопровождающееся неконтролируемым ростом клеток эндометрия расположенных как внутри, так и вне матки. Когда клетки эндометрия находятся вне матки, механизмы, контролирующие их рост, становятся не эффективными. Несмотря на это, они сохраняют способность отвечать на гормональные сигналы, вызывающие рост или регрессию в различных тканях (брюшная полость, кишечник, яичники, матка, мочевой пузырь и т.д.).
В 1992 году в сообщении из Бельгии [10] указывалось на широкую распространённость эндометриоза при бесплодии. Было высказано предположение, что это может быть связано с относительно высокой концентрацией ТХДД в грудном молоке у бельгийского населения. Фактически эти исследования впервые поставили вопрос о роли диоксинов в возникновении эндометриоза. Аналогичные данные были получены и другими исследователями, которые определяли концентрации ТХДД в крови бесплодных женщин. Было показано, что больные с эндометриозом имеют большую вероятность быть диоксин позитивными, чем женщины с трубным бесплодием. В целой серии экспериментальных исследований была показана роль диоксинов в возникновении эндометриоза [11]. Разные лаборатории показали наличие Ah рецепторов в эндометрии матки. Для выяснения роли Ah рецепторов в инициации эндометриоидного процесса было проведено исследование на мышах. Эндометриоз моделировали имплантацией эндометрия в брюшную полость и экспонированием ТХДД. Для дополнительного экспонирования использованы высокоафинные агонисты рецепторов 2,3,4,7,8-пентахлордибензофуран (4PeCDF) и 3,3′,4,4′,5-пентахлорбифенил (ПХБ 126); и 2 низкоафинных соединения — 2,2′,4,4′,5,5′-гексахлорбифенил (ПХБ 153) и 1,3,6,8,-тетрахлордибензо-p-диоксин (1,3,6,8ТХДД). Экспонирование Ah радикалами — ТХДД, 4PeCDF и ПХБ 126 способствовало развитию эндометриальных имплантов. И наоборот, не содержащие Ah рецепторных лигандов ПХБ 153 и 1,3,6,8-ТХДД, не вызывали прогрессирования очагов эндометриоза. Таким образом, было показано одно из основных условий, способствующее развитию эндометриоза — наличие требуемого сигнального Ah рецепторного пути.
Дальнейшие исследования показали, что не все конгенеры ПХБ вызывают развитие эндометриоза. Условно их можно разделить на конгенеры с эстрогенными (№ 18, 31, 44, 48, 52, 70, 99, 101, 126, 136, 153 и 188) и антиэстрогенными свойствами (№105, 114, 126 и 169). Развитию эндометриоза способствовали ПХБ с антиэстрогенными свойствами. ПХБ с эстрогенными свойствами не способствовали прогрессированию очагов эндометриоза. На первый взгляд ПХБ с антиэстрогенными свойствами должны вызывать регрессию очагов эндометрия. Однако следует не забывать, что блокирование рецепторов эстрогенов по механизмам обратной связи, способствует усилению секреции эстрогенов, которые стимулируют рост очагов эндометрия.
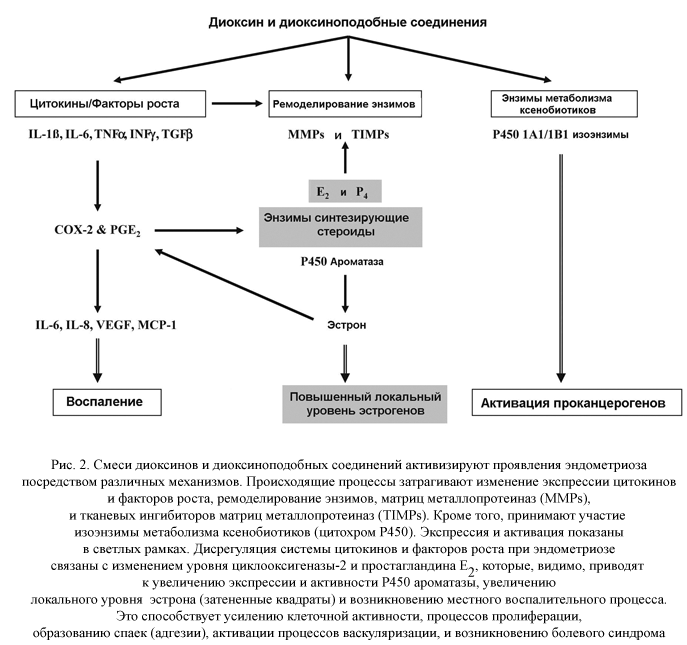
Реализация эффектов диоксинов осуществляется посредством нескольких возможных механизмов (рис. 2):
1) активация предшественников карциногенеза;
2) измененный синтез и метаболизм эстрадиола;
3) измененная продукция провоспалительных факторов роста или цитокинов;
4) ложная экспрессия реконструированых энзимов.
По мнению авторов, диоксины могут способствовать развитию эндометриоза посредством индукции экспрессии цитохрома P-450 и повышения образования катехолэстрогенов. Такие изменения способствуют хроническому локальному воздействию эстрогенов на эндометрий. Кроме эффектов локальной гиперэстрогении, диоксины, возможно, также вызывают воспалительный процесс. Диоксины и диоксиноподобные соединения, способствуют хронической стимуляции активности предшественников воспаления, таких как IL-1, IL-6, TNF , и INF?, которые в свою очередь участвуют в циклической регуляции ремоделирования эндометрия, процессах пролиферации и апоптоза [12].
Эстрогены способствуют образованию эндометриоидных поражений, в то время как прогестерон препятствует их образованию путём подавления активности эндометриальной MMP. Воздействие ТХДД в присутствии эстрадиола и прогестерона нарушает способность прогестерона блокировать образование повреждения и экспрессию MMP . Эти результаты подтверждают очевидную связь прогестерон и цитокин — зависимой регуляции секреции MMP в человеческой эндометриальной ткани, что приводит к возникновению эндометриоза, кроме того, показывают способность ТХДД нарушать механизмы этой регуляции.
Определённую роль в развитии эндометриоза играют генетические факторы.
Полиморфизм CYP1A1 и CYP1B1, видимо, влияет на чувствительность организма к органохлоринам. Так, например, при наличии генотипа CYP1A1 Ile462Val отмечено уменьшение риска возникновения эндометриоза на фоне высоких сывороточных концентраций диоксина. Полиморфизм CYP1B1 Leu432Val способствовал потенцированию эффектов ПХБ и увеличению риска возникновения эндометриоза. Эти исследования нашли дальнейшее подтверждение в работах по изучению генетического полиморфизма глутадион-S-трансферазы (ГСТ). ГСТ — это семейство ферментов, катализирующих конъюгацию различных ксенобиотиков. Каталитическая активность ГСТ обеспечивает клетку механизмом защиты от вредного воздействия этих веществ. Показано, что ГСТP1 полиморфизм может модулировать риск возникновения эндометриоза. Снижение риска отмечено при наличии генотипа ГСТ P1 val/val, а повышение риска —при наличии ГСТ P1 ile/ile. Похожие результаты были получены и в других исследованиях [13].
В последние годы появились многочисленные исследования, показывающие, что возникновение эндометриоза связано с оксидативным стрессом. Экологические факторы такие как, например, ПХБ, способствуют возникновению оксидативного стресса и появлению эндометриоза. Таким образом, накоплен большой материал, показывающий потенциальную роль факторов окружающей среды в индукции эндометриоза у человека. Агентством по защите окружающей среды (США) диоксины и диоксиноподобные соединения рассматриваются в качестве веществ, способных даже в фоновых дозах вызывать возникновение эндометриоза у человека.
Гиперплазия эндометрия.
Гиперпластические процессы эндометрия довольно часто встречаются в кинической практике. Наличие гиперплазии эндометрия не редко сопровождается нарушением менструального цикла, обильными кровотечениями, бесплодием. Согласно общепризнанной точке зрения, ведущее значение в генезе гиперпластических процессов в эндометрии отводится воздействию повышенных концентраций эстрогенов. Нарушение баланса между эстрогенами и гестагенами приводит к торможению процессов структурной подготовки клеток эндометрия к воздействию прогестерона. Даже низкие концентрации эстрадиола способны поддерживать постоянную пролиферацию эпителия и обеспечить формирование гиперплазии эндометрия. Эти взаимоотношения могут целиком быть интерпретированы в свете гипотезы «эстроген без оппозиции», которая предполагает, что рак эндометрия и гиперплазия эндометрия развиваются в результате митогенных эффектов эстрогенов, когда они недостаточно сбалансированы прогестероном.
В регуляции процессов клеточной пролиферации принимают участие не только эстрогены. Тиреоидные гормоны являются модуляторами действия эстрогенов на клеточном уровне. Дисбаланс этих гормонов может способствовать прогрессированию нарушений гисто-и органогенеза гормонально-зависимых структур и формированию гиперпластических процессов эндометрия. Установлено, что в регуляции процессов клеточной пролиферации принимают участие также биологические амины (норадреналин, мелатонин, серотонин, брадикинин, гистамин, инсулин, простагландины, паратгормон, глюконат, гастрин), хориогонин и прочие пептиды, вырабатываемые клетками так называемой диффузной эндокринной системы — АПУД-системы (Amino Prekursor Uptake and Dekarboxylation). Таким образом, современные представления о патогенезе гиперпластических процессов в эндометрии не ограничиваются традиционными концепциями гиперэстрогении. По-видимому, патологическую трансформацию слизистой оболочки тела матки необходимо рассматривать как сложный биологический процесс, затрагивающий все звенья нейрогуморальной регуляции организма женщины.
Большинство существующих исследований посвящены изучению влияния органохлоринов на частоту возникновения рака эндометрия. По всей вероятности, это связано с тем, что ответная реакция эндометрия на эстроген, может рассматриваться как спектр изменений, который заканчивается образованием рака эндометрия. При этом гиперплазия эндометрия рассматривается в качестве промежуточного этапа трансформации эндометрия. Однако далеко не всегда прогрессирование гиперплазии эндометрия приводит к образованию атипии. В большинстве случаев гиперплазия вызывает разнообразные нарушения или может регрессировать.
В эндометрии человека были выявлены ПХБ и ДДТ. Обнаружение АhR транскрипционного фактора в клетках эндометрия, поставило вопрос о возможном участии агонистов АhR в формировании заболеваний эндометрия. Таким образом, появились все основания полагать, что органохлорины могут быть причастными к патологии эндометрия. Существует огромный материал о влиянии органохлоринов на эндометрий. Однако имеются лишь единичные сообщения о роли эндокринных дисрапторов в патогенезе гиперплазий эндометрия у человека. Было показано, что при воздействии диоксинов и бифенилов возрастает частота возникновения кистозной гиперплазии эндометрия. Предполагают, что ПХБ могут имитировать действие эстрогенов в эндометрии матки. Необходимо учитывать, что разные конгенеры ПХБ и диоксинов обладают эстрогенными или антиэстрогенными свойствами и соответственно вызывают различные клинические проявления. Это даёт основание говорить о двунаправленности возможных эффектов. Похожие двунаправленные эффекты выявлены при изучении влияния диоксинов и бифенилов на ткань эндометрия. Бифенилы вместе с эндогенными эстрогенами создают эффект локальной гиперэстрогении, что способствует росту эндометрия. Блокирование рецепторов эстрогенов вызывает увеличение секреции эндогенных эстрогенов, что также способствует возникновению гиперэстрогении. Вместе с тем, при наличии атипии наблюдаются низкие концентрации бифенилов. Хотя причины таких изменений остаются неясными, высказывается предположение, что такие изменения вызваны активацией метаболических превращений в эндометрии. Это предположение подтверждается исследованиями метаболических процессов. Показано, что под воздействием ДДЕ в эндометрии человека наблюдается активация процессов метаболизма. Более того, в эндометрии выявлена большая разновидность цитохромов, принимающих участие в метаболизме ксеноэстрогенов [14]. Ксеноэстрогены реализуют своё действие в эндометрии через генетические механизмы регуляции роста и размножения клеток. В большинстве случаев внешние клеточные стимуляторы сигналов, приводят к активации или ингибированию транскрипционных факторов таких как, например, активатор протеина-1 (AP-1) и ядерного фактора kB (NFkB), регулирующих генную экспрессию. Было установлено, что ДДТ и его метаболиты могут вызывать активацию AP-1 в клетках эндометрия, минуя эстрогенрецепторные механизмы. Более того, есть основания полагать, что внутриутробное экспонирование в критические периоды развития изменяет ход онтогенетического развития матки. Иными словами, имеет место внутриутробный импринтинг развития матки, который определяет возможность возникновения патологии морфологии эндометрия в более поздних периодах развития [15].
Таким образом, имеющиеся исследования наглядно показывают роль ксеноэстрогенов в инициации гиперпластических процессов в эндометрии. Однако мы не нашли информации об эпидемиологических исследованиях гиперплазии эндометрия среди различных групп населения.
Рак эндометрия.
Существующие эпидемиологические исследования по изучению патологии эндометрия в основном посвящены проблемам рака эндометрия. Между тем, по мнению многих учённых накопленная информация не позволяет сделать однозначные выводы о влиянии органохлоринов на возникновение рака эндометрия. По нашему мнению, это связано с тем, что в большинстве работ проводится изучение влияния факторов питания на частоту возникновения рака эндометрия. Показано, что возникновению рака эндометрия способствует употребление в пищу животных жиров и протеинов, которые могут быть загрязнены органохлоринами.
Целая серия исследований посвящена употреблению рыбы, котрая может быть загрязнена органохлоринами. В исследованиях, проведенных среди рыбаков, живущих на Балтийском побережье в Швеции, не выявлено взаимосвязи высокого уровня ПХБ в крови и раком эндометрия. Высокие уровни органохлоринов связывались с употреблением в пищу рыбы. Контролем были женщины из тех же районов, отобранных методом случайной выборки. Не исключено, что отсутствие взаимосвязи употребления рыбы с риском возникновения рака эндометрия связано с возможными низкими концентрациями этих веществ или другими факторами снижающими риск возникновения рака (например, омега 3 жирные кислоты).
Высказываются предположения, что определённые метаболиты органохлоринов, например o,p’-ДДТ, обладают онкопротекторными свойствами [16]. Снижение пролиферативной активности выявлено в культуре клеток эндометрия в присутствии левоноргестрела, o,p’-ДДТ, ПХБ 77, ПХБ 126, и 2,3,7,8-ТХДД [14]. Кроме того, o,p’-ДДТ, ПХБ 77, ПХБ 126 оказывали влияние на жизнеспособность клеток эндометрия и активизировали процессы апоптоза. Такой метаболит, как o,p’-ДДТ имеет слабую тропность к рецепторам эстрогенов. Он в небольшом количестве содержится в организме человека, концентрация его существенно ниже, чем p,p’- ДДТ — метаболита с высокой эстрогенной активностью. По нашему мнению, учитывая всё сказанное, не стоит преувеличивать онкопротекторного значения o,p’-ДДТ. Существует целый ряд других факторов, которые при суммарном воздействии могут нивелировать возможные канцерогенные эффекты органохлоринов. Так, например, снижать риск возникновения рака эндометрия могут и целый ряд продуктов питания. Например, показано, что употребление растительных продуктов на основе сои или чая, снижает риск возникновения рака эндометрия. Действие чая связывают с воздействием на ген CYP19A1, а эффективность соевых продуктов — с наличием у женщин G/G генотипа (rs2070959) в гене UGT1A1. Доказано, что пища, богатая изофлавонами, снижает активность пролиферативных процессов в эндометрии и способствует снижению риска возникновению рака эндометрия. Онкопротекторными свойствами обладает гликодеин А (GdA). Гликодеин А — иммуносупрессивный эндометриальный гликопротеин секретируемый эндометрием перимущественно в секреторную фазу. Ранее ему отводилась роль протеина, препятствующего имплантации эмбриона. Сейчас установлено, что контрацептивный эффект связан с ингибированием роста эндометрия в секреторную фазу. Синтезируется он в клетках эндометрия под воздействием прогестерона. В пролиферативной фазе гликодеин не определяется. Последние исследования показали, что этот гликопротеин причастен к регуляции неопластических процессов. Исследования проводили в культуре тканей эндометрия человека. Экспланты эндометрия культивировали в присутствии ТХДД. Выявлено резкое увеличение секреции GdA в среде с добавлением 10 nM ТХДД. Считают, что имеет место AhR опосредованное действие диоксинов на транскрипцию гена, контролирующего секрецию GdA. Остаётся открытым вопрос о том, как влияют диоксины на содержание GdA в эндометрии в пролиферативную фазу. Поскольку одним из побочных эффектов диоксинов является их способность нарушать процессы созревания фолликулов и блокировать овуляцию. Это фактически означает отсутствие влияния прогестерона, необходимого для инициации синтеза GdA.
Таким образом, на сегодняшний день не существует единого мнения о влиянии органохлоринов на возникновение рака эндометрия. Вполне возможно, что негативные эффекты органохлоринов компенсируются действием других онкопротекторных факторов. К таким факторам можно отнести активность метаболических процессов в организме, специфику диеты, генетические особенности и целый ряд других факторов.
По заключению ВОЗ, ткань эндометрия очень чувствительна к воздействию эстрогенных и антиэстрогенных соединений и может быть мишенью для действия эндокринных дисрапторов. Однако имеющиеся экспериментальные исследования и ограниченное количество исследований, выполненных на людях не позволяет говорить о наличии взаимосвязи между экспонированием органохлоринами и риском возникновения рака эндометрия.
Патология шейки матки.
Патология шейки матки является актуальной проблемой акушерства и гинекологии. Одной из причин широкого распространения патологии шейки матки по праву считается влияние неблагоприятных факторов внешней среды и вредных привычек. Неблагоприятные факторы оказывают неспецифическое комплексное воздействие на организм женщины, вызывая существенные нарушения в иммунной системе, что способствует изменению биоценоза влагалища и приводит к повышению инфицированности экзо-и эндоцервикса. Показано негативное влияние атмосферных факторов на частоту и структуру предраковых заболеваний шейки матки. К факторам, способствующим развитию рака шейки матки относят интенсивное применение пестицидов в сельском хозяйстве. При обследовании женщин, страдающих бесплодием, были выявлены органохлорины в цервикальной жидкости. Концентрация этих соединений в цервикальной слизи была в двадцать раз выше, чем в фолликулярной жидкости. Экспериментальные исследования в культуре клеток c применением ТХДД подтвердили наличие Ah рецепторов в плоском эпителии шейки матки. Наличие высоких концентраций органохлоринов и обнаружение Ah рецепторов поставило вопрос об участии органохлоринов в формировании патологии шейки матки. Экспериментальные исследования на обезьянах подтвердили, что под воздействием диоксинов происходит метаплазия плоского эпителия шейки матки.
Сегодня доказано, что причиной возникновения дисплазии шейки матки является вирус папилломы человека. Показано, что диспластические поражения шейки матки в 90% случаев ассоциируются с вирусом папилломы человека. Среди всего разнообразия раковых заболеваний, рак шейки матки уникальный из-за его ассоциации с высоким риском заражения вирусом папилломы человека (ВПЧ), особенно штаммами ВПЧ-16 и ВПЧ-18. Однако для активизации атипических процессов — не достаточно только инфицирования клетки. Необходима активная экспрессия генов Е6 иЕ7 вируса, индукция метаболических механизмов конверсии эстрадиола в 16 -ОН, индукция множественных повреждений хромосомной ДНК в инфицированной клетке [17]. Только небольшая часть повреждений клетокпредшественников зараженных ВПЧ, перерождается в агрессивные раковые новообразования. Высказано предположение, что дополнительные генетические факторы и факторы микросреды, приводят к заражению ВПЧ, и видимо играют важную роль в возникновении и развитии неоплазии шейки матки. На примере взаимодействия инфицированных ВПЧ клеток с бенз-а-пиреном был показан механизм перерождения кератиноцитов. Эти исследования дали объяснение, почему рак шейки матки значительно чаще наблюдается у курящих женщин. Похожие механизмы действия на кератиноциты наблюдались и при воздействии ТХДД и бифенилов.
Представляют интерес исследования, связанные с изучением влияния гигиенических тампонов на частоту инфицирования ВПЧ. Показано, что использование тампонов, увеличивает риск инфицирования ВПЧ и уменьшает вероятность элиминации вируса из организма. Эти сообщения появились после того, как в средствах личной гигиены — тампонах, было выявлено присутствие диоксинов. Проведенные после этого исследования показали, что тампоны содержат минимальные количества диоксинов, не сравнимые с поступлением этих соединений в организм алиментарным путём или при грудном вскармливании. Существует мнение, что содержащиеся в тампонах диоксины могут вызвать совсем незначительный кумулятивный эффект и соответственно не оказывают влияние на здоровье человека. Несмотря на это, остаётся открытым вопрос местного воздействия диоксинов на эпителий шейки матки, поскольку именно в цервикальной слизи были выявлены очень высокие концентрации органохлоринов.
Менструальный цикл.
Менструальный цикл является результатом гормональной активности гипоталамуса, гипофиза и яичников (гипоталамо-гипофизарнояичниковой системы). Менструальная функция женщины весьма чувствительна к воздействию неблагоприятных факторов окружающей среды. Нарушения менструального цикла являются показателем дезадаптации женского организма, что приводит к возникновению синдрома экологогенеративного диссонанса, который сопровождается ростом акушерско-гинекологической патологии нейроэндокринного профиля.
Время наступления менархе.
Менархе — первый менструальный цикл, первое менструальное кровотечение. Появлению менструации предшествует целая цепочка событий, которые обеспечивают в дальнейшем нормальное функционирование репродуктивной системы. Прежде всего, это появление первых признаков полового созревания. Меняется амплитуда и частота импульсной секреции гонадотропинов и гормонов гипофиза. Наступление менархе свидетельствуют о наличии достаточных уровней гормонов, обеспечивающих циклическую секрецию. После наступления менархе происходит дальнейшее созревание системы регуляции выброса гонадотропинов. Закрепляются установившиеся механизмы.
По завершении созревания репродуктивной системы устанавливается регулярный менструальный цикл. Взрослый репродуктивный тип функционирования эндокринной системы позволяет обеспечить осуществление генеративной функции — зачатие, вынашивание беременности, рождение и вскармливание ребенка.
У девочек в период полового созревания гормональная функция яичников выражена недостаточно, несовершенен также и рецепторный аппарат яичников. Действующие на этом фоне разнообразные внешние и внутренние раздражители могут легко нарушать регуляторный механизм менструальной функции, препятствуя установлению ее стереотипа и вызывая различную патологию, которая сохраняется на всю жизнь. Имеются многочисленные исследования, посвящённые изучению влияния факторов окружающей среды на время наступления менархе [4, 18]. Группой исследователей [9] было проведено изучение взаимосвязи между сроками наступления менархе и уровнями 6 экологических загрязняющих агентов, которыми дети были экспонированы: ДДЕ, ГХБ, ПХБ (16 конгенеров 52, 70, 74, 84, 87, 95, 99, 101 [+90], 105, 110, 118, 138 [+163 и 164], 149 [+123], 153, 180, и 187), мирекс, свинец, и ртуть. Исследование проводилось среди жителей федерации индейцев в районе Реки Св. Лоренса. Уровни ПХБ, ДДЕ, ГХБ, и мирекса превышали рекомендованные FDA допустимые пределы экспонирования человека. Уровень ртути был на пороговом уровне или ниже, а уровень свинца был намного ниже уровня, рекомендованного Центром по контролю и профилактике заболеваний (США). Не было выявлено взаимосвязи между содержанием мирекса, ДДЕ или ГХБ и временем наступлением менархе. Авторы полагают, что в период достижения менархе, по всей вероятности, организм девочек более чувствительный к сравнительно низким концентрациям свинца и некоторым конгенерам ПХБ. Определённая группа ПХБ с потенциально эстрогенными эффектами способствует раннему наступлению менархе и, наоборот, у девочек с высокой концентрацией свинца наблюдалась задержка наступления менархе.
Подобные эффекты наблюдались при воздействии полибромированных соединений. Случайное загрязнение полибромироваными бифенилами (ПББ) в Мичигане привело к экспонированию более 4000 человек. Определяли ПББ в сыворотке крови. Среди девушек, вскармливавшихся грудью, перинатальное воздействие ПББ способствовало более раннему росту лобковых волос. Внутриутробное воздействие ПББ вызывало более раннее менархе [4]. Разнообразное воздействие на время наступления менархе (задержка, ускорение или отсутствие эффекта) может быть связано с экспонированием различными типами и/или комбинациями токсикантов, которые обладают эстрогенными, андрогенными или антиандрогенными свойствами. Кроме того, некоторые из этих исследований сконцентрированы на определении 1 или 2 токсикантов или классов токсических соединений. При этом не учитывается возможность того, что присутствуют токсические эффекты других соединений, определение которых не проводилось.
Органохлорины могут менять не только время наступления менархе, а также и характеристики менструального цикла. Направленность эффектов зависит от того, в каком периоде онтогенеза будущая женщина подвергается экспонированию. После аварии в Севезо (Италия), проводили наблюдение за женщинами, которые подверглись воздействию диоксинов. Результаты обследования женщин, проживавших в Севезо во время химического взрыва, свидетельствуют, что ТХДД может нарушать формирование менструальной функции. Среди женщин, которые были в пременархеальном периоде во время взрыва, более высокие уровни ТХДД в сыворотке были связаны с более длинными менструальными циклами, но менее обильными. Однако среди женщин, которые были постменархеальном периоде во время взрыва, более высокие уровни ТХДД не ассоциировались с длительностью цикла или интенсивностью менструального кровотечения. Хотя эта группа авторов в более позднем исследовании утверждала, что все эти изменения носили недостоверный характер [19].
Похожие результаты были получены и в других исследованиях. Проведено изучение [20] эффектов внутриутробного воздействия ПХБ и ДДЕ на время наступления первой менструации у потомства. Было обследовано два поколения женщин. Женщины (и их потомки) из когорты рыбаков в Мичигане ранее обследованы на содержание органохлоринов. У них были выявлены высокие концентрации ПХБ и ДДЕ. У женщин, несмотря на высокие концентрации органохлоринов, не наблюдалось изменений менструальной функции. Однако при изучении влияния внутриутробного экспонирования ПХБ и ДДЕ на время наступления первой менструации выявлено, что внутриутробное экспонирование вызывало более раннее (на 1 год) наступление первой менструации.
В Китае у ткачих определяли концентрацию ДДТ/ДДЕ в сыворотке крови. Анамнестически изучали время наступления менархе. Высокие концентрации ДДТ/ДДЕ наблюдались у женщин с более ранним менархе.
В других исследованиях было показано, что у женщин с ранним менархе — в 9 лет и ранее показатели ДДЕ и бета-гексохлорциклогексана были выше в 2 раза по сравнению с теми, у кого менархе наступило в 15 лет и позже. Исследователи приходят к выводу, что более раннее менархе наблюдается в районах загрязнённых пестицидами.
Несколько другие данные были получены при обследовании семей шведских рыбаков на восточном побережье Балтийского моря. В этой группе женщины были экспонированы внутриутробно и в постнатальном периоде при употреблении рыбы с высоким содержанием органохлоринов. У них определяли средний возраст наступления менархе. Контролем служили женщины из 3-х групп. Первая — женщины, которые выросли в рыбацких семьях, проживающих на шведском западном побережье, где рыба менее загрязнёна. Вторая и третья группы — это женщины с восточного побережья и западного побережья, однако, росли в семьях, где не занимались рыбным промыслом и не употребляли рыбу в большом количестве. Авторы пришли к выводу, что менархе отмечалось несколько позже у экспонированных женщин. Между другими группами не было отличий.
На примере ДДЕ и других пестицидов был показан механизм возможного действия органохлоринов со слабыми эстрогенными свойствами. У детей, прибывших из развивающихся стран, наблюдались повышенные концентрации ДДЕ и раннее половое созревание. Высказывается предположение, что органохлорины вызывают ингибирование секреции гонадотропинов посредством отрицательной обратной связи. После иммиграции эстрогенные эффекты органохлоринов уменьшаются, что приводит к снижению ингибирования секреции гонадотропинов и активации гипоталамо-гипофизарной системы. У детей, которые не эмигрировали и находились под воздействием органохлоринов, наблюдалась задержка развития гипоталамо-гипофизарной системы. С другой стороны, органохлорины вызывают слабую стимуляцию эстроген чувствительных тканей, включая гипоталамус. У детей, испытывающих хроническое воздействие ксеноэстрогенов, наблюдается ингибирование секреции гонадотропинов. Однако, по мнению авторов, эти изменения компенсируются эстрогенной стимуляцией тканей, что в результате приводит к нормальному или запоздалому гипоталамо-гипофизарному развитию.
Таким образом, препубертатное воздействие органохлоринов приводит к изменению сроков наступления менархе и инициации процессов полового созревания.
Нарушение менструального цикла.
Менструальная функция женщины является сложным саморегулирующимся механизмом. У женщин репродуктивного возраста под воздействием эндокринных дисрапторов могут наблюдаться разнообразные нарушения менструальной функции. Так, например, в Австрии описан случай аменореи у 30 летней женщины, отравившейся высокими дозами ТХДД. Далеко не во всех случаях воздействие органохлоринов приводит к аменорее, могут наблюдаться и другие проявления. Было обследовано 55 женщин, работающих на ферме, которые подверглись воздействию пестицидов. Выявлено, что средние уровни p,p’-ДДТ в сыворотке — вдвое выше у женщин, которые жаловались на нарушение менструальной функции, однако эти отличия не были статистически достоверными.
Другими исследователями проведено изучение особенностей менструального цикла (продолжительность межменструального периода, регулярность менструаций, длительность менструаций и наличие дисменореи). Исследовали концентрации 11-ти конгенеров ПХБ и ДДЕ в крови. Результаты показали, что суммарный уровень содержания ПХБ позитивно коррелировал с продолжительностью межменструального периода. Нерегулярные циклы встречались несколько чаще среди 2-х групп женщин. Это были женщины с самым высоким уровнем экспонирования ПХБ, и слабая корреляция выявлена у женщин с высоким содержанием ДДЕ. Повышение уровней ДДЕ или ПХБ сопровождалось увеличением продолжительности менструации, интенсивности кровотечений или дисменореей [21].
На фермах Айова и Северная Каролина проводили исследование влияния пестицидов на состояние менструальной функции у женщин пременопаузального возраста [4], определяли характеристики менструального цикла: длину цикла, периоды отсутствия менструаций и межменструальные кровотечения. При оценке результатов авторами учитывалась связь между использованием пестицидов и характеристиками менструального цикла, возрастом, индексом массы тела и курением. Контролем служила группа женщин, не использовавших пестициды. У женщин, использовавших, предположительно гормонально активные пестициды, наблюдалось увеличение продолжительности менструальных циклов, периодов отсутствия менструаций и межменструальных кровотечений.
В исследованиях, проведенных в Китае, определяли взаимосвязь нарушений менструального цикла с сывороточными концентрациями ДДТ и его метаболитов в сыворотке у нерожавших женщин текстильного производства в возрасте 20—34 лет. Женщины не курили и не подвергались профессиональному экспонированию пестицидами. Показано, что у женщин с более короткими менструальными циклами, чаще наблюдались высокие концентрации ДДТ и p,p’-ДДЕ.
В 1979 на Тайване в провинции Юченг около 2000 человек использовали масло, зараженное ПХБ. Нарушение менструальной функции выявлено у 16% женщин по сравнению с 8% в контрольной группе. Однако, другие характеристики менструальной функции, фертильности, времени наступления менопаузы — остались без изменений. Кроме того, отмечено увеличение частоты случаев замершей беременности 4,2% против 1,7% в контроле [21]. Дальнейшие исследования показали, что у девушек, которые родились от матерей экспонированных ПХБ и ПХБФ, отмечено укорочение средней продолжительности менструального кровотечения, чаще имели место нерегулярные менструальные циклы. Гормональное обследование показало высокие уровни эстрадиола и ФСГ в фолликулярную фазу менструального цикла. Авторы делают заключение, о том, что пренатальное воздействие ПХБ и ПХБФ вызывают нарушения менструального цикла, которые связанны с изменением секреции гормонов. Кроме этого, было проведено определение уровня диоксинов и бифенилов в плаценте. Показана прямая зависимость содержания экотоксикантов в плаценте и степенью экспонирования. Показано, что высокий уровень плацентарных диоксинов соответствовал нерегулярным менструальным циклам, а высокие концентрации ПХБ были в плаценте у женщин с длительным менструальным циклом (более 33 дней). Авторы приходят к выводу, что под воздействием диоксинов и бифенилов наблюдаются устойчивые изменения менструального цикла. Органохлорины вызывают нарушения гормонального баланса, которые могут сопровождаться и снижением уровня гормонов, причём изменения сохраняются даже при наступлении беременности. Показано, что под влиянием ДДТ наблюдается снижение уровней прогестерона и эстрадиола в ходе менструального цикла, в период овуляции и ранних сроках беременности. Снижение уровня прогестерона является одной из причин угрозы прерывания и невынашивания беременности.
Часть исследований посвящена влиянию различных факторов на характеристики менструального цикла у экспонированных женщин. В исследовании, проведенном в Мичигане, определяли сывороточные концентрации ПХБ. Кроме того, сопоставляли характеристики менструальной функции с физической активностью, курением, образованием, доходами семьи. Укорочение менструального цикла и увеличение длительности кровотечения выявлено у женщин с высокими концентрациями ПХБ, которые за последний год потеряли в весе. По мнению авторов, состояние менструальной функции зависит не только от содержания бифенилов, но и от состояния гипоталамо-гипофизарно-гонадной системы, выраженности подкожной клетчатки (поскольку эти вещества липофильны), физических нагрузок, резкого снижения веса и т.д. [21]. Похоже, что степень зрелости репродуктивной системы также имеет значение для последствий экспонирования диоксинами. У девушек из Севезо, которые подверглись экспонированию диоксинами в препубертатном периоде, отмечены нарушения менструальной функции. Экспонирование в постпубертатном периоде не оказывало влияния на менструальную функцию. Обследования, проведенные через 20 лет не выявили отклонений в функции яичников. Можно предположить, что различия клинических проявлений могут быть связаны с накоплением в организме различных видов органохлоринов и их метаболитов. Так, например, в Шанхае (Китай) изучали влияние сывороточных концентраций ДДЕ и ДДТ на характеристики менструального цикла: длительность, продолжительность менструации и их интенсивность. Высокие концентрации p,p’-ДДЕ выявлены у женщин с длинными менструальными циклами. Тогда, как высокие концентрации p,p’ДДТ o,p’-ДДТ не оказывали влияния на характеристики менструального цикла. Однако исследования, проведенные в Европе, не подтвердили существенную роль отдельных соединений или их метаболитов в нарушении менструальной функции. Были проведены исследования содержания ПХБ — 153 и ДДЕ в организме жителей различных стран Европы. Самые высокие концентрации ПХБ — 153 выявлены среди популяции шведских рыбаков, а самые высокие концентрации ДДЕ — среди жителей Харькова. Дальнейшие исследования показали, что в Швеции среди жён рыбаков экспонированных ПХБ, чаще наблюдается укорочение длительности менструального цикла (менее 24 дней), а у жителей Варшавы с высокими содержаниями ДДЕ наблюдалось увеличение продолжительности менструального цикла (более 32 дней). Было высказано мнение, что ДДЕ и ПХБ скорее всего не оказывают сильного влияния на характеристики менструального цикла. Поскольку такие изменения наблюдались бы и среди популяции других стран. На характеристики менструального цикла, по мнению авторов, влияют другие факторы, такие как, например, генетические особенности, образ жизни, традиции питания и другие.
Таким образом, существуют неоднозначные данные о влиянии эндокринных дисрапторов на менструальную функцию. Похоже, что эндокринные дисрапторы играют определённую роль в нарушении функции эндокринной системы, что способствует возникновению патологии менструального цикла. Хотя механизмы повреждающего действия остаются неизвестными, есть основания полагать, что имеет место нарушение функции системы гипоталамус-гипофиз-гонады. Отмечены также нарушения функции яичников, их фолликулярного аппарата, процессов мейотического развития в ооцитах и других интрафолликулярных механизмов. Кроме того, нельзя исключать повреждение механизмов функционирования стероидогенеза и системы рецепции гормонов.
Менопауза
Наступление климактерического периода связано с истощением фолликулярного аппарата. Менопауза проявляется прекращением менструаций в связи с уменьшением числа примордиальных фолликулов, что приводит к снижению продукции эстрадиола и сопровождающимся повышением концентрации ФСГ. Возраст наступления менопаузы соответствует степени истощения овариальных фолликулов. Изменение возраста менопаузы имеет большое значение для здоровья, поскольку раннее наступление менопаузы повышает риск возникновения остеопороза, кардиоваскулярных и раковых заболеваний. Существуют немногочисленные исследования, которые позволяют предположить наличие взаимосвязи между воздействием эндокринных дисрапторов и ранним наступлением менопаузы.
В экспериментальных исследованиях было показано, что ТХДД может изменять функцию яичника, воздействуя непосредственно на фолликулярный аппарат или опосредованно через гипофиз [3, 4, 6]. Высказывались предположения, что экспонирование ТХДД снижает чувствительность гипоталамо-гипофизарной системы к действию эстрогенов. Однако последние работы указывают, на то, что преждевременное нарушение цикличности не связано с изменением чувствительности к рилизинг-гормонам. Предполагается, что преждевременное репродуктивное старение вызвано, прежде всего, повреждением яичников. При интранатальном экспонировании отмечено снижение веса яичников, уменьшение количества жёлтых тел, преантральных и антральных фолликулов. Постнатальное экспонирование вызывает уменьшение числа овуляций, количества фолликулов, а также целый ряд морфологических изменений в яичниках и нарушение эстрального цикла. Исследования показали что, например, метоксихлор оказывает прямое ингибирующее воздействие на развитие фолликулов за счёт воздействия на гены Bcl-2 и Bax, и активизирует атрезию, посредством Bcl-2 и Bax пути. Другие исследователи полагают, что это не связанно с активацией процессов апоптоза или апаптоз играет не существенную роль[22]. Кроме того, есть основания полагать, что метоксихлор вызывает индукцию секреции антиМюллерового гормона в яичниках, который ингибирует процессы раннего фоликулогенеза. Показана также роль оксидативного стресса в нарушении функции яичников при воздействии метоксихлора. Не исключено влияние пренатального импринтинга на развитие и функцию репродуктивной системы.
Клинические исследования показали, что у женщин, проживающих в Северной Каролине повышенный уровень ДДЕ (ДДТ) в плазме крови коррелировал с более ранним наступлением менопаузы. В то же время авторы не выявили взаимосвязи между содержанием ПХБ и временем наступления климактерического периода [23].
Аналогичные результаты были получены и у женщин, проживающих в округе Юченг в Китае, которые отравились маслом, содержащим ПХБ. Не отмечено отличий в возрасте наступления менопаузы между экспонированными женщинами и контрольной группой.
В Мичигане (США) в 1973 году, около 4000 человек подверглись экспонированию при употреблении в пищу мяса и молока, полученных от экспонированных ПХБ и ПББ животных. Обследование этих женщин не выявило зависимости между сывороточным содержанием ПХБ, ПББ и временем наступления менопаузы. Отмечено более раннее наступление менопаузы у курящих женщин. [23].
Однако есть основание полагать, что некоторые из органохлоринов могут вызывать более раннее наступление менопаузы. В Латинской Америке проведено перекрестный анализ для установления взаимосвязи между экспонированием органохлоринами — пестицидами (p,p’-ДДТ, p’,p’-ДДЕ, диелдрин, гексахлорбензен, гексахлорциклогексан, оксихлордан и транснанохлор) и возрастом наступления менопаузы у женщин, находящихся в периоде менопаузы. Показано, что сывороточные концентрации p,p’-ДДТ, p,p’-ДДЕ, -гексахлорциклогексана и транснанохлора коррелировали с ранним наступлением менопаузы.
После аварии в Севезо в 1976 году, женщины были обследованы на сывороточное содержание ТХДД. Была проведена оценка индивидуальных доз экспозиции. Более чем через 20 лет было проведено детальное обследование этих женщин. Была выявлена U-образная зависимость между содержанием ТХДД и ранним наступлением климактерического периода. В более поздней работе авторы отвергают роль апоптоза и нарушения функции гипоталамо-гипофизарной системы. Для объяснения полученных результатов предлагается использование гипотезы перевернутого U-образного распределения дозозависимого ответа эндокринной системы на воздействие химических соединений. Myers и соавт. (2003) предложили гипотезу, согласно которой низкие «физиологические» дозы химических соединений, имитируют действие гормона. При более высоких дозах наблюдается токсическое действие, которое проявляется разнообразными изменениями и реакциями организма (изменение метаболизма, функции иммунной системы, стрессовыми реакциями и.т.д.) [24].
Между тем, не во всех случаях воздействие эндокринных дисрапторов вызывает более раннее наступление менопаузы. Так, например, в штате Айова и Северная Каролина обследовали женщин 35–55 лет, работающих на фермах. Авторы указывают на существование 2-х типов пестицидов с гормональной активностью, которые действуют, как агонисты или антагонисты половых гормонов [25]. Гормонально активные пестициды вызывают более позднее (на 3–5 месяцев) наступление менопаузы.
При проведении исследований необходимо учитывать, что на время наступления менопаузы может влиять внутриутробное экспонирование ДЭС. Этот препарат раннее широко применялся в лечении невынашивания беременности. Кроме того, доказано, что у курящих женщин наблюдается более ранее наступление климактерического периода, при этом изменения будут наблюдаться даже у детей, подвергшихся внутриутробному экспонированию. На время наступления менопаузы оказывают влияние и особенности питания. Употребление в пищу продуктов богатых соей, продлевает время наступления менопаузы. Подобные изменения отмечены также при употреблении алкоголя. Правда в данном случае механизм действия остаётся неизвестным.
В последние годы началось активное изучение влияния неблагоприятных факторов внешней среды на возникновение заболеваний, ассоциирующихся с наступлением менопаузы. Ранее считалось, что возникновение в постменопаузальном периоде таких заболеваний, как остеоартороз, болезнь Альцгеймера, заболевания сердечнососудистой системы и другие, является генетически детерминированным. Однако недавние исследования показали, что кроме генетических факторов, существенную роль в возникновении этих заболеваний, играют факторы внешней среды и в частности диоксины и бифенилы.
Таким образом, органохлорины способны изменять время наступления менопаузы. Направленность действия зависит от многих факторов, таких как гормональные свойства органохлоринов и их метаболитов, дозы экспонирования, особенностей метаболизма, генетических особенностей. Не исключается суммирование различных других факторов, например, особенности питания, курение, стрессы и др. Факторы внешней среды могут оказывать влияние и на увеличение частоты других заболеваний, ассоциирующихся с наступлением менопаузы. Имеющиеся в литературе данные указывают на негативное воздействие органохлоринов на репродуктивную систему. Нарушение функции репродуктивной системы связано с изменениями функции различных органов и систем. Деструктивные процессы затрагивают изменение генома клетки и могут программироваться ещё во внутриутробном периоде.
Результаты исследования
Активное расширение производства, использование благ цивилизации неизбежно сопровождается выбросом большого количества хлорорганических соединений. В городе Киеве расположен мусоросжигательный завод (МСЗ). Предприятия такого типа относят к источникам непреднамеренного производства и выбросов полихлорированных дибензо-пара-диоксинов и дибензофуранов, ГХБ и ПХБ. Мы провели исследование состояния репродуктивного здоровья у женщин, у трёх групп женщин. Первая группа — это контрольная группа. Она состояла из 29 492 женщин, проживающих, на расстоянии более 20 км от мусоросжигательного завода, вдали от промышленных предприятий, крупных магистралей. Вторая группа —это женщины, проживающие в радиусе 2х километров от мусоросжигательного завода (МСЗ) вг. Киеве. В этой группе объектом статистических исследований было 89 747 женщин. Оценка репродуктивного здоровья в первой и второй группе проводилась по информации предоставленной центрами медицинской статистики районных поликлиник и отчётам женских консультаций. Третья группа — это женщины, которые работают дезинфекторами, профессионально контактируют со средствами защиты от насекомых и грызунов (инсектициды, зооциды, дезрастворы). Обследование этих женщин проводили во время ежегодного профосмотра. Эта группа состояла из 208 человек. Выявленную патологию мы относили к показателю распространённости. Исключение составили два случая рака шейки матки, которые мы интерпретировали, как показатель заболеваемости.
Распространённость и заболеваемость патологии репродуктивной системы определяли из расчёта на 10 000 человек. Относительные показатели распространённости и заболеваемости во 2-йи 3-й группе сравнивали с контрольной 1-й группой. Оценку показателей достоверности делали с помощью критерия t и таблицы Стьюдента. Результаты исследования представлены в таблице № 1.
Хотя матка и состоит в основном из мышечной ткани, она является весьма чувствительной к изменениям, происходящим в эндокринной системе. Нарушение эндокринной функции организма, нередко является причиной возникновения патологии матки. В клинической практике часто приходится сталкиваться с такими гормонально зависимыми заболеваниями, как лейомиома, гиперплазия эндометрия, эндометриоз. Проведенные нами исследования показали, что по сравнению с контролем, у женщин, проживающих вблизи МСЗ, почти в 2 раза чаще встречаются лейомиомы матки. Очень высокая частота этой патологии выявлена у женщин, профессионально контактирующих с пестицидами. На момент осмотра лейомиома матки выявлена у 52 женщин 3-й группы. Кроме того, ещё 14 женщин были уже прооперированы по поводу быстрорастущей или множественной миомы матки. Распространённость лейомиомы матки в этой группе женщин составила 2500,0 случаев на 10 000 населения, что в 20,65 раза выше, чем в контрольной группе. Таким образом, наши исследования подтвердили данные о том, что экспонирование ксенотоксикантами способствует увеличению риска возникновения лейомиомы матки. У женщин, проживающих в экологически опасной зоне (2-я группа) распространённость эндометриоза была выше в 1,5 раза, чем в контрольной группе
При обследовании женщин, работающих дезинфекторами, в 3-х случаях с помощью кольпоскопа был диагностирован эндометриоз шейки матки. По сравнению с контролем, распространённость этого заболевания была в 8 раз выше, однако из-за малой выборки данные изменения не нашли статистического подтверждения.
Формирование гиперплазии эндометрия связано с нарушением гормонального баланса в организме. Изучение влияния неблагоприятных факторов на формирование этой патологии показало, что женщины, проживающие в близи МСЗ, в 1,67 раза чаще болеют гиперплазией эндометрия. Среди женщин, профессионально контактирующих с пестицидами, в одном случае выявлена гиперплазия эндометрия. При расчёте мы получили высокий показатель распространённости заболевания, однако в данном случае нельзя говорить о его достоверности. Полученные нами данные позволяют говорить о возможном влиянии факторов окружающей среды в возникновении гиперплазии эндометрия.
Мы не ставим под сомнение роль вируса папилломы человека в возникновении дисплазии шейки матки. Однако есть основания полагать, что ВПЧ реализует неопластические эффекты при наличии гормональных нарушений в организме. В связи с этим, представляло интерес определить влияние неблагоприятных факторов внешней среды на частоту возникновения патологии шейки матки.
При проведении профосмотра женщиндезинфекторов в 2-х случаях с помощью кольпоскопа и цитологического исследования нами было выявлено рак шейки матки. Диагнозы были подтверждены гистологически и женщины были прооперированы. Дисплазия эпителия шейки матки была выявлена в 9 случаях. Показатель заболеваемости раком шейки матки в этой группе составил 96,15, а распространённость дисплазии шейки матки — 432,69 случаев на 10 000 населения соответственно. Полученные показатели были выше для рака шейки матки в 46 раз, а для дисплазии шейки матки — в 12 раз по сравнению с контролем. После статистической обработки результатов мы констатировали у женщин-дезинфекторов, достоверно более высокие показатели распространённости дисплазии шейки матки и тенденцию к увеличению заболеваемости раком шейки матки. Заболеваемость и распространённость рака шейки матки у женщин, проживающих вблизи МСЗ (2-я группа), не отличалась от контрольных показателей. Однако в этом районе показатель распространённости дисплазии шейки матки был почти в 2 раза выше, а заболеваемости — в 3,45 раза выше, чем в контрольной группе.
В последнее время, появились данные, указывающие на то, что гормональные нарушения причастны к возникновению полипозных процессов матки. Мы не встретили данных об участии экологических факторов в формировании полипозных заболеваний репродуктивной системы. В связи с этим нами было проведено исследование показателей распространённости и заболеваемости в исследуемых группах женщин. Оказалось, что показатель заболеваемости и распространённости полипозных процессов репродуктивной системы в первых двух группах, был одинаковым. У дезинфекторов в 5 случаях с помощью кольпоскопа было диагностировано полип цервикального канала. В этой группе женщин показатель распространённости патологии был выше в 12 раз по сравнению с контролем, хотя изменения носили тенденциозный характер.
Неблагоприятное воздействие факторов окружающей среды на репродуктивную систему не ограничивается повреждающим действием на матку. В этом исследовании мы попытались выяснить воздействие экологических факторов на менструальную функцию и на частоту возникновения патологии климакса. Из таблицы №1 видно, что у женщин, проживающих вблизи МСЗ (2-я группа), частота нарушений менструального цикла не отличалась от контрольной группы. При обследовании дезинфекторов мы не выявили случаев нарушения менструального цикла. В данном случае мы вынуждены ограничиться констатацией факта. Менструальная функция зависит от воздействия многих факторов. Для исследования этого феномена необходимы более детальное исследование показателей менструальной функции, оценка показателей эндокринной системы, возрастной структуры, определение органохлоринов в организме.
Как известно, наступление менопаузы связано со снижением уровня циркулирующих эстрогенов. Это приводит к изменению секреции других гормонов, перестройке других метаболических процессов. Компенсаторные резервы организма способствуют адаптации к новым условиям. Большинство существующих исследований посвящено выяснению времени наступления менопаузы. По мнению разных исследователей, частота преждевременной менопаузы колеблется в пределах 1–3%, а поздняя менопауза наблюдается примерно у 1% женщин. Нам представилась возможность изучить время наступления менопаузы у женщин, профессионально контактирующих с пестицидами. Исследования показали, что преждевременная менопауза наблюдалась у 2-х женщин (около 1%). Позднее наступление менопаузы отмечено у 7 женщин — 3,38% женщин. Таким образом, у нас есть основание говорить, у женщин дезинфекторов наступление преждевременной менопаузы не связано с контактом с пестицидами. Более позднее наступление менопаузы вполне может быть связано с эстрогенными эффектами пестицидов применяемых для дезинфекции. В этом случае становится вполне объяснимой высокая частота эстроген зависимых заболеваний у этой группы женщин.
Мы исследовали частоту патологии климакса у разных групп женщин. Наши исследования показали, что среди женщин, проживающих около МСЗ, патологические изменения в менопаузальном периоде наблюдаются в несколько раз чаще по сравнению с контрольной группой. При обследовании женщин-дезинфекторов показатель распространённости патологии менопаузального периода был в 6,71 раза выше, по сравнению с 1-й группой. В основном мы наблюдали выраженные атрофические изменения слизистой влагалища и вульвы и вегето-сосудистые нарушения.
Таким образом, проведенные исследования показали, что воздействие неблагоприятных факторов вызывает нарушение функции репродуктивной системы и способствует формированию патологии других органов и систем. Похоже, что степень повреждения репродуктивной системы напрямую зависит от интенсивности воздействия неблагоприятных факторов. Обращают на себя внимание показатели высокой заболеваемости у женщин-дезинфекторов. Из-за малой выборки мы вынуждены были констатировать тенденцию к увеличению заболеваемости. Для проведения исследования нами целенаправленно было выбрано достаточно крупное предприятие дезинфекторов. Во многих областях численность персонала значительно ниже и соответственно, вывести статистические результаты состояния здоровья ещё сложнее. Результаты показали существование проблемы высокой заболеваемости на предприятиях высокого риска экспонирования, однако, из-за особенностей статистической обработки, эта проблема может нивелироваться. По нашему мнению, выход из сложившейся ситуации необходимо искать в централизации результатов обработки профосмотров по отдельным специальностям и изучении показателей индивидуальной токсической нагрузки у лиц, контактирующих с токсическими веществами.
В данной работе мы дали анализ имеющимся в литературе данным, по проблеме влияния органохлоринов на репродуктивную систему женщин. Рассмотрели некоторые механизмы, лежащие в основе патогенеза патологии репродуктивной системы. Кроме того, мы привели данные о состоянии здоровья нескольких групп женщин, которые подвержены комбинированному воздействию неблагоприятных факторов большого города.
По нашему мнению, затронутая проблема является актуальной для Украины, поскольку мы практически не имеем представления о количестве органохлоринов, накопившихся в организме людей. Нередко экологически опасные производства с устаревшими технологиями соседствуют рядом с зонами интенсивного жилищного строительства. Существующая нормативноправовая база не учитывает наличие патологии репродуктивной системы у женщины. Нередко на работу с токсическими соединениями принимают женщин с патологией, которая в дальнейшем начинает прогрессировать.
Уже доказано негативное влияние органохлоринов на функцию других органов и систем. Есть данные об участии этих соединений в формировании патологии щитовидной железы, инсулинорезистентности, нарушении развития центральной нервной системы и других заболеваний. Во многих странах разработаны карты, которые учитывают степень накопления органохлоринов в организме людей. На основе собранной информации разрабатываются соответствующие программы по минимизации последствий загрязнения. Эффективность таких программ уже доказана временем. В связи с этим представляется целесообразным создание базы данных о накоплении диоксинов и диоксиноподобных соединений в организме населения Украины. Это позволит разработать рекомендации по снижению заболеваемости в определённых районах, среди определённых групп населения, внести соответствующие изменения в действующее законодательство.
Литература
1.Проданчук Н.Г. Продукты питания и риск развития интоксикации диоксинами и диоксиноподобными соединениями / Н.Г. Проданчук, Г.М. Балан // Проблеми харчування. —2005. —№3. —С. 5–18.
2.Dioxines dans l’environnement : quels risques pour la sant? / [S. Alexander, D. Bard, R. Barouki et al.]; Ed. Chollet-Przednowed E. —Paris :INSERM, 2000. —406 p.
3.Pocar P. The impact of endocrine disruptors on oocyte competence / P. Pocar, T.A.L. Brevini,B. Fischer B. [et al.] // Reproduction .—2003. — V.125, №3. —P. 313–325.
4.Crain D.A. Female reproductive disorders: the roles of endocrine-disrupting compounds and developmental timing / D.A. Crain, S.J. Janssen, T.M. Edwards [et al.]// Fertility and Sterility. —2008. — V.90, №4. —P. 911–940.
5.Pocar P. Molecular interactions of the aryl hydrocarbon receptor and its biological and toxicological relevance for reproduction / P. Pocar, B. Fischer,T. Klonisch [et al.] // Reproduction. —2005. —V.129, № 4. —P. 379–389.
6. Brevini T.A. Effects of endocrine disruptors on developmental and reproductive functions / T.A. Brevini, S.B. Zanetto, F. Cillo // Curr. Drug Targets Immune Endocr. Metabol. Disord. —2005. —V.5, № 1. —P. 1–10.
7.Flake G.P. Etiology and pathogenesis of uterine leiomyomas: a review / G.P. Flake, J. Andersen, D. Dixon // Environ Health Perspect. —2003. — V.111, №8. —P. 1037–1054.
8.
Bredhult C. Effects of chlorinated biphenyls and metabolites on human uterine myocyte proliferation / C. Bredhult, B.-M. Backlin, M. Olovsson // Carolina Bredhult Human & Experimental Toxicology. — 2007. —V.26, N10. — P. 801–809.
9.Eskenazi B. Serum Dioxin Concentrations and Risk of Uterine Leiomyoma in the Seveso Women’s Health Study / B. Eskenazi, M. Warner, S. Samuels [et al.] // Am. J. Epidemiol. —2007. —V.166, №1.— P. 79–87.
10.Mueller M. D. 2,3,7,8-Tetrachlorodibenzop-Dioxin Increases Glycodelin Gene and Protein Expression in Human Endometrium / M.D. Mueller, J.-L. Vigne, M. Streich [et al.] // The Journal of Clinical Endocrinology & Metabolism. —2005. —V.90, №8. —P. 4809–4815.
11.Birnbaum L. S. Dioxins and Endometriosis: A Plausible Hypothesis / L.S. Birnbaum, A.M. Cummings // Environmental Health Perspectives. — 2002. —V.110, №1. —P. 15–21.
12.Rier S. Environmental Dioxins and Endometriosis / S. Rier, W.G. Foster // Toxicological Sciences. —2002. —V.70, № 2. —P. 161–170.
13.Tempfer C.B. Functional genetic polymorphisms and female reproductive disorders: Part IIendometriosis / C.B. Tempfer, M. Simoni, B. Destenaves [et al.] // Human Reproduction Update. —2009. —V.15, №1. — P. 97–118.
14.Bredhulta C. Effects of some endocrine disruptors on the proliferation and viability of human endometrial endothelial cells in vitro / C. Bredhulta, B.-M. Backlinb, M. Olovsson // Reproductive Toxicology. —2007. —V.23, № 4. —P. 550–559.
15.Bartol F.F. Uterine development and endometrial programming / F.F. Bartol, A.A. Wiley, C.A. Bagnell // Soc. Reprod. Fertil. —2006. —Suppl 62 . —P. 113–130.
16. Bredhult C. Gene expression analysis of human endometrial endothelial cells exposed to op’DDT / C. Bredhult, L. Sahlin, M. Olovsson // Molecular Human Reproduction. —2008. —V.14, №2. —P. 97–106.
17.Киселев В.И. Этиологическая роль вируса папилломы человека в развитии рака шейки матки: генетические и патогенетические механизмы, возможности терапии и профилактики / В.И. Киселев, Л.А. Ашрафян, С.О. Бударина // Гинекология. —2004. —T.6, №4. —C. 174–179.
18.Louis G.M.B. Environmental factors and puberty timing: expert panel research needs / G.M.B. Louis, L.E. Gray, M. Marcus [et al.]// Pediatrics. — 2008. —V.121, Suppl 3. —P. S192–S207.
19.Denham M. Relationship of lead, mercury, mirex, dichlorodiphenyldichloroethylene, hexachlorobenzene, and polychlorinated biphenyls to timing of menarche among Akwesasne Mohawk girls / M. Denham, L.M. Schell, G. Deane [et al.] // Pediatrics. —2005. —V.115, №.2. —P. e127–e134.
20.Vasiliu O. In utero exposure to organochlorines and age at menarche / O. Vasiliu, J. Muttineni, W. Karmaus // Human Reproduction. —2004. —V.19, No.7. —P. 1506–1512.
21.Davis S.I. Menstrual function among women exposed to polybrominated biphenyls: A follow-up prevalence study / S.I. Davis, H.M. Blanck,V.S. Hertzberg, [et al.] // Environmental Health: A Global Access Science Source. —2005. —V.4, №1. —P. 1–15.
22.Greenfeld C.R. BAX is involved in regulating follicular growth, but is dispensable for follicle atresia in adult mouse ovaries / C.R. Greenfeld, J.K. Babus, P.A. Furth, [et al.] // Reproduction. —2007. — V.133, №1. —P. 107–116.
23.Eskenazi B. Serum dioxin concentrations and age at menopause / B. Eskenazi, M. Warner,A.R. Marks, [et al.]// Environ. Health. Perspect. — 2005. —V.113, №7. —P. 858–862.
24. The emerging science of endocrine disruption: Proceedings of Conference [International Seminar on Nuclear War and Planetary Emergencies— 30th Session], (Erice, Italy, 18–26 August, 2003) / Centre for Scientific Culture. —Singapore: World Scientific Publishers, 2004. —592 p.
25. Farr S.L. Pesticide Exposure and Timing of Menopause. The Agricultural Health Study / S.L. Farr, J. Cai, D.A. Savitz [et al.] // Am. J. Epidemiol. — 2006. —V.163, №8. —P. 731–742.










Комментировать