Важность постпрандиальной регуляции. Постпрандиальная гликемия. Оценка результатов зарубежных исследований.
Аметов А.С., Мельник А.В.
По данным Международной диабетической федерации на 2006 год, в мире 246 млн человек в воз- расте от 20 до 79 лет страдают сахарным диабетом (СД) [1], что вызывает серьезные опасения медицинского сообщества, так как на сегодняшний день СД является одной из ведущих причин смертности в большинстве развитых стран и распространенность его быстро увеличивается.
Как известно, хроническая гипергликемия является причиной развития и прогрессирования ослож- нений заболевания, а макроангиопатические осложнения – основной причиной смерти пациентов с СД [2].
Результаты недавнего метаанализа, проведенного Stettler и коллегами [3], подтвердили, что улуч- шение гликемического контроля значительно снижает частоту встречаемости макроангиопатичес- ких осложнений у пациентов с СД 1 или 2 типа. До недавнего времени доминирующий фокус тера- пии заключался в снижении уровней HbA1c с особым акцентом на показатели гликемии натощак [4]. Однако, несмотря на то что контроль гликемии натощак необходим, обычно его недостаточно для достижения оптимального гликемического контроля. В настоящее время получено достаточное количество данных, которые показывают, что снижение показателей постпрандиальной (после еды) глюкозы плазмы имеет ведущую роль [5] и не менее важное значение для достижения целевых по- казателей гликированного гемоглобина (HbA1c) [6–11].
Важность постпрандиальной регуляции стала одной из основных тем дискуссий во время 43–го ежегодного собрания Европейской Ассоциации по изучению диабета в сентябре 2007 года в Амс- тердаме. Широкой медицинской общественности было представлено «Руководство по ведениюпо- стпрандиальной гликемии», разработанное Международной федерацией диабета в 2007 г. при участии ученых с большим опытом в подобной деятельности и практических врачей, а также лиц с жизненным опытом СД. Важно отметить, что руководство создавалось с использованием основных принципов доказательной медицины, с опорой на обзоры, сделанные ранее, метаанализы, клини- ческие, когортные исследования, а также эпидемиологические исследования, исследования на жи- вотных и фундаментальные работы, основные положения и руководства. В итоге достоверно признано, что постпрандиальная гипергликемия является независимым фактором риска развития макроангиопатических осложнений. Также с высокой степенью доказательности можно утверждать, что постпрандиальная гликемия (ППГ) ассоциируется:
• с повышенным риском ретинопатии [7];
• с увеличением толщины intima–media сонных артерий [11];
• со снижением миокардиального объема крови и миокардиального кровотока;
• с увеличением риска развития рака [12–16];
• с нарушением когнитивной функции у лиц старшего возраста с СД 2 типа [17];
• а также приводит к развитию оксидативного стресса, воспаления и эндотелиальной дисфункции [18–20].
Таким образом, постпрандиальная гликемия вызывает серьезные осложнения, и ее необходимо контролировать.
Многочисленные исследования доказали, что применение препаратов, снижающих постпрандиальный уровень глюкозы плазмы, способствует и снижению частоты развития сосудистых осложнений. Таким образом, терапия, направленная на снижение показателей как гликемии натощак (ГКН), так и постпрандиальной гликемии, является стратегически важной для достижения оптимального гликемического контроля через призму профилактики диабетических осложнений. Становится ясно, что внедрение в практику стратегии, направленной на нормализацию показателей постпрандиальной гликемии, абсолютно необходимо.
К каким же целевым показателям постпрандиальной гликемии следует стремиться? Известно, что уровень глюкозы в плазме крови после еды редко повышается выше 7,8 ммоль/л у лиц с нормальной толерантностью к глюкозе и обычно возвращается к исходным показателям через два часа по- сле приема пищи. Таким образом, Международная диабетическая федерация и другие компетентные организации определяют нормальную глюкозотолерантность как уровень гликемии менее 7,8 ммоль/л через два часа после нагрузки с 75 г глюкозы. С учетом того, что отсутствуют данные о су- ществовании определенного гликемического порога для снижения частоты осложнений [21,22], це- лью терапии СД должно быть достижение как можно более близкого к практически нормальным по- казателям гликемического статуса по всем трем критериям гликемического контроля: уровню HbA1c, уровню глюкозы плазмы натощак и после приема пищи. С учетом этих целей и повышения доступности различных вариантов сахароснижающей терапии, а также технологий для коррекции и мониторирования показателей постпрандиальной гликемии достижение целевого показателя глю- козы в плазме крови через 2 часа после приема пищи менее 7,8 ммоль/л можно считать резонным и достижимым.Надо отметить, что постпрандиальная гипергликемия является часто встречающим- ся феноменом у пациентов с СД как 1, так и 2 типа [37–40] и может выявляться даже если средние показатели метаболического контроля представляются адекватными при оценке по уровню HbA1c [23,24]. Так, в перекрестном исследовании с участием 443 пациентов с СД 2 типа у 71% обследуе- мых были выявлены средние двухчасовые показатели гликемии в плазме крови после еды более 14 ммоль/л [25]. При исследовании [26] с оценкой суточных гликемических профилей у 3284 пацие- нтов с СД 2 типа на инсулинотерапии в течение одной недели было показано, что уровень гликемии плазмы после еды более 8,9 ммоль/л фиксируется, по крайней мере однократно, в 84% случаев.
До настоящего времени нет завершенных специфических исследований, направленных на изучение эффектов контроля постпрандиальной гликемии на развитие макроангиопатических осложне- ний. Однако, к примеру, терапия аналогами инсулина ультракороткого действия для контроля пост- прандиальной гликемии оказывает положительный эффект на маркеры риска сердечно–сосудистых заболеваний, таких как нитротирозин [27], метилглиоксаль (МГ) и 3–деоксиглюкозон (3–ДГ) [28]. Более того, в одном из исследований контроль только показателей постпрандиальной гиперглике- мии при назначении быстродействующего инсулина повышал миокардиальный кровоток, который обычно снижен при СД 2 типа после приема пищи [29]. Аналогичные взаимосвязи были получены при оценке постпрандиальной гипергликемии, МГ и 3–ДГ у пациентов с СД 1 типа [28]. У этой же группы пациентов терапия инсулином лизпро значительно снижала колебания уровней МГ и 3–ДГ, и это снижение коррелировало с низкими показателями колебаний постпрандиальной гликемии при сравнении с терапией обычным инсулином.
В результате широко известного исследования Kumamoto [30], в котором использовался режим многократных инъекций инсулина для контроля как гликемии натощак, так и постпрандиального уровня гликемии у пациентов с СД 2 типа, не было выявлено развития или прогрессирования рети- нопатии или нефропатии при уровне гликемии натощак <6,1 ммоль/л и уровне гликемии через 2 ча- са после приема пищи <10 ммоль/л. Таким образом, предполагается, что снижение постпран- диальной гликемии и снижение гликемии натощак в значительной степени приводят к снижению ре- тинопатии и нефропатии.
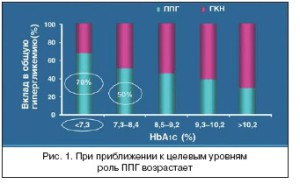
Доказано, что относительный вклад уровня глюкозы плазмы после еды в средние показатели гликемии увеличивается по мере снижения уровня HbA1c. Monnier и коллеги [31] показали, что у паци- ентов с уровнями HbA1c <7,3% вклад постпрандиальной гликемии в уровень HbA1c составлял око- ло 70%, когда же уровни HbA1c были выше 9,3%, вклад постпрандиальной гликемии составлял около 40% [32] (рис. 1).
Woerle и коллеги [33] оценивали относительный вклад контроля гликемии натощак и постпрандиа- льной гликемии у пациентов с СД 2 типа и уровнем HbA1c?7,5%. В результате только у 64% пацие- нтов, достигших уровня глюкозы плазмы натощак <5,6 ммоль/л, наблюдался уровень HbA1c<7%, в то время как такого же уровня HbA1c достигли 94% пациентов, которые имели постпрандиальные уровни гликемии менее 7,8 ммоль/л. Снижение постпрандиальных показателей гликемии привело к снижению в два раза уровня HbA1c по сравнению со снижением показателей гликемии натощак. Вклад постпрандиальных показателей гликемии составил примерно 80% HbA1c при уровне HbA1c менее 6,2% и примерно 40% в том случае, когда HbA1c был выше 9,0%.
Эти исследования подтверждают точку зрения о том, что необходим контроль гипергликемии нато- щак, но обычно этого недостаточно для достижения целевых значений HbA1c<7%, поэтому конт- роль постпрандиальной гипергликемии абсолютно необходим для достижения рекомендованных целевых значений HbA1c. Крайне важным является тот факт, что достижение целевых значений постпрандиальной гликемии не ассоциируется с повышенным риском гипогликемий. С другой сто- роны, риск развития гипогликемий может повышаться при попытках снизить уровень HbA1c до це- левых значений менее 7% посредством изолированного воздействия только на показатели глике- мии натощак. В исследовании, проводившемся по принципу «лечение до цели» («treat–to–target»)
[34] с использованием инсулинов средней продолжительности действия и длительного действия для контроля гликемии натощак, только 25% пациентов, находившихся на терапии гларгином с вве- дением препарата один раз в сутки, достигли уровня HbA1c менее 7% без зафиксированных эпизо- дов ночных гипогликемий. Bastyr и коллеги [35] показали, что целевое влияние на показатели пост- прандиальной гликемии в противоположность влиянию на уровень гликемии натощак ассоциирова- лось с аналогичной или меньшей частотой развития гипогликемических состояний. Также не было отмечено случаев тяжелых гипогликемий в исследовании Woerle и коллег, в котором было достиг- нуто снижение среднего уровня HbA1c от 8,7% до 6,5%. При этом цели исследования включали влияние на показатели глюкозы плазмы после еды [36].К препаратам, оказывающим специфическое влияние на показатели ППГ, относятся: ингибиторы ?– глюкозидазы, глиниды (секретагоги инсулина быстрого действия) и инсулин (аналоги инсулина уль- тракороткого действия, двухфазные [готовые смеси] инсулины, ингаляционный инсулин, обычный человеческий инсулин).
Аналоги инсулина ультракороткого действия были разработаны для имитации нормальной физио- логической секреции инсулина. Для них характерно быстрое начало действия и достижение пико- вой активности, а также более короткая продолжительность действия.
В двухфазных (готовых смесях) инсулинов сочетается аналог инсулина ультракороткого действия с инсулином средней продолжительности действия для имитации нормальной физиологической сек- реции инсулина и снижения показателей постпрандиальной гликемии [37–40].
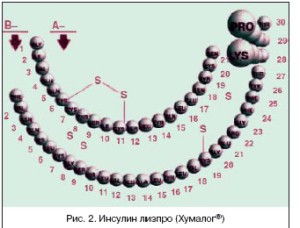
Медицинская рациональность применения аналогов инсулина заключается в том, что они более близки к физиологическим параметрам динамики инсулина, что наряду с другими преимуществами приводит к улучшению постпрандиального гликемического контроля и сочетается с низким риском развития поздней гипогликемии. Так, замена природной последовательности аминокислот с помо- щью рекомбинантной ДНК–технологии пролин–лизин В28 и В29 В–цепи инсулиновой молекулы на обратную (рис. 2) привела к появлению аналога человеческого инсулина [Лиз(В28), Про (В29)] (инсулин лизпро (Хумалог®).
Таким образом, молекулы инсулина Хумалог® имеют характерную более быструю скорость абсор- бции и более короткую продолжительность действия вследствие менее выраженной тенденции к самоассоциации по сравнению с человеческими инсулинами короткого действия. Начало действия инсулина Хумалог® наступает через 0–15 мин. после инъекции, пик действия достигается через 45–60 мин., а продолжительность действия ограничена 3–4 часами.
Стоит отметить, что изменение положения лизина и пролина в молекуле человеческого инсулина не изменяет биологических свойств активной А–цепи, но приводит к тому, что фармакокинетика Хумалога® максимально приближается к физиологическому действию инсулина у здорового чело- века. В то же время инсулин лизпро обладает таким же профилем безопасности, как простой чело- веческий инсулин. Так, в проведенном исследовании не отмечалось никаких неблагоприятных яв- лении, специфичных для инсулина лизпро [41]: препарат практически не отличается от человечес- кого простого инсулина по его иммуногенности у пациентов [42], токсическим эффектам в период репродукции и развития у животных [43] и по способности стимулировать клеточный рост [44]. Рассматривая развитие современной инсулинотерапии, следует отметить, что изменилась и тер- минология. Так, вместо «интенсивной инсулинотерапии» предлагается использовать термин «гиб- кая инсулинотерапия», а препараты инсулина подразделять в зависимости от физиологических принципов заместительной терапии на прандиальный инсулин и постабсорбционный инсулин. Лучший контроль потпрандиальной гликемии при использовнии Хумалога® по сравнению с геннои- нженерным инсулином короткого действия подтвердили и большие многоцентровые исследования с участием более 2000 пациентов с СД. Исследования длились до 12 месяцев и показали, что пост- прандиальный уровень гликемии был на 1,5–2,5 ммоль/л ниже при использовании Хумалога® [Zinman B.,1997; Melki,1998; De Verga, 1998; Garg S.K.,1999].
Отметим еще раз, что цель лечения диабета состоит в достижении хорошей компенсации показа- телей гликемии без увеличения риска гипогликемий. Результаты, полученные в рамках исследования Diabetes Control and Complications Trial («Контроль за диабетом и его осложнениями») продемо- нстрировали сложность достижения оптимальных значений HbA1c без повышения риска гипоглике- мий [45], в особенности в ночное время [46]. Гипогликемия является наиболее распространенным и одновременно опасным побочным эффектом инсулинотерапии независимо от интенсивности лече- ния. По оценкам, больной СД 1 типа за 40–45 лет жизни с диабетом испытывает в среднем 3500 приступов легкой гипогликемии, 30–70 – тяжелой гипогликемии и 3–7 случаев комы [46,47]. Пациен- ты боятся тяжелой гипогликемии не меньше, чем таких осложнений, как почечная недостаточность и слепота.
Сопоставление инсулина лизпро с простым человеческим инсулином в большом многоцентровом исследовании с участием 1008 пациентов с СД 1 типа на протяжении 6 месяцев показало [48], что в течение всего исследования постпрандиальный подъем уровня глюкозы в сыворотке крови при ле- чении инсулином лизпро был достоверно меньше. К концу исследования у больных, получавших инсулин лизпро, постпрандиальный подъем глюкозы в сыворотке был ниже через 1 ч. на 1,3 ммоль/л, а через 2 ч. – на 2,0 ммоль/л (p<0,001). С другой стороны, частота гипогликемий при лече- нии инсулином лизпро была на 12% меньше (6,4±0,2 vs. 7,2±0,3 эпизодов за 30 дней, p<0,001) неза- висимо от схемы введения базисного инсулина и уровня HbA1c. Эти снижения отмечались для эпи- зодов как с симптомами, так и для бессимптомных. При анализе суммарного числа эпизодов гипог- ликемии по каждому пациенту в отношении времени их развития обнаружилось, что это число в те- чение 3–й и 4–й четвертей дня было меньше у больных, получавших инсулин лизпро, чем у тех, кто получал простой человеческий инсулин (p<0,001). Самое большое относительное улучшение на- блюдалось ночью. Таким образом, что крайне важно, инсулин лизпро улучшает контроль постпран- диальной гипергликемии и одновременно уменьшает число эпизодов гипогликемии, являясь более удобным для пациентов.
Несомненно также, что возможность инъекции Хумалога® непосредственно перед приемом пищи или сразу после еды делает его более привлекательным именно в детской практике, когда режим питания и углеводная нагрузка непостоянны.
Мы знаем, что с позиции современных критериев компенсации метаболических процессов у больных СД 2 типа перевод на инсулинотерапию для коррекции как тощаковой, так и постпрандиальной гипергликемии является оправданным подходом. Достаточно часто негативная точка зрения пациентов на этот метод терапии основана на боязни инъекций, нежелании терять время на обучение технике инсулинотерапии, а также на страхе перед гипогликемией и повышением массы тела. В то же время медицинский персонал поликлиник – первого звена здравоохранения – в большинстве слу- чаев не имеет достаточного количества времени и ресурсов для обучения пациентов технике инъекций и, что самое важное, для тщательного наблюдения за пациентами, переведенными на инсулинотерапию.
Очевидно, что при необходимости одновременного применения как прандиального, так и постабсо- рбционного инсулина смешанные формы инсулина, содержащие Хумалог® с инсулинами продлен- ного действия, могут упростить ситуацию. Хумалог® Микс™ 25 представляет собой готовую смесь из 75% протаминизированной суспензии инсулина лизпро и 25% инсулина лизпро. Протаминизированный компонент обеспечивает базальную потребность, так как является аналогом инсулина сре- дней продолжительности действия, а компонент с ультракоротким действием контролирует колеба- ния постпрандиальной гликемии.
По аналогии ультракороткий компонент в смеси действует гораздо быстрее и обеспечивает лучший контроль постпрандиальной гликемии по сравнению с простым человеческим инсулином в смеси [49], то есть пик концентраций инсулина плазмы при применении Хумалог® Микс™ 25 более высо- кий и достигается быстрее по сравнению с готовыми смесями человеческих инсулинов [50].
Так как ультракороткий инсулин действует быстрее, чем простой человеческий инсулин, пациенты могут применять и готовые смеси аналогов в интервале 15 мин. до начала приема пищи или даже после еды. Подобная гибкость применения улучшает качество жизни и обеспечивает высокую комплайентность [51].
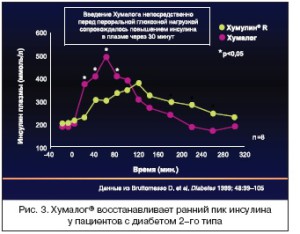
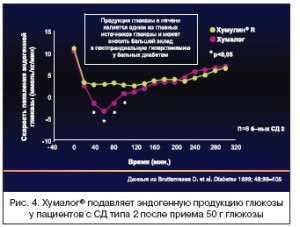
Основываясь на данных о фармакокинетических и фармакодинамических преимуществах, можно сказать, что готовые смеси инсулиновых аналогов более эффективны с точки зрения контроля пос- тпрандиальной гликемии, чем готовые смеси человеческих инсулинов. Исследования у пациентов с СД типа 2 показали, что ультракороткий аналог инсулина Хумалог®, входящий в состав смеси, по сравнению с коротким инсулином восстанавливает ранний пик секреции инсулина после приема пищи, что особенно важно для контроля постпрандиальной гликемии, и более эффективно подав- ляет эндогенную секрецию глюкозы печенью (рис. 3 и 4).
При введении Хумалог® Микс™ 25 за 5 мин. до приема пищи уровень постпрандиальной гликемии снижался на 27% больше по сравнению с человеческим инсулином 30/70 в двойном слепом рандо- мизированном кроссоверном исследовании с участием 177 пациентов с СД 1 и 2 типа [52]. В другом открытом рандомизированном кроссоверном исследовании у 33 пациентов с СД типа 2 на стандартной итальянской диете (с пониженным содержанием жиров и с повышенным содержанием сложных углеводов) инсулин Хумалог® Микс™ 25 применялся за 5 мин. до утренней и вечерней еды, а человеческий инсулин 30/70 – за 30 мин. до приемов пищи. В течение 12 дней лечения колебания постпрандиальной гликемии после ужина среди пациентов, применявших Хумалог® Микс™ 25, бы- ли достоверно ниже, чем у пациентов, применявших человеческий инсулин 30/70 (разница между группами – 66%, p<0,05) [53].
Интересны данные, полученные в открытом рандомизированном кроссоверном исследовании по сравнению эффективности инсулина Хумалог® Микс™ 25 и человеческого инсулина 30/70 у 151 пациента с СД 2 типа, которые соблюдали пост во время Рамадана и, соответственно, не принима- ли пищу в течение дня. На протяжении 14 дней смесь применялась сразу перед утренним и вечер- ним приемом пищи, тогда как пациенты, применявшие человеческий инсулин 30/70, стандартно де- лали это за 30–40 мин. до еды. После оценки гликемии в течение суток было выявлено, что досто- верно более низкие общие значения постпрандиальной гликемии (–5,9%, p=0,004) и более низкие значения гликемии перед вечерним приемом пищи (–5,5%; p=0,034) были в группе Хумалог® Микс™ 25 по сравнению с пациентами, которые применяли человеческий инсулин 30/70. Достовер- но более низкие колебания гликемии после вечернего приема пищи также были у пациентов, при менявших инсулин Хумалог® Микс™ 25 (–15%; p=0,007). Утренние значения гликемии достоверно не отличались [54].
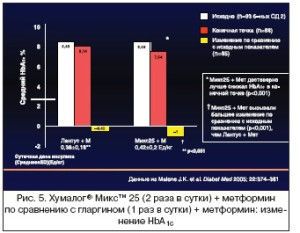
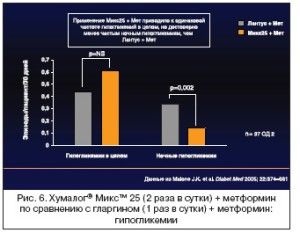
В 32–недельном (по 16 недель на каждый период) рандомизированном открытом кроссоверном ис- следовании с участием 105 пациентов с СД 2 типа, которые начали применение инсулина, но про- должали прием метформина, 42% из группы получавших смесь Хумалог® Микс™ 25 дважды в сут- ки достигали HbA1c<7% по сравнению с 18% пациентов, которые получали инсулин гларгин однок- ратно (р<0,001). Колебания ППГ после завтрака и ужина были на 65% и 70% ниже при применении Хумалог® Микс™ 25 по сравнению с инсулином гларгин (р<0,005), различий после обеда выявлено не было. Частота легких гипогликемий была достоверно выше при применении инсулина Хумалог® Микс™ 25, чем при применении инсулина гларгин (р=0,041) [55]. Другое 32–недельное открытое кроссоверное исследование с участием 97 пациентов, неадекватно контролирующихся на примене- нии одно– или двукратного режима инсулинотерапии (в виде монотерапии или в комбинации с ПСП), показало, что инсулин Хумалог® Микс™ 25 снижает HbA1c дополнительно на 0,6% по срав- нению с инсулином гларгин, применявшимся однократно (р<0,001). В общем и целом колебания гликемии были на 25% ниже при применении инсулина Хумалог® Микс™ 25 (р<0,001), но общая ча- стота легких гипогликемий достоверно не отличалась между лечебными режимами (0,61 против 0,44 эпизода на пациента за 30 дней; р=NS) [56]. Эпизодов тяжелой гипогликемии не зафиксирова- но ни в одном, ни в другом исследовании [55,56] (рис. 5 и 6).
Таким образом, Хумалог® в составе смеси Хумалог®a Миксa™ 25 позволяет проводить коррекцию ППГ более физиологично по сравнению с коротким инсулином, входящим в состав простой смеси 30/70.
Во всех проведенных исследованиях готовые смеси инсулиновых аналогов применялись, как пра- вило, дважды в день – перед утренним и вечерним приемом пищи за 0–15 мин. до еды. Это обеспечивало достаточное количество инсулина для удовлетворения базальной потребности и покрытия постпрандиальных колебаний гликемии после завтрака и ужина, которые традиционно являются самыми большими приемами пищи. Однократное применение готовых смесей аналогов инсулина также возможно как стартовый режим у пациентов с СД 2 типа в начале инсулинотерапии. При не- обходимости для покрытия колебаний гликемии в обеденное время могут быть добавлены или быс- тродействующие секретагоги, или инсулиновые аналоги ультракороткого действия, или третья инъ- екция смешанного инсулина. Последний режим максимально приближает лечение к базисно– болюсной терапии.
Как и при любом режиме применения инсулина, необходимо установить индивидуальные цели гли- кемии для каждого пациента во избежание гипогликемии и значительного прироста массы тела.
С целью подбора дозы можно использовать методические рекомендации относительно применения смешанных инсулинов 30/70. Согласно рекомендациям федеральной целевой программы «Сахарный Диабет», начальной дозой может быть назначение 12 МЕ перед завтраком и 8 МЕ перед ужи- ном с последующей коррекцией дозы через 2–3 дня (по 2 или 4 МЕ) по результатам самоконтроля до достижения установленных для данного больного целевых параметров.
Хочется акцентировать внимание на том, что с течением времени может потребоваться увеличение дозы инсулина, что обусловлено в первую очередь прогрессирующим течением заболевания, а не тем, что пациент не строго придерживался лечения.
В заключение необходимо сказать, что разработка инсулиновых аналогов ультракороткого дейст- вия позволила инсулинотерапии стать более физиологичной. Как базальная, так и прандиальная потребность в инсулине могут быть полностью покрыты при помощи одной инъекции готовой смеси инсулинового аналога, что в некоторых случаях значительно упрощает практическую реализацию инсулинотерапии.
Таким образом, характеристики инсулина лизпро (Хумалог®) показывают, что его появление можно рассматривать как шаг вперед в направлении оптимальной инсулинотерапии и достижения целевых параметров гликемии.
Литература
1. Diabetes Atlas, 3rd edition. International Diabetes Federation, 2006.
2. Niskanen L, Turpeinen A, Penttila I, Uusitupa MI. Hyperglycemia and compositional lipoprotein abnormalities as predictors of cardiovascular mortality in type 2 diabetes: a 15–year follow–up from the time of diagnosis. Diabetes Care 1998; 21(11):1861–1869.
3. Stettler (14) Diabetes Control and Complications Trial (DCCT) Research Group. The absence of a glycemic threshold for the development of longterm complications: the perspective of the Diabetes Control and Complications Trial. Diabetes 1996; 45(10):1289–1298.
4. Nathan DM, Buse JB, Davidson MB, Heine RJ, Holman RR, Sherwin R et al. Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy: A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2006; 29(8):1963–1972.
5. Sorkin JD, Muller DC, Fleg JL, Andres R. The relation of fasting and 2–h postchallenge plasma glucose concentrations to mortality: data from the Baltimore Longitudinal Study of Aging with a critical review of the literature. Diabetes Care 2005; 28(11):2626–2632.
6. Ohkubo Y, Kishikawa H, Araki E, Miyata T, Isami S, Motoyoshi S et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non–insulin– dependent diabetes mellitus: a randomized prospective 6–year study. Diabetes Res Clin Pract 1995;28(2):103–117.
7. Shiraiwa T, Kaneto H, Miyatsuka T, Kato K, Yamamoto K, Kawashima A et al. Post–prandial hyperglycemia is an important predictor of the incidence of diabetic microangiopathy in Japanese type 2 diabetic patients. Biochem Biophys Res Commun 2005; 336(1):339–345.
8. Levitan EB, Song Y, Ford ES, Liu S. Is nondiabetic hyperglycemia a risk factor for cardiovascular disease? A meta–analysis of prospective studies. Arch Intern Med 2004; 164(19):2147–2155.
9. Hanefeld M, Cagatay M, Petrowitsch T, Neuser D, Petzinna D, Rupp M. Acarbose reduces the risk for myocardial infarction in type 2 diabetic patients: meta–analysis of seven long–term studies. Eur Heart J 2004; 25(1):10–16.
10. Woerle HJ, Neumann C, Zschau S, Tenner S, Irsigler A, Schirra J et al. Impact of fasting and postprandial glycemia on overall glycemic control in type 2 diabetes Importance of postprandial glycemia to achieve target HbA1c levels. Diabetes Res Clin Pract 2007.
11. Hanefeld M, Koehler C, Schaper F, Fuecker K, Henkel E, Temelkova–Kurktschiev T. Postprandial plasma glucose is an independent risk factor for increased carotid intima–media thickness in non–diabetic individuals. Atherosclerosis 1999; 144(1):229–235.
12. Gapstur SM, Gann PH, Lowe W, Liu K, Colangelo L, Dyer A. Abnormal glucose metabolism and pancreatic cancer mortality. JAMA 2000; 283(19):2552–2558.
13. Larsson SC, Bergkvist L, Wolk A. Consumption of sugar and sugar–sweetened foods and the risk of pancreatic cancer in a prospective study. Am J Clin Nutr 2006; 84(5):1171–1176.
14. Michaud DS, Liu S, Giovannucci E, Willett WC, Colditz GA, Fuchs CS. Dietary sugar, glycemic load, and pancreatic cancer risk in a prospective study. J Natl Cancer Inst 2002; 94(17):1293–1300.
15. Michaud DS, Fuchs CS, Liu S, Willett WC, Colditz GA, Giovannucci E. Dietary glycemic load, carbohydrate, sugar, and colorectal cancer risk in men and women. Cancer Epidemiol Biomarkers Prev 2005; 14(1):138–147.
16. Lajous M, Willett W, Lazcano–Ponce E, Sanchez–Zamorano LM, Hernandez–Avila M, Romieu I. Glycemic load, glycemic index, and the risk of breast cancer among Mexican women. Cancer Causes Control 2005; 16(10):1165–1169.
17. Abbatecola AM, Rizzo MR, Barbieri M, Grella R, Arciello A, Laieta MT et al. Postprandial plasma glucose excursions and cognitive functioning in aged type 2 diabetics. Neurology 2006; 67(2):235–240.
18. Ceriello A, Quagliaro L, Piconi L, Assaloni R, Da RR, Maier A et al. Effect of postprandial hypertriglyceridemia and hyperglycemia on circulating adhesion molecules and oxidative stress generation and the possible role of simvastatin treatment. Diabetes 2004; 53(3):701–710.
19. Williams SB, Goldfine AB, Timimi FK, Ting HH, Roddy MA, Simonson DC et al. Acute hyperglycemia attenuates endothelium–dependent vasodilation in humans in vivo. Circulation 1998; 97(17):1695–1701.
20. Kawano H, Motoyama T, Hirashima O, Hirai N, Miyao Y, Sakamoto T et al. Hyperglycemia rapidly suppresses flow–mediated endothelium–dependent vasodilation of brachial artery. J Am Coll Cardiol 1999; 34(1):146–154.
21. Diabetes Control and Complications Trial (DCCT) Research Group. The absence of a glycemic threshold for the development of longterm complications: the perspective of the Diabetes Control and Complications Trial. Diabetes 1996; 45(10):1289–1298.
22. Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, Cull CA et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321(7258):405–412.
23. Erlinger TP, Brancati FL. Postchallenge hyperglycemia in a national sample of U.S. adults with type 2 diabetes. Diabetes Care 2001; 24(10):1734–1738.
24. Bonora E, Corrao G, Bagnardi V, Ceriello A, Comaschi M, Montanari P et al. Prevalence and correlates of post–prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia 2006; 49(5):846–854.
25. Akbar DH. Sub–optimal postprandial blood glucose level in diabetics attending the outpatient clinic of a University Hospital. Saudi Med J 2003; 24(10):1109–1112.
26. Bonora E, Corrao G, Bagnardi V, Ceriello A, Comaschi M, Montanari P et al. Prevalence and correlates of post–prandial hyperglycaemia in a large sample of patients with type 2 diabetes mellitus. Diabetologia 2006; 49(5):846–854.
27. Ceriello A, Quagliaro L, Catone B, Pascon R, Piazzola M, Bais B et al. Role of hyperglycemia in nitrotyrosine postprandial generation. Diabetes Care 2002; 25(8):1439–1443.
28. Beisswenger PJ, Howell SK, O’Dell RM, Wood ME, Touchette AD, Szwergold BS. alpha–dicarbonyls increase in the postprandial period and reflect the degree of hyperglycemia. Diabetes Care 2001; 24(4):726–732.
29. Scognamiglio R, Negut C, De Kreutzenberg SV, Tiengo A, Avogaro A. Effects of different insulin regimes on postprandial myocardial perfusion defects in type 2 diabetic patients. Diabetes Care 2006;29(1):95–100.
30. Ohkubo Y, Kishikawa H, Araki E, Miyata T, Isami S, Motoyoshi S et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non–insulin– dependent diabetes mellitus: a randomized prospective 6–year study. Diabetes Res Clin Pract 1995;28(2):103–117.
31. Monnier L, Lapinski H, Colette C. Contributions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbA(1c). Diabetes Care 2003; 26(3):881–885.
32. Monnier L, Colette C, Dunseath GJ, Owens DR. The loss of postprandial glycemic control precedes stepwise deterioration of fasting with worsening diabetes. Diabetes Care 2007; 30(2):263–269.
33. Woerle HJ, Neumann C, Zschau S, Tenner S, Irsigler A, Schirra J et al. Impact of fasting and postprandial glycemia on overall glycemic control in type 2 diabetes Importance of postprandial glycemia to achieve target HbA1c levels. Diabetes Res Clin Pract 2007.
34. Riddle MC, Rosenstock J, Gerich J. The treat–to–target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26(11):3080–3086.
35. Bastyr EJ, III, Stuart CA, Brodows RG, Schwartz S, Graf CJ, Zagar A et al. Therapy focused on lowering postprandial glucose, not fasting glucose, may be superior for lowering HbA1c. IOEZ Study Group. Diabetes Care 2000; 23(9):1236–1241.
36. Woerle HJ, Neumann C, Zschau S, Tenner S, Irsigler A, Schirra J et al. Impact of fasting and postprandial glycemia on overall glycemic control in type 2 diabetes Importance of postprandial glycemia to achieve target HbA1c levels. Diabetes Res Clin Pract 2007.
37. Halimi S, Raskin P, Liebl A, Kawamori R, Fulcher G, Yan G. Efficacy of biphasic insulin aspart in patients with type 2 diabetes. Clin Ther 2005; 27 Suppl 2:S57–S74.
38. Kazda C, Hulstrunk H, Helsberg K, Langer F, Forst T, Hanefeld M. Prandial insulin substitution with insulin lispro or insulin lispro mid mixture vs. basal therapy with insulin glargine: a randomized controlled trial in patients with type 2 diabetes beginning insulintherapy. J Diabetes Complications 2006; 20(3):145–152.
39. Schernthaner G, Kopp HP, Ristic S, Muzyka B, Peter L, Mitteregger G. Metabolic control in patients with type 2 diabetes using Humalog Mix50 injected three times daily: crossover comparison with human insulin 30/70. Horm Metab Res 2004; 36(3):188–193.
40. Roach P, Malone JK. Comparison of insulin lispro mixture 25/75 with insulin glargine during a 24–h standardized test–meal period in patients with Type 2 diabetes. Diabet Med 2006; 23(7):743–749.
41. Anderson J. et al.Reduction of postprandial hyperglycemia and frequency of hypoglycemia in IDDM patients on insulin–analog treatment. Multicenter Insulin Lispro Study Group Diabetes 46: 265–270
42.Fineberg SE, Fineberg NS, Anderson J.H., Birkett M:Insulin immune response to lispro human insulin therapy in insulin naive type I and type II patients (Abstract.) Diabetologia 38 (Suppl.1):A4,1995
43. Buelke–Sam J, Byrd RA, Hayt JA, Zimmerman JL: A reproductive and developmental toxicity study in CD rats of LY275585, (Lys(B28),Pro(B29)) human insulin. J Am Coll Toxicol 13:247–260, 1994
44. Slieker LJ, Brooke GS, Chance RE, Fan L, Hoffmann JA, Howey DC, Long HB, Mayer J, Shields JE, Sundell KL, DiMarshi RD: Insulin and IGF–1 analogs: novel approach to improved insulin pharmacokinetics. In Current Directions in Insulin–like Growth Factors Research. LeRoith D, Raizada MK, eds. New York, Plenum Press, 1994, p.25–32
45. The DCCT Research Group: Adverse events and their accosiation with treatment regimens in the Diabetes Control and Complications Trial. Diabetes Care 18:1415–1427, 1995
46. The DCCT Research Group: Epidemiology of severe hypoglycemia in the Diabetes Control and Complications Trial. Am J Med 90:450–459,1991
47. Pramming S, Thorsteinsson B, Bendtson I, Binder C: The relationship between symptomatic and biochemical hypoglycemia in insulin–dependent diabetic patients. J Int Med 228:641–646, 1990
48. Anderson J. et al.Reduction of postprandial hyperglycemia and frequency of hypoglycemia in IDDM patients on insulin–analog treatment. Multicenter Insulin Lispro Study Group Diabetes 46: 265–270
49. Rolla AR. Insulin analog mixes in the management of type 2 diabetes mellitus. Pract Diabetol. 2002;21:36–43.
50. DeWitt DE, Dugdale DC. Using new insulin strategies in the outpatient treatment of diabetes: Clinical applications.JAMA.2003;289:2265–2269.
51. Owens DR, Zinman B, Bolli GB. Insulins today and beyond [published correction appears in Lancet. 2001;358:1374]. Lancet. 2001;358: 739–746.
52. MaloneJK, Yang H, WoodworthJR, et al. Humalog Mix25 offers better mealtime glycemic control in patients with type 1 or type 2 diabetes. Diabetes Metab.2000;26:481–487.
53. Coscelli C, lacobellis G, Calderini C, et al. Importance of premeal injection time in insulin therapy: Humalog Mix25 is convenient for improved post–prandial glycemic control in type 2 diabetic patients with Italian dietary habits. Acta Diabetol. 2003; 40:187–192.
54. Mattoo V, Milicevic Z, MaloneJK, et al, for the Ramadan Study Group. A comparison of insulin lispro Mix25 and human insulin 30/70 in the treatment of type 2 diabetes during Ramadan. Diabetes Res C/in Pract. 2003;59:137–143.
55. MaloneJK, Kerr LF, Campaigne BN, et al, for the Lispro Mixture–Glargine Study Group. Combined therapy with insulin lispro Mix 75/25 plus metformin or insulin glargine plus metformin: A 16–week, randomized, open–label, crossover study in patients with type 2 diabetes beginning insulin therapy. Clin Ther. 2004;26: 2034–2044.
56. MaloneJK, Bai S, Campaigne BN, et al. Twice–daily pre–mixed insulin rather than basal insulin therapy alone results in better overall glycaemic control in patients with type 2 diabetes. Diabet Med. 2005;22:374–381.













Комментировать