Головач І.Ю., д.мед.н., професор, Клінічна лікарня «Феофанія» Державного управління справами, Київ
Антибіотики цефалоспоринового ряду застосовуються в широкій клінічній практиці вже майже 50 років; за цей час синтезовано понад 50 різних препаратів даної групи [1]. На сьогодні цефалоспоринові антибіотики посідають провідне місце в лікуванні різних інфекцій у стаціонарі; здебільшого вони використовуються у схемах початкової емпіричної терапії інфекцій різних локалізацій. Порівняльну характеристику поколінь цефалоспоринів щодо антибактеріального спектра представлено в таблиці 1.
Широкий спектр антибактеріальної активності, сприятлива фармакокінетика, низька токсичність, можливість поєднання з іншими антибактеріальними препаратами зумовлюють широке застосування цефалоспоринів у клінічній практиці та роблять їх засобами першого вибору у боротьбі з численними інфекціями [1, 8, 22]. Водночас, обмежувальним чинником застосування цефалоспоринів є розвиток резистентності мікороорганізмів внаслідок продукції β -лактамаз. Особливого звучання ця проблема набула сьогодні через широке, іноді невиправдане і безконтрольне використання цефалоспоринів.
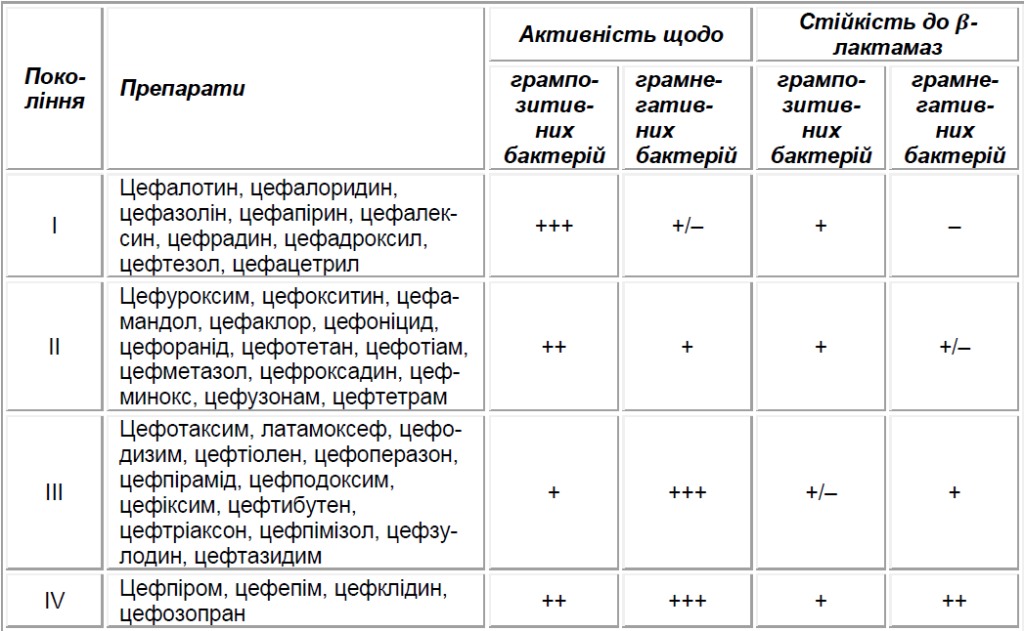
Цефалоспорини І покоління мають вузький спектр антимікробної активності. Вони ефективні щодо грампозитивних коків за винятком метицилінрезистентних стафілококів і ентерококів. Представники цієї групи легко руйнуються під впливом β -лактамаз широкого спектра дії. Порівняно з препаратами І покоління цефалоспорини ІІ покоління мають ширший спектр антимікробної активності за рахунок більш високої активності щодо грамнегативної флори. Препарати ІІІ покоління дієвіші щодо грамнегативних бактерій, зокрема багатьох штамів синьогнійної палички і грамнегативних анаеробів (цефтазидим і цефоперазон), проте слабше діють на грампозитивні мікроорганізми і зовсім неактивні щодо метицилінрезистентних стафілококів і ентерококів.
В останні десятиліття в антимікробній хіміотерапії чітко простежуються дві важливі тенденції. По-перше, істотно зростає резистентність грамнегативних мікроорганізмів до цефалоспоринів ІІІ покоління, головним чином, за рахунок продукції ними β-лактамаз різних типів і класів. Важливий механізм резистентності зумовлений гіперпродукцією хромосомних β-лактамаз за рахунок мутацій у регуляторних ділянках генома, що сприяють депресії синтезу ферменту. По-друге, сучасна тенденція пов’язана зі змінами спектра збудників госпітальних інфекцій, передусім у відділеннях інтенсивної терапії, реанімації, хірургічних стаціонарах за рахунок збільшення частоти грампозитивних мікроорганізмів і викликаних ними тяжких стаціонарних інфекцій – пневмоній, раневої інфекції, сепсису [10].
Ці дві тенденції стимулювали пошук нових антибактеріальних препаратів, котрі, з одного боку, дозволили б побороти проблему мультирезистентності грамнегативних збу дників госпітальних інфекцій, особливо продуцентів β-лактамаз розширеного спектра, і, з іншого, мали б вищу активність щодо грампозитивних мікроорганізмів. Цей пошук спричинив створення в середині 1990-х років двох нових цефалоспоринових антибіотиків, що віднесені до IV по коління препаратів, – цефпірому і цефепіму.
Тож останніми роками з’явилися нові високоефективні антибіотики цефалоспоринового ряду з біполярною структурою, притаманною цефалоспоринам IV покоління. До них належать препарати цефпіром і цефепім [9, 15, 23].
Цефалоспорини IV покоління вирізняються більшою стійкістю до β -лактамаз і внаслідок цього — високою активністю щодо полірезистентної мікрофлори. Цефпіром вирізняє також добре збалансований антимікробний спектр. Він поєднує активність цефалоспоринів І–ІІ поколінь щодо грампозитивних мікроорганізмів (метицилінчутливі стафілококи, стрептококи, пневмококи) і деяких анаеробів з високою активністю цефалоспоринів ІІІ покоління щодо грамнегативних бактерій (родини Enterobacteriaceae, Neisseriaceae, Hae mophilus influenzae, Moraxella catarrhalis, Pseudomonas spp., Acinetobacter spp.).
Особливості хімічної структури цефалоспоринів IV покоління надають цим антибіотикам низку властивостей. Цефемове ядро антибіотиків має негативний заряд, четвертинний азот циклопентопіридинової групи – позитивний, що надає молекулі структуру цвіттеріона (біполярного іона) [18]. Саме біполярна структура молекули антибіотика забезпечує швидке проникнення крізь зовнішню мембрану, що особливо важливо для грамнегативних бактерій. Позитивний заряд є провідником молекули у пошуку сприятливої позиції у пориновому каналі бактеріальної клітини. Аміноміазолін-метоксиіміногрупа, приєднана у 7-му положенні цефемового ядра, зумовлює більш виражений вплив на грамнегативні мікроорганізми і формування стійкості до β -лактамаз [18]. Ці препарати стабільні до гідролізу лактамазами, у тому числі розширеного спектра, і, відповідно, активні щодо штамів бактерій, які продукують ці лактамази, стійких до більш ранніх поколінь цефалоспоринів.
Проникаючи до мікробної клітини, цефпіром і цефепім досягають високих концентрацій у периплазматичному просторі і зв’язуються з білками (головним чином, ПБС-3), до яких мають високу спорідненість. Ці властивості молекули забезпечують високу активність щодо грамнегативних бактерій, зокрема штамів, резистентних до цефалоспоринів ІІІ покоління. Отже, активність цефалоспоринів IV покоління щодо грамнегативних бактерій не поступається або перевищує таку найбільш активних цефалоспоринів ІІІ покоління – цефотаксиму і цефтріаксону та порівняна з активністю фторхінолонів і карбапенемів [8]. Безсумнівною перевагою цефалоспоринів IV покоління є стійкість до дії β-лактамаз, що продукуються грамнегативними бактеріями, у тому числі розширеного спектра.
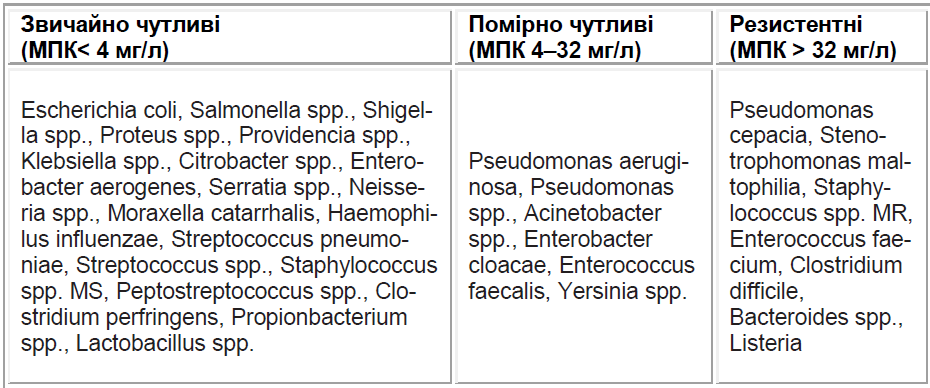
Цефпіром зберігає активність навіть щодо штамів бактерій, резистентних до цефалоспоринів ІІІ покоління [12]. За вираженістю дії на грамнегативні ентеробактерії (En terobacteriaceae) антибіотики розташовуються таким чином: меропенем > ципрофлоксацин > цефалоспорини IV покоління = іміпенем > цефалоспорини ІІІ покоління > амікацин. Цефалоспорини IV покоління мають помірну активність щодо P. aeruginosa; щодо цього мікроорганізму за активністю вони незначно поступаються цефтазидиму, меропенему і ципрофлоксацину, проте перевершують гентаміцин і піперацилін/тазобактам, дорівнюючи за активністю амікацину та іміпенему. Активність цефалоспоринів IV покоління щодо стафілококів порівняна з такою цефалоспоринів І і ІІ поколінь і перевищує цефалоспорини ІІІ покоління. Цефпіром і цефепім високоактивні щодо невмококів, у ттому числі штамів зі зниженою чутливістю до пеніцилінів. Щодо дії на грампозитивні бактерії то цефпіром помірно перевищує цефепім. Антимікробний спектр цефпірому як представника цефалоспоринів IV покоління представлено в таблиці 2.
Цефепім і цефпіром у незначному ступені зв’язуються з білками плазми і добре проникають у тканини і рідини організму, при цьому концентрації препаратів у тканинах легенів, шкіри, підшкірної клітковини, асцитичній рідині перевищують мінімальну пригнічувальну концентрацію основних збудників цих інфекцій (табл. 3).
До тяжких бактеріальних інфекцій слід віднести не лише захворювання з тяжкими клінічними проявами, а й хронічні інфекції різного генезу, що важко піддаються терапії та перебігають на фоні імунодефіциту, нейтропенії, тяжкої супутньої патології неінфекційного генезу. Тяжкі бактеріальні інфекції охоплюють велику групу захворювань різної етіології. Залежно від збудників, особливостей патогенезу і характеру перебігу патологічного процесу тяжкі бактеріальні інфекції можна розподілити на такі групи [6].
Хронічні інфекції різної локалізації з тривалим перебігом, що вимагають комбінованої антибактеріальної терапії, викликані облігатними (часто внутріклітинними) патогенами (наприклад, бруцельоз, мікобактеріози) чи умовно патогенними бактеріями, у тому числі збудниками з внутріклітинною локалізацією (наприклад хламідії). Тривалий перебіг, труднощі впливу на збудника при внутріклітинній локалізації, розвиток інфекції на фоні імунодефіциту і супутніх недуг визначають особливу тяжкість цієї інфекційної патології.
Особливу складність лікування представляють інфекції у відділеннях інтенсивної терапії, реанімаційних відділеннях та у хворих з нейтропенією. Складності лікування шпитальних інфекцій пов’язані з особливостями збудників інфекцій, що нерідко мають резистентність до численних актибактеріальних препаратів. До таких «складних» і «проб лемних» збудників відносять, передусім, Staphylococcus aureus і коагулазонегативні стафілококи (здебільшого Staphylococcus epidermidis), у тому числі штами, резистентні до метициліну, множинно резистентні ентерококи (Enterococcus faecalis і E. faecium), а також пеніцилінрезистентні пневмококи (Streptococcus pneumoniae). Серед грамнегативних мікроорганізмів слід виділити синьогнійну паличку (Pseudomonas aeruginosa) та інші псевдомонади (Pseudomonas spp.), групу ентеробактерій – Enterobacter cloacae, Klebsiella pneumoniae, Serratia spp., продукуючих β -лактамази розширеного спектра і резистентних до цефалоспоринів ІІІ покоління, Stenotrophomonas maltophilia, що викликає гідроліз більшості β-лактамних антибіотиків, зокрема карбапенемів. Ці мікроорганізми є частими збудниками госпітальних інфекцій різної локалізації (пневмонії, перитоніт, ранева інфекція, менінгіт, септичні стани, інфекційні процеси при імунодефіцитах, цукровому діабеті тощо). Тому пошук нових антибактеріальних засобів з розширеним спектром дії для лікування хворих з тяжкими інфекціями стає актуальним завданням сучасної хіміотерапії.
Раціональний вибір стартового цефалоспорину для лікування інфекцій верхніх і нижніх дихальних шляхів визначається насамперед імовірністю етіологічної ролі того чи іншого мікроорганізму в конкретній клінічній ситуації [6, 7]. Такий підхід вимагає від практичного лікаря (а саме від нього залежить адекватний вибір препарату) вміння виявляти особливості кожного випадку пневмонії (епідеміологічний стан, фонову патологію, чинники ризику тощо) і орієнтування в антимікробному спектрі антибіотика, що призначається. Проте в клінічній практиці при виборі цефалоспорину, як, зрештою, й інших антибактеріальних препаратів, необхідно враховувати разом з орієнтовною етіологією бронхолегеневого захворювання й інші фактори. Серед них неабияке значення мають фармакокінетика і фармакодинаміка препарату, наявність різних лікарських форм, ризик розвитку побічних ефектів, сумісність з іншими препаратами, вартість, доступність тощо.
Цефалоспорини IV покоління застосовуються в клінічній практиці вже майже 15 років, за цей період було проведено велику кількість порівняльних досліджень ефективності даних препаратів за різних інфекцій, головним чином, госпітальних. Аналіз результатів клінічних випробувань цефпірому і цефепіму представлено у фундаментальних оглядах L. Barradell, H. Bryson [12], H. Giamarellou [16], Norrby S.R [20].
Цефпіром продемонстрував високу ефективність, що перевищує 80%, при різних госпітальних інфекціях – пневмоніях, інфекціях шкіри і підшкірної клітковини, інтраабдомінальних, гінекологічних, урологічних, септичних станах.
За узагальнюючими даними клінічна ефективність цефпірому і цефепіму при негоспітальній пневмонії тяжкого ступеня перевищувала 90% [8, 12, 17]. Високий клінічний ефект цих препаратів спостерігався при особливо тяжких інфекціях у стаціонарі – у відділеннях інтенсивної терапії, онкогематологічних відділеннях, у хворих з нейтропенією у стані гарячки.
У порівняльних дослідженнях цефпіром продемонстрував подібну клінічну ефективність з цефалоспоринами ІІІ покоління – цефотаксимом, цефтріаксоном і цефтазидимом, при цьому позитивний бактеріологічний ефект у разі застосування цефалоспорину IV покоління був суттєво вищим, ніж при використанні цефалоспоринів ІІІ покоління [17].
У двох дослідженнях вивчено порівняльну ефективність цефпірому і цефепіму з іміпенемом: при інфекціях шкіри і підшкірної клітковини клінічний ефект при застосуванні цефпірому і іміпенему будо досягнуто у 95% і 98% хворих відповідно [8], при ускладнених інтраабдомінальних інфекціях клінічна і бактеріологічна ефективність цефалоспоринів IV покоління і метронідазолу виявилася вищою, ніж при застосуванні іміпенему (88% проти 76%) [13]. У багатоцентровому дослідженні, проведеному в Росії в 6 клінічних установах у 111 хворих з різними шпитальними інфекціями, відмічена висока клінічна і бактеріологічна ефективність цефпірому, яка при інфекціях нижніх дихальних шляхів становила 91% і 88%, при інфекціях сечовивідних шляхів – 90% і 95%, при хірургічних інфекціях шкіри і м’яких тканин – 96% і 80% [9, 10].
Ще одне російське дослідження продемонструвало високу ефективність цефпірому в лікуванні пневмоній на фоні муковісцидозу і бронхоектатичної хвороби [7]. В усіх випадках призначенню цеф пірому передувало тривале (10–14 днів) і неефективне лікування різними антибіотиками. Причинними факторами пневмоній у цих пацієнтів були S.pneumoniae, H.influenze, S.epidermidis, Neisseria, K.pneumoniae, Ps.aeruginosa, S.aureus, Str.viridans та полімікрофлора, чутлива до цефпірому. Клінічний і бактеріологічний ефект було досягнуто відповідно у 96% і 93% хворих. У всіх пацієнтів з ідентифікованою синьогнійною інфекцією досягнуто повної елімінації збудника. Лікування виявилося неефективним лише у 2-х (4,5%) пацієнтів, що зумовлено виявленням нечутливої полірезистентної мікрофлори і швидким розвитком абсцедування ще до етапу призначення цефалоспорину IV покоління.
З огляду на швидкий розвиток резистентності Ps.aeruginosa до існуючих антибіотиків, у тому числі цефалоспоринів ІІІ покоління з визначеною антисиньогнійною активністю, застосування цефпірому спричинило виражений бактеріологічний ефект. Тому автори роблять висновок, що саме цефпірому притаманні привабливі властивості порівняно з іншими цефалоспоринами. Висока активність щодо найбільш «агресивних» збудників внутрішньолікарняних інфекцій дозволяє визначити цефпіром як антибіотик широкого спектра дії і призначати його без попереднього бактеріологічного обстеження у разі серйозних інфекцій. А фармакологічні властивості цефпірому, такі як тропність до легеневої тканини, здатність нагромаджуватися в мокротинні, слизовій оболонці бронхів і легеневій паренхімі [22], дозволяють рекомендувати цефпіром як один із найбільш дієвих антибіотиків у лікуванні тяжких інфекцій нижніх дихальних шляхів.
Цефпіром і цефепім характеризуються гарною переносимстю навіть при лікуванні хворих у тяжких клінічних ситуаціях. Аналіз результатів контрольованих досліджень продемонстрував, що частота небажаних явищ при застосуванні цих препаратів не перевищує таку при використанні інших цефалоспоринових антибіотиків [8, 19].
Отже, до найважливіших особливостей цефалоспоринів IV покоління, що визначають галузь їх застосування, належать:
• широкий спектр антимікробної активності (порівняно з цефалоспоринами ІІІ покоління);
• стабільність до різних β -лактамаз;
• активність щодо численних штамів грамнегативних бактерій, резистентних до цефалоспоринів ІІІ покоління;
• добре проникнення препаратів у тканини, змінені внаслідок запалення, та утримання в них бактерицидних концентрацій упродовж 12 годин;
• зручність дозування (введення кожні 12 годин);
• добра переносимість і відсутність токсичності;
• клінічна і бактеріологічна ефективність, доведена в численних клінічних випробуваннях.
Усі вказані властивості цефпірому і цефепіму пояснюють їх виключно високу клінічну ефективність у режимі монотерапії в лікуванні різних негоспітальних і госпітальних, зокрема – особливо тяжких інфекцій.
Характеризуючи можливі перспективи клінічного застосування цефалоспоринів IV покоління при нозокоміальних інфекціях нижніх дихальних шляхів, слід особливо наголосити на пріоритеті антибактеріальної активності представників цієї групи: метицилінчутливі стафілококи, стрептококи, включаючи більшість пеніцилінстійких штамів пневмокока, родина Enterobacteriaceae, синьогнійна паличка і низка інших грамнегативних нозокоміальних патогенів [2]. Численні рандомізовані клінічні дослідження довели високу ефективність цефалоспоринів IV покоління, що дозволяє розглядати їх в одному ряду з інгібітор-захищеними β -лактамами широкого спектра дії, β -лактамами з протисиньогнійною активністю, карбапенемами і ципрофлоксацином [14].
Оцінюючи місце у клінічній практиці цефпірому як цефалоспорину IV покоління, необхідно підкреслити такі позиції. Цефалоспорини IV покоління показані для емпіричної терапії серйозних госпітальних інфекцій, враховуючи широкий протимікробний спектр цефпірому і невисокий рівень резистетності мікрофлори до цього препарату. До цього списку можна віднести пневмонії тяжкого перебігу, особливо у пацієнтів похилого віку [5], зі зниженим імунітетом, а також вентилятор-асоційовані пневмонії [7], сепсис, викликаний грамнегативною мікрофлорою, інтраабдомінальні і гінекологічні інфекції [3], інфекції у реанімаційних відділеннях і відділеннях інтенсивної терапії, супутні інфекції в онкологічних пацієнтів, інфекції м’яких тканин при цукровому діабеті [4], інфекції у хворих з лихоманкою на фоні нейтропенії чи агранулоцитозу (у режимі поєднаної терапії) [6].
Інший напрям застосування цефпірому пов’язаний зі встановленням високого рівня резистентності до цефалоспоринів ІІІ покоління грамнегативних бак-терій, передусім Enterobacter spp., Serratia marces-cens, а також інших Enterobaсteriaceae. У цьому ви-падку необхідна заміна в лікарняних формулярах цефалоспоринів ІІІ покоління, що використовуються як антибактеріальний препарат 1-го ряду емпіричної терапії, на цефалоспорини IV покоління, насам-перед – у відділеннях реанімації, інтенсивної тера-пії, у гематологічних стаціонарах [10]. Перевагою цефалоспоринів IV покоління є також те, що вони можуть застосовуватися в режимі монотерапії, на-віть за умов тяжких інфекцій. Вийнятком пацієнти з нейтропеніями і змішаними аеробно-анаеробними інфекціями.
Сьогодні на українському ринку відсутній оригіналь-ний препарат цефпірому «Кейтен» і наявний лише єдиний представник – препарат «Цефпіром» («Авант»), який продемонстрував високу ефективність і безпечність у численних дослідженнях і бага-тьох клінічних ситуаціях.
Отже, цефалоспорини IV покоління є високоефективними і перспективними препаратами для лікування госпітальних і тяжких інфекцій, зокрема викликаних мультирезистентними мікроорганізмами, що можуть застосовуватися у режимі монотерапії, і тому раціональним уявляється більш широке впровадження цих препаратів у клінічну практику.
Література
1. Антибактериальная терапия. Практ. Руководство / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – М., 2000.
2. Богомолова Н.С., Орешкина Т.Д., Большаков Л.В. Перспективы использования нового цефалоспоринового антибиотика четвертого поколения в хирургии // Антибиотики и химиотерапия. – 2003. – Т. 48, №5. – С. 1–7.
3. Ващук В.В., Бутирський О.Г., Мельников В.А. та ін. Застосування цефалоспоринів IV покоління в лікуванні хірургічних інфекцій м’яких тканин // Вісн. УМСА. – 2007. – Т. 7, вип. 1–2. – С. 198–199.
4. Краснов О.Г. Антибактеріальна терапія у хворих з гнійнонекротичними ураженнями «діабетичної ступні» // Вісн. УМСА. – 2007. – Т. 7, вип. 1–2. – С. 229–231.
5. Лукьянов С.В. Рациональный выбор цефалоспоринов при лечении инфекционно-воспалительных заболеваний // Тихоокеанский мед. журн. – 2006. – №1. – С. 11–13.
6. Падейская Е.Н. Новые антимикробные препараты в лечении тяжелых бактериальных инфекций // Качественная клин. практика. – 2004. – №1. – С. 73–88.
7. Соколов А.С., Апульцина И.Д., Авдеев С.Н. и др. Цефпиром в лечении инфекций нижних дыхательных путей // Пульмонол. – 1997. – №1. – С. 43–49.
8. Яковлев В.П., Яковлев С.В. Цефпиром: антиби-отик группы цефалоспоринов четвертого поколения. – М.: Фармарус, 1997. – 112 с.
9. Яковлев С.В., Дворецкий Л.И., Шахова Т.В., Еремина Л.В. Цефпиром – цефалоспориновый антибиотик IV поколения для лечения тяжелых госпитальных инфекций // Антибиотики и химиотерапия. – 1996. – Т. 41, №12. – С. 34–39.
10. Яковлев С.В. Когда нужны цефалоспорины четвертого поколения? // Антибиотики и химиотерапия. – 1999. – №11. – С. 4–6.
11. Baldwin D.R. The penetration of the fourth generation parenteral cephalosporins // J. Chemother. – 1996. – Vol. 8 (Suppl. 2). – P. 71–82.
12. Barradell L.B., Bryson H.M. Cefepime. A review of its antibacterial activity, pharmacokinetic properties and therapeutic use // Drugs. – 1994. – Vol. 47. – P. 471–505.
13. Barie P.S., Vogel S.B., Dellinger E.P. et al. A ran-domized double-blind clinical trial comparing cefe-pime plus metronidazole with imipenemcilastatin in the treatment of complicated intraabdominal infec-tions // Arch. Surg. – 1997. – Vol. 132. – P. 1294–1302.
14. Beaucaire G. Clinical activity of cefepime in severe infections // Clin. Microbiol. Inf. – 1999. – Vol. 5. – P. 6–14.
15. Craig W.A. The pharmacokinetics of cefpirome: rationale for a twelve-hour dosing regimen // Scand. J. Inf. Dis. – 1993. – Suppl. 91. – P. 33–40.
16. Giamarellou H. Clinical expirience with the fourth generation cephalosporins // J. Chemother. – 1996. – Vol. 8 (Suppl. 2). – P. 91–104.
17. Hafeez S., Izhar M. In vitro antimicrobial activity of Cefpirome: a new fourth-generation cephalosporin against clinically significant bacteria // J. Pak. Med. Assoc. – 2000. – Vol. 50, №8. – P. 250–252.
18. Laws A., Page M. The chemistry and structureac-tivity relationships of C3-quaternary ammonium cephem antibiotics // J. Chemother. – 1996. – Vol. 8 (Suppl. 2). – P. 7–22.
19. Neu H.C. Infection problems of the 90’s – do we have an answer? // Scand. J. Inf. Dis. – 1993. – Vol. 91. – P. 7–13.
20. Norrby S.R. Cefpirome: efficacy in the treatment of urinary and respiratory tract infections and safety profile // Scand. J. Inf. Dis. – 1993. – Suppl. 91. – P. 41–50.
21. Piriti P. Introduction: cephalosporin generations // J. Chemother. – 1996. – Vol. 8 (Suppl. 2). – P. 3–6.
22. Roos J.F., Lipman J., Kirkpatrick C.M. Population pharmacokinetics and pharmacodynamics of cefpi-rome in critically ill patients against Gramnegative bacteria // Intens. Care Med. – 2007. – Vol. 33, №5. – P. 781–788.
23. Strenkoski L.C., Nix D.E. Cefpirome clinical phar-macokinetics // Clin. Pharmacokinet. – 1993. – Vol. 25, №4. – P. 263–273.











Комментировать