Эффективность нестероидных противовоспалительных средств. Нимесулид как привлекательный вариант для лечения пациентов с ревматологическими заболеваниями.
Эффективность нестероидных противовоспалительных средств. Нимесулид как привлекательный вариант для лечения пациентов с ревматологическими заболеваниями.
Franco Dallegri and Luciano Ottonello Первая клиника внутренних болезней, Медицинский факультет Университета Генуи, Генуя, Италия.
Резюме
Несмотря на то, что эффективность нестероидных противовоспалительных средств (НПВС) в качестве противовоспалительных, обезболивающих и жаропонижающих средств хорошо изучена, открытым остается вопрос о том, могут ли их различные фармакокинетические и фармакодинамические характеристики оказывать разное клиническое влияние при лечении пациентов с ревматологическими заболеваниями.
Механизм, обуславливающий противовоспалительную активность этих препаратов, преимущественно связан с ингибированием второй изоформы циклооксигеназы (ЦОГ-2), в то время как ингибирование первой изоформы ЦОГ обуславливает побочные эффекты этих препаратов. Однако противовоспалительное и обезболивающее действие некоторых представителей класса НПВС осуществляется за счет дополнительных механизмов.
Действие нестероидного противовоспалительного препарата нимесулида, обладающего преимущественной активностью в отношении ЦОГ-2 и коротким периодом полувыведения, который коррелирует с быстрым началом обезболивающего действия, также связано с не зависящими от ЦОГ-2 механизмами, которые вносят вклад в его противовоспалительное и обезболивающее действие.
Механизмы действия нимесулида включают ингибирование высвобождения фактора некроза опухолей альфа (ФНО-α), гистамина, образования активных форм кислорода и предупреждение гибели хондроцитов. Более того, при применении нимесулида наблюдалось уменьшение уровня металлопротеаз матрикса и других биомаркеров разрушения суставов, что позволяет говорить о наличии у препарата защитного действия в отношении прогрессирования заболевания.
В связи с многофакторным механизмом действия, а также быстрым развитием обезболивающего эффекта, нимесулид представляет собой привлекательный вариант для лечения пациентов с ревматологическими заболеваниями.
Введение
Эффективность нестероидных противовоспалительных средств (НПВС) является общепризнанной. Все препараты группы НПВС обладают противовоспалительной, обезболивающей и жаропонижающей активностью. Однако входящие в ее состав вещества относятся к различным химическим классам и могут обладать разными фармакокинетическими и, в некоторой степени, фармакодинамическими свойствами. Это вызывает вопросы о клинической значимости различий между отдельными представителями класса НПВС и необходимости учитывать возможные различия между препаратами при выборе НПВС для облегчения боли и воспаления у пациентов с ревматологическими заболеваниями.
Комплексный систематический обзор клинической эффективности НПВС показал, что различные препараты данной группы обладают примерно схожей терапевтической активностью [=1]. Однако, другие данные позволяют предполагать, что различия фармакологических профилей НПВС могут оказывать влияние на их эффективность у пациентов с ревматологическими заболеваниями. В данном документе будет исследованы такие различия, и особое внимание будет уделяться НПВС нимесулиду.
Фармакологические свойства нестероидных противовоспалительных средств
Ингибирование синтеза простагландинов.
В начале 70-х годов Vane[=2] отметил, что аспирин и аналогичные ему препараты обладают способностью ингибировать биосинтез группы липидных медиаторов, известных как простагладины, путем ингибирования ответственного за их синтез фермента циклооксигеназы (ЦОГ). По-видимому, такая ингибирующая активность лежала в основе противовоспалительного действия этих препаратов. Лишь 20 лет спустя стало известно, что за синтез простагландинов отвечают две изоформы циклооксигеназы, ЦОГ-1 и ЦОГ-2, и что НПВС различаются по селективности в отношении разных изоформ ЦОГ[3]. ЦОГ-1 отвечает в основном за синтез простагландинов, участвующих в процессах гомеостаза в жизненно важных органах, например, в желудке, и ингибирование ЦОГ-1 можеть быть ответственно за хорошо известные желудочно-кишечные побочные эффекты традиционных НПВС. ЦОГ-2 участвует в синтезе воспалительных простагландинов, и ингибирование этой изоформы обеспечивает терапевтический противовоспалительный эффект НПВС.[4-6] Неселективные НПВС ингибируют как ЦОГ-1, так и ЦОГ-2 путем обратимого или необратимого связывания с ферментом. Большинство токсических эффектов этих препаратов является результатом их способности блокировать синтез физиологических простагландинов, необходимых для обеспечения гомеостаза в почках, желудке и тромбоцитах за счет ингибирования ЦОГ-1.
После более подробного исследования механизмов развития токсических реакций, связанных с НПВС, стало очевидно, что на безопасность этих препаратов может влиять большое число разнообразных факторов. Появление на рынке в конце 90-х годов селективных ингибиторов ЦОГ-2 (коксибов) было связано с ожиданием того, что эти препараты обеспечат необходимую клиническую эффективность при более низкой желудочно-кишечной токсичности[4-6]. Однако полученные недавно доказательства того, что применение селективных ингибиторов ЦОГ-2 сопровождается увеличением частоты тромбоэмболических осложнений [= 7-11] привело к выводу с рынка во всем мире таких препаратов как рофекоксиб и валдекоксиб, последний из которых также вызывал обеспокоенность в связи с развитием кожных реакций[7-9]. В поддержку этих результатов может говорить тот факт, что блокирование опосредованного ЦОГ-2 синтеза простациклинов устраняет их защитные эффекты в отношении тромбогенеза, гипертензии и атерогенеза in vivo,[=4] хотя обсуждение этой проблемы еще продолжается. Таким образом, ожидаемые преимущества селективных ингибиторов ЦОГ-2 могут быть сведены на нет их возможной более высокой по сравнению с другими НПВС кардиотоксичностью.[4-6]
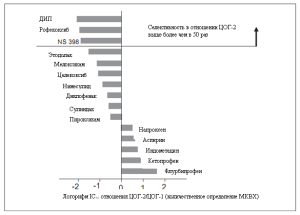
Степень селективности в отношении изоформ ЦОГ остается одним из основных способов дифференцирования между различными представителями НПВС (см. Рисунок 1).[= 3,12] Селективность в отношении ЦОГ вытекает из химической структуры НПВС.[13] Аминокислотная структура ЦОГ-1 и ЦОГ-2 является высококонсервативной, однако рентгеновские кристаллографические исследования ЦОГ показали, что канал, содержащий активную область связывания с НПВС у ЦОГ-2 позволяет связываться с большим количеством субстратов, чем центр связывания ЦОГ-1. Этот активный канал является гидрофобным, при этом у ЦОГ-2 замещение валином изолейцина в 523 положении аминокислоты позволяет открыть боковой гидрофильный карман, который у ЦОГ-1 закрыт изолейцином. Например, неселективный НПВС флурбипрофен взаимодействует с ЦОГ-1 посредством связывания фенильной группы с гидрофобным каналом и карбоксильной группы с аргинином в 120 положении. Взаимодействие флурбипрофена с ЦОГ-2 сходно с вышеописанным, однако, связываясь с аргинином в 120 положении, карбоксильная группа блокирует активный центр ЦОГ-2, не позволяя ему связываться с субстратом. Наоборот, селективные ингибиторы ЦОГ-2 не могут войти в активный канал ЦОГ-1 и не имеют карбоксильной группы для связывания с аргинином в 120 положении. Нимесулид представляет собой уникальную молекулу среди всех НПВС, являясь единственным представителем класса сульфонанилидов.
По степени селективности в отношении изоформ ЦОГ нимесулид должен быть отнесен к препаратам, ингибирующим преимущественно ЦОГ-2, активность которых в отношении ЦОГ-2 в 5-50 раз превосходит активность в отношении ЦОГ-1.[3] В исследованиях in vivo при применении нимесулида в терапевтической дозе (100 мг 2 раза в сутки) было продемонстрировано значительное снижение концентрации простагландина E2 в плазме крови. Оценка индуцированной активности ЦОГ-1 показала, что нимесулид не оказывает влияния на агрегацию тромбоцитов. Также препарат не оказывает влияния на образование в желудке простагландина E2 и простагландина I2, которое также зависит от ЦОГ-1.[14]
Рисунок 1 Селективность нестероидных противовоспалительных препаратов в отношении циклооксигеназы -1 и -2. ЦОГ = циклооксигеназа; ДИП = диизопропил; МКВХ = модифицированная методика количественного определения в цельной крови человека по Уильяму Харви. Воспроизводится по данным Warner et al.,[3] с разрешения.
Фармакокинетический профіль
Фармакокинетические параметры различных НПВС существенно отличаются друг от друга. На основании периода полувыведения, НПВС могут быть разделены на две большие группы: с коротким периодом полувыведения (менее 6 часов) и с длительным периодом полувыведения (более 10 часов).[15] Группа НПВС с коротким периодом полувыведения включает аспирин, диклофенак, ибупрофен, флурбипрофен, индометацин, лумиракоксиб и нимесулид,[=15-19] тогда как группа препаратов с длительным периодом полувыведения включает целекоксиб, напроксен, сулиндак, рофекоксиб, оксапрозин, пироксикам.[15-19] Поскольку достижение равновесной концентрацияипрепаратов в плазме крови происходит после его применения в течение периода, превосходящего период полувыведения в 3-5 раз, достижение пиковой концентрации в плазме крови и максимального клинического эффекта НПВС с коротким периодом полувыведения происходит быстрее, чем препаратов с длительным периодом полувыведения.[15,20]
Нимесулид: фармакологический профіль
У пациентов с острым артритом действие нимесулида характеризуется быстрым началом, с ранним ингибированием образования простагландина E2, выбранного в качестве маркера активности ЦОГ-2.[= 21] Клинические доказательства быстрого начала действия нимесулида были получены в исследованиях у пациентов с остеоартритом коленных суставов, у которых нимесулид вызывал значимо более быстрое облегчение болей, связанных с ходьбой, чем целекоксиб и рофекоксиб, с началом обезболивающего действия через 15 минут после приема нимесулида.[= 22] Кроме того, недавно полученные данные показали, что эффективные концентрации нимесулида в плазме крови и синовиальной жидкости обнаруживаются уже через 30 минут после его приема.[= 23] Эти характеристики убедительно доказывают быстрое обезболивающее действие данного препарата.
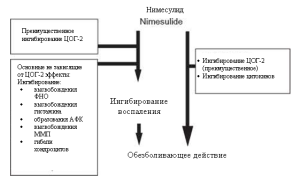
НПВС также могут обладать противовоспалительными свойствами, не зависящими от ЦОГ.[= 20] Было показано, что помимо периферического ингибирующего воздействия на ЦОГ, вносящего вклад в противовоспалительные и обезболивающие свойства нимесулида, это вещество может действовать и за счет нескольких других, не зависящих от ЦОГ механизмов.[24] Эти механизмы включают ингибирование высвобождения фактора некроза опухолей (ФНО), гистамина, образования активных форм кислорода (АФК), высвобождения матриксных металлопротеаз (ММП) и гибели хондроцитов (см. Рисунок 2).
Рисунок 2 Многофакторный механизм действия нимесулида. ЦОГ = циклооксигеназа, ММП = металлопротеазы; АФК = активные формы кислорода; ФНО = фактор некроза опухолей.
Влияние нимесулида на медиаторы воспаления.
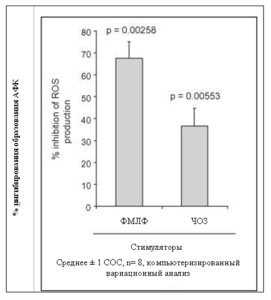
Считается, что ФНО-α играет ведущую роль в функциональной и временной иерархии биологических явлений воспалительного процесса, что делает его идеальной терапевтической целью при ревматоидном артрите. В доклинических исследованиях на крысах, которым вводили липополисахариды для увеличения уровня ФНО-α, нимесулид эффективно ингибировал высвобождение ФНО-α.[25] Выработка фагоцитами супероксида и высвобождение лактоферрина из нейтрофилов было исследовано у восьми добровольцев до и после приема нимесулида внутрь.[26] Фактор хемотаксиса Nформил-метионил-лейцил-фенилаланин и частицы опсонизированного зимозана были использованы в качестве активирующих стимулов. Нимесулид значимо ингибировал образование АФК Nформил-метионил-лейцил-фенилаланином и активированными за счет воздействия опсонизированных частиц зимозана фагоцитами (ингибирование до 67,6% и 36,8%, соответственно, см Рисунок 3).[26] Он не оказывал влияния на высвобождение лактоферрина нейтрофилами, что позволяет предполагать, что нимесулид не оказывает влияния на механизмы, задействованные в экзоцитозе специфичных гранул.
Для предупреждения повреждения тканей в ходе воспалительной реакции требуется поддержание баланса между протеиназами (преимущественно эластазами, выделяемыми мигрировавшими в очаг нейтрофилами) и антипротеазами (в основном эластаз-специфическим альфа-1-ингибитором протеиназ; A1PI).[27] Нейтрофильные клетки способны инактивировать A1PI с помощью серии окислительных реакций с участием хлорноватистой кислоты, что позволяет эластазе свободно разрушать соединительную ткань. Возможным способом регулирования активности нейтрофильной эластазы является фармакологическая защита A1PI от окислительной инактивации под действием хлорноватистой кислоты нейтрофилов. В доклинических исследованиях[27] нимесулид предотвращал инактивацию A1PI под действием выделяемой нейтрофилами хлорноватистой кислоты, позволяя тем самым осуществлять опосредованный A1PI контроль гистотоксической функции эластазы. Эти данные позволяют предполагать, что защитное влияние нимесулида на A1PI может вносить вклад в его противовоспалительное действие.
Рисунок 3 Влияние нимесулида на образование активных форм кислорода фагоцитами у здоровых добровольцев. ФМЛФ = N-формил-метионил-лейцил-фенилаланин; ЧОЗ = частицы опсонизированного зимозана; АФК = активные формы кислорода; СОС = стандартная ошибка среднего. По материалам Ottonello et al.,[26] с разрешения.
Рисунок 4 Влияние нимесулида на высвобождение гистамина и бронхоспазм у морских свинок. СОС = стандартная ошибка среднего. По материалам Rossoni et al.,[281 с разрешения.
В другом исследовании на морских свинках,[28] нимесулид дозозависимо блокировал высвобождение гистамина и развитие бронхоспазма (см. Рисунок 4). Морским свинкам предварительно вводили нимесулид или индометацин, после чего ацетальдегидом провоцировали выброс гистамина и бронхоспазм. В контрольной группе, получавшей только ацетальдегид, концентрация гистамина в крови была равна 195 ± 12 мг/л, в группе получавшей нимесулид при использовании дозы 0,1 мг/кг она была равна 154 ± 10 мг/л (p < 0,05 по сравнению с контрольной группой), дозы 0,3 мг/кг – 116 ± 13 мг/л (p < 0,01 по сравнению с контрольной группой), 63 ± 8 мг/л при использовании дозы 1 мг/кг (p <0,01 по сравнению с контрольной группой) и 222 ± 16 мг/л у животных, получавших индометацин в дозе 1 мг/кг. Такое дозозависимое снижение концентрации циркулирующего в крови гистамина сопровождалось дозозависимым защитным действием в отношении индуцированного ацетальдегидом бронхоспазма. Среднее сужение бронхов (измеряемое путем определения внутритрахеального давления, выраженного в процентах от максимального избыточного объема) в контрольной группе было равно 58%, в группе нимесулида для дозы 0,1 мг/кг его величина составляла 42% (p < 0,05 по сравнению с контрольной группой), 28% для дозы 0,3 мг/кг (p < 0,01 по сравнению с контрольной группой), 15% для дозы 1 мг/кг (p < 0,01 по сравнению с контрольной группой) и 62% для животных, получавших индометацин в дозе 1 мг/кг. В то время как индометацин не вызывал уменьшения концентрации гистамина и не предупреждал развития бронхоспазма, нимесулид оказывал дозозависимое бронхопротекторное действие и обеспечивал уменьшение уровеня гистамина в крови. Это наблюдение может иметь терапевтическое значение для пациентов с воспалительным процессом в дыхательных путях и аллергическим бронхоспазмом в анамнезе.[28]
Влияние нимесулида на костную и хрящевую ткань
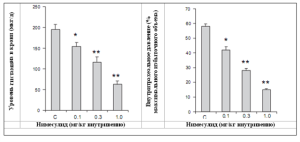
При остеоартрите ММП-1, ММП-8 и ММП-13 играют ведущую роль в деградации коллагена второго типа, фрагменты которого в дальнейшем разрушаются ММП-3.[29,30] У пациентов с остеоартритомнимесулид вызывал снижение сывороточной концентрации ММП.[31] В этом открытом пилотном исследовании 20 пациентов с остеоартритом коленных или тазобедренных суставов с выраженными болями получали нимесулид в дозе 100 мг 2 раза в сутки в течение 3 недель, при этом 22 здоровых добровольца (контрольная группа) лечения не получали. Помимо отмечавшегося в сравнении с контрольной группой уменьшения болей, терапия нимесулидом позволяла значимо степени уменьшить средних сывороточных концентраций ММП-3 (от исходной 21,1 нг/мл до 14,7 нг/мл; p<0,01) и ММП-8 (от 14,5 нг/мл до 10,0 нг/мл; p<0,05). Таким образом, нимесулид может блокировать разрушение межклеточного вещества за счет снижения концентраций ММП-8 и ММП-3.
Помимо этого, нимесулид в большей степени, чем ибупрофен снижал уровень С-телопептида коллагена II типа (CTX-II) в моче и уровни гиалуронана (HA), ММП-3 и ММП-13 у пациентов с обострением остеоартрита.[32] Гиалуронан является маркером воспаления синовиальных оболочек, а CTX-II является маркером деградации коллагена хряща, известно, что оба этих вещества являются неблагоприятными прогностическими факторами при остеоартрите. В рандомизированном, проспективном простом слепом исследовании 90 пациентов получали нимесулид в дозе 100 мг 2 раза в сутки (n = 45) или ибупрофен замедленного высвобождения по 800 мг 2 раза в сутки (n = 45) в течение 4 недель. К моменту окончания лечения в группе нимесулида было отмечено значимое снижение средней сывороточной концентрации гиалуронана (с 59 до 42 нг/мл; p < 0,05), в группе ибупрофена снижение было незначимым (с 62 до 52 нг/мл). Аналогично, средний уровень CTX-II в моче был значимо снижен в группе нимесулида (с 0,42 до 0,31 мг/моль креатинина; p < 0,001), но не в группе ибупрофена (с 0,42 до 0,38 мг/моль креатинина). Также нимесулид вызывал значимое снижение сывороточных концентраций ММП-3 (с 37 до 27 нг/мл; p < 0,05) и ММП-13 (с 92 до 58 пг/мл; p <0,001), в то время как в группе ибупрофена значимого влияния на эти показатели не отмечалось. Кроме того, наблюдалась выраженная корреляция между отмеченным в группе нимесулида снижением концентраций CTX-II со снижением концентраций гиалуронана и ММП-13.
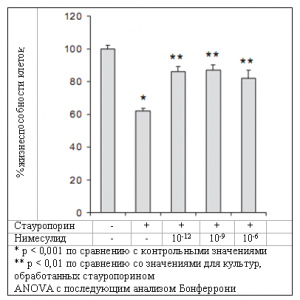
Следует отметить, что нимесулид при остеоартрозе может оказывать защитное действие путем предупреждения апоптоза хондроцитов (клеток, ответственных за восстановление хряща).[33] Для оценки влияния различных НПВС на хондроциты клеточная линия хондроцитов была подвергнута воздействию стауроспорина для индуцирования апоптоза. Культуры были предварительно обработаны нимесулидом, ибупрофеном и селективным ингибитором ЦОГ-2 NS 398. Через 4 часа индуцированный стауроспорином апоптоз был значимо менее выражен в хондроцитах, предварительно обработанных нимесулидом (см. Рисунок 5) или ибупрофеном, эффект носил дозозависимый характер (10-12 – 10-6моль/л). Однако NS 398 не оказывал такого защитного действия. Гибель клеток, повидимому, связана с изменением экспрессии гена BCL-2 и активацией каспазы-3. Исходя из полученных результатов, можно предполагать, что нимесулид может оказывать защитное действие при остеоартрозе посредством ЦОГ-независимых механизмов, например, ингибирования апоптоза хондроцитов.
Рисунок 5. Защитное действие нимесулида в отношении вызванного стауроспорином апоптоза хондроцитов. ANOVA вариационный анализ. Воспроизводится по данным Mukherjee et al.,[33] с разрешения. + и – представляют наличие или отсутствие указанного агента, т.е. стауропорина и нимесулида.
Все эти исследования демонстрируют, что многофакторные механизмы действия нимесулида, не связанные с ингибированием фермента ЦОГ-2, могут оказывать благоприятное влияние на прогрессирование болезни у пациентов с ревматологическими заболеваниями.
Заключение
Существуют различия между препаратами группы НПВС, особенно в области их фармакокинетических и фармакодинамических свойств. Терапевтический эффект этих препаратов обусловлен, преимущественно, их способностью ингибировать ЦОГ-2, однако некоторые из НПВС оказывают противовоспалительное действие за счет дополнительных механизмов.
Нимесулид, препарат, оказывающий ингибирующее действие преимущественно на ЦОГ-2, обладает многофакторным механизмом действия, который включает влияние на активность металлопротеаз матрикса и других биохимических маркеров разрушения суставов, уменьшение высвобождения АФК и других токсических веществ нейтрофилами и образования провоспалительных цитокинов. Эти свойства делают нимесулид привлекательным при разработке новых стратегий лечения пациентов с ревматологическими заболеваниями.
Список литературы
1. Gotzsche PC. Musculoskeletal disorders. Non-steroidal anti-inflammatory drugs. Clin Evidence 2004;12: 1702-10
2. Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nature 1971; 231: 232-5
3. Warner TD, Giuliano F, Vojnovic I, et al. Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclooxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro analysis. Proc Natl Acad Sci USA 1999; 96: 7563-8
4. Grosser T, Fries S, FitzGerald GA. Biological basis for the cardiovascular consequences of COX-2 inhibition: therapeutic challenges and opportunities. J Clin Invest 2006; 116: 4-15
5. Mitchell JA, Warner TD. COX isoforms in the cardiovascular system: understanding the activities of nonsteroidal anti-inflammatory drugs. Nat Rev Drug Discov 2006; 5: 75-86
6. Kean WF, Buchanan WW. The use of NSAIDs in rheumatic disorders 2005: a global perspective. Inflammopharmacology 2005; 13: 343-70
7. Bombardier C, Laine L, Reicin A, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343: 1520-8
8. Bresalier RS, Sandler RS, Quan H, et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 2005; 352: 1092-102
9. Nussmeier NA, Whelton AA, Brown MT, et al. Complications of the COX-2 inhibitors parecoxib and valdecoxib after cardiac surgery. N Engl J Med 2005; 352: 1081-91
10. Ott E, Nussmeier NA, Duke PC, et al. Efficacy and safety of the cyclooxygenase 2 inhibitors parecoxib and valdecoxib in patients undergoing coronary artery bypass surgery. J Thorac Cardiovasc Surg 2003; 125: 1481-92
11. Solomon SD, McMurray JJ, Pfeffer MA, et al. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 2005; 352: 1071-80
12. Sciulli MG, Capone ML, Tacconelli S, et al. The future of traditional nonsteroidal antiinflammatory drugs and cyclooxygenase-2 inhibitors in the treatment of inflammation and pain. Pharmacol Rep 2005; 57 (Suppl): 66-85
13. Kurumbail RG, Stevens AM, Gierse JK, et al. Structural basis for selective inhibition of cyclooxygenase-2 by anti-inflammatory agents. Nature 1996; 384: 644-8
14. Shah AA, Thjodleifsson B, Murray FE, et al. Selective inhibition of COX-2 in humans is associated with less gastrointestinal injury: a comparison of nimesulide and naproxen. Gut 2001; 48: 339-46
15. Brooks PM, Day RO. Nonsteroidal antiinflammatory drugs – differences and similarities. N Engl J Med 1991; 324: 1716-25
16. Bernareggi A. Clinical pharmacokinetics of nimesulide. Clin Pharmacokinet 1998; 35: 247-74
17. Herrera JA, Gonzalez M. Comparative evaluation of the effectiveness and tolerability of nimesulide versus rofecoxib taken once a day in the treatment of patients with knee osteoarthritis. Am J Ther 2003;10: 468-72
18. Davies NM, McLachlan AJ, Day RO, et al. Clinical pharmacokinetics and pharmacodynamics of celecoxib: a selective cyclooxygenase-2 inhibitor. Clin Pharmacokinet 2000; 38: 225-42
19. Depre M, Ehrich E, Van Hecken A, et al. Pharmacokinetics, COX-2 specificity, and tolerability of supratherapeutic doses of rofecoxib in humans. Eur J Clin Pharmacol 2000; 56: 167-74
20. Bennett A, Tavares IA. COX-2 inhibitors compared and contrasted. Expert Opin Pharmacother 2001;2: 1859-76
21. Duffy T, Belton O, Bresnihan B, et al. Inhibition of PGE2 production by nimesulide compared with diclofenac in the acutely inflamed joint of patients with arthritis. Drugs 2003; 63 (Suppl 1): 31-6
22. Bianchi M, Broggini M. A randomised, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee. Drugs 2003; 63 (Suppl 1): 37-46
23. Bianchi M, Ferrario P, Balzarini P, et al. Plasma and synovial fluid concentrations of nimesulide and its main metabolite after a single or repeated oral administration in patients with knee osteoarthritis. J Int Med Res 2006; 34: 348-54
24. Rainsford KD and Members of the Consensus Report Group on Nimesulide. Nimesulide – a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin 2006; 22: 1161 -70.
25. Azab AN, Kaplanski J. A reduction of tumor necrosis factor-alpha in paw exudate of lipopolysaccharide treated rats by nimesulide. Life Sci 2001; 68: 1667-75
26. Ottonello L, Dapino P, Pastorino G, et al. Inhibition of the neutrophil oxidative response induced by the oral administration of nimesulide in normal volunteers. J Clin Lab Immunol 1992; 37: 91-6
27. Dallegri F, Ottonello L, Dapino P, et al. The anti-inflammatory drug nimesulide rescues alpha-1proteinase inhibitor from oxidative inactivation by phagocytosing neutrophils. Respiration 1992; 59: 1-4
28. Rossoni G, Berti F, Buschi A, et al. New data concerning the antianaphylactic and antihistaminic activity of nimesulide. Drugs 1993; 46 (Suppl 1): 22-8
29. Saito S, Katoh M, Masumoto M, et al. Involvement of MMP-1 and MMP-3 in collagen degradation induced by IL-1 in rabbit cartilage explant culture. Life Sci 1998; 62: PL 359-65.
30. Wu JJ, Lark MW, Chun LE, et al. Sites of stromelysin cleavage in collagen types II, IX, X, and XI of cartilage. J Biol Chem 1991; 266: 5625-8
31. Kullich WC, Niksic F, Klein G. Effect of nimesulide on metalloproteinases and matrix degradation in osteoarthritis: a pilot clinical study. Int J Clin Pract Suppl 2002: 24-9.
32. Manicourt DH, Bevilacqua M, Righini V, et al. Comparative effect of nimesulide and ibuprofen on the urinary levels of collagen type II C-telopeptide degradation products and on the serum levels of hyaluronan and matrix metalloproteinases-3 and -13 in patients with flare-up of osteoarthritis. Drugs R D 2005; 6: 261-71
33. Mukherjee P, Rachita C, Aisen PS, et al. Non-steroidal antiinflammatory drugs protect against chondrocyte apoptotic death. Clin Exp Rheumatol 2001; 19 (1 Suppl 22): S7-11












Комментировать