Преимущества ступенчатой антимикробной терапии: сокращение длительности парентерального введения противомикробного препарата, значительное уменьшению стоимости лечения, сокращение сроков пребывания больного в стационаре при сохранении высокой клинической эффективности терапии. Эффективность и безопасность ступенчатой антибиотикотерапии с использованием Цефумакса (цефуроксима) парентерально на первом этапе и Цефутила (цефуроксима аксетила) перорально на втором этапе у детей с острым бронхитом в условиях педиатрического стационара.
А.П. Волосовец, С.П. Кривопустов, О.Л. Дзюба, Н.Н. Мягкая Национальный медицинский университет им. А.А. Богомольца, г. Киев, Киевская городская детская клиническая больница №2
Резюме. Показаны преимущества ступенчатой антимикробной терапии: сокращение длительности парентерального введения противомикробного препарата, значительное уменьшению стоимости лечения, сокращение сроков пребывания больного в стационаре при сохранении высокой клинической эффективности терапии. Изучена эффективность и безопасность ступенчатой антибиотикотерапии с использованием Цефумакса (цефуроксима) парентерально на первом этапе и Цефутила (цефуроксима аксетила) перорально на втором этапе у детей с острым бронхитом в условиях педиатрического стационара. Сделан вывод о целесообразности такого подхода к лечению данного заболевания.
Введение
Острый бронхит (J20) — воспалительное заболевание бронхов, преимущественно инфекционного происхождения, проявляющееся кашлем (сухим или с выделением мокроты) и продолжающееся не более 3 недель. Чаще всего острый бронхит является одним из проявлений острого респираторного заболевания. Возможна различная его этиология — вирусной, бактериальной, грибковой, паразитарной, смешанной природы, а также острый ирритативный бронхит химической, аллергической и другой неинфекционной природы, например, токсический ожоговый.
С практической точки зрения в педиатрии важно выделять вирусный и бактериальный бронхит; наиболее частыми этиологическими причинами являются парагрипп 1–3 типов, РС-вирус, аденовирусы, грипп А,В, вирус кори, Hemophilus influenzae, Mycoplasma pneumoniae, Chlamydia pneumoniae, Bordetella pertussis, Streptococcus pneumoniae, Streptococcus pyogenes, Moraxella catarrhalis.
Во взрослой практике при обострении хронического бронхита (ХБ) безусловными лидерами являются H. influenzae, в том числе нетипируемые штаммы, H. parainfluenzae и M. catarrhalis. Острый гнойный трахеобронхит у взрослых в 50% случаев вызывает именно гемофильная палочка (С.В. Лукьянов, 2005). При этом доказано, что определение эластазы мокроты помогает отличить обострение хронического бронхита бактериальной этиологии от вирусной (Sethi S., Muscarella K., Evans N., Klingman K.L., Grant B.J.B, Murphy T.F., 2000), что способствует наиболее рациональному использованию антибиотиков при этом заболевании.
Важность Hemophilus influenzae как этиологического фактора острого бронхита (ОБ) подчеркнута тем, что в МКБ-10 выделена отдельная нозологическая группа — J20.1 острый бронхит, вызванный Haemophilus influenzae (палочкой Афанасьева—Пфейффера). H. influenzae локализуется в верхних дыхательных путях, у детей его авирулентные штамы могут выделяться из носоглотки в 30–50% случаев. При этом от 1 до 33% детей являются носителями. В целом этот возбудитель относится к роду Haemophilus, насчитывающему 16 видов, а ведущее значение в развитии различных патологических состояний имеет именно H. influenzae типа b (ХИБ). ХИБ вместе с пневмококковой инфекцией вызывают до половины случаев воспаления легких и бронхита у детей в возрасте до 5 лет. Чрезвычайно актуальна роль ХИБ в этиологии бактериального менингита, эпиглоттита и пневмонии. Стратегическим направлением ВОЗ в борьбе с ХИБ-инфекцией является вакцинация, ас 2006 г. вакцинация против ХИБ включена в Национальный календарь прививок Украины.
Также весьма интересен Кокрановский обзор Foxwell A.R., Cripps A.W. «Haemophilus influenzae oral vaccination against acute bronchitis» (Cochrane Review, 1999, Oxford), в котором показано, что прием вакцины из нетипируемых штаммов H. influenzae снижает частоту и тяжесть рецидивов бронхита.
В принципе, ОБ представляет собой острое самокупирующееся, самоизлечивающееся заболевание, обычно завершающееся полным излечением и восстановлением функций слизистой оболочки трахеобронхиального дерева. Важно консультировать ребенка и персонал, который за ним ухаживает, о необходимости поддержания адекватной гидратации, обильного питья, так как снижение гидратации ведет к повышению вязкости бронхиальной слизи и нарушает ее отхождение. Необходимо инструктировать родителей, персонал, который ухаживает за ребенком, и о важности адекватного увлажнения воздуха. Следует устранить воздействия на больного факторов окружающей среды, вызывающих кашель (дым, пыль). Питание должно соответствовать возрасту ребенка, быть обогащенным витаминами.
Ежедневно перед клиницистом стоит непростой вопрос: каковы показания к антибиотикотерапии при остром бронхите у детей, в частности в педиатрическом стационаре. В Протоколе оказания медицинской помощи детям по специальности «детская пульмонология» (приказ МЗ Украины от 13.01.2005 №18) показаниями к назначению антибиотиков при остром бронхите у детей являются следующие:
- Наличие активных хронических очагов инфекций (тонзиллит, отит и др.).
- Тяжелое течение бронхита (нейротоксикоз и др.).
- Дети первых 6-ти месяцев жизни.
- Наличие отягощенного преморбидного фона (родовая травма, недоношенность, гипотрофия и др.).
- Подозрение на наслоение бактериальной инфекции: лихорадка с температурой тела выше 39°С; вялость, отказ от пищи; выраженные симптомы интоксикации; наличие одышки; асимметрия хрипов; лейкоцитоз, ускоренная СОЭ.
Поскольку при остром заболевании обычно отсутствуют данные о возбудителе у конкретного больного, выбор препарата, прежде всего, базируется на рекомендациях эмпирической стартовой терапии с учетом возможной этиологии болезни и чувствительности возможного возбудителя в данном регионе. О правильном выборе антибиотика свидетельствует быстрое наступление эффекта лечения. Применяют препараты цефалоспоринового ряда, защищенные пенициллины и макролиды.
По данным RMBC (ГК «Ремедиум», 2008), в аптечном секторе насчитывается 355 торговых наименований системных антибиотиков, из них в госпитальном секторе — 293, а на долю антибиотиков цефалоспоринового ряда приходится 29% общего объема продаж «десятки» лидеров в аптечном секторе и более 64% — в госпитальном секторе.
В большинство международных и отечественных стандартов лечения внебольничной пневмонии и бронхита, ввиду высокой активности против пневмококков и гемофильной палочки, входят аминопенициллины и цефалоспорин ІІ поколения цефуроксим. В современном мире широкого использования антибиотиков клиницист не может не считаться с глобальной проблемой растущей антибиотикорезистентности, например имеет место глобальный рост резистентности гемофильной палочки к аминопенициллинам и котримоксазолу.
Очень важно помнить о проблеме гастроинтестинальной безопасности лекарственных средств, применяемых в детской практике. Одним из путей решения этой задачи является создание пролекарств (Prodrugs), к которым относится цефуроксима аксетил. Это пролекарство является стабильным дериватом цефуроксима для внутреннего применения, и при приеме метаболизируется в стенке кишки до активного соединения — цефуроксима. Создание пролекарств позволяет улучшить проницаемость и оральную абсорбцию препарата, защищить активное вещество от разрушения, решить вопросы кислотной чувствительности, мембранной проницаемости, токсичности, неприятного вкуса, длительности действия, обеспечить высокую скорость всасывания и минимизировать риск гастроинтестинальных побочных действий, в том числе дисбиоза кишечника и антибиотико-ассоциированной диареи.
Другая важная задача, стоящая перед современной стационарной педиатрией, — широкое внедрение схем ступенчатой антимикробной терапии, т.е. двухэтапное применение антиинфекционных препаратов близкой химической структуры с переходом от парентерального на пероральный путь введения с учетом клинического состояния пациента («sequential therapy», «streamline therapy», «step-down therapy», «switch therapy», «follow-on therapy», «deescalation therapy»). В классическом варианте суть ступенчатой антимикробной терапии заключается в том, что лечение должно начинаться с парентерального введения эффективного антибиотика, а при улучшении клинического состояния пациента следует в возможно более короткие сроки перейти на пероральный путь приема этого же препарата.
Первые работы по ступенчатой терапии появились в медицинской литературе еще в 1970е гг., когда T. Tetzlaff и соавт. (1978), C. Prober, A. Yaeger (1979) в своих работах показали клиническую эффективность ступенчатого подхода при лечении остеомиелита и инфекционного артрита, используя различные парентеральные и пероральные β-лактамные антибиотики. Ступенчатая антибактериальная терапия пневмонии впервые была проведена в 1985 г.
F. Shann и соавт., которые использовали у детей Папуа и Новой Гвинеи тактику последовательного назначения хлорамфеникола в парентеральной, а затем и пероральной лекарственных формах. Спустя два года R. Quintiliani и соавт. (1987) научно обосновали этот новый подход к применению антибактериальных препаратов. Таким образом, ступенчатая терапия в лечении инфекционной патологии авторитетно рекомендуется вот уже более двадцати лет.
Ступенчатая терапия приводит к сокращению длительности парентерального введения противомикробного препарата, значительному уменьшению стоимости лечения, сокращению сроков пребывания больного в стационаре при сохранении высокой клинической эффективности терапии. Преимущества такой терапии, как для пациента, так и для здравоохранения, очевидны: уменьшение количества инъекций, что делает лечение более комфортным и уменьшает риск постинъекционных осложнений; возможность выписаться из стационара раньше и продолжить лечение в домашних условиях, что способствует снижению риска нозокомиальной инфекции и лучшей психологической и социальной адаптации больного. Особенно это актуально в педиатрии, где сама инъекция представляет собой серьезную психологическую травму для больного ребенка.
Следует помнить и о фармакоэкономических показателях лечения — снижении затрат в связи с меньшей стоимостью пероральных антибиотиков, устранением дополнительных затрат на введение парентеральных препаратов: специальные медицинские принадлежности (шприцы, иглы, системы для введения инфузионных растворов, перчатки, дезинфектанты и др.); стерилизация; рабочее время среднего медперсонала; терапевтический лекарственный мониторинг; утилизация шприцов, игл и других расходуемых материалов.
Несмотря на очевидные преимущества ступенчатой терапии, в силу различных причин (прежде всего сложившихся стереотипов) она не всегда применяется на практике. По данным R. Quintiliani и соавт. (1991), до 75% госпитализированных пациентов с различными инфекциями могли быть переведены с парентерального на пероральный путь введения антибактериальных препаратов.
Основные условия безопасного перехода на пероральную терапию как второй этап лечения известны. Прежде всего перевод пациента на пероральный антибиотик должен осуществляться в сроки, когда удается убедительно продемонстрировать адекватный клинический и лабораторный ответ больного на начатую парентеральную терапию. Кроме того, у пациента должна быть нормальная гастроинтестинальная абсорбция. Предпочтение при переходе с парентерального на пероральный прием следует отдавать препарату с наибольшей биодоступностью; ее необходимо учитывать и при определении оптимальной дозы. При назначении антибиотика врач должен быть уверен, что концентрация препарата в очаге инфекции будет превосходить минимальную подавляющую концентрацию для возбудителя.
Классической схемой ступенчатой терапии является применение цефуроксима внутривенно или внутримышечно с переходом на цефуроксима аксетил через рот. Это один из наиболее широко применяемых цефалоспоринов, который выпускается как в формах для парентеральных инъекций, так и для перорального приема. Следует напомнить, что цефуроксима аксетил является пролекарством, и после приема внутрь он быстро гидролизируется в слизистой оболочке тонкой кишки до активного вещества — цефуроксима. При его применении внутрь в дозе 500 мг уже через 3 часа в крови обнаруживается максимальная концентрация цефуроксима (от 4 до 8 мг/л); в легочной ткани его концентрация после приема той же дозы составляет 2,2–3,8 мг/л, что превышает МПК для основных возбудителей внебольничных инфекций дыхательных путей.
К цефуроксиму чувствительны ведущие возбудители инфекций дыхательных путей — S. pneumoniae, H. Influenzae. Известный российский ученый чл.-кор. РАМН, проф. Л.С. Страчунский подчеркивал: «Цефуроксим более активен, чем цефалоспорины I поколения, в отношении H. influenzae, M. catarrhalis, включая βлактамазопродуцирующие штаммы, E. coli, P. mirabilis, P. vulgaris и других, но так же, как и цефалоспорины I поколения, активен по отношению к стрептококкам, стафилококкам, включая MRSA».
Цефуроксим отличает и высокий профиль безопасности. По данным профессора А.П. Викторова (2006), аллергические реакции на цефалоспорины встречаются реже, чем на антибиотики пенициллинового ряда, а в соответствии со степенью риска аллергических реакций цефалоспорины располагаются в таком порядке (по убыванию риска): цефтриаксон > цефоперазон > цефокситин > цефтазидим > цефотаксим > цефуроксим. Таким образом, цефуроксим в ряду других цефалоспоринов в этом отношении находится в наиболее выигрышном положении.
В современной практике широко применяются такие препараты цефуроксима, как Цефумакс для парентерального и Цефутил для перорального приема. Цефумакс (цефуроксим) в виде порошка для приготовления раствора для инъекций и инфузий выпускается по 750 мг и 1500 мг цефуроксима натрия во флаконе. При внутримышечном введении 750 мг цефуроксима натрия Cmax в плазме крови достигается через 30–40 мин после введения и составляет 35–40 мкг/мл. При внутривенном введении 750 мг препарата в течение 30 мин уровень цефуроксима в плазме крови составляет 51 мкг/мл на момент окончания инфузии. Более 95% цефуроксима выводится почками не метаболизируясь, при этом экскреция цефуроксима равномерно распределена между клубочковой фильтрацией (50%) и канальцевой секрецией (50%). Около 90% цефуроксима выводится с мочой через 6 ч после внутримышечной инъекции и 96% — через 24 ч. Около 33% цефуроксима связывается с белками плазмы крови. Терапевтические концентрации цефуроксима достигаются, в частности, в плевральной жидкости, а также в мокроте. Вводят Цефумакс внутривенно или внутримышечно. Для в/в введения во флакон, содержащий 750 мг цефуроксима, добавляют 6 мл воды для инъекций; во флакон, содержащий 1,5 г препарата, добавляют 15 мл воды для инъекций. Для в/м введения к 750 мг препарата добавляют 3 мл воды для инъекций, осторожно встряхивают до образования непрозрачной суспензии. Для приготовления инфузионного раствора к 1,5 г препарата добавляют 50 мл воды для инъекций, 5% раствора глюкозы или 0,9% раствора натрия хлорида.
Детям в возрасте до 3 мес суточная доза препарата Цефумакс вводится за 2–3 введения из расчета 30–60 мг/кг/сут, при необходимости доза может быть повышена до 100 мг/кг/сут. Детям в возрасте старше 3 мес. Цефумакс назначают из расчета 30–60 мг/кг/сут., при необходимости доза может быть повышена до 100 мг/кг/сут. Суточная доза распределяется на 3–4 введения. Взрослым Цефумакс назначают в дозе 750 мг 3 раза в сутки. При инфекциях тяжелой степени дозу повышают до 1,5 г 3 раза в сутки. При необходимости кратность введения Цефумакса может быть увеличена до 4 раз с 6-часовым интервалом. Суточная доза составляет 3–6 г, максимальная суточная доза — 6 г.
Цефутил (цефуроксима аксетил) — полусинтетический цефалоспориновий антибиотик II поколения для перорального применения. Форма выпуска — таблетки, которые содержат 125, 250, и 500 мг цефуроксима аксетила. Это неактивное соединение, которое быстро гидролизируется в слизистой оболочке стенки тонкой кишки с образованием активного цефуроксима, быстро всасываеющегося в кровь, он не вызывает дисбактериоза кишечника.
Применение Цефутила после приема пищи значительно повышает биодоступность препарата. После перорального приема Цефутила пиковая концентрация в плазме достигается через 2–3 часа. На протяжении 24 часов препарат выводится в не измененном виде с мочой. Период полувыведения составляет 1,2 часа. При легких инфекциях дыхательных путей у детей от 3 до 12 лет применяют по 125 мг 2 раза в сутки, при более тяжелом течении — 250 мг 2 раза в сутки, а дети старше 12 лет или с массой более 50 кг должны лечиться дозами, которые рекомендуют для взрослых: 250–500 мг 2 раза в сутки. Цефутил принимается внутрь с пищей или сразу после приема пищи.
В Киевской городской детской клинической больнице №2 — клинической базе кафедры педиатрии №2 Национального медицинского университета им. А.А. Богомольца — накоплен опыт ступенчатой антимикробной терапии острых бронхитов у детей в возрасте от 3 до 14 лет, которые имели показания к антимикробной терапии в условиях стационара согласно критериев, изложенных в приказе МЗ Украины №18 от 13.01.2005.
Цель работы: изучить эффективность и безопасность ступенчатой антибиотикотерапии с использованием Цефумакса (цефуроксима) парентерально на первом этапе и Цефутила (цефуроксима аксетила) перорально на втором этапе у детей с острым бронхитом в условиях педиатрического стационара.
Материал и методы исследования
Под нашим наблюдением находилось 30 детей в возрасте от 3 до 14 лет с диагнозами острый бронхит (14 детей)и острый обструктивный бронхит (16 детей), клинически состояние детей при поступлении оценивалось как тяжелое (12 детей) или среднетяжелое (18 детей). Дети были госпитализированы в клинику на 3–5 сутки заболевания и в большинстве случаев не получали на дому антибактериальную терапию (лишь 3 детей получали амоксициллин и 1 ребенок получал амоксициллин/клавулановую кислоту). В исследование не включали детей до 3 лет, детей с заболеваниями почек и/или печени, с известным иммунодефицитом, аллергическими реакциями на прием цефалоспоринов или других беталактамных антибиотиков в анамнезе. Всем детям проводили общеклинический и биохимический анализ крови, а также рентгенографию органов грудной клетки с целью дифференциального диагноза. Бактриологическое обследование проводили при появлении влажного кашля с мокротой.
Дети получали Цефумакс внутривенно (12 детей) или внутримышечно (18 детей) в течение 4 дней (2 детей), 3 дней (19 детей), 2 дней (9 детей) с последующим переходом на пероральный прием Цефутила. Цефумакс дозировали из расчета 30–60 мг/кг/сут в 3 введения. Цефутил назначали 250 мг 2 раза в сутки внутрь с пищей. Общая длительность антимикробного лечения составила в среднем 7 дней.
Перевод на пероральный антибиотик осуществлялся тогда, когда лечащий врач был убежден в том, что получен адекватный клиниколабораторный ответ на начатую парентеральную терапию Цефумаксом: нормализация температуры тела, отсутствие одышки, уменьшение клинических проявлений интоксикационного синдрома, некоторое уменьшение кашля, отсутствие тошноты и рвоты, тенденция к нормализации первоначальных изменений со стороны крови, в частности количества лейкоцитов, сдвига лейкоцитарной формулы влево и скорости оседания эритроцитов.
Рентгенологически диагноз острого бронхита (ОБ), острого обструктивного бронхита (ООБ) был подтвержден у всех детей, а контрольная рентенография в конце курса стационарного лечения была проведена по показаниям у 6 детей. Кроме антибактериальной терапии, 4 ребенка получали дезинтоксикационную инфузионную терапию (по показаниям), а дети с острым обструктивным бронхитом (16 пациентов) — «Трайфед экспекторант» (трипролидина гидрохлорид, псевдоэфедрина гидрохлорид и гвайфенезин). Также использовались физиотерапевтические методы лечения и терапия сопутствующих заболеваний (у 4 детей имел место острый гайморит, у 3 детей — острый средний отит, у 4 детей — ацетонемический синдром).
Эффективность лечения оценивали по регрессии клинической симптоматики (уменьшение интоксикационного синдрома, нормализация температуры тела, уменьшение кашля, выделения мокроты), а также изменению физикальных данных со стороны легких, нормализации лабораторных показателей и, по показаниям, рентгенологической картины. Безопасность и переносимость лечения оценивали на основании клинической симптоматики, связанной с возможными побочными явлениями, а также лабораторных показателей (биохимического анализа крови, копрограммы).
Результаты исследования и их обсуждение
В результате клинического обследования выявлено преобладание респираторного и интоксикационного синдромов. Регистрировались жалобы на общую слабость — 19 детей, потливость— 6 детей, снижение аппетита — 12 детей. Кашель имел место у всех детей. Одышка отмечалась у 18 пациентов, среди которых преобладали дети с острым обструктивным бронхитом.
У детей с ОБ нами перкуторно отмечалось сохранение легочного звука, иногда с небольшим коробочным оттенком. Аускультативная картина варьировала от жесткого дыхания до обилия разнокалиберных влажных и сухих хрипов, обычно уменьшающихся или исчезающих после откашливания. У детей с ООБ нами отмечался коробочный оттенок легочного звука, ау 6 детей отмечались и небольшие участки укорочения перкуторного тона. При рентгенографии диагноз пневмонии был исключен, и данные явления нами расценены как субсегментарные ателектазы. Аускультативно у всех выслушивалось удлинение и усиление выдоха, на выдохе сухие свистящие хрипы, немногочисленные мелкопузырчатые хрипы и значительное количество крупнопузырчатых влажных хрипов. Изменения периферической крови были представлены лейкоцитозом (14 детей), сдвигом лейкоцитарной формулы влево (12 детей), повышением СОЭ (28 детей). Клинические симптомы оценивали по балльной шкале (табл.).
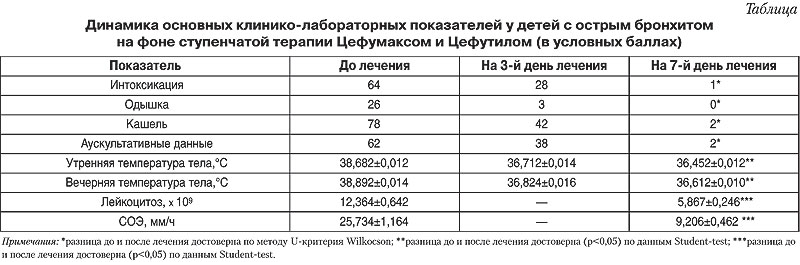
Степень интоксикации: интоксикация отсутствует — 0 условных баллов, легкая — 1 балл, среднетяжелая — 2 балла, тяжелая — 3 балла. Одышка: 0 баллов — отсутствует, 1 балл — незначительная, 2 балла — умеренная, 3 балла — выраженная.
Выраженность кашля: 0 баллов — отсутствие кашля, 1 балл — редкий, 2 балла — частый, 3 балла — очень частый.
Аускультативные данные: везикулярное дыхание — 0 баллов, жесткое дыхание, единичные хрипы — 1 балл, немногочисленные хрипы — 2 балла, многочисленные хрипы — 3 балла.
У детей уже на 3-е сутки уменьшились признаки интоксикации, у некоторых пациентов уменьшилась интенсивность кашля, он стал менее изнуряющим, в ряде случаев более влажным и стала легче отходить мокрота. Исчезла или значительно уменьшилась одышка, нормализовался сон, улучшился аппетит. В конце курса лечения интоксикация расценена в 1 у.б. у одного ребенка с хроническим тонзиллитом в декомпенсированной форме. Одышки в конце курса лечения не было ни у одного ребенка, а незначительный кашель — у двух пациентов, причем он не сопровождался изменениями общего состояния детей, аускультативно у них отмечалось жесткое дыхание. Графика температурной кривой у детей, получавших ступенчатую терапию, отражала один из важных критериев перевода детей на пероральный этап антибиотикотерапии.
У всех детей в конце курса лечения отмечалась нормализация гематологических показателей — количества лейкоцитов, лейкоцитарной формулы, СОЭ. Контроль биохимического анализа крови (почечные и печеночные пробы) патологических изменений не выявил. При копрологическом исследовании изменения микробиоценоза кишечника выявлено не было. Микробиологическое исследование мокроты проведено у 12 детей, при этом выделеные микроорганизмы во всех случаях были чувствительны к цефуроксиму. Контрольная рентгенография у тех детей, которым она проводилась (6 детей), показала, что у всех больных отмечалась нормализация рентгенологической картины. У 7 детей, которые имели острый гайморит и/или острый средний отит, на 7 день лечения оториноларинголог констатировал нормализацию соответствующей клинической картины.
Все дети на втором этапе лечения не получали инъекций, что значительно повышало качество их жизни и устраняло необоснованную психологическую травму, что подтверждалось результатами анкетирования больных и их родителей.
Клинически в конце курса лечения состояние всех детей расценивалось как удовлетворительное. Аллергических реакций не выявлено ни в одном случае. Препараты Цефумакс и Цефутил хорошо переносились детьми. Побочные действия не выявлены.
В целом результаты данного исследования подтвержают результаты фундаментального исследования Юлиша Е.И., Сороки Ю.А., Левченко Ю.А (2007), в котором изучалась антибиотикорезистентность распространенных ответственных патогенов внебольничных инфекций респираторного тракта у детей. Микробиологическое исследование проводилось методом сбора индуцированной мокроты путем ингаляции через небулайзер 3% раствора NaCl. Критериями пригодности мокроты для бактериологического исследования являлось наличие более 25 сегментоядерных лейкоцитов и не более 10 эпителиальных клеток в поле зрения при просмотре, как минимум, 20 полей зрения мазка, окрашенного по Граму (под увеличением х100). При этом выделены: Streptococcus pneumoniae, Staphylococcus aureus, Staphylococcus epidermidis, Haemophilus influenzae в диагностически значимых количествах (от 106 до 5х105 бактерий в 1 мл). В качестве стартовой антибактериальной терапии больные получали Цефутил, и авторами убедительно продемонстрирована высокая чувствительность микрофлоры к этому препарату.
Цефутил (цефуроксима аксетил), как цефалоспорин ІІ генерации, имеет такую особенность по сравнению с цефалоспоринами І поколения, как выраженная активность в отношении микроорганизмов семейства Enterobacteriaceae, Haemophilus influenzae и Moraxella catarrhalis при сопоставимой активности в отношении грамположительных кокков. Это обусловлено тем, что цефуроксим обладает высокой устойчивостью к бета-лактамазам, продуцируемым грамотрицательными возбудителями.
Другая особенность — доза препарата не является определяющей для клинического эффекта цефуроксима, а более важной является длительность взаимодействия антибиотика с микроорганизмом. Доказано, что концентрация цефуроксима, превышающая МПК в 2–4 раза, должна сохраняться около 50% времени между введениями, а повышение МПК, к примеру, до 20 раз не будет сопровождаться увеличением выраженности клинического эффекта. Цефумакс (цефуроксима натрий) предназначен исключительно для парентерального введения, так как натриевая соль цефуроксима практически не всасывается при приеме внутрь. При периоде полувыведения, составляющем около 80 мин, терапевтическая концентрация цефуроксима сохраняется на протяжении 5–8 ч в зависимости от величины дозы. Это определяет 3–4-кратное введение цефуроксима натрия.
Цефутил (цефуроксима аксетил) в форме таблеток, напротив, после приема внутрь хорошо всасывается и быстро гидролизуется в слизистой оболочке кишечника и крови в цефуроксим (биодоступность цефуроксима аксетила повышается до 50% при приеме во время еды). В результате плавного повышения концентрации цефуроксима при применении цефуроксима аксетила увеличивается время экспозиции антибиотика с микроорганизмом, что позволяет использовать двукратный режим дозирования препарата (по 250–500 мг).
Выводы
Цефуроксим в виде натриевой соли для парентеральной формы (Цефумакс) и в виде перорального цефуроксима аксетила (Цефутил) является эффективным и безопасным антимикробным лекарственным средством для стационарного лечения детей с острым бронхитом.
Их применение в виде ступенчатой схемы антибиотикотерапии обладает рядом клинических, экономических и психологических преимуществ. Этот подход, в частности, решает актуальную на сегодняшний день проблему лечения инфекций, вызванных H. influenzae. Оба препарата цефуроксима (Цефумакс и Цефутил) удобны в педиатрической практике и рекомендуются для клинического использования.
Литература
- Nelson Textbook of Pediatrics / Robert M. Kliegman, Richard E. Behrman, Hal B. Jenson, Bonita F. — Stanton, 18th edition, Saunders, 2007.
- Сенаторова А. С. Дифференциальная диагностика бронхообструктивного синдрома у детей / А. С. Сенаторова, Д. А. Хоружевский // Здоровье Украины. — 2007. — № 18/1.
- Кривопустов С. П. Острый бронхит у детей: акцент на предупреждение полипрагмазии при лечении / С. П. Кривопустов // Рациональная фармакотерапия. — 2008. — № 3 (2).
- Антибактериальная терапия : практ. рук_во / [под ред. Л. С. Страчунского Ю. Б. Белоусова, С. Н. Козлова]. — М. : РЦ «Фармединфо», 2000.
- Волосовец А. П. К вопросу о комбинированной терапии острых заболеваний бронхолегочной системы в практике стационарной педиатрии / А. П. Волосовец, С. П. Кривопустов // Лекарь.— 2008. — № 5 (11).
- Волосовец А. П. Цефалоспорины в практике современной педиатрии : монография / А. П. Волосовец, С. П. Кривопустов. — Х. : Прапор, 2007.
- Майданник В. Г. Проблемы рациональной антибиотикотерапии в педиатрии / В. Г. Майданник // Здоров’я України. — 2007. — № 10 (167).
- Цефалоспорины для орального применения при лечении неосложненных форм пневмоний у детей / Абатуров А. Е., Герасименко О. Н., Высочина И. Л., Ивашина В. И. // Совр. педиатрия.— 2006. — № 4 (13).
- Юлиш Е. И. Подходы к оптимизации антибактериальной терапии внебольничных пневмоний у детей / Е. И. Юлиш, Ю. А. Сорока, С. А. Левченко // Здоровье ребенка. — № 4 (7). — 2007.
- Airway inflammation and etiology of acute exacerbations of chronic bronchitis / Sethi S., Muscarella K., Evans N. [et al.] // Chest. — 2000. — Vol.118.
- Diagnosis and management of cough: ACCP evidence_based clinical practice guidelines / Irwin R. S., Baumann M. H., Bolser D. C. [et al.] // Chest. — 2006. — Vol. 129 (Suppl. 1).
- Red Book: 2006 Report of the Committee on Infectious Diseases, 27th Edition. by American Academy of Pediatrics / [editor Larry K. Pickering], 2006.












Комментировать