Изучение роли мембранодеструктивных процессов и нарушений структурно-функционального состояния гемоглобина в патогенезе перинатальных гипоксически-ишемических поражений (ПГИП) ЦНС у новорожденных и оценка возможности их коррекции. Клинико-инструментальные методы и результаты исследования с определением фракций липидов и спектроскопией гемоглобина обследованы 226 новорожденных.
Л.В. Ледяйкина1,2, Л.А. Балыкова2, А.П. Власов2, И.С. Назарова1, М.А. Сюняева2, В.А. Трофимов2
1Мордовский республиканский клинический перинатальный центр, 2Мордовский государственный университет им. Н.П. Огарева, г. Саранск, РФ
Цель работы — изучение роли мембранодеструктивных процессов и нарушений структурно-функционального состояния гемоглобина в патогенезе перинатальных гипоксически-ишемических поражений (ПГИП) ЦНС у новорожденных и оценка возможности их коррекции. Клинико-инструментальными методами с определением фракций липидов и спектроскопией гемоглобина обследованы 226 новорожденных. У 76 недоношенных детей с ПГИП ЦНС легкой и средней степени тяжести оценена эффективность L-карнитина. При ПГИП ЦНС установлены липидный дисбаланс и нарушение свойств гемоглобина, которые усугублялись под действием высоких концентраций кислорода и коррелировали с тяжестью перинатальной гипоксии. Установлен положительный клинический эффект Элькара у недоношенных новорожденных с ПГИП ЦНС, который реализуется отчасти благодаря способности нормализовать липидный состав мембран эритроцитов и структурно-функциональные показатели гемоглобина.
Ключевые слова: перинатальная гипоксия, гипоксическая энцефалопатия, новорожденные, липидный дисбаланс, структурно-функциональное состояние гемоглобина, L-карнитин, Элькар.
Одно из лидирующих мест в структуре заболеваемости и смертности новорожденных и детей первого года жизни традиционно занимают перинатальная гипоксия/асфиксия и ее последствия [1-3]. Тяжелая сочетанная (анте- и интранатальная) асфиксия/гипоксия несмотря на внедрение протокола реанимации и современных нейропротективных стратегий вызывает гибель 0,5-3% новорожденных [4-6], оказывает повреждающее действие на рост и развитие плода в целом и на состояние отдельных органов и систем (постгипоксическая кардиопатия, нефропатия, энтеропатия и др.) с разнообразной клинической картиной [7-10]. Наибольшую опасность и прогностическую значимость среди клинических проявлений и последствий перинатальной гипоксии представляют гипоксически-ишемические поражения центральной нервной системы (ЦНС), нередко являющиеся причиной летальных исходов и играющие ведущую роль в дальнейшей дезадаптации детей и возникновении тяжелых инвалидизирующих заболеваний [11, 12].
В Республике Мордовия на протяжении последних 15 лет благодаря ряду организационно-методических решений (создание в 1997 г. Республиканского перинатального центра, организация работы выездных реаниматологических бригад и др.) уровень младенческой и неонатальной смертности стабильно сохраняется ниже среднероссийских показателей (2,9-6,6 и 5,210,2 на 1000 живорожденных соответственно) и в последние годы имеет тенденцию к снижению. Однако при этом общая заболеваемость новорожденных растет, и в ее структуре преобладают перинатальные гипоксически-ишемические поражения ЦНС (что согласуется с данными Российских эпидемиологических исследований, определяющих диагноз «перинатальной церебральной ишемии» в 700 случаев на 1000 [13]) и замедления роста и питания, в генезе которых в 70-80% случаев лежит хроническая гипоксия плода.
Многие аспекты патогенеза перинатальных гипоксически-ишемических повреждений (ПГИП) органов и систем, особенностей адаптации новорожденных к перинатальной гипоксии и коррекции их последствий до настоящего времени изучены недостаточно [14, 15]. Определенное значение в их развитии имеет изменение структурно-функциональных свойств мембран (в т.ч. олигодендроцитов) вследствие активации свободно-радикального окисления [16]. Разработка данной проблемы даст возможность обосновать новые схемы терапевтического вмешательства в цепь инициированных гипоксией патологических процессов, которые могут существенно снизить тяжесть гипоксически-ишемических повреждений и улучшить жизненный прогноз, в т.ч. у недоношенных новорожденных.
Цель работы: изучить роль нарушений структурно-функционального состояния гемоглобина в патогенезе гипоксически-ишемического поражения ЦНС у новорожденных и оценить возможность их фармакологической коррекции.
Материалы и методы исследования
В клиническое исследование, проведенное с одобрения Локального этического комитета при Мордовском государственном университете, включены 226 новорожденных (из них 86 недоношенных), рожденных и/или находившихся на выхаживании и лечении в ГБУЗ РМ «Мордовский республиканский клинический перинатальный центр» и «Мордовская детская республиканская клиническая больница» с ПГИП ЦНС.
Диагноз ПГИП ЦНС по типу церебральной ишемии (ЦИ) I—III степени, внутрижелудочковых кровоизлияний (ВЖК) I–III степени (в основном у недоношенных) и их сочетание, как основное органное следствие перенесенной гипоксии, установлен на основании комплексного клинико-инструментального обследования в соответствии с действующими рекомендациями Общества специалистов по перинатальной медицине (2002).
У всех детей перинатальный анамнез был отягощен по хронической внутриутробной гипоксии плода (хроническая маточно-плацентарная недостаточность, тяжелые гестозы, предлежание плаценты, рубец на матке, курение, сочетанные соматические заболевания матери) и/или острой асфиксии в родах. У 1/3 детей имели место признаки задержки внутриутробного развития. В остром периоде (первые 28 дней постнатальной жизни) клиническая картина складывалась из признаков гипервозбудимости (преимущественно у доношенных с ЦИ I степени тяжести), синдрома угнетения ЦНС (у недоношенных и доношенных детей с ЦИ II степени), синдромов мышечной гипотонии (25-44% в зависимости от степени тяжести ЦИ) и вегетативно-висцеральных дисфункций (38-71%).
При тяжелом ПГИП ЦНС с массивными ВЖК в клинической симптоматике лидировали падение мышечного тонуса с исчезновением рефлексов (в т.ч. сосательного и глотательного), приступы апноэ, артериальная гипотония и тахикардия, глазная симптоматика (неподвижность взора, постоянный горизонтальный или вертикальный нистагм, нарушение окулоцефалических рефлексов, отсутствие реакции зрачков на свет), снижение гематокрита и гемоглобина в анализах крови, признаки внутричерепной гипертензии (выбухание большого родничка). У 22 новорожденных из 226 (9,1%) отмечались судороги.
Дети были разделены на 3 группы соответственно степени тяжести ПГИП ЦНС (табл. 1). Из исследования исключались дети с пороками развития ЦНС, поражениями травматического и инфекционного генеза, а также с клинически значимой сопутствующей патологией. Контрольную группу составили 50 сопоставимых с ними по полу практически здоровых новорожденных от физиологических беременностей и родов.
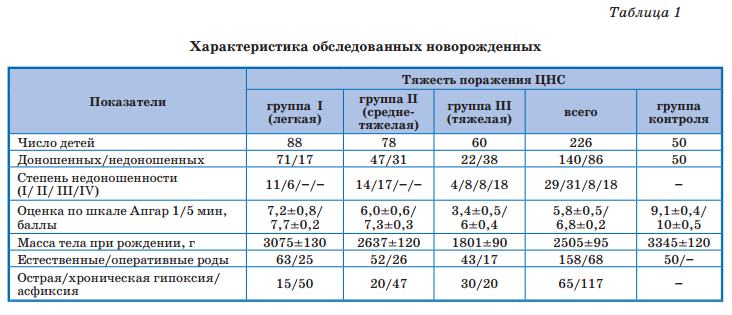
Комплексное обследование новорожденных, помимо общеклинического, включало нейросонографию (НСГ) с допплерографическим исследованием церебральных сосудов, электроэнцефалографию, по показаниям — компьютерную и магнитно-резонанскую томографию и др. РАМАН-спектроскопия гемоглобина проведена 151 новорожденному с перинатальной гипоксией и 50 здоровым детям на аппарате in via Basis фирмы «Renishaw» с короткофокусным высокосветосильным монохроматором. Выписывали полосы спектра гемоглобина при возбуждении лазером с диной волны 532 нм и проводили соотнесение полос с колебаниями связей порфирина.
На 2-м этапе проведено клиническое исследование эффективности L-карнитина (Элькар®, ООО «ПИК-ФАРМА», Россия) в комплексной терапии ПГИП ЦНС у 76 недошенных новорожденных. В исследование включали детей с I-III степенью недоношенности и ишемически-геморрагическими повреждениями ЦНС нетравматического генеза — ВЖК субэпендимальными и/ или интравентрикулярными легкой (n=36) и среднетяжелой (n=40) степени. Гестационный возраст варьировал от 28 до 37 недель, средняя масса тела при рождении составила 2030±40 г. В связи с общей тяжестью состояния, морфо-функциональной незрелостью, наличием синдрома угнетения ЦНС и дыхательных расстройств 27,6% новорожденных проводилась искусственная вентиляция легких (ИВЛ), 49,5% — зондовое и/или частичное парентеральное питание. По данным НСГ у большинства детей имели место ВЖК I–II степени по L.-A. Papile.
Дети были разделены на 2 группы с учетом степени недоношенности и тяжести ПГИП ЦНС. 1-я группа в остром периоде после проведения (по показаниям) реанимационных мероприятий получала стандартное лечение, включающее щадящий режим, рациональное питание и посиндромную терапию, направленную на поддержание адекватной легочной вентиляции и стабильной гемодинамики (раствор альбумина, кристаллоиды, допамин, медикаментозное закрытие гемодинамически значимого открытого артериального протока), коррекцию электролитных нарушений (препараты калия, кальция, натрия, магния), ликвидацию отека мозга (сернокислая магнезия, маннитол, фуросемид), купирование и/или профилактику судорожного синдрома (диазепам, фенобарбитал), нормализацию метаболизма нервной ткани и повышение ее устойчивости к гипоксии (ГОМК, глюкоза), коррекцию гемостаза и проницаемости сосудистой стенки (производные витамина K, этамзилат, свежезамороженная плазма), по показаниям проводили нейрохирургическое лечение и др., а 2-я группа получала дополнительно Элькар в дозе 100 мг/кг/сут в 2 приема в течение месяца. Назначение L-карнитина обосновано данными зарубежных исследований о его незаменимости для недоношенных детей и способности оказывать энерготропное, антиоксидантное и нейропротекторное действие [17-19].
Динамику состояния оценивали по клиническим данным и шкалам оценки мышечно-постурального тонуса INFANIB и нервно-психического развития младенцев BSID-II (Bayley Scales of Infant Development 2-nd ed). При этом на 14-е сутки жизни по шкале INFANIB 87,590% детей с ВЖК I степени имели транзиторные нарушения, а у остальных показатели нервно-психического развития соответствовали диапазону «норма» (более 66 баллов). У пациентов с ПГИП ЦНС средней степени тяжести ни в одном случае нервно-психическое развитие не соответствовало норме, у 48-40% детей выявлялись «транзиторные нарушения» и у 52-60% — «патология».
Полученные данные обработаны статистически с использованием пакета программ «Statistica 8», достоверность результатов оценивали по t-критерию Стьюдента. Корреляционный анализ проводили с использованием критерия Пирсона (при нормальном распределении и линейной зависимости) или коэффициента ранговой корреляции Спирмена.
Результаты и их обсуждение
В ходе комплексного обследования подтвержден факт прямой зависимости выраженности клинико-инструментальных проявлений ПГИП ЦНС от тяжести перенесенной перинатальной гипоксии/асфиксии. Доля детей, рожденных в тяжелой асфиксии, была значимо выше среди детей с ЦИ и ВЖК III степени: 28 из 60 (46,7%) относительно детей I группы (1 из 88 -1,1%, p<0,05). Выявлено, что сатурация кислорода по данным пульсоксиметрии в первые сутки после рождения составила 89,9±2,3% у детей I группы и 79,9±2,2% — в III группе (p<0,05),
а выраженность метаболического ацидоза (рН) 7,1±0,1 при тяжелом ПГИП ЦНС и 7,4±0,1 при ПГИП ЦНС легкой степени (p<0,05). Основной объективный показатель эффективности мозгового кровотока по данным допплерографии — индекс резистентности (RI), оцененный на передней и средней мозговых артериях, имел сильную положительную связь (г=0,94-0,97) с оценкой тяжести гипоксии/асфиксии по шкале Апгар и сатурацией кислорода.
Для изучения некоторых новых аспектов патогенеза гипоксии, в частности, нарушений кислород-транспортирующих свойств гемоглобина как важнейшего механизма формирования кислородной недостаточности у новорожденных с ПГИП ЦНС, были изучены спектры комбинационного рассеивания (СКР) гемоглобина в зависимости от тяжести церебрального повреждения (рис. 1).
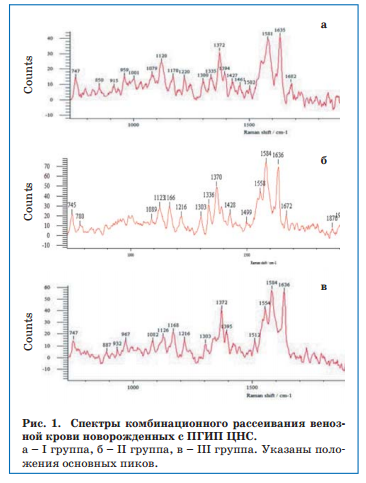
Установлено, что показатели, отражающие сродство гемоглобина к лигандам (к кислороду) (I1355/ I1550)/(I1375/I1580), и способность гемоглобина связывать их (I1355/I1550) уменьшались с увеличением тяжести ПГИП ЦНС (рис. 2).
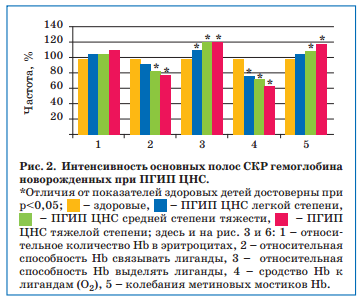
При проведении статистического анализа нами установлена корреляционная зависимость между показателями структурно-функциональных свойств гемоглобина новорожденных и некоторыми клиническими показателями, отражающими тяжесть перинатальной гипоксии и ее последствий, что доказывает их важность и патогенетическую значимость (табл. 2), давая основания для разработки новых подходов к фармакологической коррекции.
Показатели, отражающие способность гемоглобина выделять лиганды (I1375/I1580), а также конформационные изменения гемоглобина (I1375/I1172), у детей с перинатальной энцефалопатией были выше, чем у здоровых, и возрастали по увеличению тяжести повреждения ЦНС. Следовательно, при тяжелом ПГИП ЦНС присоединение кислорода к гемоглобину становится недостаточно эффективным, способствуя усугублению гипоксии. Полученные данные согласуются с известным мнением о нецелесообразности значительного повышения напряжения кислорода во вдыхаемой смеси при проведении ИВЛ новорожденным (особенно недоношенным) с тяжелой перинатальной гипоксией. Доказательства данного положения получены нами в исследованиях in vitro при анализе СКР крови новорожденных с ПГИП ЦНС на фоне подачи кислорода.
Установлено, что показатели, отражающие сродство гемоглобина к кислороду и способность его связывать, у новорожденных с ЦИ в пробах без подачи кислорода были выше, чем в пробах с газацией, и уменьшались пропорционально увеличению потока кислорода. Кроме того, параллельно увеличению потока кислорода менялась и конфигурация пиррольного кольца гемоглобина (что отражает показатель колебания метиновых мостиков), приводя к снижению способности гемоглобина связывать кислород и нарушению его транспортной функции (рис. 3).
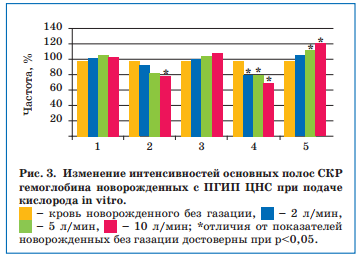
При дополнительном назначении Элькара недоношенным детям с ПГИП ЦНС по типу ВЖК I степени (субэпендимальных и/или интравентрикулярных, небольших паренхиматозных) был получен более значимый клинико-лабораторный эффект, чем при использовании только стандартной терапии. В обеих группах через 1 месяц отмечались улучшение общего состояния, восстановление мышечного тонуса и рефлексов, но при дополнительном приеме Элькара отмечались более быстрая положительная динамика массы тела, более выраженный регресс вегето-висцеральных дисфункций (уменьшение мраморности кожных покровов, частоты и интенсивности срыгиваний) и уменьшение потребности в кислороде.
Положительная динамика массы тела у недоношенных с ПГИП ЦНС легкой степени (по типу ВЖК I степени), среди которых преобладали новорожденные с I степенью недоношенности (по 75% в каждой группе), наступала раньше в группе детей, получавших дополнительно Элькар, наблюдаясь с 3,9±0,41 суток жизни, тогда как в контрольной группе она отмечалась с 5,26±0,36 суток (р<0,05). При этом среднесуточная прибавка массы тела у недоношенных, принимавших Элькар, была достоверно больше по сравнению с детьми, находившимися только на стандартном лечении (28,47±0,29 и 24,15± 0,94 г соответственно, р<0,05). Положительная динамика массы тела у детей с ПГИП ЦНС по типу ВЖК II степени (среди которых почти половину составили дети со II степенью недоношенности) отмечалась с 5,02±0,34 суток жизни при дополнительном лечении Элькаром и с 7,24±0,47 суток жизни — при стандартной терапии и составила 27,23±0,27 и 23,75±0,87 г соответственно (р<0,05). За месяц новорожденные с I степенью недоношенности, получавшие дополнительно Элькар, прибавили в весе в среднем 1002±68,5 против 886,1±56,3 г в контрольной группе (р>0,05). При II степени недоношенности ежемесячные прибавки массы тела составили 950,3±36,3 г в группе Элькара и 829,05±31,0 г в группе стандартной терапии, а при III степени недоношенности — 649,9±26,1 и 546,8±24,2 г соответственно (р<0,05).
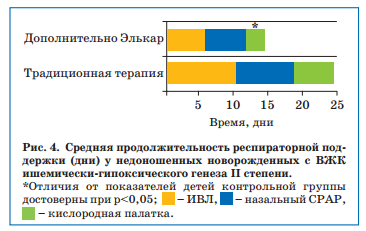
Так, несмотря на то, что среди недоношенных с ВЖК II степени основной группы было несколько больше детей со сроком гестации менее 35 недель (17 из 25 — 68%) по сравнению с контрольной (9 из 15 — 60%), что диктовало необходимость проведения ИВЛ у 9 (36%) и 7 (46,6%) детей с рождения соответственно, потребность в ИВЛ была выше в контрольной группе, сохраняясь к 14-м суткам жизни у 1/3 детей против 3 (17,6%) в контрольной группе (р>0,05). Более того, дети основной группы реже нуждались в повышенной концентрации кислорода: дополнительное использование Элькара позволило в первые 10 суток снизить содержание О2 в дыхательной смеси до 25-28%, а у недоношенных контрольной группы это произошло только к исходу 2-й недели жизни. В целом, общая продолжительность респираторной поддержки у детей с ВЖК II степени в основной группе была статистически значимо меньше против группы контроля (рис. 4).
При динамическом обследовании недоношенных новорожденных с ВЖК I степени в возрасте 40 недель от зачатия по шкале INFANIB у 56,3-55% детей в каждой группе (против 10-12,5% исходно) оценка соответствовала диапазону «норма», средний балл увеличился сопоставимо в обеих группах. У детей с ВЖК II степени в аналогичном возрасте на фоне дополнительного приема Элькара средний балл увеличился до 53,9±2,5 против 47,7±4,8 исходно (p<0,05), тогда как в группе традиционной терапии он не изменился и ни в одном случае не соответствовал норме (рис. 5). При этом «патологические изменения» выявлялись у 8 (53,3%) пациентов контрольной и 5 (20%) — основной группы (p<0,05).
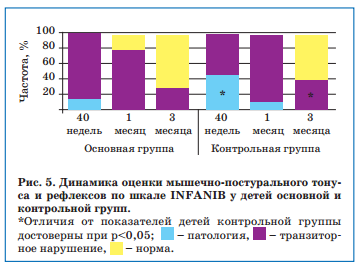
При обследовании недоношенных с ВЖК I степени в постконцептуальном возрасте 1 месяц у всех детей независимо от характера терапии наблюдалась нормализация мышечного тонуса и двигательных функций. У недоношенных с ВЖК II степени в аналогичном возрасте также была отмечена положительная динамика среднего балла по шкале INFANIB относительно исходных значений и в основной (59,5±3,8 против 47,7±4,8 баллов, p<0,05), и в контрольной группе (56,9±3,2 против 46,8±4,3 баллов, p<0,05), но распределение оценок было различным, и только в контрольной группе выявлялись дети с оценками в диапазоне «патология» (рис. 5). При наблюдении в катамнезе к постконцептуальному возрасту 3 мес более полное восстановление мышечно-постурального тонуса и рефлексов отмечалась у детей, получавших дополнительно Элькар.
Положительная динамика показателей НСГ в виде рассасывания ВЖК и образования псевдокист наблюдалась у 9 (56,25%) недоношенных основной группы с ВЖК I степени в среднем через 11,2±1,6 дней наблюдения; при ВЖК II степени — в13 (52%) случаев через 19,1±1,3 дней. В контрольной группе аналогичная динамика наблюдалась у 7 (35%) и 5 (33%) детей через 16,1±1,1 (p<0,05) и 22,1±1,3 (p>0,05) дней наблюдения соответственно.
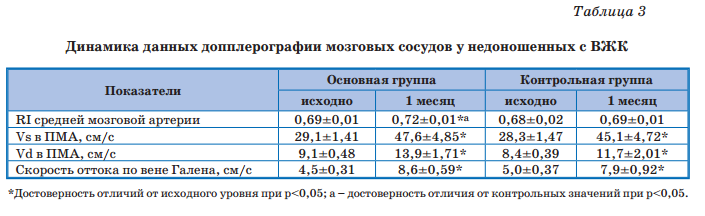
По данным допплерографии сосудов головного мозга (табл. 3) в постконцептуальном возрасте 1 мес у детей основной группы отмечалось статистически значимое (относительно исходных значений и контроля) повышение индекса резистентности средней мозговой артерии в пределах нормальных значений. На фоне лечения в процессе созревания у всех детей отмечалось повышение соответственно скоростей систолического и диастолического кровотока (Vs и Vd), а также скорости оттока по вене Галена, хотя у 1/3 детей сохранялось наличие венозной дисциркуляции. Таким образом, дополнительное применение Элькара способствовало не только уменьшению выраженности клинических проявлений ПГИП ЦНС, но и улучшению процессов регуляции мозгового кровотока.
После проведенной терапии Элькаром отмечалось заметное улучшение функциональных свойств гемоглобина — улучшение его относительной способности связывать лиганды и сохранять конформацию молекулы (за счет уменьшения колебания метиновых мостиков), а также повышение сродства гемоглобина к кислороду, которое однако продолжало отличаться от уровня здоровых детей у пациентов с ВЖК II степени (рис. 6).
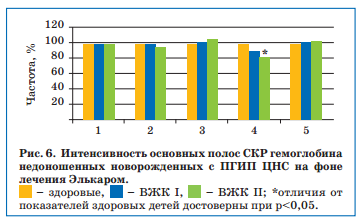
В абсолютном большинстве это были дети с транзиторными нарушениями мышечного тонуса и рефлексов, сохраняющейся венозной дисциркуляци-ей и образованием псевдокист по данным НСГ. К постконцептуальному возрасту 3 мес у всех этих детей сформировался гипертензионно-гидроцефальный синдром.
Заключение
Проведенные исследования позволяют предложить в качестве одного из новых критериев тяжести гипоксии и определения прогноза эффективности лечения новорожденных с ПГИП ЦНС, особенно находящихся на ИВЛ, показатели структурно-функциональных свойств гемоглобина. Детям, перенесшим тяжелую перинатальную гипоксию с развитием поражения ЦНС, нецелесообразно применение высоких концентраций кислорода, так как гемоглобин с измененной молекулярной структурой не в состоянии будет его связывать и высвобождать. Одним из препаратов, коррегирующих гипоксически-обу-словленные нарушения функции ЦНС, отчасти за счет восстановления кислородтранспортной функции гемоглобина и эритроцитов, является Элькар. Очевидно, включение L-карнитина в дозе 100 мг/кг/сут в 2 приема в течение месяца в комплекс терапии перинатальных гипоксически-ишемических и нетравматических ишемически-геморрагических повреждений ЦНС (особенно у недоношенных новорожденных) позволит ускорить процесс восстановления структуры и функций ЦНС и улучшить общее состояние пациентов за счет антигипоксантного и, возможно, ряда других эффектов препарата, значение которых еще предстоит доказать.

На правах рекламы
Ознакомьтесь с инструкцией
Литература
- Rajaratnam JK, Marcus JR, Flaxman AD, et al. Neonatal, postneonatal, childhood, and under-5-mortality for 187 countries, 1970-2010; a systematic analysis of progress towards Millennium Development Goal 4. Lancet. 2010; 14: 1988-2008.
- Байбарина Е.Н., Дегтярев Д.Н. Перинатальная медицина: от теории к практике. Российский вестник перинатологии и педиатрии. 2013; 5: 4-7.
- Donn SM, Chiswick ML, Fanaroff JM. Medico-legal implications of hypoxic-ischemic birth injury. Semin Fetal Neonatal Med. 2014; 19 (5): 317-321.
- Singhal N, Lockyer J, Fidler H, et al. Helping Babies Breathe: global neonatal resuscitation program development and formative educational evaluation. Resuscitation. 2011. doi:10.1016/j.resuscitation.2011.07.010.
- Неонатология: национальное руководство. Н.Н. Володин, ред. М.: ГЭОТАР-Медиа, 2013: 896 с.
- Martinez-Biarge M, Diez-Sebastian J, Kapellou O, et al. Predicting motor outcome and death in term hypoxic-ischemic encephalopathy. Neurology. 2011; 76 (24): 2055-2061.
- Sweetman D, Armstrong K, Murphy JF, Molloy EJ. Cardiac biomarkers in neonatal hypoxic ischaemia. Acta Paediatr. 2012; 101 (4): 338-343.
- Durkan AM, Alexander RT. Acute kidney injury post neonatal asphyxia. J. Pediatr. 2011; 158: e29-33.
- Al Tawil K, Sumaily H, Ahmed IA, et al. Risk factors, characteristics and outcomes of necrotizing enterocolitis in late preterm and term infants. J. Neonatal Perinatal. Med. 2013; 6 (2): 125-130.
- Marret S, Jadas V, Kieffer A, et al. Hypoxic-ischemia and encephalopathy in at-term new-born. Arch. Pediatr. 2014; 21 (9): 1026-1034.
- Herrera-Marschitz M, Neira-Pena T, Rojas-Mancilla E, et al. Perinatal asphyxia: CNS development and deficits with delayed onset. Front Neurosci. 2014; 8: 47.
- Пальчик А.Б., Шабалов Н.П. Гипоксически-ишемическая энцефалопатия новорожденных М.: МЕДпресс-информ, 2009: 228 с.
- Руководство по педиатрии. А.А. Баранов, ред. Неонатология. Г.В. Яцык, ред. М.: «Династия», 2006: 48.
- Alonso-Alconada D, Alvarez A, Alvarez-Granda L, Hilario E. Therapeutic potential of the endocannabinoid system in perinatal asphyxia. Rev Neurol. 2011; 53 (12): 758-764.
- Distefano G, Pratico AD. Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Ital. J. Pediatr. 2010; 36: 63.
- Volpe JJ, Kinney HC, Jensen FE, Rosenberg PA. The developing oligodendrocyte: key cellular target in brain injury in the premature infant. Int. J. Dev. Neurosci. 2011; 29 (4): 423-440.
- Schmidt-Sommerfeld E, Penn D, Novak M, Wolf H. Carnitine in human perinatal fat metabolism. J. Perinat. Med. 1985; 13 (3): 107-116.
- Bonner CM, DeBrie KL, Hug G, et al. Effects of parenteral L-carnitine supplementation on fat metabolism and nutrition in premature neonates. J. Pediatr. 1995; 126 (2): 287-292.
- Scafidi S Fiskum G, Lindauer SL, et al. Metabolism of acetyl-L-carnitine for energy and neurotransmitter synthesis in the immature rat brain. J. Neurochem. 2010; 114 (3): 820-831.









Комментировать