Л.В. Ледяйкина1,2, Л.А. Балыкова2, А.П. Власов2, И.С. Назарова1, М.А. Сюняева2, В.А. Трофимов2
1Мордовский республиканский клинический перинатальный центр, 2Мордовский государственный университет им. Н.П. Огарева, г. Саранск, РФ
Цель работы — изучение роли мембранодеструктивных процессов и нарушений структурно-функционального состояния гемоглобина в патогенезе перинатальных гипоксически-ишемических поражений (ПГИП) ЦНС у новорожденных и оценка возможности их коррекции. Клинико-инструментальными методами с определением фракций липидов и спектроскопией гемоглобина обследованы 226 новорожденных. У 76 недоношенных детей с ПГИП ЦНС легкой и средней степени тяжести оценена эффективность L-карнитина. При ПГИП ЦНС установлены липидный дисбаланс и нарушение свойств гемоглобина, которые усугублялись под действием высоких концентраций кислорода и коррелировали с тяжестью перинатальной гипоксии. Установлен положительный клинический эффект Элькара у недоношенных новорожденных с ПГИП ЦНС, который реализуется отчасти благодаря способности нормализовать липидный состав мембран эритроцитов и структурно-функциональные показатели гемоглобина.
Ключевые слова: перинатальная гипоксия, гипоксическая энцефалопатия, новорожденные, липидный дисбаланс, структурно-функциональное состояние гемоглобина, L-карнитин, Элькар.
Одно из лидирующих мест в структуре заболеваемости и смертности новорожденных и детей первого года жизни традиционно занимают перинатальная гипоксия/асфиксия и ее последствия [1-3]. Тяжелая сочетанная (анте- и интранатальная) асфиксия/гипоксия несмотря на внедрение протокола реанимации и современных нейропротективных стратегий вызывает гибель 0,5-3% новорожденных [4-6], оказывает повреждающее действие на рост и развитие плода в целом и на состояние отдельных органов и систем (постгипоксическая кардиопатия, нефропатия, энтеропатия и др.) с разнообразной клинической картиной [7-10]. Наибольшую опасность и прогностическую значимость среди клинических проявлений и последствий перинатальной гипоксии представляют гипоксически-ишемические поражения центральной нервной системы (ЦНС), нередко являющиеся причиной летальных исходов и играющие ведущую роль в дальнейшей дезадаптации детей и возникновении тяжелых инвалидизирующих заболеваний [11, 12].
В Республике Мордовия на протяжении последних 15 лет благодаря ряду организационно-методических решений (создание в 1997 г. Республиканского перинатального центра, организация работы выездных реаниматологических бригад и др.) уровень младенческой и неонатальной смертности стабильно сохраняется ниже среднероссийских показателей (2,9-6,6 и 5,210,2 на 1000 живорожденных соответственно) и в последние годы имеет тенденцию к снижению. Однако при этом общая заболеваемость новорожденных растет, и в ее структуре преобладают перинатальные гипоксически-ишемические поражения ЦНС (что согласуется с данными Российских эпидемиологических исследований, определяющих диагноз «перинатальной церебральной ишемии» в 700 случаев на 1000 [13]) и замедления роста и питания, в генезе которых в 70-80% случаев лежит хроническая гипоксия плода.
Многие аспекты патогенеза перинатальных гипоксически-ишемических повреждений (ПГИП) органов и систем, особенностей адаптации новорожденных к перинатальной гипоксии и коррекции их последствий до настоящего времени изучены недостаточно [14, 15]. Определенное значение в их развитии имеет изменение структурно-функциональных свойств мембран (в т.ч. олигодендроцитов) вследствие активации свободно-радикального окисления [16]. Разработка данной проблемы даст возможность обосновать новые схемы терапевтического вмешательства в цепь инициированных гипоксией патологических процессов, которые могут существенно снизить тяжесть гипоксически-ишемических повреждений и улучшить жизненный прогноз, в т.ч. у недоношенных новорожденных.
Цель работы: изучить роль нарушений структурно-функционального состояния гемоглобина в патогенезе гипоксически-ишемического поражения ЦНС у новорожденных и оценить возможность их фармакологической коррекции.
Материалы и методы исследования
В клиническое исследование, проведенное с одобрения Локального этического комитета при Мордовском государственном университете, включены 226 новорожденных (из них 86 недоношенных), рожденных и/или находившихся на выхаживании и лечении в ГБУЗ РМ «Мордовский республиканский клинический перинатальный центр» и «Мордовская детская республиканская клиническая больница» с ПГИП ЦНС.
Диагноз ПГИП ЦНС по типу церебральной ишемии (ЦИ) I—III степени, внутрижелудочковых кровоизлияний (ВЖК) I–III степени (в основном у недоношенных) и их сочетание, как основное органное следствие перенесенной гипоксии, установлен на основании комплексного клинико-инструментального обследования в соответствии с действующими рекомендациями Общества специалистов по перинатальной медицине (2002).
У всех детей перинатальный анамнез был отягощен по хронической внутриутробной гипоксии плода (хроническая маточно-плацентарная недостаточность, тяжелые гестозы, предлежание плаценты, рубец на матке, курение, сочетанные соматические заболевания матери) и/или острой асфиксии в родах. У 1/3 детей имели место признаки задержки внутриутробного развития. В остром периоде (первые 28 дней постнатальной жизни) клиническая картина складывалась из признаков гипервозбудимости (преимущественно у доношенных с ЦИ I степени тяжести), синдрома угнетения ЦНС (у недоношенных и доношенных детей с ЦИ II степени), синдромов мышечной гипотонии (25-44% в зависимости от степени тяжести ЦИ) и вегетативно-висцеральных дисфункций (38-71%).
При тяжелом ПГИП ЦНС с массивными ВЖК в клинической симптоматике лидировали падение мышечного тонуса с исчезновением рефлексов (в т.ч. сосательного и глотательного), приступы апноэ, артериальная гипотония и тахикардия, глазная симптоматика (неподвижность взора, постоянный горизонтальный или вертикальный нистагм, нарушение окулоцефалических рефлексов, отсутствие реакции зрачков на свет), снижение гематокрита и гемоглобина в анализах крови, признаки внутричерепной гипертензии (выбухание большого родничка). У 22 новорожденных из 226 (9,1%) отмечались судороги.
Дети были разделены на 3 группы соответственно степени тяжести ПГИП ЦНС (табл. 1). Из исследования исключались дети с пороками развития ЦНС, поражениями травматического и инфекционного генеза, а также с клинически значимой сопутствующей патологией. Контрольную группу составили 50 сопоставимых с ними по полу практически здоровых новорожденных от физиологических беременностей и родов.
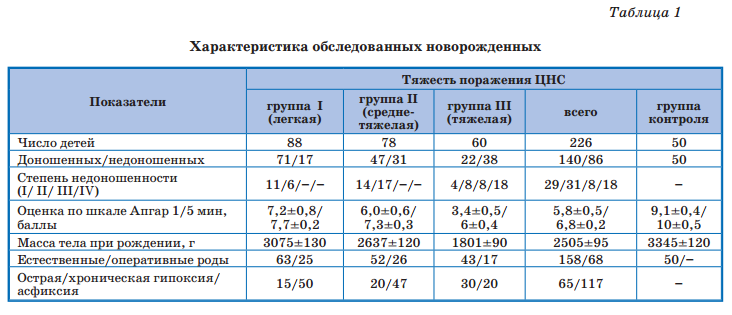
Комплексное обследование новорожденных, помимо общеклинического, включало нейросонографию (НСГ) с допплерографическим исследованием церебральных сосудов, электроэнцефалографию, по показаниям — компьютерную и магнитно-резонанскую томографию и др. РАМАН-спектроскопия гемоглобина проведена 151 новорожденному с перинатальной гипоксией и 50 здоровым детям на аппарате in via Basis фирмы «Renishaw» с короткофокусным высокосветосильным монохроматором. Выписывали полосы спектра гемоглобина при возбуждении лазером с диной волны 532 нм и проводили соотнесение полос с колебаниями связей порфирина.
На 2-м этапе проведено клиническое исследование эффективности L-карнитина (Элькар®, ООО «ПИК-ФАРМА», Россия) в комплексной терапии ПГИП ЦНС у 76 недошенных новорожденных. В исследование включали детей с I-III степенью недоношенности и ишемически-геморрагическими повреждениями ЦНС нетравматического генеза — ВЖК субэпендимальными и/ или интравентрикулярными легкой (n=36) и среднетяжелой (n=40) степени. Гестационный возраст варьировал от 28 до 37 недель, средняя масса тела при рождении составила 2030±40 г. В связи с общей тяжестью состояния, морфо-функциональной незрелостью, наличием синдрома угнетения ЦНС и дыхательных расстройств 27,6% новорожденных проводилась искусственная вентиляция легких (ИВЛ), 49,5% — зондовое и/или частичное парентеральное питание. По данным НСГ у большинства детей имели место ВЖК I–II степени по L.-A. Papile.
Дети были разделены на 2 группы с учетом степени недоношенности и тяжести ПГИП ЦНС. 1-я группа в остром периоде после проведения (по показаниям) реанимационных мероприятий получала стандартное лечение, включающее щадящий режим, рациональное питание и посиндромную терапию, направленную на поддержание адекватной легочной вентиляции и стабильной гемодинамики (раствор альбумина, кристаллоиды, допамин, медикаментозное закрытие гемодинамически значимого открытого артериального протока), коррекцию электролитных нарушений (препараты калия, кальция, натрия, магния), ликвидацию отека мозга (сернокислая магнезия, маннитол, фуросемид), купирование и/или профилактику судорожного синдрома (диазепам, фенобарбитал), нормализацию метаболизма нервной ткани и повышение ее устойчивости к гипоксии (ГОМК, глюкоза), коррекцию гемостаза и проницаемости сосудистой стенки (производные витамина K, этамзилат, свежезамороженная плазма), по показаниям проводили нейрохирургическое лечение и др., а 2-я группа получала дополнительно Элькар в дозе 100 мг/кг/сут в 2 приема в течение месяца. Назначение L-карнитина обосновано данными зарубежных исследований о его незаменимости для недоношенных детей и способности оказывать энерготропное, антиоксидантное и нейропротекторное действие [17-19].
Динамику состояния оценивали по клиническим данным и шкалам оценки мышечно-постурального тонуса INFANIB и нервно-психического развития младенцев BSID-II (Bayley Scales of Infant Development 2-nd ed). При этом на 14-е сутки жизни по шкале INFANIB 87,590% детей с ВЖК I степени имели транзиторные нарушения, а у остальных показатели нервно-психического развития соответствовали диапазону «норма» (более 66 баллов). У пациентов с ПГИП ЦНС средней степени тяжести ни в одном случае нервно-психическое развитие не соответствовало норме, у 48-40% детей выявлялись «транзиторные нарушения» и у 52-60% — «патология».
Полученные данные обработаны статистически с использованием пакета программ «Statistica 8», достоверность результатов оценивали по t-критерию Стьюдента. Корреляционный анализ проводили с использованием критерия Пирсона (при нормальном распределении и линейной зависимости) или коэффициента ранговой корреляции Спирмена.
Результаты и их обсуждение
В ходе комплексного обследования подтвержден факт прямой зависимости выраженности клинико-инструментальных проявлений ПГИП ЦНС от тяжести перенесенной перинатальной гипоксии/асфиксии. Доля детей, рожденных в тяжелой асфиксии, была значимо выше среди детей с ЦИ и ВЖК III степени: 28 из 60 (46,7%) относительно детей I группы (1 из 88 -1,1%, p<0,05). Выявлено, что сатурация кислорода по данным пульсоксиметрии в первые сутки после рождения составила 89,9±2,3% у детей I группы и 79,9±2,2% — в III группе (p<0,05),
а выраженность метаболического ацидоза (рН) 7,1±0,1 при тяжелом ПГИП ЦНС и 7,4±0,1 при ПГИП ЦНС легкой степени (p<0,05). Основной объективный показатель эффективности мозгового кровотока по данным допплерографии — индекс резистентности (RI), оцененный на передней и средней мозговых артериях, имел сильную положительную связь (г=0,94-0,97) с оценкой тяжести гипоксии/асфиксии по шкале Апгар и сатурацией кислорода.
Для изучения некоторых новых аспектов патогенеза гипоксии, в частности, нарушений кислород-транспортирующих свойств гемоглобина как важнейшего механизма формирования кислородной недостаточности у новорожденных с ПГИП ЦНС, были изучены спектры комбинационного рассеивания (СКР) гемоглобина в зависимости от тяжести церебрального повреждения (рис. 1).
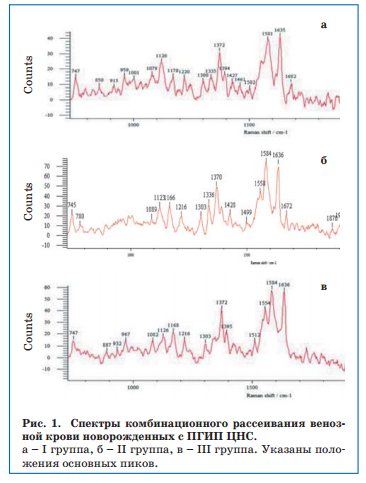
Установлено, что показатели, отражающие сродство гемоглобина к лигандам (к кислороду) (I1355/ I1550)/(I1375/I1580), и способность гемоглобина связывать их (I1355/I1550) уменьшались с увеличением тяжести ПГИП ЦНС (рис. 2).
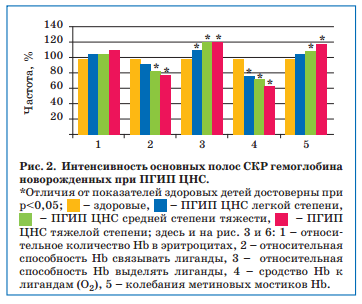
При проведении статистического анализа нами установлена корреляционная зависимость между показателями структурно-функциональных свойств гемоглобина новорожденных и некоторыми клиническими показателями, отражающими тяжесть перинатальной гипоксии и ее последствий, что доказывает их важность и патогенетическую значимость (табл. 2), давая основания для разработки новых подходов к фармакологической коррекции.
Показатели, отражающие способность гемоглобина выделять лиганды (I1375/I1580), а также конформационные изменения гемоглобина (I1375/I1172), у детей с перинатальной энцефалопатией были выше, чем у здоровых, и возрастали по увеличению тяжести повреждения ЦНС. Следовательно, при тяжелом ПГИП ЦНС присоединение кислорода к гемоглобину становится недостаточно эффективным, способствуя усугублению гипоксии. Полученные данные согласуются с известным мнением о нецелесообразности значительного повышения напряжения кислорода во вдыхаемой смеси при проведении ИВЛ новорожденным (особенно недоношенным) с тяжелой перинатальной гипоксией. Доказательства данного положения получены нами в исследованиях in vitro при анализе СКР крови новорожденных с ПГИП ЦНС на фоне подачи кислорода.
Установлено, что показатели, отражающие сродство гемоглобина к кислороду и способность его связывать, у новорожденных с ЦИ в пробах без подачи кислорода были выше, чем в пробах с газацией, и уменьшались пропорционально увеличению потока кислорода. Кроме того, параллельно увеличению потока кислорода менялась и конфигурация пиррольного кольца гемоглобина (что отражает показатель колебания метиновых мостиков), приводя к снижению способности гемоглобина связывать кислород и нарушению его транспортной функции (рис. 3).
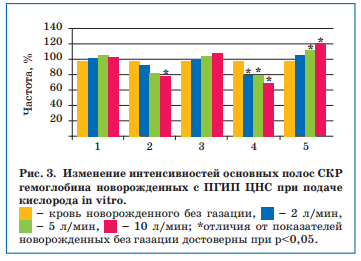
При дополнительном назначении Элькара недоношенным детям с ПГИП ЦНС по типу ВЖК I степени (субэпендимальных и/или интравентрикулярных, небольших паренхиматозных) был получен более значимый клинико-лабораторный эффект, чем при использовании только стандартной терапии. В обеих группах через 1 месяц отмечались улучшение общего состояния, восстановление мышечного тонуса и рефлексов, но при дополнительном приеме Элькара отмечались более быстрая положительная динамика массы тела, более выраженный регресс вегето-висцеральных дисфункций (уменьшение мраморности кожных покровов, частоты и интенсивности срыгиваний) и уменьшение потребности в кислороде.
Положительная динамика массы тела у недоношенных с ПГИП ЦНС легкой степени (по типу ВЖК I степени), среди которых преобладали новорожденные с I степенью недоношенности (по 75% в каждой группе), наступала раньше в группе детей, получавших дополнительно Элькар, наблюдаясь с 3,9±0,41 суток жизни, тогда как в контрольной группе она отмечалась с 5,26±0,36 суток (р<0,05). При этом среднесуточная прибавка массы тела у недоношенных, принимавших Элькар, была достоверно больше по сравнению с детьми, находившимися только на стандартном лечении (28,47±0,29 и 24,15± 0,94 г соответственно, р<0,05). Положительная динамика массы тела у детей с ПГИП ЦНС по типу ВЖК II степени (среди которых почти половину составили дети со II степенью недоношенности) отмечалась с 5,02±0,34 суток жизни при дополнительном лечении Элькаром и с 7,24±0,47 суток жизни — при стандартной терапии и составила 27,23±0,27 и 23,75±0,87 г соответственно (р<0,05). За месяц новорожденные с I степенью недоношенности, получавшие дополнительно Элькар, прибавили в весе в среднем 1002±68,5 против 886,1±56,3 г в контрольной группе (р>0,05). При II степени недоношенности ежемесячные прибавки массы тела составили 950,3±36,3 г в группе Элькара и 829,05±31,0 г в группе стандартной терапии, а при III степени недоношенности — 649,9±26,1 и 546,8±24,2 г соответственно (р<0,05).
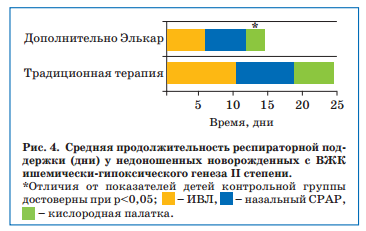
Так, несмотря на то, что среди недоношенных с ВЖК II степени основной группы было несколько больше детей со сроком гестации менее 35 недель (17 из 25 — 68%) по сравнению с контрольной (9 из 15 — 60%), что диктовало необходимость проведения ИВЛ у 9 (36%) и 7 (46,6%) детей с рождения соответственно, потребность в ИВЛ была выше в контрольной группе, сохраняясь к 14-м суткам жизни у 1/3 детей против 3 (17,6%) в контрольной группе (р>0,05). Более того, дети основной группы реже нуждались в повышенной концентрации кислорода: дополнительное использование Элькара позволило в первые 10 суток снизить содержание О2 в дыхательной смеси до 25-28%, а у недоношенных контрольной группы это произошло только к исходу 2-й недели жизни. В целом, общая продолжительность респираторной поддержки у детей с ВЖК II степени в основной группе была статистически значимо меньше против группы контроля (рис. 4).
При динамическом обследовании недоношенных новорожденных с ВЖК I степени в возрасте 40 недель от зачатия по шкале INFANIB у 56,3-55% детей в каждой группе (против 10-12,5% исходно) оценка соответствовала диапазону «норма», средний балл увеличился сопоставимо в обеих группах. У детей с ВЖК II степени в аналогичном возрасте на фоне дополнительного приема Элькара средний балл увеличился до 53,9±2,5 против 47,7±4,8 исходно (p<0,05), тогда как в группе традиционной терапии он не изменился и ни в одном случае не соответствовал норме (рис. 5). При этом «патологические изменения» выявлялись у 8 (53,3%) пациентов контрольной и 5 (20%) — основной группы (p<0,05).
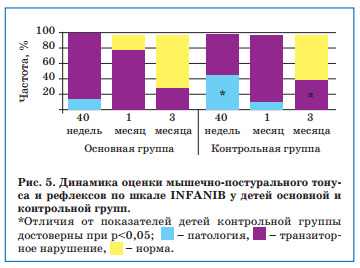
При обследовании недоношенных с ВЖК I степени в постконцептуальном возрасте 1 месяц у всех детей независимо от характера терапии наблюдалась нормализация мышечного тонуса и двигательных функций. У недоношенных с ВЖК II степени в аналогичном возрасте также была отмечена положительная динамика среднего балла по шкале INFANIB относительно исходных значений и в основной (59,5±3,8 против 47,7±4,8 баллов, p<0,05), и в контрольной группе (56,9±3,2 против 46,8±4,3 баллов, p<0,05), но распределение оценок было различным, и только в контрольной группе выявлялись дети с оценками в диапазоне «патология» (рис. 5). При наблюдении в катамнезе к постконцептуальному возрасту 3 мес более полное восстановление мышечно-постурального тонуса и рефлексов отмечалась у детей, получавших дополнительно Элькар.
Положительная динамика показателей НСГ в виде рассасывания ВЖК и образования псевдокист наблюдалась у 9 (56,25%) недоношенных основной группы с ВЖК I степени в среднем через 11,2±1,6 дней наблюдения; при ВЖК II степени — в13 (52%) случаев через 19,1±1,3 дней. В контрольной группе аналогичная динамика наблюдалась у 7 (35%) и 5 (33%) детей через 16,1±1,1 (p<0,05) и 22,1±1,3 (p>0,05) дней наблюдения соответственно.
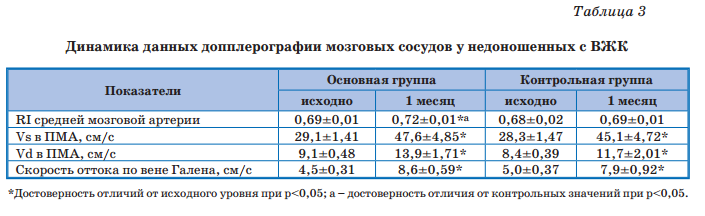
По данным допплерографии сосудов головного мозга (табл. 3) в постконцептуальном возрасте 1 мес у детей основной группы отмечалось статистически значимое (относительно исходных значений и контроля) повышение индекса резистентности средней мозговой артерии в пределах нормальных значений. На фоне лечения в процессе созревания у всех детей отмечалось повышение соответственно скоростей систолического и диастолического кровотока (Vs и Vd), а также скорости оттока по вене Галена, хотя у 1/3 детей сохранялось наличие венозной дисциркуляции. Таким образом, дополнительное применение Элькара способствовало не только уменьшению выраженности клинических проявлений ПГИП ЦНС, но и улучшению процессов регуляции мозгового кровотока.
После проведенной терапии Элькаром отмечалось заметное улучшение функциональных свойств гемоглобина — улучшение его относительной способности связывать лиганды и сохранять конформацию молекулы (за счет уменьшения колебания метиновых мостиков), а также повышение сродства гемоглобина к кислороду, которое однако продолжало отличаться от уровня здоровых детей у пациентов с ВЖК II степени (рис. 6).
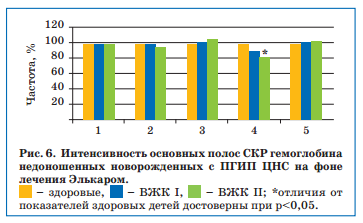
В абсолютном большинстве это были дети с транзиторными нарушениями мышечного тонуса и рефлексов, сохраняющейся венозной дисциркуляци-ей и образованием псевдокист по данным НСГ. К постконцептуальному возрасту 3 мес у всех этих детей сформировался гипертензионно-гидроцефальный синдром.
Заключение
Проведенные исследования позволяют предложить в качестве одного из новых критериев тяжести гипоксии и определения прогноза эффективности лечения новорожденных с ПГИП ЦНС, особенно находящихся на ИВЛ, показатели структурно-функциональных свойств гемоглобина. Детям, перенесшим тяжелую перинатальную гипоксию с развитием поражения ЦНС, нецелесообразно применение высоких концентраций кислорода, так как гемоглобин с измененной молекулярной структурой не в состоянии будет его связывать и высвобождать. Одним из препаратов, коррегирующих гипоксически-обу-словленные нарушения функции ЦНС, отчасти за счет восстановления кислородтранспортной функции гемоглобина и эритроцитов, является Элькар. Очевидно, включение L-карнитина в дозе 100 мг/кг/сут в 2 приема в течение месяца в комплекс терапии перинатальных гипоксически-ишемических и нетравматических ишемически-геморрагических повреждений ЦНС (особенно у недоношенных новорожденных) позволит ускорить процесс восстановления структуры и функций ЦНС и улучшить общее состояние пациентов за счет антигипоксантного и, возможно, ряда других эффектов препарата, значение которых еще предстоит доказать.

На правах рекламы
Ознакомьтесь с инструкцией
Литература
- Rajaratnam JK, Marcus JR, Flaxman AD, et al. Neonatal, postneonatal, childhood, and under-5-mortality for 187 countries, 1970-2010; a systematic analysis of progress towards Millennium Development Goal 4. Lancet. 2010; 14: 1988-2008.
- Байбарина Е.Н., Дегтярев Д.Н. Перинатальная медицина: от теории к практике. Российский вестник перинатологии и педиатрии. 2013; 5: 4-7.
- Donn SM, Chiswick ML, Fanaroff JM. Medico-legal implications of hypoxic-ischemic birth injury. Semin Fetal Neonatal Med. 2014; 19 (5): 317-321.
- Singhal N, Lockyer J, Fidler H, et al. Helping Babies Breathe: global neonatal resuscitation program development and formative educational evaluation. Resuscitation. 2011. doi:10.1016/j.resuscitation.2011.07.010.
- Неонатология: национальное руководство. Н.Н. Володин, ред. М.: ГЭОТАР-Медиа, 2013: 896 с.
- Martinez-Biarge M, Diez-Sebastian J, Kapellou O, et al. Predicting motor outcome and death in term hypoxic-ischemic encephalopathy. Neurology. 2011; 76 (24): 2055-2061.
- Sweetman D, Armstrong K, Murphy JF, Molloy EJ. Cardiac biomarkers in neonatal hypoxic ischaemia. Acta Paediatr. 2012; 101 (4): 338-343.
- Durkan AM, Alexander RT. Acute kidney injury post neonatal asphyxia. J. Pediatr. 2011; 158: e29-33.
- Al Tawil K, Sumaily H, Ahmed IA, et al. Risk factors, characteristics and outcomes of necrotizing enterocolitis in late preterm and term infants. J. Neonatal Perinatal. Med. 2013; 6 (2): 125-130.
- Marret S, Jadas V, Kieffer A, et al. Hypoxic-ischemia and encephalopathy in at-term new-born. Arch. Pediatr. 2014; 21 (9): 1026-1034.
- Herrera-Marschitz M, Neira-Pena T, Rojas-Mancilla E, et al. Perinatal asphyxia: CNS development and deficits with delayed onset. Front Neurosci. 2014; 8: 47.
- Пальчик А.Б., Шабалов Н.П. Гипоксически-ишемическая энцефалопатия новорожденных М.: МЕДпресс-информ, 2009: 228 с.
- Руководство по педиатрии. А.А. Баранов, ред. Неонатология. Г.В. Яцык, ред. М.: «Династия», 2006: 48.
- Alonso-Alconada D, Alvarez A, Alvarez-Granda L, Hilario E. Therapeutic potential of the endocannabinoid system in perinatal asphyxia. Rev Neurol. 2011; 53 (12): 758-764.
- Distefano G, Pratico AD. Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy. Ital. J. Pediatr. 2010; 36: 63.
- Volpe JJ, Kinney HC, Jensen FE, Rosenberg PA. The developing oligodendrocyte: key cellular target in brain injury in the premature infant. Int. J. Dev. Neurosci. 2011; 29 (4): 423-440.
- Schmidt-Sommerfeld E, Penn D, Novak M, Wolf H. Carnitine in human perinatal fat metabolism. J. Perinat. Med. 1985; 13 (3): 107-116.
- Bonner CM, DeBrie KL, Hug G, et al. Effects of parenteral L-carnitine supplementation on fat metabolism and nutrition in premature neonates. J. Pediatr. 1995; 126 (2): 287-292.
- Scafidi S Fiskum G, Lindauer SL, et al. Metabolism of acetyl-L-carnitine for energy and neurotransmitter synthesis in the immature rat brain. J. Neurochem. 2010; 114 (3): 820-831.








Комментировать