Препарат Спазмалгон («БорИагта», Болгария) с абдоминальной болью спастического происхождения. Острая абдоминальная боль. Патофизиологические механизмы развития спастической висцеральной боли. Регуляция моторной функции ЖКТ. Механизмы сокращения и расслабления гладких мышц. Клиническая характеристика спастической абдоминальной боли. Купирование спастической абдоминальной боли: Спазмалгон.
Щербак И. Б.,Редакция «Украинского медицинского журнала»
Резюме. Ведущую роль в структуре абдоминального болевого синдрома играет спастическая боль при различной патологии желудочно-кишечного тракта, являющаяся одним из наиболее частых поводов для вызова скорой медицинской помощи и госпитализации пациентов в хирургические и терапевтические отделения. При отсутствии необходимости экстренного хирургического вмешательства основным способом купирования спастической абдоминальной боли (как органического, так и функционального генеза) является введение анальгетиков и спазмолитических средств. В настоящее время с этой целью все чаще применяют комбинированные препараты, обеспечивающие быстрое и эффективное обезболивание и устранение спазма гладких мышц. Примером такой комбинации является препарат Спазмалгон («БорИагта», Болгария), широко применяющийся во многих странах мира для лечения пациентов с абдоминальной болью спастического происхождения.
Актуальность проблемы
Острую абдоминальную боль рассматривают как ургентную ситуацию: хирургическая оценка этого распространенного в клинической практике симптома необходима для опровержения или подтверждения острой хирургической патологии. В США из 5-10 млн человек, ежегодно обращающихся за медицинской помощью с жалобами на острую боль в животе, у 40% диагностируют признаки острого живота. В то же время у каждого четвертого отмечают «функциональную», или «неспецифическую» абдоминальную боль (Бабак О.Я., 2006).
Следует отметить, что функциональные расстройства (ФР) желудочно-кишечного тракта (ЖКТ) чрезвычайно распространены в популяции: у 20-30% населения земного шара отмечают те или иные их проявления. При этом большинство ФР сопровождается гиперкинетическими реакциями гладких мышц и развитием спазма (Вейн А.М. (ред.), 2000; Белоусова Е.А., 2002). По данным Э.П. Яковенко и соавторов (2009), почти у половины всех больных гастроэнтерологического профиля (в том числе с органической патологией органов пищеварения) отмечают симптомы гипермоторной, и в первую очередь — спастической, дискинезии гладких мышц ЖКТ.
Нередко спазм гладких мышц при ФР ЖКТ является ведущим проявлением заболевания и главной причиной боли. Так, функциональная дисфагия, функциональная боль за грудиной, пилороспазм, кишечные дисфункции (синдром раздраженного кишечника, функциональная диарея, функциональный запор, функциональная абдоминальная боль) в большинстве случаев проявляются нарушением кишечного транзита и спастической болью в животе.
Нарушение эвакуации желчи и растяжение желчного пузыря (ЖП) при ФР его работы также сопровождается абдоминальной болью спастического характера. Среди факторов, способствующих развитию дисфункции ЖП, существует и ряд специфических причин (генетически обусловленная патология гладких мышц ЖП, дискоординация работы ЖП и пузырного или общего желчного протока, воспалительные изменения стенки ЖП и др.) (Белоусова Е.А., 2002).
По данным А.А. Ильченко (2004), 85-90% всех нарушений функции желчевыводящей системы возникает в результате развития органической билиарной патологии. При этом основными причинами боли являются спазм гладких мышц, перерастяжение стенки ЖП и желчных протоков в результате развития билиарной гипертензии, механическое раздражение стенки ЖП и протоковой системы билиарным сладжем или конкрементом.
Тесная анатомо-функциональная взаимосвязь билиарной системы и гастропанкреатодуоденальной зоны обусловливает смешанный характер боли при билиарной патологии. Так, дисфункция сфинктера печеночно-поджелудочной ампулы (сфинктера Одди) проявляется симптомами поражения билиарного тракта, поджелудочной железы или обоими симптомокомплексами. Нарушения работы сфинктерного аппарата также могут быть вызваны органическими нарушениями (стенозом сфинктера Одди или дистальной части общего желчного протока после холецистэктомии, опухолью большого дуоденального (Фатерова) соска).
Спастическая абдоминальная боль при органической патологии ЖКТ (пилороспазм при язвенной болезни, спазм шейки ЖП при желчнокаменной болезни и др.) имеет вторичный характер и усугубляет болевой синдром, вызванный основным деструктивным, воспалительным или неопластическим процессом (Белоусова Е.А., 2002).
Таким образом, в симптомокомплексе различных заболеваний ЖКТ спастическая висцеральная боль является ведущим клиническим проявлением органической и/или функциональной патологии.
Патофизиологические механизмы развития спастической висцеральной боли
В формировании абдоминальной боли участвуют висцеральные болевые рецепторы (ноцицепторы) и окончания чувствительных нервных волокон. Висцеральные ноцицепторы включают:
- высокопороговые механорецепторы (находятся в сердце, пищеводе, бронхах, желчевыводящих путях, тонкой и толстой кишке, мочеточнике, мочевом пузыре, матке), которые реагируют только на выраженный стимул (например чрезмерное сокращение и спазм полых органов), формируя острую боль;
- ноцицепторы «интенсивности» (находятся в сердце, пищеводе, толстой кишке, мочевом пузыре), возбуждающиеся в ответ на слабые механические стимулы;
- «немые», или «молчащие», ноцицепторы, которые активизируются только при повреждении клеток в результате воспаления, ишемии, некроза и обусловливают длительную диффузную боль (Баранская Е.К., 2009; Яковенко Э.П. и соавт., 2009).
Болевые рецепторы локализуются в мышечной и серозной оболочке стенок полых органов и капсуле паренхиматозных органов брюшной полости. Брыжейка и париетальная брюшина также обладают чувствительностью к болевым стимулам, тогда как висцеральная брюшина и большой сальник ее лишены (Яковенко Э.П. и соавт., 2009).
Истинно висцеральная боль возникает при возбуждении ноцицепторов в результате растяжения стенки полого органа (в комбинации с сокращением его гладких мышц) или капсулы паренхиматозного органа, натяжении брыжейки, сосудистых нарушениях. Таким образом, по механизму развития выделяют: спастическую (обусловленную спазмом гладких мышц ЖКТ), дистензионную (связанную с гипомоторной дискинезией гладких мышц и растяжением полого органа), перитонеальную (в основе которой лежит натяжение капсулы или висцерального листка брюшины) и сосудистую висцеральную боль (Садовникова И.И., 2009; Яковенко Э.П. и соавт., 2009).
Сообщение о ноцицептивном раздражении, воспринятое болевыми рецепторами, передается по различным каналам периферической нервной системы (в большинстве случаев проводниками висцеральной боли являются немиелинизированные С-волокна малого диаметра, обладающие низкой скоростью проведения импульса, при раздражении которых ощущается отсроченная тупая диффузная жгучая длительная боль) и затем обрабатывается в центральной нервной системе сложным нейрофизиологическим комплексом, включающим как специфические, так и неспецифические механизмы (Лиманский Ю.П., 1986; Ивашкин В.Т., Шульпекова Ю.О., 2002; Хвисюк А.Н., Федоренко Н.А., 2007; Баранская Е.К., 2009).
Регуляция моторной функции ЖКТ
Моторная функция ЖКТ контролируется многочисленными регулирующими влияниями со стороны центральной и периферической нервной системы, а также большой группой желудочнокишечных пептидов и биоактивных молекул, действующих на уровне подслизистого (Мейснеровского) и межмышечного (Ауэрбаховского) нервных сплетений ЖКТ. Все компоненты этой системы поддерживают равновесие между стимулирующими и ингибирующими импульсами, что способствует поддержанию нормального тонуса и сократительной активности гладких мышц.
Вегетативная нервная система (внешняя иннервация двигательной функции ЖКТ) оказывает разнонаправленное сбалансированное действие: парасимпатическая стимуляция вызывает сокращение, симпатическая — расслабление гладких мышц. Таким образом, усиление парасимпатических или ослабление симпатических влияний способствует нарушению двигательной функции ЖКТ. Наличие интрамуральных нейронов в межмышечном сплетении (внутренняя иннервация) позволяет осуществлять автономный контроль двигательной активности ЖКТ (Белоусова Е.А., 2002; Садовникова И.И., 2009).
Немаловажную роль в развитии спастической абдоминальной боли играет нарушение баланса нейротрансмиттеров и регуляторных пептидов, контролирующих основные кишечные функции.
Серотонин, активирующий несколько подтипов рецепторов (наиболее изучены 5-НТ3 и 5НТ4), играет существенную роль в регуляции моторики ЖКТ, вызывая диаметрально противоположные эффекты. Так, его связь с рецепторами 5НТ3 способствует расслаблению, с 5-НТ4 — сокращению мышечного волокна.
Определенная роль в регуляции моторной функции кишечника отводится эндогенным опиатам: при связывании их с ^и б-опиоидными рецепторами миоцитов происходит стимуляция, а с крецепторами — замедление моторики ЖКТ.
Субстанция Р (группа тахикининов), связываясь с рецепторами миоцитов, повышает моторную функцию последних за счет прямой активации и выделения ацетилхолина.
Соматостатин может как стимулировать, так и ингибировать интрамуральные нейроны, что приводит к аналогичным изменениям моторики.
Непосредственное влияние полипептида мотилина на рецепторы мышечных клеток повышает тонус нижнепищеводного сфинктера, ускоряет опорожнение желудка и усиливает сократительную активность толстого кишечника.
Вазоактивный интестинальный пептид (преимущественная область секреции — подслизистое и межмышечное сплетения в толстом кишечнике) способствует расслаблению мышц нижнепищеводного сфинктера, фундальной части желудка, толстой кишки (Белоусова Е.А., 2002; Ивашкин В.Т. (ред), 2003; Садовникова И.И., 2009).
Таким образом, патогенез гладкомышечного спазма, независимо от уровня поражения, обусловлен нарушением взаимодействий между больным органом-мишенью и регуляторными системами, поскольку любой висцеральный орган и весь ЖКТ в целом находятся под контролем многочисленных регулирующих влияний (Белоусова Е.А., 2002).
Механизмы сокращения и расслабления гладких мышц
Состояние сократительного аппарата гладкомышечных клеток находится в прямой зависимости от ионного состава, где главенствующую роль играют ионы кальция (Са2+). Повышение их концентрации в цитоплазме миоцитов сопровождается сокращением, а снижение — релаксацией мышечного волокна.
Транспорт ионов Са2+ через клеточные мембраны осуществляется посредством специальных кальциевых, или медленных, каналов, которые представлены встроенными в мембрану клетки макромолекулярными белками, содержащими рецепторы, распознающие ионы Са2+. В регуляции транспорта ионов Са2+ участвует ряд нейрогенных медиаторов — ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Так, связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку, что сопровождается деполяризацией мембраны и открытием потенциалзависимых кальциевых каналов, через которые ионы Са2+ поступают в клетку. Взаимодействуя с цитоплазматическим кальцийсвязывающим белком кальмодулином, они активируют киназу легких цепей двигательного белка миозина. Последняя отщепляет фосфорный остаток от молекулы аденозинтрифосфорной кислоты, связанной с волокнами миозина. Благодаря этому миозин приобретает способность к взаимодействию с другим двигательным белком — актином. В результате между актином и миозином устанавливаются «молекулярные мостики», благодаря которым они «сдвигаются» по отношению друг к другу, что приводит к укорочению клетки.
Одним из условий, необходимых для сокращения мышечного волокна, является высокая активность фермента фосфодиэстеразы, которая участвует в расщеплении циклического аденозинмонофосфата (цАМФ) и циклического гуанозинмонофосфата (цГМФ), молекулы которых снижают содержание ионов Са2+ в цитоплазме и тем самым способствуют снижению сократительной активности клетки (Ивашкин В.Т. (ред), 2003; Яковенко Э.П. и соавт., 2009).
Основной механизм снижения тонуса и сократительной активности гладких мышц зависит от импульсов со стороны симпатической нервной системы и стимуляции норадреналином а1адренегических рецепторов наружной мембраны миоцитов, что приводит к открытию быстрых ионных каналов, утечке положительно заряженных ионов из клетки и ее гиперполяризации. В условиях нарастания мембранного потенциала медленные кальциевые каналы прекращают функционировать, концентрация цитозольного Са2+ резко падает и наступает релаксация мышечного волокна.
Клиническая характеристика спастической абдоминальной боли
Классическое проявление висцеральной абдоминальной боли — колика (греч. коНкё — кишечная болезнь) — характеризуется схваткообразной болью в животе высокой интенсивности, при которой периоды нарастания боли чередуются со «светлыми промежутками». Во время очередной «схватки» интенсивность боли быстро нарастает, затем наступает «плато» — период, когда выраженность боли максимальна по интенсивности (продолжается от 15 мин до нескольких часов), после чего боль постепенно стихает. Между приступами болевые ощущения полностью отсутствуют (Губергриц Н.Б., 2010).
Коликообразная боль, как правило, характеризуется высокой интенсивностью. На высоте боли пациенты беспокойны, часто меняют положение тела, мечутся либо принимают вынужденную позу, стараясь найти положение, которое уменьшит страдания.
При чрезмерной интенсивности импульса (например при прохождении камня) или анатомическом повреждении органа (например ущемлении кишки) возникает иррадиирующая боль в участках тела, имеющих общую корешковую иннервацию с пораженным органом (Бабак О.Я., 2006; Яковенко Э.П. и соавт., 2009).
Висцеральная боль характеризуется отсутствием четкой локализации — зоны восприятия ее, как правило, размыты. При повреждении пищевода, желудка, ЖП, билиарных протоков, поджелудочной железы боль локализуется в эпигастральной; при патологии тонкой, слепой кишки — мезогастральной; при поражении толстой кишки, органов малого таза — гипогастральной области. При этом боль ощущается ближе к срединной линии живота, поскольку внутренние органы имеют билатеральную иннервацию.
Абдоминальная боль редко отмечается как самостоятельный симптом и часто сопровождается тошнотой, рвотой, горечью во рту, изжогой, ощущением переполнения в желудке, метеоризмом, поносом, запором и другими симптомами. При острой висцеральной боли нередко отмечают сопутствующие вегетативные реакции (слабость, бледность, потливость, одышку и др.), лихорадку рефлекторного генеза, локальное напряжение мышц передней брюшной стенки (Баранская Е.К., 2005; Садовникова И.И., 2009).
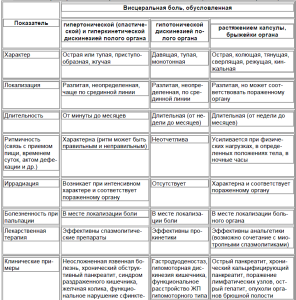
Дифференциально-диагностические признаки различных типов висцеральной абдоминальной боли представлены в таблице.
Таблица. Характеристика висцеральной абдоминальной боли (Яковенко Э.П. и др., 2009)
Купирование спастической абдоминальной боли: Спазмалгон
Известно, что пациентам с неуточненным диагнозом и/или признаками острого живота введение анальгетиков противопоказано. Так, большинство авторов считают ошибочным решение купировать острую абдоминальную боль на догоспитальном этапе в связи с риском нивелирования картины острой хирургической патологии: обезболивание может затруднить диагностику и создать впечатление мнимого благополучия. Отличить в этот период острое хирургическое заболевание от нехирургических причин боли в животе трудно, поэтому при любых проявлениях острой абдоминальной боли от применения анальгетиков следует воздержаться (Бабак О.Я., 2006). В то же время клиническая практика свидетельствует, что в большинстве случаев приступ спастической абдоминальной боли сопровождается значительно выраженным болевым синдромом: страдания пациента в этот период настолько мучительны, что требуют обезболивания. Таким образом, при отсутствии необходимости экстренного оперативного вмешательства применение анальгетиков является необходимым компонентом лечения.
Спазмолитическая терапия не сопровождается непосредственным вмешательством в механизмы болевой чувствительности, не затрудняет диагностику острой хирургической патологии (Ивашкин В.Т. (ред.), 2003). Кроме того, применение спазмолитиков в данном случае является патофизиологически обоснованным. Так, с целью достижения релаксационного эффекта на периферическом уровне, снижения сократительной активности гладких мьшц, устранения спазма и восстановления нормального транзита показано применение релаксантов гладких мышц ЖКТ — холинолитиков и миотропных спазмолитиков, терапевтический эффект которых основан на вмешательстве в механизмы сокращения гладкомышечных клеток.
Антихолинергические средства обладают способностью блокировать мускариновые рецепторы клеточной мембраны, в результате чего снижается внутриклеточная концентрация ионов Са2+, что в конечном итоге приводит к расслаблению мышечного волокна. В настоящее время применение антихолинергических средств в купировании спастической боли считается абсолютно обоснованным и достаточно эффективным. В свою очередь, миотропные спазмолитики, являющиеся препаратами выбора для устранения спазма любого генеза и купирования боли (особенно при ФР), способствуют расслаблению гладких мышц, что сопровождается снижением тонуса полого органа и внутрипросветного давления, восстановлением пассажа содержимого и улучшением кровоснабжения стенки органа (Белоусова Е.А., 2002).
В настоящее время для купирования боли спастического характера все чаще применяют комбинированные препараты, активные компоненты которых обладают взаимодополняющими механизмами действия и способствуют быстрому и эффективному устранению и боли, и спазма.
Оптимальным примером такой комбинации является препарат Спазмалгон («Sopharma», Болгария). Согласно унифицированной анатомотерапевтической и химической классификации лекарственных средств — классификационной системе АТС (AnatomicalTherapeuticChemicalclassificationsystem), препарат относят к спазмолитическим средствам в комбинации с анальгетиками (код препарата — A03DА02) (Компендиум 2010 — лекарственные препараты, 2010). В его составе — три действующих вещества (ненаркотический анальгетик метамизол натрий, миотропный спазмолитик питофенона гидрохлорид и антихолинергическое средство фенпивериния бромид), оказывающих выраженный анальгезирующий и спазмолитический эффект.
Представитель нестероидных противовоспалительных препаратов (НПВП) группы производных пиразолона — метамизол натрий, входящий в состав препарата Спазмалгон, с 1922 г. известен клиницистам как лекарственное средство, обладающее мощным анальгезирующим и жаропонижающим эффектом в сочетании с менее выраженной противовоспалительной и спазмолитической активностью (FendrichZ., 2000). Отметим, что НПВП нашли широкое применение во всем мире и включены в алгоритмы обезболивающей терапии при болевом синдроме различной степени выраженности (Мазуренко О., 2006). За долгую историю применения фармакологические свойства метамизола натрия подробно изучены, а терапевтическая эффективность подтверждена многими исследованиями. В настоящее время препарат по-прежнему очень популярен во многих странах в качестве монокомпонента терапии и в комбинации со спазмолитиками.
По сути метамизол натрий является пролекарством — предшественником лекарственного средства, который превращается в организме в активную форму. Хорошо всасываясь в пищеварительном тракте, он гидролизируется с образованием активного метаболита, 50-60% которого связывается с белками плазмы крови.
Механизм противовоспалительного, анальгезирующего и жаропонижающего действия метамизола натрия обусловлен ингибированием фермента циклооксигеназы и блокированием синтеза простагландинов из арахидоновой кислоты (напомним, что являясь медиаторами воспалительного процесса, эти вещества повышают чувствительность ноцицепторов и таким образом участвуют в механизме восприятия боли). Помимо этого, под влиянием метамизола натрия происходит нарушение проведения болевых экстраи проприоцептивных импульсов, повышение порога возбудимости таламических центров болевой чувствительности, повышение теплоотдачи (Денисенко П.П. и соавт., 2004; Компендиум 2010 — лекарственные препараты, 2010).
Благодаря вышеуказанным свойствам метамизол натрий незаменим при сильной боли, обусловленной спазмом гладких мышц. Его высокая анальгезирующая активность подтверждена в ряде контролируемых исследований (Бутров А.В. и соавт., 2009), а по наблюдениям некоторых авторов, при применении в равных дозах анальгезирующий эффект препарата сравним и в отдельных случаях даже превосходит таковой некоторых опиоидных анальгетиков (SchmiederG. etal., 1993; FendrichZ., 2000; HaenЕ., 2007). Обзор литературы, проведенный F. Arellano, J.A. Sacristan (1990), свидетельствует о целесообразности парентерального введения метамизола натрия в качестве препарата первого выбора при колике в случаях необходимости применения ненаркотических анальгетиков. По наблюдениям Z. Fendrich (2000), побочные эффекты терапии метамизолом натрием выражены нечетко, а лекарственное взаимодействие — минимально, что делает возможным его применение для купирования болевого синдрома различного происхождения.
Второй активный компонент препарата Спазмалгон — питофенона гидрохлорид — обладает прямым миотропным (по отношению к гладким мышцам) спазмолитическим (папавериноподобным) действием. По механизму релаксирующего действия питофенона гидрохлорид является ингибитором фосфодиэстеразы (последняя, как отмечено выше, разрушает внутриклеточный цАМФ и цГМФ, участвующие в механизмах регуляции гомеостаза Са2+ в миоцитах). Это способствует накоплению в миоците цАМФ и цГМФ, что снижает концентрацию Са2+ и приводит к расслаблению гладких мышц. Выраженный и продолжительный антиспастический эффект питофенона гидрохлорида подтвержден в исследованиях invitroи invivo, проведенных S. Bal-Tembeи соавторами (1997).
Фенпивериния бромид, оказывая Мхолиноблокирующее действие, способствует дополнительному расслаблению гладких мышц ЖКТ.
Таким образом, выраженная спазмолитическая и анальгезирующая активность препарата Спазмалгон позволяют применять его с целью симптоматического лечения приступов желчной и кишечной колики, спастической дискинезии желчевыводящих путей и другой патологии, сопровождающейся абдоминальной болью спастического характера.
Форма выпуска препарата (раствор для внутримышечного введения в ампулах по 2 и 5 мл) удобна при необходимости быстрого купирования боли как в домашних условиях, так и в стационаре. При острых эпизодах боли препарат применяют однократно (при необходимости дозу повторяют через 6-8 ч) или короткими курсами — 2-3 дня.
После достижения быстрого терапевтического эффекта можно продолжить лечение пероральными обезболивающими и спазмолитическими средствами.
Литература
- Бабак О.Я. (2006) Острая боль в животе: где хирург, где терапевт? Острые и неотложные состояния в практике врача, 2: 8-13.
- Баранская Е.К. (2005) Боль в животе: клинический подход к больному и алгоритм лечения. Место спазмолитической терапии в лечении абдоминальной боли. Гастроэнтерология, 14(109): 49-57.
- Баранская Е.К. (2009) Терапия абдоминальной боли. Справочник поликлинического врача, 1: 40-43.
- Белоусова Е.А. (2002) Спазмолитики в гастроэнтерологии: сравнительная характеристика и показания к применению. Фарматека, 9: 40-46.
- Бутров А.В., Кондрашенко Е.Н., Ибарра-Пенья Н.А. (2009) Современные НПВП в практике врача анестезиолога-реаниматолога. РМЖ (Русский медицинский журнал), 17(25): 16311635.
- Вейн А.М. (ред.) (2000) Вегетативные расстройства: клиника, лечение, диагностика. Медицинское информационное агентство, Москва, 752 с.
- Губергриц Н.Б. (2010) Желчнокаменная болезнь: от классики к современности. Гастроэнтерология, 1:83-95.
- Денисенко П.П., Бурбелло А.Т., Шабров А.В. (2004) Современные лекарственные средства: клинико-фармакологический справочник практического врача. Нева, Санкт-Петербург, 896 с.
- Ивашкин В.Т. (ред.) (2003) Рациональная фармакотерапия заболеваний органов пищеварения: руководство для практикующих врачей. Литтерра, Москва, 1046 с.
- Ивашкин В.Т., Шульпекова Ю.О. (2002) Нервные механизмы болевой чувствительности. Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 4(12): 16-20.
- Ильченко А.А. (2004) Билиарная патология и абдоминальная боль. Врач, 2: 51-53.
- Компендиум 2010 — лекарственные препараты (2010) В.Н. Коваленко, А.П. Викторов (ред.) МОРИОН, Киев, с. С-122.
- Лиманский Ю.П. (1986) Физиология боли. Здоров’я, Киев, 96 с.
- Мазуренко О. (2006) Если боль застала врасплох… Препарат выбирает посетитель аптеки. Еженедельник Аптека, 19(540) .
- Садовникова И.И. (2009) Абдоминальный болевой синдром: диагностика, лечение. РМЖ (Русский медицинский журнал), 2: 72-75.
- Хвисюк А.Н., Федоренко Н.А. (2007) Нейрофизиологические механизмы боли. Медицина неотложных состояний, 6(13): 7-11.
- Яковенко Э.П., Яковенко А.В., Агафонова Н.А. и др. (2009) Абдоминальные боли: механизмы формирования, рациональный подход к выбору терапии. РМЖ (Русский медицинский журнал), 11(2): 48-53.
- Arellano F., Sacristan J.A. (1990) Metamizole: reassessment of its therapeutic role. Eur. J. Clin. Pharmacol., 38(6): 617-619.
- Bal-Tembe S., Bhedi D.N., Mishra A.K. et al. (1997) HL 752: a potent and long-acting antispasmodic agent. Bioorg. Med. Chem., 5(7): 1381-1387.
- Fendrich Z. (2000) Metamizol — a new effective analgesic with a long history. Overview of its pharmacology and clinical use. Cas. Lek. Cesk., 139(14): 440-444.
- Haen E. (2007) Clinical pharmacology of analgesics. Orthopade, 36(1): 17-22.
- Schmieder G., Stankov G., Zerle G. et al. (1993) Observer-blind study with metamizole versus tramadol and butylscopolamine in acute biliary colic pain. Arzneimittelforschung, 43(11): 1216-1221.









Комментировать