Тенденции. Антибактериальная терапия. Бронхолитическая терапия. Глюкокортикостероиды. Влияние фармакотерапии на частоту обострений ХОБЛ.
Синопальников А.И., Зайцев А.А.
Государственный институт усовершенствования врачей Министерства обороны РФ, Москва
Как свидетельствуют эпидемиологические исследования, хронической обструктивной болезнью легких (ХОБЛ) в странах Евросоюза и Северной Америки страдают от 4 до 10% взрослого населения [1]. В структуре общей смертности среди лиц старше 45 лет ХОБЛ занимает 4-е место, уступая только сердечно-сосудистым, цереброваскулярным заболеваниям и пневмонии, ежегодно становясь причиной смерти более 2,75 млн человек [2]. Не менее важна экономическая составляющая: по величине затрат ХОБЛ занимает лидирующее место среди болезней органов дыхания. В частности, в США ежегодные расходы здравоохранения на лечение больных ХОБЛ в 2002 г. составили 18 млрд долларов, а общий экономический ущерб от заболевания превысил 32 млрд долларов [3]. Кроме всего прочего, эксперты ВОЗ прогнозируют, что к 2020 г. общемировая распространенность ХОБЛ переместится с 12-го места на 5-е, а смертность от этого заболевания к 2030 г. удвоится [4]. Между тем официальная статистика Министерства здравоохранения и социального развития Российской Федерации учитывает порядка 2,4 млн больных ХОБЛ, однако данные выборочных эпидемиологических исследований позволяют предположить, что их число может достигать 16 млн человек.
Установлено, что пациенты с хронической обструктивной болезнью легких переносят от одного до четырех и более обострений заболевания в течение года, и именно частота обострений является одним из наиболее важных факторов, определяющих качество жизни больных ХОБЛ, темпы прогрессирования заболевания и экономические потери [5, 6].
Под обострением хронической обструктивной болезни легких принято понимать ухудшение в состоянии пациента, возникающее остро, сопровождающееся усилением кашля, увеличением объема отделяемой мокроты и/или изменением ее цвета, появлением/нарастанием одышки, которое выходит за рамки ежедневных колебаний и является основанием для модификации терапии [7, 8].
Выделяют обострения инфекционной и неинфекционной природы, имеющие неодинаковый прогноз и требующие различной терапевтической тактики.
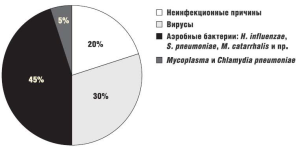
В числе неинфекционных факторов обострения ХОБЛ стоит отметить пренебрежение врачебными предписаниями (низкая комплаентность пациентов). В ряде случаев обострение вызывают нахождение в районах с загрязнением воздуха (промышленные объекты, задымление и пр.), декомпенсации сопутствующих заболеваний внутренних органов, ятрогении (неадекватное использование седативных препаратов, бета-блокаторов), травмы грудной клетки. Достаточно частой причиной обострения является тромбоэмболия ветвей легочной артерии [9]. Однако подавляющее число обострений ХОБЛ (75–80%) имеют инфекционную природу, из них порядка 50% вызывают бактериальные патогены и 30% – вирусы (рис. 1).
Доминирующими микроорганизмами при бактериологическом исследовании образцов мокроты (бронхиального секрета) у больных, переносящих обострение хронической обструктивной болезни легких, являются Haemophilusinfluenzae, а также Streptococcuspneumoniae и Moraxellacatarrhalis, удельный вес которых, по данным различных исследователей, составляет 13–46%, 7–26% и 9–20% соответственно [10]. Реже выделяются Haemophilusparainfluenzae, Staphylococcusaureus, Pseudomonasaeruginosa и представители сімейства Enterobacteriaceae [6]. Удельный вес Mycoplasmapneumoniaeи Chlamydiapneumoniae в развитии обострений составляет порядка 5%, однако точная распространенность данных инфекций неизвестна ввиду трудностей диагностики. До 30% случаев обострений ХОБЛ имеют вирусную природу [13,14]. Чаще всего выявляют риновирусы – 27%, реже вирусы гриппа – 3% [15]. В другом исследовании вирусы гриппа были ответственны за 13% случаев тяжелого обострения ХОБЛ, потребовавшего проведения искусственной вентиляции легких, респираторносинцитиальный вирус был обнаружен в 3% [16]. Столь противоречивые данные, возможно, связаны с сезонными эпидемиями вирусных инфекций.
Результаты исследований свидетельствуют, что степень тяжести хронической обструктивной болезни легких корреспондирует с типом возбудителя. Так, у пациентов с легкой ХОБЛ обострение чаще всего обусловленоS. pneumoniae, по мере прогрессирования болезни (снижение объема форсированного выдоха за 1-ю секунду – ОФВ1, частые обострения) выявляютH. influenzae, M. catarrhalis и Enterobacteriaceae(табл. 1) [11, 12]. В случае тяжелой хронической обструктивной болезни легких нередко обнаруживают P. aeruginosa.
Рисунок 1. Этиология обострений ХОБЛ[8]
Таблица 1. Этиология инфекционного обострения ХОБЛ в зависимости от выраженности нарушений бронхиальной проходимости [58]
| Возбудитель | ОФВ1> 50% | ОФВ1< 50% |
| H. influenzae | 16,3% | 39,4% |
| S. pneumoniae | 25,6% | 12,7% |
| M. catarrhalis | 25,6% | 11,3% |
| P. aeruginosa | 7,0% | 28,2% |
| Enterobacteriaceae | 25,6% | 8,4% |
Классическими признаками, характеризующими обострение заболевания, являются критерии, предложенные N. Anthonisen и соавт. [17]: появление или усиление одышки; увеличение объема отделяемой мокроты и усиление гнойности мокроты. Наличие всех трех вышеуказанных критериев описывается как I тип, двух из них – как II тип, одного –как III тип обострения заболевания.
Антибактериальная терапія
Назначение антибактериальных препаратов оправдано у пациентов с I типом обострения ХОБЛ, так как в данном случае наиболее вероятна инфекционная природа обострения [18]. Кроме того, показаниями к назначению антимикробной химиотерапии являются II тип обострения ХОБЛ (при наличии гнойной мокроты), а также тяжелое обострение (т.е. сопровождаемое признаками острой дыхательной недостаточности).
Эмпирическая антибиотикотерапия инфекционного обострения хронической обструктивной болезни легких предусматривает выбор препаратов, активных в отношении наиболее вероятных бактериальных возбудителей с учетом распространенности механизмов приобретенной устойчивости к различным классам антибиотиков. С учетом вышеперечисленных требований в лечении инфекционного обострения ХОБЛ с успехом применяются беталактамные антибиотики, макролиды и «респираторные» фторхинолоны. Эволюция отношения к вышеперечисленным классам антибиотиков берет свое начало с метаанализа, выполненного I. Siempos и соавт. [19], в ходе которого проводилась сравнительная оценка эффективности и безопасности использования макролидов, «респираторных» фторхинолонов и амоксициллина/клавуланата в терапии обострения ХОБЛ. В результате метаанализа все перечисленные антибиотики продемонстрировали сравнимую эффективность, при этом отмечено, что использование «респираторных» фторхинолонов характеризовалось более высокой микробиологической эффективностью и меньшей частотой рецидивов заболевания по сравнению с макролидами, тогда как прием амоксициллина/клавуланата сопровождался наиболее высокой частотой развития нежелательных явлений (НЯ) по сравнению с другими препаратами.
Стоит отметить, что в настоящее время известны результаты целого ряда исследований в отношении перспектив применения представителей класса «респираторных» фторхинолонов (моксифлоксацин, левофлоксацин и гемифлоксацин). Так, в исследовании GLOBE прием больными гемифлоксацина характеризовался достоверным снижением частоты развития последующих обострений по сравнению с кларитромицином [20]. В исследование MOSAIC включались пациенты в стабильном состоянии, в последующем, при развитии у них обострения (I тип по Antonisen), создавались рандомизированные лечебные группы, получающие антибиотикотерапию по одному из четырех режимов: моксифлоксацин, амоксициллин, кларитромицин или цефуроксим. Наблюдение продолжалось в течение 9 мес. после обострения. Процент выздоровевших больных оказался сходным, однако время безрецидивного периода было более продолжительным в группе, получавшей моксифлоксацин [21].
В исследовании Canut et al. путем создания терапевтической модели результатов было доказано, что фторхинолоны (моксифлоксацин, левофлоксацин, ципрофлоксацин), а также амоксициллин/клавуланат и цефдиторен (цефалоспорин II поколения) обеспечивают наиболее высокую эффективность в лечении пациентов с обострением хронической обструктивной болезни легких по сравнению с эритромицином, азитромицином, кларитромицином и цефаклором [59].
Согласно рекомендациям Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии [8], для лечения больных с простым неосложненным Enterobacteriacea, увеличение частоты выделения резистентных микроорганизмов), рекомендуется применение ингибиторозащищенных пенициллинов или «респираторных» фторхинолонов. Присутствие же факторов риска синегнойной инфекции (ОФВ1 <35% от должных значений, хроническое отделение гнойной мокроты, наличие бронхоэктазов, предшествующее выделение P. aeruginosaиз мокроты) определяет выбор в пользу ципрофлоксацина или левофлоксацина.обострением ХОБЛ в качестве препаратов выбора рекомендуются амоксициллин или макролиды (азитромицин, кларитромицин), а альтернативой является применение «ингибиторозащищенных» пенициллинов или «респираторных» фторхинолонов. Напротив, в группе пациентов, переносящих осложненное обострение ХОБЛ[ii](возрастание этиологической роли представителей семейства.
Согласно результатам метаанализа, включившего 21 исследование (10 698 пациентов), короткие курсы антибиотикотерапии (5 дней) азитромицином или «респираторными» фторхинолонами неосложненного обострения хронической обструктивной болезни легких являются столь же эффективными, как и стандартные режимы применения антибиотиков [60].
Бронхолитическая терапія
B настоящее время наиболее предпочтительными бронхолитиками для лечения обострений ХОБЛ остаются короткодействующие ингаляционные бета2агонисты и антихолинергические препараты [22]. Так, по данным рандомизированных контролируемых исследований, у больных с обострением ХОБЛ не было показано преимуществ ипратропия бромида по сравнению с сальбутамолом или фенотеролом [23].
Напротив, метилксантины (теофиллин, аминофиллин) для внутривенного введения используются как препараты второй линии, т.е. при недостаточной эффективности ингаляционных бронхолитиков. Такая позиция обусловлена исследованиями, показавшими, что добавление аминофиллина к стандартной терапии (ингаляционные бета2-агонисты) не приводит к дальнейшему улучшению состояния больного и спирометрических показателей, но характеризуется значительным ростом числа побочных эффектов, преимущественно со стороны желудочно-кишечного тракта [24]. Существуют данные, говорящие о том, что добавление аминофиллина в комбинацию с бета2-агонистами и парентеральными глюкокортикостероидами (ГКС) у пациентов с острым бронхоспазмом, обусловленным ХОБЛ, ведет к снижению необходимости госпитализации до 7%, по сравнению с 26% в группе не получавших аминофиллин [25]. При этом добавление препарата не сопровождалось достоверным улучшением функциональных показателей. Возможным объяснением данного факта является наличие у метилксантинов небронхолитических свойств (уменьшение феномена воздушной ловушки, улучшение газообмена, физической работоспособности, силы дыхательных мышц и уменьшение диспноэ) [26].
Оптимальной ингаляционной техникой доставки препарата при тяжелом обострении ХОБЛ являются небулайзеры, так как их использование не зависит от возможностей ингаляционного усилия больного.
Вопрос о преимуществах комбинированной терапии бета2-агонист + антихолинергический препарат в лечении обострений ХОБЛ до настоящего времени остается открытым. С одной стороны, существуют отдельные исследования, доказавшие эффективность такой комбинации. Так, например, комбинированная терапия фенотеролом и ипратропия бромидом у пациентов с острой дыхательной недостаточностью, получающих респираторную поддержку, оказалась более действенной по влиянию на респираторные показатели больных, чем монотерапия данными препаратами [27]. В другом исследовании комбинация бета2-агониста и ипратропия бромида в лечении тяжелого обострения ХОБЛ в условиях отделения неотложной помощи позволила сократить время пребывания больных в отделении по сравнению с пациентами, которым назначали только бета2-агонист [28]. Но, с другой стороны, целый ряд рандомизированных исследований не выявил каких-либо преимуществ комбинированной терапии при обострении ХОБЛ [29, 30].
Глюкокортикостероиды
Значительное повышение уровня провоспалительных цитокинов (ИЛ-6) и увеличение числа эозинофилов в слизистой дыхательных путей при обострении хронической обструктивной болезни легких создает предпосылки к применению ГКС. Стоит заметить, что в воспалительном каскаде при стабильном течении ХОБЛ участвуют нейтрофилы, Tлимфоциты (популяция CD8+), цитокины (ИЛ-8, ФНО-альфа), что объясняет невысокий эффект ГКС вне обострения заболевания [31].
Отсутствие адекватной доставки ингаляционных ГКС при обострении ХОБЛ вследствие отека слизистой и гиперсекреции мокроты делает малоэффективным их применение. Напротив, пероральные или внутривенные формы стероидов обладают выраженным противовоспалительным эффектом и в настоящее время являются рекомендуемыми препаратами наряду с бронхолитической терапией для лечения обострений ХОБЛ в стационаре.
Доказательства эффективности системных ГКС при обострении хронической обструктивной болезни легких доказаны в целом ряде клинических исследований (табл. 2). Так, в плацебо-контролируемом исследовании SCOPE (метилпреднизолон 125 мг каждые 6 часов внутривенно в течение трех дней с последующим переходом на пероральный прием преднизолона 60 мг с постепенным снижением дозы) в первый же день терапии в группе, получавшей ГКС, был отмечен прирост ОФВ1 на 100 мл выше по сравнению с плацебо [32]. Кроме того, применение ГКС позволило сократить длительность пребывания больных в стационаре (8,5 дней против 9,7) и характеризовалось снижением случаев неэффективности терапии. В другом исследовании применение пероральной формы преднизолона в течение 14 дней сопровождалось более высоким приростом ОФВ1 по сравнению с плацебо (в среднем на 90 мл в день против 30 мл в день в группе плацебо) и уменьшением продолжительности госпитализации (7 дней против 9) [33]. При этом спирометрические показатели через 6 недель после госпитализации не отличались от таковых на 5-й день терапии ГКС, что говорит о быстром, максимально возможном эффекте системных ГКС при обострении ХОБЛ.
Таблица 2. Результаты исследований эффективности использования кортикостероидов при ХОБЛ по сравнению с плацебо [35, 36]
| Исследование | Прирост ОФВ1 | Частота обострений | НЯ |
| Niewoehner D. и соавт.,2002 [32] | ↑ | ↓ | ↑ |
| Davies L. и соавт., 1999[33] | ↑ | ↓ | |
| Aaron S. и соавт., 2003[34] | ↑ | ↓ | ↑ |
В исследовании S. Aaron и соавт. (2003) показано, что прием системных ГКС, наряду с более выраженным ростом ОФВ1, характеризуется увеличением временного интервала до следующего обострения [34].
Системные стероиды следует принимать курсами не более 14 дней, предпочтительны средние дозы (эквивалент 30 мг/сут преднизолона внутрь) и пероральный прием препаратов. В ряде случаев (тяжелое обострение ХОБЛ, сопровождающееся выраженной дыхательной недостаточностью) требуется внутривенное введение ГКС.
Влияние фармакотерапии на частоту обострений ХОБЛ
В ряде исследований и метаанализе, включавшем только рандомизированные исследования длительностью более 6 мес., показано, что длительное применение ингаляционных ГКС способствует снижению частоты обострений ХОБЛ преимущественно у больных с выраженными вентиляционными нарушениями (ОФВ1 <50%) [37–39]. Однако топические ГКС не влияют на долговременное падение ОФВ1 и не снижают показатели общей смертности, кроме того, их использование характеризуется риском появления ряда значимых побочных явлений. В этой связи эксперты GOLD рекомендуют лечение ингаляционными ГКС только у пациентов с тяжелыми формами ХОБЛ и повторяющимися обострениями.
В отношении комбинированных препаратов (длительно действующий бета2-агонист + ингаляционный ГКС) существуют достоверные доказательства положительного влияния на частоту обострений у больных ХОБЛ. Так, в исследовании P. Kardos и соавт. (2007) [40] терапия сальмотеролом/флутиказона пропионатом в течение 44 недель была эффективнее, чем применение сальмотерола, и характеризовалась снижением общего числа обострений и количества тяжелых обострений. По результатам исследования TORCH комбинация сальмотерол/флутиказона пропионат позволяет снизить количество среднетяжелых и тяжелых обострений на 25% в год по сравнению с плацебо (p<0,001), на 12% по сравнению с сальмотеролом (p<0,012), на 9% по сравнению с флутиказона пропионатом (p<0,024) и на 17% по сравнению с плацебо снижает общее число обострений, требующих госпитализации [41].
Длительное применение антихолинергического препарата тиотропия бромида также характеризуется снижением частоты среднетяжелых и тяжелых обострений ХОБЛ [42]. В октябре 2008г. были опубликованы результаты 4-летнего периода в рамках исследования UPLIFT (изучение долгосрочного влияния тиотропия бромида у больных ХОБЛ), согласно которым длительное применение тиотропия бромида на 14% по сравнению с плацебо снижало риск развития обострений и связанных с ним госпитализаций [43].
Кроме всего прочего, существуют данные метаанализа, включавшего порядка 35 исследований (26 786 пациентов), согласно которым применение бета2-агонистов длительного действия и использование тиотропия бромида характеризуется снижением частоты обострений. У пациентов с выраженными нарушениями бронхиальной проходимости (ОФВ1 < 40%) наиболее оправдано применение тиотропия и комбинации «длительно действующий бета2-агонист + ингаляционный ГКС», так как эти режимы более эффективны, чем монотерапия бета2-агонистами длительного действия (рис. 2) [61].
Рисунок 2. Длительно действующий антихолинергеческий препарат vs ингаляционные ГКС vs комбинация «длительно действующий бета2—агонист + ингаляционный ГКС» у пациентов с ХОБЛ в зависимости от выраженности вентиляционных нарушений [61]
Одним из важных факторов развития обострений хронической обструктивной болезни легких является вирусная инфекция. Доказано, что вакцинация противогриппозными вакцинами способна снизить частоту тяжелых обострений ХОБЛ [44] и общую смертность в целом на 50% [45]. Таким образом, ежегодная вакцинация противогриппозными вакцинами должна проводиться всем пациентам, страдающим ХОБЛ.
Использование 23-валентной пневмококковой вакцины позволяет снизить частоту обострений ХОБЛ и развитие внебольничной пневмонии [46], в этой связи вакцинация рекомендована пациентам старших возрастных групп (>65 лет) и больным с тяжелой ХОБЛ (ОФВ1 <40%) вне зависимости от возраста.
В 2008 г. было опубликованы данные исследования, согласно которым применение комбинированной вакцинации с использованием 23-валентной пневмококковой вакцины и вакцины против гриппа достоверно снижает частоту обострений (р=0,022) у пациентов с ХОБЛ по сравнению с моновакцинацией против гриппа [47].
В отношении профилактического применения антибиотикотерапии с целью уменьшения частоты и выраженности обострений ХОБЛ до настоящего времени не утихают дискуссии. В ряде исследований была доказана эффективность химиопрофилактики, показаны целевые группы (пациенты с частыми обострениями более 4 раз в год) [48, 49], однако в других действенность данного метода подвергается серьезному сомнению [50, 51]. Впрочем, стоит заметить, что указанные исследования проводились достаточно давно и, возможно, наличие современных антибактериальных препаратов и дальнейших исследований позволит яснее высказаться в пользу химиопрофилактики обострений ХОБЛ. Однако пока эксперты программы GOLD не рекомендуют широкое профилактическое использование антибиотиков при ХОБЛ.
В настоящее время имеется целый ряд доказательств уменьшения частоты эпизодов обострения ХОБЛ на фоне приема N-ацетилцистеина у больных с частыми обострениями [52–54]. Так, в рандомизированном исследовании N. Hansen и соавт. прием больными N-ацетилцистеина в дозе 600 мг 2 раза в сутки [55] характеризовался уменьшением числа обострений на 40% по сравнению с плацебо. Метаанализ С. Stey и соавт. также подтвердил снижение количества обострений ХОБЛ при длительной (до 6 мес.) терапии N-ацетилцистеином [56]. Однако проведенное в 2005 г. масштабное исследование не выявило влияния препарата на частоту обострений, за исключением пациентов, не принимавших ингаляционные ГКС [57], что в конечном итоге определило пока сдержанное отношение экспертов к данному методу лечения [7].
Существуют данные о положительном влиянии больших доз N-ацетилцистеина непосредственно при обострении хронической обструктивной болезни легких. Так, в исследовании R. Zuin и соавт. больные с обострением в дополнение к стандартной терапии получали плацебо, N-ацетилцистеин в дозе 600 мг/сут и 1200 мг/сут. В группах, получающих N-ацетилцистеин, к 10-му дню было отмечено улучшение ОФВ1, более выраженный регресс клинических симптомов, кроме этого выявлено более быстрое по сравнению с плацебо снижение уровней Среактивного белка и ИЛ-8 [58].
ЛИТЕРАТУРА
1. Roche N., Huchon G. // Rev. Prat.– 2004.– Vol.54, N13.– P.1408–1413.
2. World Health Report 2000. Health systems:improving performance. Annex table 3. – Geneva,2000.
3. Mapel D., Chen J.C., George D. et al. // Manag.Care Interface.– 2004.– Vol.17, N4.– P.61–66.
4. Lopez A.D., Murray C. // Nat. Med.– 1998.–Vol.4.– P.1241–1243.
5. Fein A., Fein A.M. // Curr. Opin. Pulm. Med.–2000.– Vol.6, N2.– P.122–126.
6. Donaldson G.C., Seemungal T., Bhowtnik A. et al.// Thorax.– 2002.– Vol.57.– P.847–852.
7. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких (пересмотр 2007): Пер. с англ. под ред. А.Г. Чучалина.– М., 2008.– 100 c.
8. Синопальников А.И., Козлов Р.С., Романовских А.Г., Рачина С.А. // Рос. Мед. Вести.– 2006.– T.XI, № 1.– C.4–18.
9. Derenne J.P., Fleury B., Pariente R. // Amer. Rev.Respir. Dis.– 1988.– Vol.138.– P.1006–1033.
10. Sethi S. // The Proceedings of the AmericanThoracic Society.– 2004.– Vol.1.– P.109–114.
11. Eller J., Ede A., Schaberg T. et al. // Chest.–1998.– Vol.113, N6.– P.1542–1548.
12. Miravitlles M., Espinosa C., Fernandez-Lazo E. et al.// Chest.– 1999.– Vol.116, N1.– P.40–46.
13. Sethi S., Murphy T. F. // Clin. Microbiol. Reviews.–2001.– Vol.14, N2.– P.336–363.
14. Ball P. // Chest.– 1995.– Vol.108.– P.43–52.
15. Seemungal T.A., Harper-Owen R., Bhowmik A. et al.// Thorax.– 1999.– Vol.54, Suppl. 3.– Abstract A70.
16. Soler N., Torres A., Ewig S. et al. // Am. J. Respir.Crit. Care Med.– 1998.– Vol.157.– P.1498–1505.
17. Anthonisen N.R., Manfreda J., Warren C.P. et al. // Ann. Intern. Med.– 1987.– Vol.106.– P.196–204.
18. Saint S., Bent S., Vittinghof E., Grady D. // JAMA.–1995.– Vol.273.– P.957–960.
19. Siempos II. Dimopoulos G., Korbila I.P., Manta K., Falagas M.E. // Eur. Respir. J.– 2007.– Vol.29.–P.1127–1137.
20. Wilson R., Schentag J.K., Ball P., Mandell I.A. // Clin. Terap.– 2002.– Vol.24.– P.639–652.
21. Wilson R., Allegra L., Huchon G. et al. // Chest.–2004.– Vol.125.– P.953–964.
22. Celli B.R., MacNee W. // Eur. Respir. J.– 204.–Vol.23, N6.– P.932–946.
23. Rebuck A., Karpel J.P., Pesin J. et al. // Chest.–1990.– Vol.98.– P.835–839.
24. Rice K.L., Leatherman J.W., Duane P.G. et al. //Ann. Intern. Med.– 1987.– Vol.107, N3.– P.305–309.
25. Wrenn K., Slovis C.M., Murphy F., Greenberg R.S.// Ann. Intern. Med.– 1991.– Vol.115.– P.241–247.
26. Kirsten D.K., Wegner R.E., Jorres R.A., Magnussen H. // Chest.– 1993.– Vol.104.– P.1101–1105.
27. Fernandez A., Munoz J., de la Calle B. et al. // Intensive Care Med.– 1994.– Vol.20.– P.199–202.
28. Shrestha M., O’Brien T., Haddox R. et al. // Ann.Emerg. Med.– 1991.– Vol.20, N11.– P.1206–1209.
29. O’Driscoll B.R., Taylor R.J., Horsley M.G. et al. // Lancet.– 1989.– Vol.1.– P.1418–1420.
30. Rebuck A., Chapman K. R., Abboud R. et al. //Am. J. Med.– 1987.– Vol.82.– P.59–64.
31. Wedzicha J.A. // Thorax.– 2000.– Vol.55, Suppl.1.– P.23–27.
32. Niewoehner D.E., Erbland M.L., Deupree R.H. et al.// N. Engl. J. Med.– 1999.– Vol.340.– P.1941–1947.
33. Davies L., Angus R.M., Calverley P.M. // Lancet.–1999.– Vol.354.– P.456–460.
34. Aaron S.D., Vandemheen K.L., Hebert P. et al. // N. Engl. J. Med.– 2003.– Vol.348.– P.2618–2625.
35. Therapeutic Strategies in COPD.– Oxford, 2005.
36. СинопальниковА.И., ВоробьевА.В. // Consilium medicum.– 2006.– T. 8, №3.– С.52–55.
37. Burge P.S. // Thorax.– 1999.– Vol.54, N4.– P.287–288.
38. Burge P.S., Calverley P., Jones P.W. et al. // BMJ.– 2000.– Vol.320, N7245.– P.1297–1303.
39. Alsaeedi A., Sin D.D., McAlister F.A. // Am. J.Med.– 2002.– Vol.113, N1.– P.56–65.
40. Kardos P., Wensker M., Glaad T., Vodelmeier C. // Am. J. Respir. Crit. Care Med.– 2007.– Vol.175.–P.144–149.
41. Сelli B., Calverley P., Anderson J.A., Ferguson G.T.// Eur. Respir. J.– 2006.– Vol.28, Suppl. 50.– P.34.
42. Busasco V., Hodder R., Miravitlles M. et al. // Thorax.– 2003.– Vol.58.– P.399–404.
43. Tashkin D.P., Celli B., Senn S. et al. // N. Engl. J.Med.– 2008.– Vol.359.– P.1543–1544.
44. Wongsurakiat P., Maranetra K.N., Wasi C. et al. // Chest.– 2004.– Vol.125, N6.– P.2011–2020.
45. Nichol K.L., Margolis K.L., Wuorenma J., VonSternberg T. // N. Engl. J. Med.– 1994.– Vol.331, N12.– P.778–784.
46. Jackon L.A., Neuzil K.M., Yu O. et al. // N. Engl. J.Med.– 2003.– Vol.348, N18.– P.1747–1755.
47. Furumoto A., Ohkusa Y., Chen M. et al. // Vaccine.– 2008.– Vol.26, N33.– P.4284–4289.
48. Black P., Staykova T., Chacko E. et al. //Cochrane Database Syst. Rev.– 2003.– Vol.1.–CD004105.
49. Murphy T.F., Sethi S. // Am. Respir. Dis.– 1992.–Vol.146.– P.1067–1083.
50. Fletcher C.M., Ball J.D., Carstairs L.W. et al. // BMJ.– 1966.– Vol.1, N5499.– P.1317–1322.
51. Johnston R.N., McNeill R.S., Smith D.H. et al. //Br. Med. J.– 1969.– Vol.4, N678.– P.265–269.
52. Poole P., Black P. The effect of mucolytic agents on exacerbation frequency in chronic bronchitis.The Cochrane Library. – Oxford, 1998.
53. Poole P., Black P. // BMJ.– 2001.– Vol.322.–P.1271–1274.
54. Sutherland E.R. et al. // J. COPD.– 2006. – Vol.3.–P.195.
55. Hansen N.C., Skriver A., Brorsen-Riis L. et al. // Respir. Med.– 1994.– Vol.88, N7.– P.531–535.
56. Stey C., Steurer J., Bachmann S. et al. // Eur.Respir. J.– 2000.– Vol.16.– P.253–262.
57. Decramer M., Rutten-van-Molken M., Dekhuijzen P.N. et al. // Lancet.– 2005.– Vol.365, N8470.– P.1552–1560.
58. Zuin R., Palamidese A., Negrin R. et al. // Clin.Drug. Investig.– 2005.– Vol.25, N6.– P.401–408.
59. Canut A., Martin-Herrero J.E., Labora A., Maortua H.// J. of Antimicrob. Chemother.– 2007.– Vol.60.– P.605–612.60
. El Moussaoui R., Roede B.M., Speelman P. et al.// Thorax. – 2008.– Vol.63, N5.– P.415–422.
61. Puhan M.A., Bachmann L.M., Kleijnen J. et al. // BMC Med.– 2009. – Vol.7.– P.2.
Статья предоставлена Представительством АО«Bauer Schering Pharma Aktiengesellschaft» (ФРГ) в Республике Беларусь
Источник: Медицинские новости. – 2010. – №10. – С. 13-17.








Комментировать