Остеоартроз и остеопороз как наиболее распространенные возраст- ассоциированные заболевания в популяции. Изучение частоты встречаемости остеоартроза у пациентов с низкотравматическими переломами шейки бедренной кости в РНПЦ радиационной медицины и экологии человека. Результаты проведенных исследований.
Романов Г.Н., Руденко Э.В.
РНПЦ радиационной медицины и экологии человека, Гомель, Белорусская медицинская академия последипломного образования, Минск
Резюме. Остеоартроз (ОА) и остеопороз (ОП) относятся к наиболее распространенным возраст- ассоциированным заболеваниям в популяции. С увеличением возраста доля лиц, у которых возможно сочетание указанных заболеваний, увеличивается, что требует изучения особенностей оказания лечебнодиагностической помощи данной категории пациентов. Изучение частоты встречаемости ОА у пациентов с низкотравматическими переломами шейки бедренной кости (ШБК) проведено в РНПЦ радиационной медицины и экологии человека. Согласно полученным данным, у 43,6% женщин и 35,3% мужчин с переломами ШБК отмечено наличие в анамнезе ОА. При анализе частоты падений выявлено двукратное увеличение вероятности падений у пациентов с ОА в сравнении с группой пациентов, у которых отсутствуют заболевания суставов. Пациенты с ОА, несмотря на повышенные значения минеральной плотности костной ткани, имеют риск развития низкотравматических переломов, превышающий общепопуляционный. Одним из ключевых моментов в увеличении риска развития переломов при ОА является наличие дефицита витамина Д. Основная роль в медикаментозной коррекции (снижении) риска падений принадлежит комбинированным препаратам витамина Д в сочетании с препаратами кальция.
Ключевые слова: остеопороз, остеоартроз, витамин Д, препараты кальция.
Взаимосвязь между остеоартрозом (ОА) и остеопо- розом (ОП) является предметом пристального изучения специалистов многих медицинских направлений. Длительное время существовало стойкое убеждение об отсутствии всякой связи между ОА и ОП как о взаимоисключающих нозологических единицах [1, 2]. Однако в последние несколько лет был опубликован ряд статей о наличии точек соприкосновения не только в этиологии и патогенезе, но и в лечении этих двух заболеваний [3, 4].
Согласно статистическим данным, ОА и ОП относятся к наиболее распространенным возраст- ассоциированным заболеваниям со значительным преобладанием лиц женского пола. ОА встречается у каждого третьего пожилого человека, достигая 70% среди лиц старше 65 лет [5]. ОП ввиду отсутствия выраженных клинических проявлений регистрируется гораздо реже, но его распространенность прогрессивно увеличивается от 20% у женщин в возрасте 55 лет до 50% в популяции старше восьмидесяти лет [6, 7]. Из приведенных данных следует, что с возрастом увеличивается доля пациентов, у которых возможно сочетание указанных заболеваний, другими словами, у пациента с осте- опорозом может диагностироваться остеоартроз и наоборот.
К ведущим этиологическим факторам в развитии постменопаузального ОП относятся дефицит эстрогенов, а также генетическая предрасположенность к ОП, ассоциированная с полиморфизмом гена ESR2 [8]. Вместе с тем, согласно проведенным эпидемиологическим исследованиям, рост заболеваемости ОА также тесно связан с наступлением менопаузы у женщин и, соответственно, с дефицитом эстрогенов [9]. Выявленная схожесть в развитии ОА и ОП положила начало изучению общих этиологических и патогенетических звеньев этих двух широко распространенных заболеваний.
Оценка минеральной плотности костной ткани у пациентов с ОА
Основным методом диагностики ОП в настоящее время является рентгеновская осевая двухэнергетическая денситометрия (ДРА). Метод позволяет с высокой точностью количественно измерить минеральную плотность костной ткани (МПК). Стандартные зоны исследования: поясничный отдел позвоночника и проксимальные отделы бедер. Выбор этих участков скелета обусловлен возможностью дифференцированно прогнозировать риск наиболее значимых переломов позвоночника и/или шейки бедренной кости (ШБК). У пациентов с ОА часто рентгенологически регистрируются остеофиты, особенно при ОА коленных и тазобедренных суставов. Наличие остеофитов связано с прямым или косвенным увеличением МПК не только в зоне выявления остеофитов, но и в поясничном отделе позвоночника [10]. Однако увеличение костной плотности не только не приводит к снижению количества переломов у пациентов с ОА, но даже может быть связано с некоторым увеличением риска переломов [11]. Данные денситометрических исследований широко применяются для прогнозирования риска переломов. Для оценки 10-летнего риска переломов с использованием системы FRAX® необходимо учитывать данные Т-критерия ШБК. У пациентов с ОА этот показатель заведомо выше, чем у пациентов без ОА. Это может привести к существенной недооценке риска развития низкотравматического перелома и неправильному выбору тактики мониторинга и лечения [12].
Субхондральная костная ткань при ОА
Субхондральная кость (СК) находится в области эпифиза под суставным хрящом и включает в себя пластину СК, трабекулярную и субартикулярную части. Пластина СК в свою очередь состоит из кальцинированного хряща и тонкого кортикального слоя, отделенного от гиалинового хряща демаркационной линией, которую невозможно определить invivoсовременными методами визаулизации. При нормальном функционировании сустава СК обеспечивает важные амортизирующие функции и ослабляет около 30% нагрузки на сустав. Кроме этого, СК является проводником питательных веществ для хряща и способствует удалению продуктов метаболизма. В процессе развития ОА субхон- дральная кость подвергается структурным изменениям, включая увеличение скорости метаболизма костной ткани, нарушение архитектоники с микропереломами, а также неоваскуляризацию и костный склероз на более поздних стадиях ОА. В результате СК утолщается, изменятся ее структура и вследствие этого нарушается метаболизм одной из важнейших функциональных субъединиц сустава. Таким образом, изменения в СК — решающий фактор в патогенезе ОА.
Независимо от локального взаимодействия между СК и суставными хрящами системный ОП может участвовать в прогрессировании ОА посредством увеличения ремоделирования субхондральной кости, что изменяет ее свойства и может способствовать раннему проявлению признаков ОА. Таким образом, у пациентов со сниженной МПК или с установленным диагнозом ОП может быть повышен риск нарушения целостности хряща. В соответствии с полученными данными, следует ожидать положительный эффект у пациентов с ОА при назначении препаратов, предназначенных для лечения остеопороза [13].
Риск переломов у пациентов с ОА
Итак, основным методом диагностики ОП является ДРА с определением Т-критерия согласно рекомендациям ВОЗ. Низкие значения Т-критерия служат достоверным и наиболее существенным фактором риска развития остеопоротического перелома. Интуитивно следует предположить, что нормальные или повышенные значения Т-критерия будут способствовать снижению риска переломов, в частности у пациентов с ОА. Однако, согласно исследованиям G.Jonesetal., несмотря на статистически значимо более высокие показатели МПК позвоночника и ШБК, у пациентов с ОА обоих полов не выявлено достоверного снижения риска переломов в сравнении с группой пациентов без ОА [14].
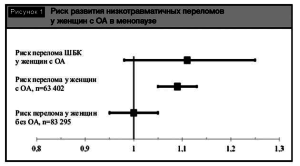
Результаты наиболее масштабного исследования по выявлению риска переломов у женщин с ОА были опубликованы в 2011 г. в рамках исследования Women’sHealthInitiative[15]. В исследование было включено более 146000 женщин в менопаузе, разделенных на две группы по наличию ОА в анамнезе. Установлено, что риск переломов костей скелета в группе пациенток с ОА превышает таковой у женщин без ОА и составляет 1,09 (95% ДИ 1,051,13; p<0,001). При изолированной оценке подгруппы с переломами ШБК отмечено увеличение риска в сравнении с контрольной группой, однако не был достигнут необходимый уровень статистической значимости (рис. 1).
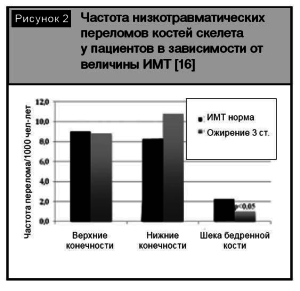
Важную роль в этологии и прогрессировании ОА играет избыточный вес. Частота встречаемости избыточного веса и ожирения у пациентов с ОА достигает 90-100%. Существует прямая зависимость между индексом массы тела (ИМТ) и МПК: с увеличением ИМТ изменяются геометрические параметры костей скелета с перераспределением нагрузки. При проведении сравнительного анализа частоты переломов конечностей у пациентов с нормальным ИМТ и ожирением 3-й степени не выявлено статистически значимого увеличения частоты переломов в группе пациентов с ожирением в сравнении с контрольной группой, за исключением переломов ШБК (рис. 2).
В другом международном крупномасштабном исследовании, которое включало более 60000 женщин из 10 европейских стран, доказано увеличение риска переломов верхних конечностей и лодыжки у пациенток с ожирением в сравнении с женщинами с нормальным ИМТ. Одним из важных выводов данного исследования было установление причинной связи между риском падения и увеличением частоты переломов конечностей у пациенток с ожирением [16].
Дефицит витамина Д и остеоартроз
Классические эффекты витамина Д в организме изучены достаточно хорошо и в основном связаны с поддержанием кальций-фосфорного гомеостаза через действие паратироидного гормона. Кроме перечисленных эффектов существуют другие, не менее важные, функции витамина Д в организме человека. Витамин Д участвует в дифференциров- ке остеобластов и остеокластов, способствует увеличению мышечной силы и увеличению подвижности суставов. Указанные свойства исключительно важны для поддержания мышечного баланса и, соответственно, предотвращают падения. В рамках Роттердамского исследования была изучена взаимосвязь между дефицитом витамина Д и особенностями течения ОА. На большой когорте пациентов (п=1248) показано, что в подгруппе с лабораторно подтвержденным дефицитом витамина Д в 1,5 раза чаще регистрировались падения и в 1,8 раза чаще отмечалось рентгенологическое сужение суставной щели [17].
Проведено большое количество рандомизированных плацебо-контролируемых исследований (РКИ) по изучению влияния приема витамина Д на склонность к падениям. Всего в этих исследованиях приняло участие более 45000 пациентов, большинство из которых составили лица женского пола. В результате мета-анализа установлено, что статистически значимого снижения риска падений можно достичь только с помощью приема комбинированных препаратов кальция и витамина Д. Наибольшее количество элементарного кальция в процентном соотношении содержится в карбонатной соли, — в этом ее преимущество перед другими лекарственными формами. Сравнительный анализ влияния витамина Д на склонность к падениям показал, что суммарная суточная дозировка 800 1и является достаточной для снижения риска падений. Применение витамина Д в более высокой дозировке не приводит к дополнительному снижению риска падений (таблица).
Таким образом, прием препаратов витамина Д в суточной дозировке 800 іив виде комбинированного препарата с карбонатом кальция снижает риск падений у пациентов, тем самым снижая риск развития низкотравматических переломов.
Низкотравматические переломы ШБК и остеоартроз (результаты собственных исследований)
Частота встречаемости ОА у пациентов с низкотравматическими переломами ШБК изучалась согласно дизайну исследования, разработанному в ГУ «РНПЦ радиационной медицины и экологии человека». Проведено анкетирование пациентов, перенесших с 2007 по 2010 г. перелом ШБК в возрасте старше 50 лет, который был документально верифицирован в медицинском учреждении. Критерии исключения из исследования: наличие тяжелых травм, связанных с ДТП, падение с высоты и др.
Анкета включала вопросы о наличии в анамнезе ОА, склонности к падениям (более одного раза в месяц), перенесенные переломы другой локализации и прием препаратов для лечения ОП до и после перелома. Всего было разослано 300 анкет, получено обратно 158 (52,7%). В дальнейший анализ было включено 135 заполненных анкет, из которых 101 (74,8%) принадлежала пациентам женского пола, 34 (25,2%) — мужского. Средний возраст на момент перелома: 72,9 года — для женщин, 70,3 — для мужчин, (р=0,488).
На вопрос о наличии в анамнезе ОА положительно ответили 43,6% женщин и 35,3% мужчин с переломами ШБК. Из них 20% пациентов имели ОА преимущественно тазобедренных суставов, 35% — ОА коленных суставов, 40% — сочетанное поражение тазобедренных и коленных суставов. На долю других локализаций ОА пришлось только 5%. Статистически значимых различий по частоте встречаемости ОА у мужчин и женщин не было (хи2=0,72; р=0,399). Частота встречаемости ОА у пациентов с изолированным переломом ШБК составила 36,6%. В группе пациентов с дополнительным указанием в анамнезе перелома предплечья частота встречаемости ОА увеличилась до 58,3%.
Одной из причин высокой частоты переломов верхних конечностей у пациентов с ОА может являться увеличение склонности к падениям. В связи с этим пациенты были разделены на две подгруппы согласно наличию ОА в анамнезе. Склонность к падениям (одно и более в месяц) отмечена у 33,9% пациентов с ОА и у 17,7% пациентов без ОА; ОШ (95% ДИ) — 2,35 (1,07-5,40), р=0,049. Полученные результаты свидетельствуют о более чем двукратном увеличении вероятности падений у пациентов с ОА в сравнении с группой пациентов, у которых отсутствуют заболевания суставов.
В процессе исследовательской работы проводился анализ лечебных консервативных мероприятий до наступления перелома ШБК и после травмы в амбулаторных условиях. Из перечня специфических средств лечения остеопороза пациенты применяли комбинированные препараты кальция и витамина Д. Оценить их эффективность не представлялось возможным ввиду небольшого количества пациентов, принимавших препараты. Только 2,2% пациентов (с их слов) до наступления перелома принимали препараты кальция и витамина Д. После выписки из стационара количество пациентов, получающих данный вид терапии, увеличилось лишь до 18,5%, что является крайне низким показателем для оценки положительных эффектов лекарственного препарата.
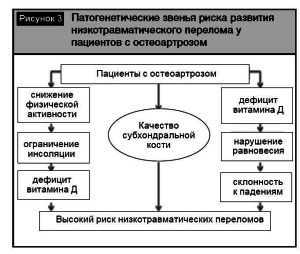
Особенность современной ситуации в здравоохранении такова, что с ростом доли пожилых людей в популяции и увеличением продолжительности жизни растет распространенность воз- раст-ассоциированной патологии. Остеоартроз и остеопороз являются наиболее значимыми заболеваниями опорно-двигательного аппарата ввиду их трудности патогенетической терапии и эффективного предотвращения осложнений в виде переломов и ограничения мобильности. Ситуация осложняется тем обстоятельством, что ОА и ОП могут сосуществовать и каждое из заболеваний ухудшает прогноз для конкретного пациента. Наличие ОА у пациента с ОП может маскировать истинное состояние МПК и препятствовать правильной диагностике и, что самое важное, недооценке риска возможного перелома. Состояние костного метаболизма субхондральной кости при ранних стадиях ОА очень напоминает процессы, протекающие у пациентов с ОП. Уже существуют экспериментальные работы и клинические исследования по эффективности применения антиосте- опоротических препаратов в лечении ранних стадий ОА [19-20]. Однако эти лечебные технологии еще не доступны практическому здравоохранению. Наиболее перспективна в настоящее время коррекция дефицита витамина Д у пациентов с статочным содержанием витамина Д в организме ОА. Общая схема патогенеза развития переломов пациента (рис. 3). при ОА в большей мере связана именно с недостаточным содержанием витамина Д в организме пациента (рис. 3).
Таким образом, пациенты с остеоартрозом, несмотря на повышенные значения МПК, имеют риск развития низкотравматических переломов, превышающий общепопуляционный. Одним из ключевых моментов в увеличении риска развития переломов при остеоартрозе является наличие дефицита витамина Д. Основная роль медикаментозной коррекции с целью снижения риска падений принадлежит комбинированным препаратам витамина Д в сочетании с препаратами кальция.
ЛИТЕРАТУРА
- Sambrook, P. What is the relationship between osteoarthritis and osteoporosis? / P.Sambrook, V.Naganathan // Baillieres Clin. 1997. — Vol. 11. — P. 695-710.
- Dequeker, J. Osteoarthritis and clinical and research evidence relationship / J.Dequeker,
- P.Luyten //Aging Vol. 15. — P. 426-439.
- Hochberg, M.C. Bone mineral density and osteoarthritis: data from the Baltimore Longitudinal Study of Aging /M.C.Hochberg, M.Lethbridge- Cejku, J.D.Tobin //Osteoarthritis Cartilage. — 2004. — Vol. 12A. — S. 45-48.
- Iwamoto, J. Effects of Risedronate on Osteoarthritis of the Knee /J.Iwamoto //Yonsei Med. J. — 2010. — Vol. 51, N 2. — P. 164-170.
- Arden, N. Osteoarthritis: Epidemiology /N.Arden, M.C.Nevitt //Best Pract. Research Clin. Rheumatol. — 2006. — Vol. 20, № 1. — P. 3-25.
- Руденко, Э.В. Аудит состояния проблемы осте- опороза в странах Восточной Европы и Центральной Азии. — IOF, 2011.
- Diagnosis of osteoporosis and fracture threshold in men / J.A.Kanis [et al.] //Calcif Tissue Int. — 2001. — Vol. 69. — P. 218-221.
- The ESR2 Alul gene polymorphism is associated with bone mineral density in postmenopausal women /M.Curro [et al.] //J. Steroid Biochem. Mol. Biol. — 2011. — Vol. 127. — P. 413-417.
- Christgau, S. Sex hormones in the regulation of bone and cartilage metabolism: an old paradigm and a new challenge /S.Christgau, P.A.Cloos //Minerva Ginecol. — 2005. — Vol. 57, N6. — P. 611617.
- Radiographic osteoarthritis of the hip and bone mineral density. The Study of Osteoporotic Fractures Research Group /M.C.Nevitt [et al.] //Arthritis Rheum. — 1995. — Vol. 38. — P. 907-916.
- Osteoarthritis of the knee is associated with vertebral and nonvertebral fractures in the elderly: the Rotterdam Study /A.P.Bergink [et al.] //Arthritis Rheum. — 2003. — Vol. 49. — P. 648-657.
- Underestimated Fracture Probability in Patients With Unilateral Hip Osteoarthritis as Calculated by FRAX /N. Setty [et al.] //J. Clin. Densitom. — 2011. — Vol. 14, N 4. — P. 447-452.
- Subchondral bone as a key target for osteoarthritis treatment / S.Castaneda [et al.] // Biochem. Pharmacol. — 2012. — Vol. 83. — P. 315-323.
- Osteoarthritis, bone density, postural stability, and osteoporotic fractures: a population based study /
- Jones [et al.] // J. Rheumatol. — 1995. — Vol. 22, N 5. — P. 921-925.
- Arthritis increases the risk for fractures — results from the Women’s Health Initiative / N.C.Wright [et al.] // J. Rheumatol. — 2011. — Vol. 38, N 8. — P. 1680-1688.
- Obesity Is Not Protective against Fracture in Postmenopausal Women: GLOW / J.E.Compston [et al.] // Am. J. Med. — 2011. — Vol. 124, N 11. — P. 1043-1050.
- Vitamin D Status, Bone Mineral Density, and the Development of Radiographic Osteoarthritis of the Knee: The Rotterdam Study / A.Bergink [et al.] // J. Clin. Rheumatol. — 2009. — Vol. 15. — P. 230-237.
- The effect of vitamin D on falls: a systematic review and meta-analysis / M.H.Murad [et al.] // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96. — P. 2997-3006.
- Relationships between biochemical markers of bone and cartilage degradation with radiological progression in patients with knee osteoarthritis receiving risedronate: the Knee Osteoarthritis Structural Arthritis randomized clinical trial / P.Garnero [et al.] // Osteoarthritis Cartilage. — 2008. — Vol. 16. — P. 660-666.
- Strontium ranelate effect in postmenopausal women with different clinical levels of osteoarthritis / P.Alexandersen [et al.] // Climacteric. — 2011. — Vol. 14, N 2. — P. 236-243.
Статья опубликована в журнале «Медицинские новости», 2012, №8.
Источник: www.mednovosti.by







Комментировать