Проведение профилактических мероприятий на уровне семьи, как до наступления беременности, так и на ее протяжении – их значение для матери и ребенка. Программы преконцепционной подготовки к беременности для супружеских пар, для женщин с отягощенным акушерским и соматическим анамнезом. Обзор литературы и собственные исследования: анализ результатов.
В. П. Квашенко, О. И, Остапенко, Г.М. Адамова
Рождение здорового поколения зависит от состояния здоровья родителей и в первую очередь от состояния здоровья матери. Экологические катастрофы, техногенные нагрузки привели к ухудшению здоровья населения, к снижению иммунитета и нарушению системы адаптационной защиты. Все это сказывается на течение беременности и внутриутробное состояние плода.
В связи с этим проведение профилактических мероприятий на уровне семьи (как до наступления беременности, так и на ее протяжении) имеет для матери и ее ребенка важное значение для благополучного исхода беременности и родов.
Сегодня вряд ли можно найти человека, не понимающего значения планирования семьи. Оптимально, когда, планируя рождение ребенка, супружеская пара «готовится к беременности». То есть будущим родителям рекомендуется проверить состояние своего здоровья (как репродуктивного, так и соматического). Это позволит своевременно выявить заболевания и провести профилактические и лечебные мероприятия. Большое значение для привлечения пациентов к участию в программе преконцепционной подготовки к беременности имеют санитарно-просветительная работа, повышение информированности населения, воспитание у будущих родителей чувства ответственности за жизнь и здоровье своего ребенка.
Разработаны программы преконцепционной подготовки к беременности для супружеских пар, для женщин с отягощенным акушерским и соматическим анамнезом.
Преконцепционная подготовка семьи к зачатию проводится по следующему алгоритму:
- Общие данные:
- соматический анамнез;
- перенесенные инфекционные заболевания;
- семейный анамнез;
- профессиональные вредности;
- вредные привычки.
- Состояние репродуктивной системы:
- акушерско-гинекологический анамнез (менструальная функция, перенесенные гинекологические заболевания, течение предыдущих беременностей, родов);
- гинекологический осмотр:
а) осмотр и пальпация молочных желез;
б) осмотр и пальпация наружных и внутренних половых органов;
в) лабораторное обследование (цитологическое, бактериоекопическое);
г) проведение пробы Шиллера.
Андрологический осмотр:
- использование методов контрацепции (на время обследования.
- Серологическое обследование:
- Rh, RW, ВИЧ.
- Консультация специалистов:
- осмотр терапевта, эндокринолога, ЛОР, стоматолога и др. (по показаниям).
- Медико-генетическое консультирование (по показаниям).
- Рациональное питание.
- Здоровый образ жизни:
- отказ от вредных привычек.
- Витамины и другие добавки:
- витаминизация организма (мультитабс, витрум, юникап);
- фолиевая кислота — 400 мкг/сут в течение 3 месяцев до наступления беременности (NB! Во время приема витаминов не принимать!);
- йодированная соль.
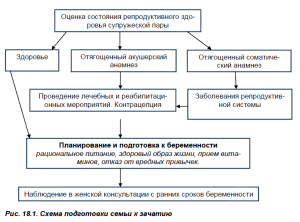
- Наблюдение в женской консультации с ранних сроков беременности (рис. 18.1).
Сбор анамнеза (соматический, семейный, профессиональный, акушерско-гинекологический, андро3. логический), вредные привычки.
Осмотр и обследование:
- Осмотр (гинекологический, андрологический).
- Обследование (клиническое, cepoлогическое — по показаниям).
- Консультация смежных специалистов (по показаниям).
- Медико-генетическое консультирование (по показаниям).
- Консультация сотрудника кафедры (по показаниям)
Преконцепционная подготовка к зачатию женщин с ОСА проводится по следующему плану, который включает в себя:
- Гинекологическое обследование:
- осмотр и пальпация молочных желез;
- осмотр и пальпация наружных и внутренних половых органов;
- лабораторное обследование (цитологическое, бактериоскопическое);
- проведение пробы Шиллера.
- Консультация смежных специалистов:
- терапевт, эндокринолог, ЛОР и др. (по показаниям).
- Медико-генетическое консультирование (по показаниям).
- Планирование беременности в зависимости от результатов обследований.
- Проведение лечебных и реабилитационных мероприятий совместно со смежными специалистами для подготовки к беременности.
- Подбор метода контрацепции на период проведения реабилитационных мероприятий.
- При наступлении беременности:
- наблюдение в женской консультации с ранних сроков беременности;
- диспансерное наблюдение лечащего врача соответственно экстрагенитальной патологии;
- при необходимости — плановая госпитализация в отделение патологии беременности или профильное стационарное отделение.
В алгоритм преконцепционной подготовки женщины с отягощенным гинекологическим анамнезом включают гормональное обследование и по показаниям обследуют на TORCH-инфекции.
Одной из наиболее важных современных проблем акушерства и перинатологии является внутриутробное инфицирование плода. Частота его колеблется от 6 до 53%, достигая 70% среди недоношенных детей. В структуре перинатальной смертности удельный вес внутриутробной инфекции составляет от 2 до 65%.
Такие различия в показателях связаны с трудностями диагностики этой патологии, которая часто скрывается за диагнозами: гипоксия, родовая травма и т. д.
Диапазон клинических проявлений внутриутробных инфекций (ВУИ) достаточно широк. Тератогенное воздействие на плод или эмбрион, различные пороки развития, стойкие врожденные структурные дефекты, остаточные явления или текущий патологический процесс — это некоторые из основных проблем, которые обусловлены инфицированием плода внутриутробно. Неонатологи и педиатры утверждают, что количество детей с последствиями ВУИ значительно больше, чем число диагностированных в постнатальном периоде врожденных инфекций.
Доказано, что TORCH-инфекции в зависимости от периода внутриутробной агрессии могут поражать различные органы и системы плода, но с наибольшим постоянством — нервную систему.
По данным В.Ю. Мартынюк (1999), при обследовании 65 детей с ограниченными поражениями нервной системы в возрасте от не-онатального периода до 14 лет у 54,8% была установлена этиологическая роль одной из TORCH-инфекций в развитии заболевания.
При этом частота выявления активных форм врожденных TORCH-инфекций зависела от клинической активности процесса и составила от 11,1% в группе детей с резидуальными проявлениями органических поражений нервной системы до 81,5% — в остром периоде заболевания.
Правильная этиологическая верификация клинического диагноза позволяет выбрать адекватную лечебную тактику и обусловливает ее позитивный результат.
Считают, что большинство внутриутробных инфекций, вызывающих заражение плода, относится к хроническим либо преимущественно первично латентным. Пожизненное персистирование возбудителя в организме человека сопровождается постоянной циркуляцией в крови маркера инфекции — специфических антител класса IgG. Такие же антитела могут быть пожизненно обнаружены и после некоторых ранее перенесенных инфекционных заболеваний (например, краснухи, токсоплазмоза). В этих случаях стандартные, хорошо известные методы лабораторной диагностики теряют свою информативность и диагностическую ценность. Вопрос «лечить или наблюдать» — почти как «быть или не быть» — остается без ответа (И.С. Марков, 2002).
Существующая классическая лабораторная диагностика острых инфекций базировалась на обнаружении общих антител (класса иммуноглобулинов М и G) к конкретному патогену в серологических реакциях преципитации, связывания комплемента (РСК), агглютинации, непрямой гемагглютинации и торможения гемаг-глютинации (РНГА и РТГА) и некоторых других. Обнаружение диагностического титра антител или четырехкратное и более нарастание титров в парных сыворотках служили неоспоримым верификационным критерием диагноза. Более того, высота обнаруженных титров косвенно рассматривалась в качестве критерия активности инфекционного процесса. Наиболее высокие титры ассоциировали с большей инфицирующей дозой, большей вирулентностью, а следовательно, и более тяжелым клиническим течением заболевания.
Однако несомненные диагностические преимущества серологических методов, многократно подтвержденные на практике в случаях верификации острых инфекционных заболеваний, оказались мало или вообще неинформативными при хронических инфекциях, в том числе и при интегративном механизмом персистенции возбудителя. Анамнестический характер обнаруживаемых антител класса IgGк токсоплазмам, ЦМВ и ВПГ и их пожизненная персистенция в крови в диагностических титрах вообще лишили здравого смысла само понятие «диагностический титр антител». Так, по данным Л.В. Василик и соавт. (1998), среди 99 пациентов (беременных женщин — 94, детей — 5) с диагнозом токсоплазмоза, установленным на основании обнаружения диагностических титров антител к Тох. gondiiв РСК и РИФ, повышения общего уровня неспецифических IgGи М, а также положительной кожио-аллер-гической пробы, только в 2-х случаях этот диагноз оказался правомочен. В остальных случаях имела место гипердиагностика. Попытки назначения специфической этиотропной терапии на основании обнаружения диагностических титров/уровней антител класса IgG, как правило, оказываются неэффективными и вызывают чувство неудовлетворенности у врача и глубокого скепсиса, граничащего с медицинским нигилизмом, у пациентов.
По ранее опубликованным данным, полученным в клинике «Vi-tacell» (И.С. Марков, Е.И. Маркова, 1999), антитела класса IgGк ВПГ 1/2 были обнаружены у 94% обследованных женщин детородного возраста и беременных, а также у 55,6% детей в возрасте до 14 лет, к ЦМВ — у 86% и 64,5% соответственно, Тох. gondii— у 51% и 35,1% соответственно. Специфическое лечение до обращения в клинику было назначено и в большинстве случаев проведено 14% взрослых и детей, у которых были обнаружены антитела класса IgGк ЦМВ, у 58% — к ВПГ 1/2 и у 82% — к токсоплазмам. Лечение было назначено без учета стадии инфекционного процесса. При токсоплазме, например, из 79 человек, которым ранее была рекомендована или проведена специфическая терапия, лабораторные показания для ее назначения были определены при лабораторном исследовании в клинике только в 17,7% случаев. То есть более 80% пациентов получили длительные и нередко повторные курсы антипротозойных препаратов безосновательно, а в 5 случаях у беременных женщин было произведено искусственное прерывание беременности по «медицинским» показаниям. При этом 5-7% женщин в странах с высоким уровнем медицинского обслуживания впервые инфицируются токсоплазмами в период беременности, что в 30% случаев может приводить к заражению плода. В связи с нераспознанным своевременно токсоплазмозом у беременных еще недавно только в США ежегодно рождалось 3300 детей с врожденным токсоплазмозом, расходы на лечение и социальную адаптацию которых составляли 221,9 млн долларов в год (R. Fayer, 1981).
Поэтому диагностическое значение обнаружения ДНК/РНК-вирусных, бактериальных и протозойных патогенов, позволяющих четко разграничить репликативные (активные) и интегративные (латентные) формы инфекционного процесса, сегодня трудно переоценить. Впервые появилась возможность разграничить латентную форму каждой из обнаруженных инфекций от активной и назвать конкретную этиологическую причину возникшей патологии. «Прицельное» назначение адекватного лечения на основании результатов ПЦРдиагностики дает максимально положительный ближайший и отдаленный клинический эффект, а также позволяет избежать неоправданной полипрагмазии.
С целью изучения целесообразности и экономической эффективности обследования беременных на инфекции группы TORCH, в Донецке с 2001 по 2004 год обследовано 15 250 беременных, что составило 75% от общего количества беременных женщин, произведено 45 750 исследований.
Показаниями для направления беременных явились: наличие в анамнезе мертворождений, самопроизвольных абортов, смертей детей в неонатальном периоде, хронические воспаления гениталий, острые респираторные инфекции в период беременности, патологические изменения шейки матки (эрозия, дисплазия), бесплодие, беременные с угрозой прерывания настоящей беременности, имеющие в анамнезе рождение детей с врожденными пороками развития.
Беременным проводилось определение IgGк ЦМВ, токсоплазме, краснухе, хламидиям и герпесу 1/2 типа. При получении положительных результатов проводилось определение IgGв парных сыворотках и IgM. Средняя стоимость одного исследования составила 15 гривен. Общая сумма затраченных средств составила 686 250 гривен.
Ретроспективный анализ результатов обследований женщин за 2004-й год показал, что у 85,5% беременных женщин были положительные результаты иммуноферментных исследований к различным возбудителям инфекций. Так, IgGк ЦМВ были обнаружены у 54,7% , причем у 35,6% этих женщин имелись IgM. Эта группа пациенток повторно обследовалась на IgM к ЦМВ и у 99,3% результаты были отрицательными. У 0,7% женщин с положительным результатом беременность закончилась рождением здоровых детей без признаков инфекции.
Обследование на токсоплазмоз обнаружило IgG у 41,7% беременных, из них у 13,1% имело место наличие IgM; повторное обследование подтвердило положительный результат лишь у 0,9% беременных.
При обследовании на краснуху IgG были обнаружены у 75,7% беременных, IgM — у 0,3% .
Обследование беременных к IgG к герпесу 1/2 типа выявил положительные результаты у 93,6% беременных, к IgM — у 0,9% . Перинатальная смертность за 2004-й год составила 8,3% на 1000 родившихся живыми и мертвыми, что в абсолютных числах равнялось 56 случаям. Среди причин перинатальной смертности внутриутробная пневмония имела место у 6 детей, этиологической связи врожденной пневмонии с инфекцией матери установлено не было.
Обзор литературы и собственные исследования распространенности, диагностики, лечения и профилактики внутриутробного инфицирования позволили сделать следующие выводы:
- инфицирование вирусом простого герпеса выявляется до 92% у женщин детородного возраста и беременных с отягощенным анамнезом; у 34,2% детей с органическими поражениями нервной системы в возрасте до 1 года; у 65,6% — в возрасте от 1 года до 6 лет; у 82,6% — от 6 до 14 лет;
- диагностические уровни антител класса IgG к вирусу простого герпеса не являются критериями активности инфекционного процесса. Отсутствует также прямая корреляция между уровнем специфических IgG и активностью инфекционного процесса. Репликативные формы ВПГ-инфекции чаще были обнаружены у пациентов с низкими (у 55% детей и 33% взрослых) и средними (40% и 45% соотв.) диагностическими уровнями анти-!дО;
- специфические антитела к ВПГ 1/2 класса IgM были обнаружены только у 4,1% женщин и у 10,9% детей с диагностическими уровнями анти-IgG. Их обнаружение совпало с ДНК-позитивной фазой инфекции менее чем в 50% случаев, что не дает основания рассматривать обнаружение специфических IgM при ВПГ-инфекции как бесспорный диагностический критерий активности процесса и показание к назначению этиотропной терапии (И.С. Марков, 2002);
- лабораторными критериями активной репликации вируса являются обнаруженные ДНК ВПГ 1/2 в различных биосубстратах. Репликативные формы инфекции диагностированы всего у 4,6% женщин и 16,3% детей с диагностическими уровнями антител класса IgG к HSV 1/2;
- показанием к проведению специфической терапии хронической герпетической инфекции без характерных клинических признаков поражения кожи и слизистых оболочек, а также критерием ее эффективности и продолжительности служит наличие репликации ВПГ, определяемой методом ПЦРанализа;
- знание своего ВПГ-статуса может быть полезно для женщин, планирующих беременность. При подтверждении наличия ВПГантител необходимо установление уровня ферментов печени и ВПГ РНК. При отсутствии ВПГ РНК риск трансмиссии является минимальным.
Преконцепционная подготовка женщин с герпетической инфекцией должна проходить по следующей программе.
В течение всего времени подготовки (8-12 месяцев) необходима контрацепция, предпочтительно барьерным методом.
При подтверждении хронической герпетической инфекции лабораторными методами (ИФА, ПЦР и др.) провести комплекс лечебно-профилактических мероприятий:
- Санация очагов инфекции — заболевания носоглотки (в том числе хронический тонзиллит), дисбактериоз кишечника, синдром раздраженной толстой кишки, хронический пиелонефрит.
- Коррекция иммунитета. С целью коррекции неспецифической резистентности организма назначают метаболическую терапию.
Т.Н. Демина (2003) в течение 1 месяца предлагает проводить рео-корригирующую терапию, включающую: ПА, иммуноглобулин, АУФОК, затем в следующие два менструальных цикла — метаболическую терапию. При отсутствии эффекта (не наступает ремиссия) в лечение добавляют иммунокорригирующие препараты (лаферон).
Через 4-6 недель —контроль состояния специфического иммунитета по IgG и М; если IgG в норме, a IgM отсутствует — показано наблюдение. По ее данным, в 82% случаев рецидив герпетической инфекции не наблюдается в течение 6 месяцев. Таким пациенткам, разрешается планирование беременности.
В случае рецидивов инфекции женщинам после иммунокоррекции назначают базовые противовирусные препараты: ацикловир, валацикловир, зовиракс, вальтрекс. В зависимости от степени иммунодефицита, проводится реабилитация, включающая иммунокоррекцию иммуноглобулином. При этом, по данным Т.Н. Деминой, у 87% наступила длительная ремиссия, а 13% женщин проводили дополнительную противовирусную терапию.
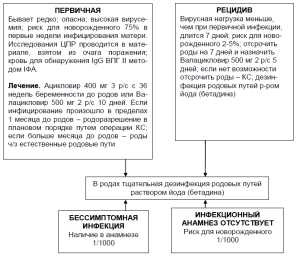
Учитывая, что герпетическая инфекция наиболее опасна накануне родов и в родах, нами разработан следующий алгоритм (рис. 18.2), с помощью которого врач акушер-гинеколог может определить вид инфекционного процесса и тактику ведения, а также последовательность действий врача с целью снижения риска инфицирования новорожденного.
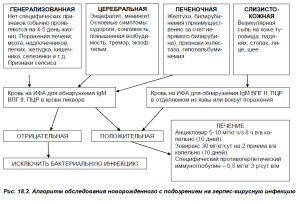
При подозрении инфицирования новорожденного необходимо также обследовать ребенка по особому алгоритму (рис. 18.3).
Виды инфекционного процесса
Рис. 18.2. Генитальный герпес и тактика ведения
Обследование новорожденного с подозрением на герпес-вирусную инфекцию (при обработке новорожденного не обтирать, промокнуть сухой пеленкой)
При отсутствии клинических проявлений герпеса новорожденный не обследуется. Формы клинических проявлений.
Цитомегаловирусная инфекция
Инфицирование ЦМВ установлено у 88% клинически здоровых женщин детородного возраста и беременных с отягощенным акушерским анамнезом, у 54 (± 6)% детей с органическими поражениями нервной системы в возрасте до 1-го года, у 77 (± 5)% — возрасте от 1 года до 6 лет, у 81 (± 6)% — от 6 до 14 лет. Одной из существенных особенностей проблемы ЦМВ-инфекции являются непреодоленные еще сегодня дистанции между возможностями лабораторной диагностики, практическим использованием этих методов и адекватной интерпретацией полученных результатов. Однако в связи с удивительно многообразным клиническим полиморфизмом и отсутствием нозологически обособленной симптоматики при ЦМВ-инфекции именно корректной лабораторной диагностике следует отвести главенствующую роль.
- Доказано, что высота уровня анти-ЦМВ1дО не отражает активность патологического инфекционного процесса и не имеет в этом аспекте диагностического значения, характеризуя при скрининге лишь сам факт инфицирования ЦМВ.
- Установлена обратная зависимость между уровнем специфических IgG и репликативной активностью ЦМВ-инфекции: репликативные формы, как правило, обнаруживали у пациентов с низкими (от 54 до 69% всех случаев) и средними (от 19 до 36%) уровнями антител и только в 10-12% случаев — при максимальной их высоте.
- Антитела класса IgG при хронической ЦМВинфекции не несут протективной функции и не защищают плод от внутриутробного инфицирования во время беременности, а инфицированных детей — от развития различных ЦМВ-ассоциированных заболеваний.
- Специфические антитела к ЦМВ класса ^ были обнаружены только у 4,8% взрослых и 20,1% детей с повышенными уровнями анти^. При этом только в 19-24% случаев их выявление совпало с обнаружением вирусной ДНК, а в 2,2-5,2% фиксировалось у пациентов с отрицательным результатом тестирования на ДНК ЦВМ, что не позволяет рассматривать этот тест как бесспорный диагностический критерий активности процесса, показание для назначения этиотропной терапии, а при негативных результатах тестирования — как повод для прекращения дальнейшего обследования.
- Лабораторными критериями активной репликации вируса является обнаружение ДНК ЦМВ в различных биосубстратах. Репликативные формы ЦМВ-инфекции у пациентов с повышенными уровнями антител класса IgG диагностированы у 14% клинически здоровых женщин и беременных с отягощенным акушерским анамнезом и у 62,6% детей с органическим поражением нервной системы, что соответственно в 3,0 и 3,8 раза выше, чем результаты обследования этой же группы больных на ВПГ 1/2.
- Цитологический метод исследования с обнаружением в моче и слюне характерно трансформированных эпителиальных клеток-цитомегалов позволяет в 4,2% ДНКпозитивных случаев дополнительно подтвердить репликативную фазу ЦМВинфекции, а в 13,4% — имеет самостоятельное диагностическое значение и при наличии клинических показаний может быть использован как критерий назначения и оценки эффективности проводимой противовирусной терапии.
- Показанием для проведения противовирусной терапии при хронической ЦМВинфекции, а также основным критерием ее эффективности и продолжительности является наличие у пациента репликативной формы инфекции, подтвержденной (или исключенной) на основании протокольного исследования с определением ДНК ЦМВ как минимум в 3-х биосубстратах (в крови, слюне, моче) и клеток-цитомегалов в слюне и моче.
В зарубежных клиниках существует алгоритм врачебной тактики ЦМВ-инфекции, который предельно прост и практически безальтернативен: лечению, как правило, подлежат только случаи ЦМВинфекции у иммунокомпрометированных пациентов, прежде всего у ВИЧ-инфицированных и больных СПИДом. Стереотипный тезис «нет СПИДа — не надо лечить ЦМВ-инфекцию» как чрезмерный балласт сдерживает и ограничивает свободный полет клинической мысли. В неоправданности такого подхода нам неоднократно приходилось убеждаться на практике.
Для объективной оценки ситуации необходимо отметить и другую существующую сегодня крайнюю тенденцию — назначать и проводить этиотропное лечение ЦМВ-инфекции лицам без достаточно веских обоснований, как правило, при латентной форме инфекции, которая вообще не нуждается в лечении. В том числе здоровым серопозитивным к ЦМВ мужьям женщин с отягощенным акушерским анамнезом. Используемые с этой целью ЦМВ класса IgG и высота их титров абсолютно некорректны. Вероятность «попадания в цель» при таком подходе, с учетом частоты обнаружения репликативных форм ЦМВ-инфекции среди серопозитивных по анти-ЦМВ-^, не превышает 1:5-1:10. Ничего иного, кроме напрасной траты времени, денег, эмоций и возможных медикаментозных осложнений, такая терапия пациенту не дает.
Противовирусная терапия ЦМВ-инфекции показана пациентам с репликативными формами заболевания, определенной клинической симптоматикой и женщинам с отягощенным анамнезом на этапе планирования беременности. Основным антицитомегаловирусным химиопрепаратом, обладающим выраженным эффектом, является цимевен (ганцикловир) производства компании «Хофф-ман-Ля Рош» (Швейцария).
Основное правило, которого должен придерживаться акушер-гинеколог, — проводить лечение только в тех ситуациях, когда ожидаемый результат превышает риск развития побочных проявлений, — применимо, на наш взгляд, и при назначении цимевена не только новорожденным, детям в возрасте до 2-х лет и беременным, но и всем пациентам.
В качестве триединого условия для принятия решения о применении антивирусной терапии могут служить результаты адекватной лабораторной диагностики, подтверждающие репликативную активность вируса, клинические показания и врачебная этика, которая не позволит лечащему врачу подвергать жизнь больного неоправданному риску, а также оставить пациента без адекватного и жизненно необходимого лечения.
Апробированная эффективная комбинация противовирусных и иммуномодулирующих препаратов позволяет прервать репликативную активность ЦМВ и перевести инфекционный процесс в иммунокомпетентном организме из неуправляемого в контролируемый с длительной клинической ремиссией.
То есть при репликативных формах ЦМВинфекции, независимо от иммунологического фона, на котором она развивается, может быть рекомендовано противовирусное лечение. Показанием для назначения антивирусной терапии иммунокомпетентным лицам является клинически манифестная форма ЦМВ-инфекции в реп-ликативной стадии (обнаружение фрагмента вирусной ДНК в различных биосубстратах и экскреции с мочой и слюной клеток-цитомегалов) с поражением жизненно важных органов и систем, а также при клинически бессимптомной ДНК-позитивной форме хронической ЦМВ-инфекции у женщин с отягощенным акушерским анамнезом в период подготовки к беременности.
Токсоплазмоз
Ситуация, сложившаяся сегодня в Украине с лабораторной диагностикой и лечением токсоплазмоза, которых, представлен первой буквой в аббревиатуре «TORCH-инфекции», выглядит удручающе пессимистично. С одной стороны, сотни и, повидимому, тысячи здоровых детей и взрослых, преимущественно женщин, которым в результате гипердиагностики было необоснованно назначено противопротозойное лечение, как правило, повторными курсами, и также необоснованно (без проведения корректного лабораторного исследования) прерванные беременности. С другой — внутриутробно инфицированные младенцы-инвалиды, матерей которых не обследовали на токсоплазмоз до или хотя бы во время беременности и, соответственно, превентивно не лечили. В результате врожденный токсоплазмоз и пожизненная инвалидность с наиболее частыми проявлениями в виде органических поражений глаз и нервной системы. В домах-интернатах для незрячих и слабовидящих детей основной контингент формируется именно за счет детей с катарактами, ретинопатиями и другими поражениями глаз, развившимся в результате врожденного токсоплазмоза,
В монографии И.С. Маркова (2002) приведены данные, которые перекликаются с нашими наблюдениями, а именно:
- высота титров/уровней антител класса IgG к токсоплазме, определенные методами РСК, РИФ, ИФА и др., не отражает активности специфического инфекционного процесса, не является показанием для назначения противопротозойного лечения и критерием угрозы внутриутробного заражения плода во время беременности, а служит всего лишь скрининговым тестом и свидетельствует о факте предшествующего инфицирования пациента;
- обнаружение IgM к токсоплазме не имеет самостоятельного диагностического значения, поскольку в 16,5% случаев у взрослых и в 7,8% У детей не сопровождается репликативной активностью токсоплазм, а у 6% взрослых и 4,7% детей их персистенция сохраняется длительно — от 8 до 39 месяцев (срок наблюдения), а возможно и пожизненно;
- обнаружение IgM к токсоплазме у 3% взрослых носит ложнопозитивный характер, а у 5,5% беременных во время сероконверсии — ложно-негативный, в связи с чем их выявление может иметь диагностическое значение для решения вопроса о назначении специфической терапии и выработке соответствующих рекомендаций только при остром токсоплазмозе в случае зафиксированной серо-конверсии при наличии клинических симптомов заражения или угрозы инфицирования плода у беременных;
- основным лабораторным критерием назначения и проведения противопротозойной терапии, а также угрозы инфицирования плода во время беременности является обнаружение методом ПЦР-анализа ДНК токсоплазм в крови и моче, что позволило исключить активную форму инфекции у всех 133-х серопозитивных женщин (в том числе у 52-х — во время беременности) и у 93,8% серопозитивных детей, несмотря на наличие в 1416,5% всех случаев серологически активного профиля токсоплазмоза;
- серологическая диагностика токсоплазмоза, также, как изолированное проведение ПЦРанализа, не имеет самостоятельного диагностического значения для выработки лечебной тактики и прогноза заболевания и должна быть учтена одновременно и в комплексе с клиническими и (по показаниям) инструментальными данными;
- серопозитивные IgG женщины с наличием 1д1 к токсоплазме, независимо от обнаруженного уровня/титра антител, при отрицательных результатах однократного тестирования на 1дМ к токсоплазме, анти-Tox.g.-IgA и в ПЦР-анализе на ДНК к токсоплазме в крови и моче, а также при отсутствии характерных жалоб и клинических симптомов могут быть в дальнейшем исключены во время беременности из группы наблюдения по поводу токсоплазмоза;
- группу риска по внутриутробному инфицированию плода токсоплазмозом составляют серонегативные IgG к токсоплазме женщины, за которыми во время беременности устанавливается иммунологический мониторинг с динамичным тестированием на антитела классов 1дМ и IgG каждые 4-6 недель, что позволило в 2/18 (11,1%) случаях выявить первопричинную клинически бессимптомную инвазию с репликативной активностью Тох.д. и угрозой инфицирования плода.
Токсоплазмоз может быть отнесен к инфекциям с высоким уровнем поражения населения (63,7% взрослых и 26,8% детей) и низкой заболеваемостью, что обусловлено оппортунистическим характером возбудителя, который вызывает клинически манифестные проявления, как правило, у иммунокомпрометированных лиц, а также у новорожденных в результате их внутриутробного инфицирования.
Краснуха
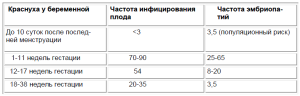
Известно, что внутриутробное заражение плода может происходить во время беременности у матери. Последствия зависят от срока гестации, при котором произошло инфицирование вирусом краснухи,
Таблица 18.1. Частота инфицирования плода и эмбриопатий при первичном инфицировании беременной, %
После 20 недель беременности риск возникновения однако остается риск поражения нервной системы и врожденных пороков развития плода снижается, органов чувств.
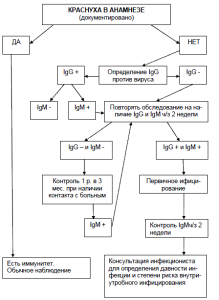
Большую тревогу беременные женщины испытывают по поводу возможного инфицирования вирусом краснухи. На основе здравых размышлений, а также в результате опыта зарубежных, отечественных коллег и нашего личного опыта, был разработан следующий алгоритм тактики врача при обследовании беременной на краснуху (рис. 18.4).
Рис. 18.4. Алгоритм тактики врача при обследовании беременных на краснуху
Выводы
- Инфекции у матери в период беременности, включая вирусные, бактериальные, вызываемые простейшими и спирохетами, могут оказывать потенциальный риск заражения плода или новорожденного.
- Плацента в большинстве случаев защищает плод от инфицирования.
- Первичная инфекция в период беременности представляет более серьезную угрозу для 9. плода или новорожденного, нежели рецидивирующая или вторичная инфекция. Это связано с иммунным статусом матери и уровнем воздействия на организм возбудителя.
- Сходство клинической картины при различных внутриутробных инфекциях не позволяет окончательно расшифровать этиологию заболевания без проведения специальных лабораторных исследований. Достоверность этиологической диагностики TORCH-инфекций только по клиническим данным не превышает 10% (А.Г. Базаламах, Ф.Е. Серебур, 1988).
- Диагностика специфических перинатальных инфекций во время беременности осложняется особыми проблемами, так как большинство материнских инфекций являются асимптомными или симптомы являются похожими на острые респираторные инфекции.
- Лечение виростатиками, назначенное в латентную фазу любой из TORCH-инфекций, клинически неэффективно, способствует формированию фармакорезистентных штаммов вируса, сопровождается неоправданными побочными действиями препаратов, не говоря уже о бессмысленном бремени материальных затрат для пациентов и их семей.
- Вероятность «прицельного попадания» этиотропных препаратов, назначенных без определения репликативнои активности возбудителей, колеблется (с учетом установленной Марковым частоты реактивации хронических инфекций) от 0,5-2,0:10 при герпесассоциированных заболеваниях до 00,6:10 при токсоплазмозе.
- Определение «диагностического» уровня /титра специфических антител класса IgG и динамика его колебания в парных сыворотках при хронических герпетических инфекциях и ранее перенесенном инфицировании токсоплазмозом утратило свой смысл в качестве критерия активной формы заболевания и показания для назначения соответствующей этиотропной терапии и может быть использовано лишь для назначения соответствующего скрининга серопозитивных лиц и выявления.
- К вопросу о диагностике внутриутробной инфекции у новорожденных / Л.Л. Нисевич, Е.В., Е.Л. Королькова и др. // Акушерство и гинеко10. логия. — 1998. — № 3. — С. 16-20.
- Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гени11. талий: Руководство для врачей. — 5-е изд. —СПб.: Омега, 2000. — 572 с.12.
- Марков И.С., Маркова Е.И. Сравнительный анализ современных методов лабораторной диагностики (ИФА, ПЦР) TORCH-инфекций //Лаб. диагностика. — 1999. — № 3. — С. 43-47.
- Марков И.С. Диагностика и лечение герпетиче13. ских инфекций и токсоплазмоза: Сб. статей —К.: «Арт ЭК», 2002, — 192 с, ил, 16 с.
- Невынашивание беременности: проблемы и 14. тактика лечения / Под ред. В.К. Чайки, Т.Н. Деминой. — Севастополь-Донецк: Вебер,2001. — 262 с.
- Орехов К.Ц. Внутриутробные инфекции и патология новорожденных. — М.: Медпрактика15. М, 2002. — 148 с.
- Чайка В.К., Квашен ко В.П. Современное направление амбулаторной помощи в акушерстве и гинекологии. — Донецк: 000 «Лебедь», 2008. -С. 282-317.
- Чайка В.К., Остапенко О.И., Могилевкина ИЛ. Диагностика, терапия, профилактика: Метод, рекомендации. — 2004. — 32 с.
- Шабалова Н.П. Современная терапия в неонатологии. — М.: Медпресс, 2000.
- Jorge E. Tolosa Praktical aspects of trating asymptomatic bacteria during preynancy — WHO Reproductive Heals Librari, № 6 Geneva, World Health Onganizathion 2003 [WHO/RHRO 35]
- Congenital and perinatal infection: Prevention, diagnosis and treatment // Editedby M.L. Newell and J. Mcintyre. — London, 2000. — 442 p.
- O’Brien J.J., Campoli-Richards D.M.Acyclovir. An updated review of its antiviral octiviti, pharmacokinetic properties and therapoutic offieacy. Drugs. — 1989. — N 37 (3). — P. 233309.
- Smaill F. Antibiotics forasymptomatic bacteria in pregnancy [Cochran Revien] In: The Cochran Librari Issueu, 2002, Oxford: Update Seftware.










Комментировать