Остеопороз у детей. Современные подходы к фармакологическому и нефармакологическому лечению остеопороза у детей.
Почкайло А.С., Белорусская медицинская академия последипломного образования, Минск
Резюме. Остеопороз у детей становится все более актуальной проблемой в практике педиатра, развиваясь вследствие влияния ряда факторов – в виде как первичной, так и вторичной формы при воздействии различных заболеваний и/или их лечения. Представлены современные подходы к фармакологическому и нефармакологическому лечению остеопороза у детей.
Ключевые слова:остеопороз у детей, лечение, кальций, витамин Д, бисфософонаты.
Summary. Оsteoporosis in children is being increasingly recognized in pediatric practice as a consequence of several factors – as a primary problem and as secondary to various diseases and/or medications. This article the modern pharmaceutical and non-pharmaceutical approaches to the treatment of osteoporosis in children
Keywords:osteoporosis in children, treatment, calcium, vitamin D, bisphosphonates.
Дефицит костной массы и остео-пороз у детей – актуальная и противоречивая проблема современной педиатрии. Наследственные заболевания, замедление формирования генетически детерминированной пиковой костной массы либо снижение ее уровня под влиянием факторов риска в детском возрасте ведут к развитию дефицита костной массы и остеопороза у ребенка, предрасполагают к ранней и тяжелой манифестации остеопороза и связанных с ним инвалидизирующих переломов во взрослой популяции [4, 20, 24, 28]. Распространенность нарушений костной минерализации среди здоровых детей по данным российских специалистов составляет 2–3%, достигая 10–12% у детей с различной хронической патологией, более 22% здоровых детей находятся в зоне риска по их возникновению [15]. Многие аспекты этой проблемы, включая эпидемиологию, критерии диагностики и подходы к лечению, остаются противоречивыми и изучаются [4].
Факторы риска развития дефицита костной массы и остеопороза у детей сходны с таковыми у взрослых. С их выявления начинается диагностика, с установления контроля – профилактика и лечение патологии. В зависимости от генеза и возможности воздействия выделяют эндогенные и экзогенные, модифицируемые и немодифицируемые факторы. Генетическими (как правило, немодифицируемыми) факторами определяется до 80% влияния на вариабельность формирующейся костной ткани [4, 25, 27, 46]. Экзогенные факторы детерминируют лишь 15–20% такого влияния, но в силу модифицируемости обладают значимым профилактическим и терапевтическим потенциалом[3]. Важнейшие экзогенные факторы – особенности питания и физической активности, вредные привычки, экологическое окружение [4, 10]. Сложно определить генез и степень модифицируемости такого фактора риска, как хронические заболевания и/или их лечение, но именно ими обусловлено развитие вторичных нарушений костной минерализации у детей. И именно вторичная форма остеопороза преобладает у детей в отличие от взрослых. Широкий спектр ревматических, эндокринных, почечных, желудочно-кишечных, онкогематологических и других заболеваний, прием ряда лекарств (стероиды, антиконвульсанты, тироидные гормоны, цитостатики и др.), ятрогенные воздействия (гемодиализ, трансплантация, лучевая терапия) способны индуцировать развитие дефицита костной массы и остеопороза у детей [3, 19, 25, 47]. Примеры первичного остеопороза у детей: несовершенный остеогенез, идиопатический ювенильный остеопороз и синдром остеопороз-псевдоглиомы [26, 47]. Заболеваемость патологией, ассоциированной с остеопорозом, известна и ежегодно уточняется, что позволяет прогнозировать количество находящихся в группе риска или уже имеющих нарушения минерализации детей в масштабах страны. Особое внимание специалистов уделяется детям с первичными формами остеопороза (несовершенный остеогенез и др.) ввиду тяжести их состояния и возрастающих возможностей лечения.
Диагностика. Внедрение в педиатрическую практику методов денситометрии, оценки костного метаболизма и обеспеченности витамином Д, молекулярно-генетических методов позволяет осуществлять раннюю диагностику нарушений костной минерализации. Ключевыми диагностическими и определяющими критериями остеопороза у детей является сочетание низкой костной массы и плотности по данным рентгеновской денситометрии со значимым анамнезом низкотравматических переломов (наличие перелома длинных костей ног, компрессионного перелома позвоночника, двух и более переломов длинных костей рук) [19, 35, 42]. Большое значение для верификации диагноза имеет наличие у пациента факторов риска остеопороза, возможных жалоб и клинических проявлений, данных иных лабораторно-инструментальных методов исследования.
В Беларуси эксплуатируется несколько современных рентгеновских денситометров, оснащенных педиатрическим программным обеспечением. В соответствии с международными нормами [1], необходимо наращивание их количества для восполнения потребности в таких исследованиях, включая выделение оборудования для педиатрических целей. В ряде лабораторий республики определяются биохимические маркѐры костного метаболизма и метаболиты витамина Д, выполняются молекулярно-генетические исследования. Остеопороз признан важнейшей проблемой здравоохранения на государственном уровне [1]. Утверждена инструкция для специалистов, регламентирующая диагностику дефицита костной массы и остеопороза в педиатрии [16], что, наряду с действующими международными документами [3, 35], является методической базой для организации диагностического процесса.
Лечение остеопороза у детей (в первую очередь, медикаментозное) – одна из наиболее сложных педиатрических проблем в мире. Существующая неопределенность с эпидемиологическими, терминологическими, диагностическими аспектами осложняет оценку клинической значимости этой патологии у детей, разграничение физиологических и патологических (требующих коррекции) костных изменений [2]. Широкий арсенал лекарств, применяемый в лечении взрослых, не имеет столь же обширной доказательной базы их эффективности и безопасности в педиатрической практике [19,26, 47]. Вместе с тем необходимость лечения таких детей очевидна, особенно детей, страдающих среднетяжелыми и тяжелыми формами остеопороза, с сопутствующими переломами, болевым синдромом, иммобилизацией, снижением качества и продолжительности жизни. На протяжении последних десятилетий в мире проводятся исследования по изучению безопасности и эффективности ряда лекарственных средств (бисфосфонаты, кальцитонин, метаболиты витамина Д и др.) у детей с остеопорозом. Продолжается дискуссия об этичности их назначения детям, однако на другой чаше весов – страдания тяжелобольного ребенка, лишенного лечения, что также требует этической оценки.
Лечение остеопороза у детей проводится после точной верификации диагноза. Основной его принцип – старт с наиболее простых и изученных методов (включая немедикаментозные, которыми зачастую пренебрегают) с переходом (при отсутствии эффекта) к более сложным и менее изученным [19,20]. Основные цели лечения – обеспечение нормального роста и развития ребенка, замедление или прекращение потери (в идеале – прирост) костной массы и плотности, нормализация костного метаболизма и достижение пиковой костной массы, расширение двигательной активности, повышение качества жизни, купирование болевого синдрома, предотвращение и лечение первичных и последующих переломов [3, 11, 12]. Лечебные мероприятия организуются как на амбулаторном, так и на стационарном этапе.
Показания к госпитализации при остеопорозе у детей: впервые выявляемый остеопороз (обследование, верификация диагноза, подбор лечения), возникновение перелома и или/ отрицательная динамика по клиническим, денситометрическим данным при ранее верифицированном остеопорозе (травматологическая помощь, дообследование, пересмотр терапии), назначение бисфосфонатов (определение показаний, противопоказаний, предварительное обследование, клинико-лабораторно-инструментальный мониторинг в процессе лечения), низкая костная масса и плотность без переломов, если причина не определена (диагностика, коррекция), вторичный остеопороз (по основному заболеванию в соответствии с протоколами) [12].
Лечение у детей, как и у взрослых, проводится по трем направлениям: этиотропное, симптоматическое и патогенетическое [5, 11]. Приоритет этиотропной терапии остеопороза в педиатрии связан со стратегией предпочтения более безопасных методов и ограниченными фармакологическими возможностями. Этиотропное лечение первичных форм остеопороза перспективно и остается предметом исследований (например, стволовые клетки при несовершенном остеогенезе) [41, 50]. При вторичных формах этиотропная терапия подразумевает установление контроля над первичной причиной его развития – обеспечивается достижение ремиссии по основной патологии, предупреждение ее прогрессирования [5,19,49]. Оптимизируется лечение основного заболевания (минимально эффективная доза, своевременное и обоснованное ее снижение, обоснованная смена или чередование лекарств в пользу наименее остеотропных). В ряде случаев для ремиссии необходимо наращивание терапии, в том числе за счет лекарств с негативным действием на кость. Ослабление многовекторного влияния основного заболевания на костную ткань в этом случае может оказаться весомее побочного действия лекарств [19].
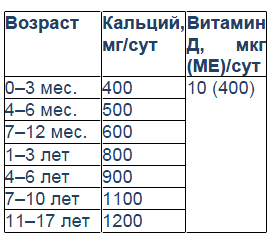
Модификацию питания и физической активности, отказ от вредных привычек, обеспечение благоприятного экологического окружения также можно отнести к этиотропному лечению, учитывая их роль в развитии остеопороза. Диета подбирается индивидуально в соответствии с возрастными принципами рационального питания, учетом ограничений по основной патологии. Необходимость подбора диеты связана также с риском ожирения на фоне длительной иммобилизации у таких пациентов. Особую роль играет специальная диета при ряде заболеваний, сопровождающихся нарушениями костной минерализации (целиакия, лактазная недостаточность, анорексия и др.), поскольку способна инициировать восстановление этих нарушений еще до начала фармакологической коррекции [19, 25, 37]. Один из приоритетов в питании ребенка с остеопорозом – обеспечение норм физиологической потребности по кальцию, витамину Д (табл. 1), белку, иным нутриентам [27]. В этих целях рацион обогащается продуктами с высоким их содержанием, включая разнообразные молочные продукты [3]. Следует отметить доступность широкого спектра лечебных молочных смесей, фортифицированных молочных продуктов [1], компенсирующих в питании нативные молочные продукты, если они противопоказаны (воспалительные заболевания кишечника, пищевая аллергия, лактазная недостаточность и др.).
Обеспечение организма витамином Д осуществляется путем эндогенного синтеза при инсоляции (в норме до 90%), при поступлении с пищей (до 10%), лекарствами [4, 24]. Поэтому при отсутствии противопоказаний рекомендована адекватная естественная инсоляция (с соблюдением общепринятых в педиатрии правил безопасности), хотя оптимальный баланс между потребностью в инсоляции и риском онкопатологии остается предметом дискуссии [10, 24, 27, 33, 38]. Уровень 25(ОН)Д в сыворотке крови, равный 20–32 нг/мл (50–80 нмоль/л), признан экспертами границей обеспеченности витамином Д у детей [31, 33, 36, 40, 46]. Естественное или искусственное поддержание уровня выше этих значений обусловливает реализацию физиологических эффектов витамина Д, эффективность любых лечебно-профилактических мер, является условием назначения ряда лекарств (бисфосфонатов, кальцитонина и др.).
Приоритет в обеспечении организма кальцием и витамином Д должен отдаваться естественным источникам, поскольку в ряде исследований отмечается недостаточный эффект в отношении прироста костной плотности и риска переломов от дополнительного их введения у здоровых детей, что, однако, не распространяется на пациентов, имеющих нарушения костного метаболизма [23, 29, 48]. При невозможности адекватного естественного обеспечения кальцием и витамином Д (элиминационная диета, недостаточная инсоляция и др.) показана их дотация лекарственными средствами в пределах суточной потребности [3, 12, 19, 24, 29, 38].
Физическая активность пересматривается с целью подбора оптимального уровня. Ее объем определяется как состоянием пациента по основному заболеванию, так и ограничениями, связанными с тяжестью остеопороза, наличием и локализацией переломов, стадией их лечения, иными факторами. Восстановление структуры и метаболизма костной ткани, увеличение костной плотности происходят только в условиях стимуляции при нагрузках [10,27]. Увеличение объема активности проводится в возможно ранние сроки под контролем специалиста – от постепенной вертикализации, до пеших прогулок, плавания, занятий на велотренажерах, аква-аэробики. Под руководством специалиста организуется подбор и обучение пациента комплексам ЛФК (принцип «ЛФК без боли»)[5, 11]. Исключается активность с чрезмерными нагрузками, переносом тяжестей, толчками, риском травмирования патологически измененных костных структур [12]. Организуется травмобезопасное бытовое окружение, подбирается ортопедическая мебель и принадлежности для сна, обучения и работы. Противопоказан профессиональный спорт, решение о возможности и сроках посещения оздоровительных секций принимается индивидуально с участием специалистов.
Выявление и устранение причин нарушения физического и полового развития, ликвидация гормональных нарушений (дефицит/избыток массы тела, ожирение, эндо/экзогенный избыток тироидных гормонов и стероидов, дефицит половых гормонов, гормона роста и др.) проводятся с участием эндокринолога [19, 20, 36, 40, 49].
Симптоматическая терапия остеопороза включает купирование болевого синдрома, мышечного спазма, физиотерапевтические методы, ортопедическое лечение [5]. Купирование болевого синдрома и спазма осуществляется в соответствии с общепринятыми в педиатрии подходами, включая применение НПВС, миорелаксантов, кратковременную иммобилизацию, использование корсетов [12]. Физиотерапевтическое лечение дополняет медикаментозное, физиотерапевтом подбирается индивидуальная программа из широкого диапазона методов (магнито / лазероротерапия, ультразвук, электростимуляция, вибротерапия и др.) [5, 6]. Например, вибротерапия показана для укрепления костной массы и мышечной силы у пациентов, не способных обеспечить адекватную нагрузку из-за тяжести состояния [19, 31, 32, 42]. Переломы – обязательный критерий верификации остеопороза у детей, в связи с чем все они нуждаются в наблюдении у специалиста. Диагностика, консервативное и оперативное лечение переломов и деформаций проводятся травматологом-ортопедом в соответствии со стандартами [42].
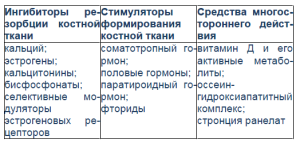
Патогенетическая терапия остеопороза включает применение лекарств, воздействующих на костный метаболизм. Их классификация в зависимости от преобладающего механизма действия представлена в табл. 2 (не все применяются у детей).
Таблица 2. Лекарственные средства для патогенетического лечения остеопороза [3]
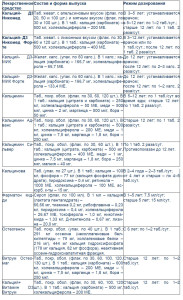
Лекарственные средства на основе кальция и витамина Д применяются у детей с остеопорозом для восполнения физиологической потребности (при невозможности обеспечения из естественных источников), в составе комбинированного лечения с иными лекарствами (бисфосфонаты, кальцитонин), включая купирование возможных побочных реакций на фоне такого лечения (гипокальциемия) [5, 6]. По мнению ряда авторов, самостоятельного значения в лечении остеопороза препараты кальция и витамина Д не имеют [2, 5, 12]. Тем не менее нередко они с успехом применяются в качестве «стартовой» (базисной) монотерапии и в профилактических целях [10, 11]. Дозы кальция и витамина Д в лечении остеопороза, гиповитаминоза Д при соответствующем клиниколабораторном контроле могут превышать нормы физиологической потребности в них [18, 31, 47]. Лекарственные средства с кальцием и витамином Д разделяют на изолированные, комбинированные (их сочетание), комплексные (кальций, витамин Д, другие компоненты) [4, 8]. Содержание элементарного кальция в разных солях различается, составляя: для карбоната – 400 мг/1000 мг, трифосфата – 290 мг/1000 мг, хлорида – 270 мг/1000 мг, цитрата – 210 мг/1000 мг, лактата и глицерофосфата – 190 мг/1000 мг, глюконата – 90 мг/1000 мг соли [3, 12]. Особенности применения этих лекарственных средств представлены в табл. 3.
Таблица 3. Особенности применения лекарственных средств с кальцием и витамином Д [4, 8]
• применяют средства со значимым (близким к физиологической потребности) содержанием кальция и витамина Д;
• это полноценные лекарства – с показаниями, противопоказаниями и побочными эффектами;
• дозирование, режим, длительность приема определяют индивидуально, исходя из инструкции, возрастной потребности, данных об обеспеченности ими из других источников (пища, инсоляция), степени влияния факторов риска, комплаентности пациента и др.;
• комбинированные средства предпочтительнее изолированных; безопасность и эффективность длительного применения иных компонентов в составе комплексных средств не доказана в сопоставимой с кальцием и витамином Д мере, нет доступных клиниколабораторно-инструментальных критериев их контроля, что подвергает сомнению их длительное назначение;
• основой лекарства должна служить соль кальция с максимальным элементарным его содержанием (например, карбонат); среди нативных форм витамина Д предпочтительнее средства на основе холекальциферола (Д3) перед таковыми с эргокальциферолом (Д2);
• средства на основе карбоната кальция принимают во время или после еды, что повышает их всасывание, снижает риск ряда побочных эффектов;
• избегают одновременного приема кальция и пищи, снижающей его всасывание (с вы-
соким содержанием оксалатов, фосфатов, фитина, пищевых волокон); средство запивают водой (избегают чая, сока, минеральной воды);
• суточную дозу кальция разделяют на несколько приемов (выше биодоступность, ниже риск побочных эффектов); обязателен прием одной из доз вечером (выше эффективность);
• при необходимости одновременного со средствами на основе кальция и витамина Д приема иных лекарств учитывают их взаимодействие (избегают одновременного применения, разобщают прием в течение суток, чередуют курсы лечения);
• при патологии печени, почек предпочтительны активные метаболиты витамина Д (не требуют активации в отличие от нативных его форм);
• длительность применения (в течение месяцев-лет), особенно у детей, может снижать комплаентность (подбор удобного дозирования, формы с хорошей органолептикой, способной к растворению, измельчению, рассасыванию, приемлемой стоимости курсового лечения);
• длительное применение требует регулярного клинико-лабораторноинструментального контроля безопасности и эффективности, осведомленности пациента о симптомах передозировки и побочных эффектах, порядке действий при их возникновении;
• применение на фоне ряда заболеваний (диабет, целиакия, фенилкетонурия и др.)
требует выбора конкретного средства (непереносимость вспомогательных веществ);
• применение при остеопорозе на фоне длительной иммобилизации требует осторожности в связи с риском развития гиперкальциемии.
Назначение кальция в раннем возрасте проблематично из-за недостатка зарегистрированных для этой категории пациентов средств с высоким элементарным его содержанием. Применяемые глюконат, глицерофосфат, хлорид, лактат кальция нежелательны в связи с низким содержанием элементарного кальция, местным раздражающим действием, отсутствием пероральных форм с хорошей органолептикой. Вместе с тем, наличие инъекционной формы хлорида и глюконата кальция определяет их как средство выбора при острой гипокальциемии [33]. Необходимость лечения в раннем возрасте заболеваний, сопровождающихся нарушением костной минерализации, обмена кальция и витамина Д (рахит, несовершенный остеогенез, гипопаратироз, вторичный остеопороз, элиминационная диета и др.), обусловливает потребность в препаратах кальция, лишенных указанных недостатков. Применение в раннем возрасте специализированных средств (бисфосфонатов, кальцитонина) также предполагает их сочетание с кальцием.
На фармацевтическом рынке представлены десятки средств, но в значимых дозах кальций и витамин Д содержатся лишь в некоторых из них (табл. 4).
Таблица 4. Лекарственные средства со значимым содержанием кальция и витамина Д [4]
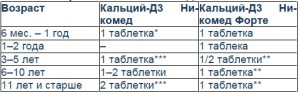
Примером качественных, эффективных и безопасных витаминно-минеральных комплексов на основе кальция и витамина Д, в полной мере соответствующих предъявляемым требованиям, являются «Кальций-Д3 Никомед» и «Кальций-Д3 Никомед Форте» (Takeda Company, Япония). Значимые преимущества их применения в педиатрии: удобная форма выпуска (гибкое дозирование, возможность измельчения, растворения, рассасывания без потери биодоступности), комбинация карбоната кальция с холекальциферолом, привлекательные органолептические свойства (важно при длительном применении, особенно у детей), отсутствие сахара. Эти средства зарегистрированы к применению с 3 лет, однако опубликованы данные об успешном их назначении детям раннего возраста (табл. 5), что также отражено в профильной российской научно-практической программе [3, 11].
Таблица 5. Применение «Кальций-Д3 Никомед» и «Кальций-Д3 Никомед Форте» у детей [11]
* возможно применение при вскармливании адаптированными смесями, содержащими витамин Д;
** при достаточном потреблении кальция с пищей;
*** при низком потреблении кальция с пищей.
При необходимости применения изолированного витамина Д одним из лучших лекарственных средств является «Вигантол», содержащий масляный раствор холекальциферола. Отечественный и зарубежный опыт свидетельствует об эффективности и безопасности применения этих лекарственных средств у детей с остеопорозом в лечебных и профилактических целях [3, 5, 9, 11].
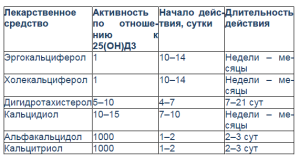
Среди лекарственных средств на основе витамина Д выделяют: 1) содержащие нативный витамин Д (холекальциферол, эргокальциферол), 2) структурные аналоги (печеночные метаболиты) витамина Д2 (дигидротахистерол, кальцидиол), 3) активные метаболиты витамина Д (альфакальцидол, кальцитриол) [12]. Средства на основе активных метаболитов оказывают многоплановое действие: регулируют синтез тканевых факторов роста, коллагена, матриксных белков, увеличивают объем, минерализацию и кортикальный слой кости, восстанавливают ее микроповреждения, улучшают механические свойства, уменьшают болевой синдром, повышают мышечную силу, обладают противовоспалительным эффектом [2]. Их активность, начало, длительность действия в сравнении с нативными формами различаются (табл. 6).
Таблица 6. Характеристика лекарственных средств на основе витамина Д [3]
Наиболее широко у детей применяются средства на основе альфакальцидола и кальцитриола [17]. Кальцитриол характеризуется более быстрым и коротким действием, узким терапевтическим диапазоном, вследствие чего высок риск гиперкальциемии. Альфакальцидол действует медленнее, что позволяет назначать его 1 раз в сутки. Для превращения альфакальцидола в активный метаболит (кальцитриол) необходимо гидроксилирование в печени. Скорость такого превращения регулируется физиологическими потребностями организма, что в определенной мере снижает риск развития гиперкальциемии [12]. Альфакальцидол эффективен и при заболеваниях почек, поскольку не требует почечного гидроксилирования [12, 17, 18]. Одинаково эффективны различные методы его введения: ежедневный, интермиттирующий, пульс-терапия [2]. Может применяться без кальция, однако добавление солей кальция усиливает эффективность [2, 12], возможно сочетание с кальцитонином, бисфосфонатами, оссеин-гидроксиапатитным комплексом [6, 12, 18]. Лечение активными метаболитами требует лабораторного контроля (кальций крови и мочи) в начале (подбор дозы) и в дальнейшем (во избежание передозировки) [6, 18].
Бисфосфонаты – средства на основе неорганических пирофосфатов, ингибирующие костную резорбцию. Их антирезорбтивная активность варьирует, что связано с химической структурой: этидронат (принята за 1), клодронат и тилудронат (10), памидронат и неридронат (100), олпадронат (200–500), ибандронат (500–1000), алендронат (1000–2000), ризедронат (2000), золендронат (10 000 раз) [43,44,45]. Азотсодержащие бисфосфонаты – более сильные ингибиторы резорбции, чем препараты 1-го поколения (табл. 7) [45].
Применение бисфосфонатов в педиатрии остается противоречивой проблемой, их безопасность и эффективность у детей не подтверждены с позиций доказательной медицины [21, 22, 31]. Тем не менее возрастающее их применение у детей со среднетяжелыми и тяжелыми формами остеопороза подтверждает, что польза выше риска побочных эффектов, а безопасность у детей сопоставима с таковой у взрослых [20, 32, 43]. Важный довод в пользу их применения – отсутствие эффективной альтернативы в лечении тяжелой патологии (несовершенный остеогенез, остеопороз при ревмопатологии и др.) – бездействие чревато прогрессирующим ухудшением состояния [7]. На сегодня получен и совершенствуется опыт назначения детям большинства бисфосфонатов, включая парентеральные формы памидроната, золедроната, неридроната, ибандроната и пероральные – алендроната и ризедроната [19, 31]. Одна из нерешенных проблем – стандартизация показаний, режима дозирования, длительности применения для разработки стратегии их использования в педиатрии [19, 43]. Это представляется сложной задачей по ряду причин. Так, при различной этиологии остеопороза дозирование может различаться (например, несовершенный остеогенез сопровождается повышением костного метаболизма, а высокодозная стероидная терапия его, напротив, угнетает)[31]. Костный метаболизм ребенка активнее, чем у взрослого, что также сказывается на дозе и кратности применения этих лекарств у детей [13].
Условно определены три основных группы показаний к назначению бисфосфонатов у детей:
1) заболевания и ятрогенные воздействия, сопровождающиеся остеопорозом (несовершенный остеогенез, ревмопатология, стероидный остеопороз и др.),
2) заболевания, ассоциированные с гиперкальциемией (иммобилизация, онкологические заболевания, гиперпаратироз и др.),
3) заболевания, сопровождающиеся кальцификацией мягких тканей (дерматомиозит и др.) [2, 30,43].
Бисфосфонаты показаны детям при среднетяжелых и тяжелых формах остеопороза [19]. К настоящему времени унифицированные критерии тяжести остеопороза (как и критерии эффективности его терапии) у детей не определены. В качестве возможных критериев предложены следующие: наличие и выраженность болевого синдрома, количество, частота, локализация переломов, наличие и выраженность костных деформаций, степень снижения костной массы и плотности, выраженность нарушений костного метаболизма, степень нарушения качества жизни и др. [43, 49].
Наиболее противоречивым из них остается эффективность терапии бисфосфонатами в отношении последующих переломов [19, 36]. Спорно также применение бисфосфонатов при нетяжелых формах остеопороза с редкими переломами (например, легкие формы несовершенного остеогенеза), при спонтанно излечивающихся формах первичного остеопороза у детей (большинство случаев ювенильного идиопатического остеопороза) [20, 43, 49]. В подобных случаях вопрос об их назначении решается индивидуально. Обоснованность профилактического применения бисфосфонатов у детей с высоким риском остеопороза также дискутабельна [31, 42, 47]. Примеры таких ситуаций – низкая костная масса и плотность на фоне тяжелого заболевания или его лечения (например, длительной стероидной терапии) в отсутствие переломов, либо возникновение переломов при нормальной костной плотности (может отмечаться при ряде заболеваний, например, лейкемии) [43, 49]. При манифестации переломов в динамике, на фоне снижения костной плотности, решают вопрос о назначении бисфосфонатов [49].
У детей бисфосфонаты применяются при подтвержденном диагнозе, при отсутствии эффекта от немедикаментозного лечения и более изученных у детей лекарственных средств (кальций, витамин Д и его активные метаболиты, кальцитонин), причем в условиях специализированного центра под контролем специалиста в области детского остеопороза в соответствии с программой управления рисками и контролируемого доступа к терапии [20, 40, 43, 49]. Назначение возможно после тщательного клинико-лабораторно-инструментального обследования (включающего в том числе оценку костного метаболизма, стоматологического статуса, уровня обеспеченности кальцием и витамином Д), исключения оперативных ортопедических вмешательств в период лечения, противопоказаний к их назначению, при условии динамического наблюдения. Введение внутривенных форм бисфосфонатов детям осуществляется стационарно под наблюдением или после консультации специалиста. Лечение пероральными формами возможно в амбулаторных условиях под контролем специалиста при условии наблюдения ребенка. Предпочтительно начинать его в условиях стационара с переходом на амбулаторный прием при хорошей переносимости. В соответствии с мировой практикой применение бисфосфонатов у детей требует письменного добровольного согласия представителей ребенка, а также одобрения со стороны локальных и национальных этических комитетов [13].
Основной фармакологический эффект средств на основе кальцитонина – ингибирование костной резорбции; их сравнительно слабая эффективность позиционирует кальцитонин в качестве средства второй-третьей линии лечения остеопороза [41]. Наиболее активный (в 40 раз активнее человеческого) и часто используемый из них – синтетический аналог кальцитонина лосося. Это единственная группа средств с анальгезирующим действием, сравнимым с действием нестероидных противовоспалительных средств [5, 17]. Ранее препараты на основе кальцитонина применялись в лечении несовершенного остеогенеза, в настоящее время уступили место бисфосфонатам [13]. Средства на основе кальцитонина эффективны при вторичном остеопорозе – ГКС-индуцированном, при ревматических заболеваниях (ревматоидный артрит, системная красная волчанка, дерматомиозит), а также при иммобилизационном остеопорозе, гиперкальциемии, фиброзной дисплазии [2,17, 30]. У детей предпочтительно применение интраназальной формы выпуска (переносится лучше инъекционной) [2, 5]. Некоторыми специалистами изолированная или комбинированная (с активными метаболитами витамина Д / кальцием и витамином Д) терапия кальцитонином рассматривается как этап лечения остео-пороза у детей, предшествующий бисфосфонатам [7]. Комбинированное применение кальцитонина эффективнее монотерапии [2]. Кальцитонин обладает хорошим уровнем безопасности [6,17], не отмечено специфических для детей побочных эффектов. Вместе с тем, установлена связь кальцитонина с увеличением риска онкологической патологии у взрослых, что может ограничивать его применение и у детей [31].
Оссеин-гидроксиапатитный комплекс – комплексный препарат с двойным действием на костный метаболизм (стимулирует остеобласты, ингибирует остеокласты). Замедленное высвобождение кальция из гидроксиапатита обусловливает отсутствие пика гиперкальциемии. Органический компонент содержит локальные регуляторы ремоделирования костной ткани (трансформирующий фактор роста-?, инсулиноподобные факторы роста I и II, остеокальцин, коллаген I типа), активизирующие формирование и угнетающие резорбцию. Разрешен с 6 лет в связи с лекарственной формой. Особенность средств – отсутствие в составе витамина Д, часто назначаемого дополнительно. Может комбинироваться с бисфосфонатами, кальцитонином.
Половые гормоны, гормон роста. Применение лекарственных средств на основе половых гормонов, гормона роста оказывает лечебный эффект при остео-порозе у детей с гипогонадизмом, задержкой полового развития, дефицитом гормона роста. Лечение гормоном роста продемонстрировало положительный эффект у части детей при несовершенном остеогенезе, ювенильном артрите [34,42]. Показания к назначению, дозирование, длительность, контроль лечения при применении этих средств определяются эндокринологом.
Ряд лекарственных средств (модуляторы эстрогеновых рецепторов, стронция ранелат, иприфлавон, фториды, терипаратид, деносумаб, антитела к склеростину) не применяются при остеопорозе у детей в отличие от взрослых по причине своего состава, побочных эффектов, отсутствия опыта применения в педиатрии [3,17]. Так, терипаратид (рекомбинантный человеческий паратироидный гормон) продемонстрировал развитие остеосаркомы у молодых крыс в преклинических исследованиях (но имеются данные его успешного применения у детей с гипопаратирозом) [12, 19, 31, 50]. Описано применение деносумаба (моноклональное анти-RANCL антитело) при тяжелой фиброзной дисплазии, несовершенном остеогенезе у детей [31, 39].
Таким образом, остеопороз у детей –противоречивая и актуальная проблема современной педиатрии. Главной целью проводимых в мире и в нашей стране исследований является разработка унифицированных, научно обоснованных, эффективных и безопасных методов диагностики, лечения и профилактики этой патологии. Опыт применения у детей ряда лекарств, включая средства на основе кальция, нативных и активных форм витамина Д, кальцитонина, бисфосфонатов, перспективен в решении этой проблемы. Значимая распространенность нарушений костной минерализации у детей, включая тяжелые формы остеопороза, доказанное их влияние на заболеваемость остеопорозом во взрослой популяции требуют оказания эффективной помощи этим пациентам. Важная задача – подготовка квалифицированных специалистов по проблеме, централизация помощи на базе специализированного педиатрического центра, оснащение его современным оборудованием, разработка, одобрение и внедрение в отечественную педиатрическую практику соответствующих мировому уровню подходов к лечению остеопороза у детей.
Л И Т Е Р А Т У Р А
1. Аудит состояния проблемы остеопороза в странах Восточной Европы и Центральной Азии 2010 // IOF. – 2011. – 66 с.
2. Васильева Т.Г., Кочеткова Е.А. // Рос. семейн. врач. – 2007. – Т.11, №2. – С.43–46.
3. Дефицит кальция и остеопенические состояния у детей: диагностика, лечение, профилактика:науч.-практ. программа. – М., 2006. – 48 с.
4. Диагностика и лечение дефицита костной массы и остеопороза у детей: учеб-метод. пособие /А.С.Почкайло [и др.]. – Минск, 2011. – 56 с.
5. Диагностика и терапия неврологических проявлений остеопороза у взрослых и детей: метод. рекомендации / С.К. Евтушенко [и др.]. – Донецк, 2001. – 28 с.
6. Ершова О.Б. // Остеопороз и остеопатии. – 2010. – №2. – С.41–50.
7. Лисицин А.О. [и др.] // Вопросы современной педиатрии. – 2010. – Т.9, №1. – С.116–121.
8. Мохорт Т.В. // Мед. панорама. – 2009. – №3. – С.79–84.
9. Нарушения обмена кальция у детей и подростков: диагностика, профилактика, лечение: учеб. пособие / М.В.Ханды [и др.]. – Якутск, 2009. – 81 с.
10. Овчаренко Л.С., Вертегел А.А. // Дитячий лiкар. – 2010. – №5. – С.40–44.
11. Остеопороз у детей: пособие для врачей / Н.А. Коровина [и др.]. – М., 2005. – 50 с.
12. Педиатрия: нац. рук-во: в 2 т. – М.:ГЭОТАР-Медиа, 2009. – Т. 1. – 1024 с.
13. Поворознюк В.В. и др. // Ортопедия, травматология и протезирование. – 2009. – №4. – С.110–117.
14. Санитарные нормы и правила «Требования к питанию населения: нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Республики Беларусь»: утв. Постановлением МЗ РБ 20.11.2012 №180. – 21 с.
15. Скрипникова И.А. [и др.] // Остеопороз и остеопатии. – 2010. – №2. – С.28–40.
16. Способ комплексной диагностики низкой костной массы и остеопороза у детей и молодых взрослых: инструкция по применению №154-1208: утв. МЗ РБ 13.02.2009 / В.Ф.Жерносек [и др.]. – Минск: БелМАПО, 2009. – 34 с.
17. Чумакова О.В., Картамышева Н.Н. // Педиатрия. – 2004. – №5. – С.84–87.
18. Шварц Г.Я. // Укр. ревматол. журн. – 2009. – №3. – С.63–69.
19. Bachrach L.K., Ward L.M. // J. Clin. Endocrinol. Metab. – 2009. – Vol.94, N2. – P.400–409.
20. Bianchi M.L. // Bone. – 2007. – Vol.41. – P.486–495.
21. Bisphosphonate therapy for children and adolescents with secondary osteoporosis / L.Ward [et al.] // Cochrane Database Syst. Rev. – 2007, Iss. 4.
22. Bisphosphonate therapy for osteogenesis imperfecta / C.A.Phillipi [et al.] // Cochrane Database Syst.cRev. – 2008, Iss. 4.
23. Calcium supplementation for improving bone mineral density in children / T.M.Winzenberg [et al.] // Cochrane Database Syst. Rev. – 2006, Iss. 2.
24. Ebeling P.R. [et al.] // MJA. – 2013. – Vol.2, suppl.1. – P.1–9.
25. Ferrari S. [et. al.] // Osteoporos. Int. – 2012. – Vol.23, Iss.12. – P.2735–48.
26. Khoshhal K.I. // JTU Med. Sc. – 2011. – Vol.6, N2. – P.61–76.
27. Kontulainen S.A. [et al.] // Am. J. Lifestyle Med. – 2013. – Vol.10, N10. – Р.1–13.
28. Laud K.J., Gordon C.M. // Arch. Pediatr. Adolesc. Med. – 2006. – Vol.160. – P.1026–1032.
29. Lekamwasam S. [et al.] // Osteoporos. Int. – 2012. – Vol.23, Iss.9. – P.2257–2276.
30. Lietman S.A. [et al.] // Curr. Opin. Pediatr. – 2010. – Vol.22, Iss.4. – P. 508–515.
31. Mдkitie O. // Nat. Rev. Rheumatol. – 2013. – P.1–11.
32. Marreiros H. [et al.] // J. Spinal Cord Med. – 2012. – Vol.36, N1. – P.9–21.
33. Misra M. [et al.] // Pediatrics. – 2008. – Vol.122, N2. – P.398–417.
34. Munns C.F.J., Cowell C.T // J. Musculoskelet. Interact. – 2005. – Vol.5, N3. – P.262–272.
35. Official Positions and Pediatric Official Positions of the International Society for Clinical Densitometry 2007 [Electronic resource]. – Mode of access: http: //www.iscd.org/ Visitors/ positions/ OfficialPositionsText.cfm. – Date of access: 25.05.2013.
36. Pappa H. [et al.] // JPGN. – 2011. – Vol.53, N1. – P.11–25.
37. Perez-Castrillon J.-L. // Open Bone J. – 2009. – Vol.1. – P.23–27.
38. Quinlivan R. [et. al.] // Neuromuscul. Disord. – 2010. – Vol.20, iss.11. – P. 761–9.
39. Semler O. [et al.] // J. Musculoscelet. Neuronal. Interact. – 2012. – Vol.12, N3. – P.183–188.
40. Sermet-Gaudelus I. [et al.] // J. Cystic Fibrosis. – 2011. – Vol.10, suppl.2. – P.S16–S23.
41. Sharif P.S [et al.] // Rheumat. Int. – 2011. – Vol.31. – P.289–300.
42. Shaw N.J // Europ. J. Endocrinol. – 2008. – Vol.159. – P.S33–S39.
43. Shaw N.J., Bishop N.J. // Arch. Dis. Child. – 2005. – Vol.90. – P.494–499.
44. Somalo L., Santos F. // World J. Pediatr. – 2007. – Vol.3, N4. – P.245–253.
45.Speiser Ph. W [et al.] // PER. – 2005. – Vol.3, N2. – P.87–96.
46. The Section on Endocrinology // Pediatrics. – 2011. – Vol.127, N1. – P.189–194.
47. Uziel Y. [et al.] // Pediatr. Rheumatol. – 2009. – Vol.7, iss.16.
48. Vitamin D supplementation for improving bone mineral density in children / T.M.Winzenberg [et al.] // Cochrane Database of Systematic Reviews.– 2010, iss. 10.
49. Ward L.M. [et al.] // Int. J. Clin. Rheumatol. – 2009. – Vol.4, N6. – P.657–672.
50. Zhang C. [et al.] // J. Musculoskelet. Neuronal. Interact. – 2012. – Vol.12, N3. – P.174–182.
Медицинские новости. – 2013. – №7. – С. 42-48.














Комментировать