О.В. Гончарова, д. м. н., профессор, ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России; Г.В. Куранов, к. м. н., ассистент, ГБОУ ВПО «Пермская государственная медицинская академия им. Е.А. Вагнера»
Ежегодно в мире регистрируется более миллиарда случаев острых респираторных инфекций (ОРИ), которые, кроме отрицательного влияния на организм человека, способствуют формированию хронической патологии. В структуре инфекционных болезней у детей удельный вес ОРИ достигает 90% [1]. В зависимости от возраста, эпидемиологических и социальных условий процент детей, часто болеющих острыми респираторными инфекциями, в детской популяции может достигать 30-50% [2]. При этом в среднем на долю часто болеющих детей приходится до трех четвертей всех случаев ОРИ у детей [2].
К часто болеющим детям (ЧБД) относят детей с частыми респираторными инфекциями, возникающими из-за транзиторных отклонений в защитных системах организма и не имеющими стойких органических нарушений в них. Дети могут болеть не только часто, но и длительно (одно заболевание — более 10-14 дней). Длительно болеющие дети также могут быть отнесены к категории часто болеющих.
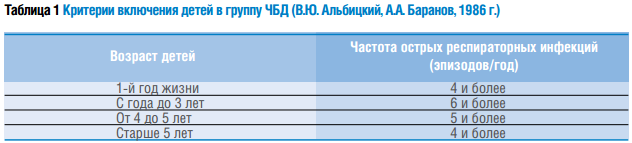
Критерии включения детей в группу ЧБД представлены в таблице 1.
Важно отметить, что частые и длительные респираторные болезни могут отмечаться также у детей с наследственной или врожденной патологией (муковисцидоз, различные варианты, формы и типы иммунных дефицитов — недостаточность IgA, в частности секреторного, различные варианты иммунодиатезов и др.). Таким образом, в каждом конкретном случае нужно выяснить причину частых респираторных инфекций у ребенка.
Наиболее часто заболевания у ЧБД проявляются в виде инфекций:
- верхних дыхательных путей: ринит, тонзиллит, эпиглоттит, фарингит, ларингит. К этой группе условно относят и заболевания лор-органов (острый средний отит и синуситы)*;
- нижних отделов дыхательных путей и легочной паренхимы: трахеит, бронхит, пневмония*.
- Чаще острый синусит, острый средний отит, пневмонии являются бактериальными осложнениями ОРВИ.
Среди этиологических факторов ОРИ «удельный вес» вирусов составляет 70-90%, а смешанной вирусно-бактериальной инфекции — 20-25%.
Среди вирусных возбудителей чаще выявляют вирусы гриппа, парагриппа, энтеровирусы, респираторно-синцитиальный вирус, риновирусы, аденовирусы и др. Среди бактериальных возбудителей преобладают Str. pneumonie, Haemophil. infl., Str. pyogenes, Staphyl. aureus и др. В последние годы возросла роль граммотрицательных бактерий, а также простейших (микоплазмы, уреаплазмы, хламидии и др.)
Факторы, способствующие возникновению частых ОРИ у детей:
- распространенность в окружающей среде вирусов, патогенной микробной флоры, простейших;
- частая активация первичной вирусной инфекцией эндогенной условно-патогенной флоры в организме детей (причина трансформации этой микрофлоры в патогенную у многих связана с особенностями иммунного ответа, детерминированными соответствующим геном системы гистосовместимости HLA);
- инициирование частыми вирусно-бактериальными инфекциями развития вторичных иммунодефицитных состояний у ребенка.
Факторы, способствующие развитию вторичных иммунодефицитных состояний у ЧБД:
- наследственная предрасположенность, характеризующаяся наличием у ребенка врожденных нарушений в иммунной системе;
- влияние неблагоприятных экологических и социальных факторов, «истощающих» иммунную систему ребенка;
- неблагоприятное анте- и постнатальное развитие ребенка (недоношенность, незрелость, рахит, анемия, раннее искусственное вскармливание, пищевая аллергия), способствующее формированию транзиторных или стойких дефектов иммунной системы;
- аллергическая настроенность организма ребенка;
- нарушения микрофлоры кишечника; слизистых, кожи;
- нарушения состояния центральной нервной системы у ребенка;
- наличие хронических очагов инфекции (хронический тонзиллит, аденоиды, кариозные зубы);
- наличие неблагоприятно влияющих на детский организм загрязнителей внешней среды (ксенобиотики, в том числе тяжелые металлы, радионуклеиды, курение в семье);
- частые психоэмоциональные стрессы, нерациональное питание, недостаточность витаминов и микроэлементов в пищевом рационе ребенка;
- социальная и экономическая нестабильность семьи, неблагоприятные социально-бытовые условия, низкий материальный и культурный уровень населения.
На фоне имеющихся неблагоприятных факторов у ребенка частые вирусно-бактериальные нагрузки истощают иммунную защиту организма и ведут к развитию вторичных иммунодефицитных состояний, создавая условия для персистирования инфекции в организме, хронизации воспалительного процесса и развития бронхолегочной патологии.
Таким образом, для профилактики и лечения ОРИ патогенетически обоснованным является использование методов лечения и/или препаратов, способствующих повышению активности неспецифических факторов защиты детского организма от инфекций.
Основные принципы лечения ЧБД
В период заболевания ОРВИ назначается (по показаниям) противовирусная и антибактериальная терапия (при наличии очагов бактериальной инфекции и определении чувствительности лекарств к возбудителям), проводится санация очагов хронической инфекции.
В период ремиссии для ЧБД важны: рациональный режим дня; здоровый образ жизни семьи (в том числе полный отказ от курения в присутствии ребенка или в помещении, где он находится); сбалансированное и полноценное питание; закаливание с использованием водных процедур и с соблюдением основного правила «не допускать переохлаждения ребенка»; общеукрепляющая и лечебная физкультура; фитотерапия (при отсутствии аллергических реакций); кислородные коктейли и витаминотерапия; использование средств, повышающих общую сопротивляемость организма ребенка; фармакологическая иммунокоррекция; лечение аллергии, болезней желчевыводящей системы и кишечника, глистных инвазий и других сопутствующих болезней, вызывающих снижение иммунитета; физиотерапевтические методы на хронические очаги инфекции носоглотки (лазеротерапия); общий и точечный массаж; вакцинация (не следует проводить в острый период ОРВИ, возможна через 7-14 дней после болезни).
Уже более 10 лет в педиатрической практике для профилактики ОРИ и лечения часто болеющих детей применяется лекарственный препарат метаболического действия на основе L-карнитина — Элькар®, выпускаемый с 2000 года отечественной компанией «ПИК-ФАРМА» в виде водного раствора левокарнитина для приема внутрь. L-карнитин (левокарнитин) способствует проникновению жирных кислот через клеточные мембраны из цитоплазмы в митохондрии, где они подвергаются процессу бета-окисления с образованием АТФ и ацетил-КоА [3]. L-карнитин улучшает белковый и жировой обмен, угнетает образование кетокислот и анаэробный гликолиз, уменьшает степень лактат-ацидоза, повышает устойчивость к физическим нагрузкам, способствует экономному расходованию гликогена и увеличивает его запасы в печени и в мышцах. Кроме того, он оказывает анаболическое действие в клетках нервной системы, способствуя синтезу белков, восстановлению их целостности и функций, что крайне важно с учетом тесной связи нервной и иммунной систем и того факта, что среди детей с последствиями перинатальных поражений ЦНС очень высокая встречаемость часто болеющих детей.
Таким образом, Элькар®, являясь универсальным стимулятором и корректором энергетического обмена при различной патологии, повышает защитные возможности организма. Он доказал свою эффективность и безопасность в лечении заболеваний детского возраста и их профилактике, в том числе в лечении часто болеющих детей [4].
Так, в исследовании, проведенном Т.Н. Накостенко, С.О. Ключниковым, В.С. Сухоруковым [5, 6], часто болеющие дети дошкольного и младшего школьного возраста (от 3 до 9 лет) получали комплексную терапию препаратами Пантогам® и Элькар® в возрастных дозах, однако, в отличие от инструкций, только однократно: Элькар* — до 10 часов утра, Пантогам® — с 12:00 до 13:00 часов в течение одного месяца. На фоне терапии у детей отмечали положительную динамику клинических проявлений (минимизация жалоб и эмоциональной лабильности, нормализация сна и аппетита, повышалась устойчивость к нагрузкам и др.) и изменений активности митохондриальных ферментов, варьирующей от 8,7% до 62,3% — в среднем от 19,5% до 27,4%. Одной из ведущих причин значительной вариабельности показателей клеточного энергообмена являются различия в исходной глубине нарушений и уровне адаптационно-приспособительных процессов у детей, только по частоте ОРИ искусственно объединяемых в одну группу «часто болеющих». Анализ результатов исследования показал, что максимальный эффект коррекции нарушенного энергетического статуса характерен для детей с изначально наиболее низкими показателями ферментативного статуса.
Авторы отметили отсутствие каких-либо побочных эффектов даже у детей с отягощенным аллергоанамнезом и наличием признаков резидуального поражения центральной нервной системы.
С учетом частой хронизации воспалительного процесса и развития бронхолегочной патологии у часто болеющих детей, актуальны результаты исследования Т.Е. Бойченко [7], в котором доказана эффективность комплексной терапии (Элькар® и Виферон) у детей в возрасте от рождения до 3 лет с пневмонией.
Дети, разделенные на 3 группы: А — получающие метаболическую коррекцию L-карнитином (Элькаром); Б — получающие метаболическую коррекцию Элькаром и иммуномодулирующую терапию Вифероном; В — группа сравнения, которым метаболическая и иммуномодулиру-ющая коррекция не проводилась, были сопоставимы по основным клиническим характеристикам. Элькар® назначали детям в суточной дозе от 50 до 100 мг/кг, Виферон — по 1 суппозиторию 3 раза в сутки через 8 часов. Курс лечения — 5 дней, 1-2 курса.
На фоне терапии продолжительность симптомов интоксикации (недомогание, слабость, снижение аппетита), частота обнаружения остаточных изменений в легких (по данным рентгенологического исследования) в группах А и Б сократилась (р<0,05) по сравнению с группой В. После лечения у больных групп А и Б отмечалось улучшение показателей иммунитета: повышение CD3 в динамике,
CD72, Ig М (р<0,05); в группе Б — увеличение CD3, CD8, CD72 (р<0,05), повышение уровня иммуноглобулинов G в сыворотке крови. Очевидно, что повышение активационных реакций свидетельствует о достаточных адаптационных возможностях организма детей и связано с иммуномодулирующей и метаболической терапией, действие которой направлено на активацию системы иммунитета и энергозатрат, то есть на активизацию саморегулирующих систем организма детей.
Частым сопутствующим заболеванием у часто болеющих детей является хронический тонзиллит. По данным В.А. Белова [8], на течение хронического тонзиллита оказывают влияние особенности энергетического метаболизма организма ребенка, в частности энергодефицит. Энергодефицитное состояние может не являться самостоятельным (первичным) заболеванием, но накладывает отпечаток на течение других болезней, в частности хронического тонзиллита, является показанием для назначения специальной корригирующей терапии и диктует необходимость особого подхода к профилактике и лечению хронического тонзиллита. Механизм такой взаимосвязи очевиден, так как изменение энергозависимых этапов защитных реакций организма может явиться одной из причин иммунологических нарушений и обострения хронического тонзиллита у часто болеющих детей.
Под наблюдением находилось 45 детей с диагнозом «хронический тонзиллит» с подтвержденным снижением активности митохондриальных ферментов, что явилось патогенетическим обоснованием назначения препарата Элькар® в возрастных дозировках курсом 2 месяца. К концу курса у детей отметили снижение утомляемости, уменьшение частоты обострений хронического тонзиллита, нормализацию цитохимических показателей активности митохондриальных ферментов.
В исследовании Н.А. Геппе, С.И. Эрдес, Е.В. Петуховой и др. [9] была проведена оценка эффективности L-карнитина, назначаемого по 250 мг 1 раз утром в течение месяца детям от 7 до 10 лет в период восстановления после перенесенных ОРВИ в связи с наличием признаков астенизации: повышенная утомляемость, плохой сон, снижение аппетита, плаксивость, агрессивность, головные боли. К концу курса лечения у 53% детей отмечены положительные изменения на ЭКГ, достоверное сокращение времени восстановления гемодинамических показателей и увеличение количества пройденных ступеней при проведении стресс-теста, что свидетельствовало о повышении устойчивости к физическим нагрузкам и о сокращении периода реабилитации.
Л.А. Балыковой и др. доказан иммунотропный и стресспротекторный эффекты Элькара у юных спортсменов при его назначении курсом 1,5 месяца в лечебной дозе 75-100 мг/кг/сут. спортсменам со стрессорной кардиомиопатией и в профилактической дозе 30-50 мг/кг/сут. спортсменам без признаков поражения сердца [10]. Так, курсовой прием Элькара вызывал изменения в эффекторных и иммунорегуляторных звеньях врожденного и адаптивного иммунитета: у большинства спортсменов (p<0,05) выявлено снижение поглотительной и повышение метаболической активности нейтрофилов с накоплением в них активных форм кислорода. Кроме того, лечение способствовало возрастанию уровня физической работоспособности, оптимизации гемодинамики в области сердца и уменьшению уровня биохимических, психологических и других маркеров стресса.
Таким образом, препарат Элькар® отличает хорошая переносимость в сочетании с высокой клинической эффективностью. Лечение Элькаром позволяет существенно улучшить состояние здоровья часто болеющих детей, нормализуя механизмы вегетативной регуляции организма, стабилизируя клеточный энергообмен, что в свою очередь способствует возрастанию физической активности детей и повышению показателей иммунитета. При этом важно учитывать индивидуальные особенности организма ребенка, в том числе и наличие различных функциональных изменений, что необходимо для составления комплексной программы лечения и реабилитации, включающей средства метаболической коррекции. Именно комплексная программа даст высокую эффективность реабилитации часто болеющих детей.
Список литературы:
- Таточенко В.К. Дифференциальная диагностика кашля у детей и его лечение // Лечащий врач, 2008, № 3: 13-15.
- Самсыгина Г.А. Острый ринофарингит у детей, его лечение и профилактика // Consilium Medicum «Педиатрия», 2013, № 3: 37-42.
- Marcovina S.M., Sirtori C., Peracino A. et al. Translating the basic knowledge of mitochondrial functions to metabolic therapy: role of L-carnitine // Translational Research, 2013, vol. 161, is. 2: 73-84.
- Брин И.Л., Неудахин Е.В., Дунайкин М.Л. Карнитин в педиатрии: исследования и клиническая практика. М.: ИД «Медпрактика-М», 2015, 112 с.
- Накостенко Т.Н., Ключников С.О., Сухоруков В.С. Коррекция нарушений вегетативного гомеостаза и внутриклеточного энергообмена у часто болеющих детей// Вестник педиатрической фармакологии и нутрициологии, 2007, № 4 (1): 25-29.
- Сухоруков В.С. Энергодефицитный диатез у детей. Издание второе. М.: ИД «Медпрактика-М», 2012, 28 с.
- Бойченко Т.Е. Особенности течения острых бронхолегочных заболеваний у детей первых трех лет жизни из социопатических семей / Автореф. дисс. канд. мед. наук. Хабаровск, 2007, 21 c.
- Белов В.А. Применение препарата Элькар при хроническом тонзиллите у детей // Практика педиатра, 2009, №5: 47-50.
- Геппе Н.А., Эрдес С.И., Петухова Е.А. и др. Эффективность L-карнитина в реабилитации детей после перенесенных ОРВИ // Вопросы практической педиатрии, 2010, т. 5, № 2: 50-56.
- Балыкова Л.А., Ивянский С.А., Широкова А.А. и др. Изменения сердечно-сосудистой и иммунной системы у юных спортсменов: положительные эффекты L-карнитина // Consilium Medicum «Педиатрия», 2014, № 4: 20-24.








Комментировать