Обзор информации о современных возможностях эффективной коррекции повышенного АД и дислипидемии с помощью использования у пациентов комбинированного препарата Кадуэт. Результаты проведенных международных клинических и экспериментальных исследований.
Павлова О.С.
Республиканский научно-практический центр «Кардиология», Минск, Республика Беларусь
Резюме. В настоящем обзоре представлена информация о современных возможностях эффективной коррекции повышенного АД и дислипидемии с помощью использования у пациентов комбинированного препарата Кадуэт. Результаты проведенных международных клинических и экспериментальных исследований доказали преимущества совместного применения амлодипина с аторвастатином c позиции снижения количества сердечно-сосудистых осложнений, протективного влияния на органы-мишени и повышения приверженности пациентов к лечению.
Ключевые слова: артериальная гипертензия, дислипидемия, сердечно-сосудистая профилактика, контроль артериального давления, терапия статинами.
Aртериальная гипертензия (АГ) относительно редко встречается у пациентов изолированно, гораздо чаще она сочетается с другими факторами сердечно-сосудистого риска – гиперхолестеринемией, избыточной массой тела, курением, нарушениями углеводного обмена. По данным Фремингемского исследования, гиперхолестеринемия отмечалась более чем у 40% лиц с повышенным АД [1]. В странах Западной Европы эти два фактора сердечнососудистого риска (АГ и гиперхолестеринемия) наблюдались у 35% населения (Tunstall-Pedoe Н. et al., 2004). Результаты проспективного 14-летнего наблюдения за состоянием здоровья 3310 врачей (Physicians’ Health Study) продемонстрировали, что дислипидемия являлась независимым фактором, ассоциированным с повышенным риском развития АД у мужчин [2]. В Республике Беларусь при обследовании 1035 пациентов с артериальной гипертензия у 36% женщин и 30% мужчин выявлена гиперхолестеринемия [3]. С возрастом распространенность АГ и гиперхолестеринемии увеличивается, и наличие у индивидуума этих факторов риска в большей степени повышает вероятность возникновения сердечно-сосудистых осложнений, чем можно было бы ожидать от отдельного вклада каждого[4].
Современные проблемы, связанные с артериальной гипертензией, характеризуются ее широкой распространенностью во взрослой популяции, недостаточной осведомленностью населения о наличии повышенного АД, неадекватным лечением и неэффективным контролем. В сравнительном исследовании лиц с АГ, проживающих в 35 странах мира, было установлено, что контроль АД у мужчин составляет всего 10,2–10,6%, у женщин незначительно выше – 16,2–17,3%. При этом достоверной разницы в степени контроля АД у пациентов в зависимости от уровня экономического развития стран не выявлено [5]. В то же время в некоторых странах (Швейцария, Канада, Чехия), по данным эпидемиологических наблюдений, в течение 10–23 лет увеличилось количество лиц с артериальной гипертензией, получающих антигипертензивную терапию, и среди них тех, у кого достигнуто целевое АД [6–8].
Гиперхолестеринемия среди населения многих стран распространена более широко, чем АГ (табл. 1).
Таблица 1. Распространенность гиперхолестеринемии по данным популяционных исследований
| Страна | Количество наблюдений | Контингент изучаемых лиц | Распространенность гиперхолестеринемии, % |
| Великобритания [9] | 14142 | > 16 лет | 59 |
| Россия [10, 11] | 7915 (мужчины)3534 (женщины) | > 30 лет | 55 (мужчины) 56,9 (женщины) |
| Китай [12] | 15540 | 35–74 года | 54 |
| США [13] | 2864 | > 20 лет | 47 |
| Испания [14] | 2833 | 25–79 лет | 37,9 (мужчины) 35 (женщины) |
Несмотря на широкую распространенность гиперхолестеринемии, доля пациентов, получающих липидоснижающую терапию, небольшая. В Великобритании только 11% лиц, нуждающихся в коррекции дислипидемии, принимают статины, a содержание холестерина липопротеинов низкой плотности (ХС ЛПНП) менее 2,5 ммоль/л отмечается у 14,3% пациентов с артериальной гипертензией [9]. В США эффективное лечение гиперхолестеринемии проводится менее чем у 1/3 пациентов с cердечно-сосудистыми заболеваниями (ССЗ) и дополнительными факторами риска [15]. Аналогичные результаты получены при изучении контроля дислипидемии у пациентов в старших возрастных группах [16]. Среди 7 839 обследованных ветеранов, имеющих более трех факторов сердечно-сосудистого риска (средний возраст 58,7 года), рекомендуемые показатели липидного спектра наблюдались только у 32%.
Недостаточные усилия по эффективному проведению коррекции артериальной гипертензии и дислипидемии как со стороны врачей, так и со стороны пациентов широко обсуждаются медицинской общественностью. К сожалению, снижение артериального давления,, общего холестерина, ХС ЛПНП в крови до требуемых значений не проводится у большинства пациентов. Одновременный контроль АГ и гиперхолестеринемии отмечается только у 9%, у пожилых лиц возрастает незначительно (до 14,3–16,0%) [13, 16].
В современных условиях активная тактика ведения пациентов с АГ и гиперхолестеринемией приводит к значимому положительному результату, а снижение распространенности этих факторов риска в течение длительного времени способствует уменьшению случаев преждевременной смерти от ССЗ на 45% [17]. Клинические рандомизированные исследования доказали, что эффективное лечение АГ существенно снижает риск развития инфаркта миокарда (на 20–25%), инсульта (на 35–40%) и сердечной недостаточности (более чем на 50%) [1, 18]. Messerli F.H. et al. при проведении метаанализа выявили, что у пациентов с артериальной гипертензией применение статинов сопровождалось снижением сердечно-сосудистой заболеваемости и смертности на 22% [19]. В крупном десятилетнем эпидемиологическом исследовании установлено, что эффективный контроль АД и коррекция содержания ХС ЛПНП, ХС ЛПВП в крови предотвращает осложнения ишемической болезни сердца (ИБС) у 51,3% мужчин и 42,6% женщин с метаболическим синдромом [20].
Таким образом, на сегодняшний день проблема неадекватного лечения повышенного АД и дислипидемии в сочетании с их высокой распространенностью у населения является актуальной и требует своевременного вмешательства с целью снижения сердечно-сосудистой заболеваемости и смертности.
В международных рекомендациях постепенно расширяется контингент пациентов с артериальной гипертензией, нуждающийся в терапии статинами [21, 22] (табл. 2).
Таблица 2. Показания для проведения терапии статинами у пациентов с АГ
| Рекомендации Европейского общества по АГ, 2007 г. | Пересмотр Рекомендаций Европейского общества по АГ 2009 г. |
|
|
Помимо гиполипидемического эффекта, статины способны оказывать влияние на снижение артериального давления, и эти свойства статинов были доказаны в клинических исследованиях [23–26]. Strazzulo P. в 2007 г. также провел метаанализ, который включал 20 рандомизированных контролируемых исследований по гиполипидемической терапии с включением 828 пациентов, часть из которых принимали сопутствующее антигипертензивное лечение [27]. Систолическое артериальное давления, (САД) было достоверно ниже в среднем на 1,9 мм рт.ст. в группе пациентов, дополнительно получавших статины. Причем в подгруппе пациентов с исходно более высокими значениями САД (>130 мм рт.ст.) снижение САД было более статистически значимым (–4,0 мм рт.ст.) Антигипертензивный эффект статинов по влиянию на диастолическое АД (ДАД) был также достоверно значимый – снижение на 0,9 мм рт.ст., а в подгруппе лиц с исходно более высоким ДАД (>80 мм рт.ст.) – 1,2 мм рт.ст. Влияние статинов на снижение артериального давления не зависело от возраста пациентов, длительности наблюдения, исходного и достигнутого содержания в крови общего холестерина или ХC ЛПНП, сопутствующего антигипертензивного лечения. В другом исследовании, опубликованном в 2011 году, показано, что контроль АД был значительно выше среди пациентов с одновременным приемом антигипертензивных средств и статинов (в 54,9% случаев) в сравнении с пациентами, которые принимали только антигипертензивное лечение (в 21,4% случаев; р<0,05). Достоверной исходной разницы между наблюдаемыми группами пациентов с АГ по полу, возрасту, спектру применения и количеству антигипертензивных лекарств не наблюдалось [28]. Таким образом, по имеющимся результатам клинических исследований можно сделать вывод, что использование статинов наряду с антигипертензивной терапией способствует не только снижению АД, но и достижению его целевого уровня.
Антигипертензивный эффект статинов исследователи объясняют несколькими возможными патофизиологическими механизмами. Статины не только снижают образование холестерина путем ингибиции 3-гидрокси, 3-метилглютарил коэнзима-А (ГМГКоА) редуктазы – гиполипидемический эффект, но и подавляют продукцию изопреноидов, фарнезилфарнезилового и геранил-геранилового дифосфатов. Снижением выработки этих агентов и объясняется дополнительный эффект статинов, связанный с уменьшением АД [29]. В результате повышается активность эндотелиальной cинтазы оксида азота (NO) и выработка NO, снижается высвобождение и циркуляция вазоконстриктора эндотелина-1, что способствует улучшению функции эндотелия, уменьшению оксидативного стресса и воспалительного ответа [30]. Кроме того, доказано, что статины уменьшают чувствительность рецепторов 1-го типа к ангиотензину II и снижают количество циркулирующего в крови альдостерона [31, 32]. В ряде клинических работ также доказано положительное влияние статинов, связанное с уменьшением жесткости крупных артерий, при изолированной систолической артериальной гипертензией [33, 34].
С целью эффективного контроля АГ и гиперхолестеринемии разработан лекарственный препарат «Кадуэт» (Pfizer), который включает антагонист кальция дигидропиридинового ряда – амлодипин и ингибитор ГМГ-КоА редуктазы – аторва-статин.
Амлодипин уменьшает трансмембранное поступление внеклеточного кальция в гладкомышечные клетки сосудов, в результате расслабления гладкомышечных клеток артерий происходит вазодилатация, снижается общее периферическое сопротивление и системное АД. Наряду с высокой антигипертензивной эффективностью амлодипин обладает кардиопротекторными свойствами за счет противоишемической активности, способности влиять на атерогенез и дисфункцию эндотелия. Поэтому использование амлодипина у пациентов с АГ, ИБС положительно влияет на снижение количества сердечно-сосудистых осложнений, как это доказано в крупных многоцентровых исследованиях VALUE, ALLHAT, ASCOT-BPLA, CAMELOT [35].
Аторвастатин ингибирует фермент ГМГ-КоА редуктазу, снижая образование мевалоновой кислоты, являющейся предшественником холестерина. Уменьшается содержание ОХ и ХС ЛПНП в плазме за счет угнетения синтеза холестерина в печени и увеличения числа рецепторов ХС ЛПНП на поверхности гепатоцитов. Крупные клинические исследования по применению аторвастатина показали его высокую эффективность при коррекции дислипидемии, а также в плане уменьшения сердечнососудистых осложнений у пациентов c острыми коронарными синдромами (PROVE-IT, MIRACL), сахарным диабетом 2 типа (CARDS), с хронической ИБС (TNT, ALLIANCE, AVERT, GREACE), с АГ и тремя сопутствующими сердечно-сосудистыми факторами риска (ASCOT-LLA), после инфаркта миокарда (IDEAL) [36–40].
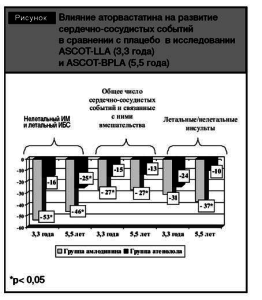
Положительные эффекты совместного использования амлодипина и аторвастатина у пациентов с АГ по предотвращению ССЗ и их осложнений впервые были доказаны в многоцентровом проспективном контролируемом исследовании ASCOT, проводившемся в Великобритании, Ирландии и скандинавских странах [41]. В первую ветвь исследования (ASCOT-BPLA) было включено 19 257 пациентов, которые были рандомизированы на две группы, принимавших амлодипин и атенолол в течение 5,5 года. Критериями включения пациентов в наблюдение были имеющаяся АГ без перенесенного инфаркта миокарда в анамнезе или клинических признаков ИБС, но с наличием трех и более факторов риска ССЗ: курение, гипертрофия левого желудочка (ЛЖ), отягощенная сердечно-сосудистая наследственность в первой линии родства, возраст >55 лет, микроальбуминурия или протеинурия, СД 2 типа, заболевания периферических артерий, инсульт или транзиторные ишемические атаки в анамнезе, мужской пол, отношение ОХ/ХС ЛПНП ? 6. Для второй ветви исследования (ASCOT-LLA) из этих пациентов были отобраны 10 305 человек с содержанием ОХ ? 6,5 ммоль/л, которым были назначены дополнительно аторвастатин или плацебо (2 группы). Критерием оценки эффективности проводимого лечения в сформировавшихся таким образом 4 группах была первичная комбинированная конечная точка, включающая развитие нелетального инфаркта миокарда и летальной ИБС у наблюдаемых пациентов. Исследование ASCOT-LLA было остановлено досрочно через 3,3 года по причине статистически значимого снижения количества сердечно-сосудистых событий в 2 группах пациентов, получавших аторвастатин и антигипертензивные препараты (амлодипин и атенолол) в сравнении с 2 группами пациентов, принимавших антигипертензивное лечение и плацебо. Дальнейший анализ показал, что такой положительный результат наблюдался преимущественно в группе больных, принимавших амлодипин и аторвастатин, при этом у них регистрировалось на 53% меньше случаев нелетального инфаркта миокарда и летальной ИБС в сравнении с группой амлодипина и плацебо (р<0,001) (рисунок). У пациентов, получавших атенолол и амлодипин, количество сердечнососудистых событий снизилось на 16%, что было статистически незначимо в сравнении с пациентами, лечившимися атенололом и плацебо (р=0,3). Показательны отдаленные результаты ASCOT-LLA которые оценивались через 5,5 года, когда закончилась вторая ветвь исследования ASCOT-BPLA и пациенты еще 2,2 года получали антигипертензивное лечение (амлодипин или атенолол) [42]. В течение этого периода 65% пациентов из группы аторвастатина продолжили принимать этот препарат, а 56 % пациентов группы плацебо был назначен аторвастатин. К концу наблюдения помимо антигипертензивных препаратов 65% пациентов обеих групп закончившегося исследования ASCOT-LLA принимали статины и содержание ОХ и ХС ЛПНП в крови у них было идентичным. При этом было установлено, что наименьший относительный риск развития нелетального инфаркта миокарда и летальной ИБС, сердечно-сосудистых осложнений и связанных с ними вмешательств, нелетального/ летального инсультов был достигнут в группе пациентов, принимавших амлодипин с аторвастатином, в сравнении с другими тремя группами (см. рисунок).
Таким образом, в крупном англо-скандинавском исследовании ASCOT были доказаны синергичные эффекты совместного использования амлодипина с аторвастатином по снижению количества сердечно-сосудистых событий с нелетальным и летальным исходами у пациентов с АГ.
Терапевтическая эффективность сочетанного применения амлодипина с аторвастатином изучалась в исследованиях как при применении отдельных таблетированных форм (AVALON, RESPOND), так и в виде единой комбинированной таблетки, содержащей фиксированные дозы (СUSP, GEMINI, GEMINI-AALA, JEWEL I-II, CAPABLE).
В 2006 г. были опубликованы результаты клинического рандомизированного двойного слепого, плацебо-контролируемого исследования AVALON с включением 847 пациентов с артериальной гипертензией и дислипидемией, большинство из которых (94%) имели высокий сердечно-сосудистый риск [43]. После 8 недель лечения в группе принимавших амлодипин 5 мг и аторвастатин 10 мг целевые уровни артериального давления и ХС ЛПНП были достигнуты у 45,5% пациентов в отличие от пациентов остальных трех групп, где были назначены: только амлодипин в дозе 5 мг – 8,3%; только аторвастатин в дозе 10 мг – 28,6% и плацебо – 3,5%.
После 28 недель терапии двумя препаратами десятилетний сердечно-сосудистый риск по Фремингемской шкале у пациентов снизился более чем в два раза (с 15,1 до 6,9%). Аналогичные результаты были получены в многоцентровом рандомизированном исследовании RESPOND с участием 1660 пациентов с АГ и дислипидемией [44]. Снижение САД и ХС ЛПНП было достоверно более значимым через 8 недель в группах пациентов, получавших одновременно амлодипин и аторвастатин. Авторы исследования сделали также важный вывод, что сочетанное использование этих препаратов и их применение в различных дозах (от 5 до 10 мг амлодипина и от 10 до 80 мг аторвастатина) не влияет на эффективность действия каждого из них в отдельности. У пациентов без сопутствующего ССЗ или сахарного диабета сочетанная терапия сопровождалась снижением риска ИБС в среднем от 15,8–18% до 7,3–10,7% по Фремингемской системе оценки риска.
Подтверждают целесообразность создания комбинированной лекарственной формы, содержащей в одной таблетке амлодипин и аторвастатин, результаты клинических исследований, проведенных с участием большого количества пациентов, нуждающихся в одновременной коррекции артериальной гипертензии и дислипидемии [45–49] (табл. 3).
Таблица 3. Результаты применения комбинированной формы амлодипина/аторвастатина (Кадуэт) по данным рандомизированных исследований
| Исследование | Длительность лечения | Количество участников | Контингент пациентов | Результаты |
| GEMINI – многоцентровое, открытое (США, 2005) | 14 недель | 1220 | АГ и дислипидемия | ↓АД и ↓ ХС ЛПНП до целевых значений у 57,7% пациентов |
CUSP – многоцентровое двойное слепое, плацебоконтролируемое (США, 2009) | 8 недель | 123 | АГ (САД=140– 169 и/или ДАД= 90–105 мм рт.ст.) и дислипи- демия (ХС ЛПНП 2,8– 4,14 ммоль/л) | ↓АД и ↓ХС ЛПНП до целевых значений у 55,6% пациентов (в группе плацебо – 5%); ↓ риска ИБС на 38% по Фремингемской шкале |
| CAPABLE – многоцентровое, открытое (США, 2009) | 20 недель | 489 | Неконтролируемая АГ и дислипидемия, у 34% – СД 2 типа | ↓АД и ↓ХС ЛПНП до целевых значений у 48,3% пациентов, в группе с СД – ↓ХС ЛПНП у 61,5% |
GEMINI-AALA – многоцентровое, открытое (Латинская Америка, Африка, Ближний Восток, АзиатскоТихоокеанский регион, 2009) | 14 недель | 1638 | АГ и дислипидемия | ↓АД и ↓ХС ЛПНП до целевых значений у 55,2% пациентов |
JEWEL I – многоцентровое, открытое (Великобритания, Канада, 2009 г.) | 16 недель | 1135 | Неконтролируемая АГ и дислипидемия, у 35% пациентов – СД | ↓АД и ↓ХС ЛПНП до целевых значений у 62,9% пациентов |
JEWEL II – многоцентровое, открытое (Европа, 2009) | 16 недель | 1084 | Неконтролируемая АГ и дислипи-демия, у 27,4% пациентов – СД | ↓АД и ↓ХС ЛПНП до целевых значений у 50,6% пациентов |
Преимущества одновременного или синхронного назначения антигипертензивной и гиполипидемической терапии заключаются не только в успешной коррекции двух факторов сердечно-сосудистого риска, но и в повышении приверженности пациентов к лечению. Отсутствие приверженности к лечению приводит к серьезным клиническим и экономическим последствиям как для индивидуума, так и для общества в целом. Данные ретроспективного когортного анализа более 11 тысяч пациентов показали, что отсутствие приверженности к лечению существенно увеличивает случаи госпитализации (в среднем на 52%) и риска смертности от всех причин (на 81%) [50]. Поэтому отсутствие приверженности к лечению профессор Marc Munger и Benjamin Tassel назвали одним из пока не признанных факторов сердечно-сосудистого риска [51].
В большом ретроспективном американском исследования CARPE изучалась приверженность пациентов к лечению в зависимости от приема амлодипина и аторвастатина в виде единой таблетированной формы или двух отдельных таблеток [52]. В анализируемую когорту было включено 4703 пациента с АГ и дислипидемией. Методом контроля приверженности к лечению являлись данные аптечной сети по частоте выписывания рецептов в течение 6 месяцев. Приверженность к лечению у пациентов оценивалось по количеству дней приема таблеток (?80%) в течение анализируемого периода. Используемый в исследовании метод оценки приверженности к лечению – один из наиболее объективных косвенных методов измерения приверженности к лечению в странах с закрытой системой аптек. Результаты CARPE показали, что приверженность пациентов к лечению при использовании одной таблетки с фиксированными дозами амлодипина и аторвастатина была почти в 2 раза больше (ОШ=1,95; р<0,0001), чем при их назначении в отдельных таблетированных формах.
Преимущества активной профилактической стратегии с целью снижения сердечно-сосудистого риска были установлены в недавно опубликованном многоцентровом проспективном открытом рандомизированном исследовании CRUCIAL (2011) с участием 1461 пациента из 19 стран Азии, Европы, Ближнего Востока, Латинской Америки [53]. В CRUCIAL были включены пациенты в возрасте от 35 до 79 лет с неконтролируемой АГ, гиперхолестеринемией (ОХ? £ ?6,5 ммоль/л) и средним сердечнососудистым риском. Все пациенты были разделены на две группы. В первой группе всем пациентам назначался Кадуэт (амлодипин с аторвастатином в фиксированных дозах 5/10 мг или 10/10 мг соответственно). Во второй группе пациентов использовалось обычное антигипертензивное и гиполипидемическое лечение, но в отдельных таблетированных формах. В обеих группах врачи при недостаточно эффективном снижении АД и ХС ЛПНП, ОХ у пациентов могли назначать дополнительно антигипертензивные и гиполипидемические препараты. Промежуточные результаты исследования оценивались через 16 недель, конечные результаты – через 52 недели наблюдения. К концу наблюдения целевые уровни артериального давления, и ХС ЛПНП были достигнуты у почти каждого второго пациента (49,6%) в группе больных, принимавших комбинированный препарат амлодипина с аторвастатином, в сравнении с группой пациентов, для лечения которых использовался традиционный подход (26,5%). Более того, использование фиксированных доз амлодипина с аторвастатином в одной таблетке у пациентов первой группы привело к снижению на 33% десятилетнего риска ИБС, рассчитанного по Фремингемской шкале, в отличие от второй группы пациентов, где риск снизился только на 4% (p<0,001).
Большинство экспертов объясняют успешные клинические результаты совместного применения аторвастатина и амлодипина не только антигипертензивным и липидоснижащим эффектами, но и другими доказанными фармакодинамическими свойствами [36].
Основные фармакодинамические преимущества сочетанного применения амлодипина с аторвастатином [36]:
- Увеличение оксида азота в эндотелии сосудов.
- Уменьшение размера и кальцификации атеросклеротической бляшки.
- Снижение маркеров воспаления в плазме крови.
- Уменьшение жесткости артерий.
- Уменьшение гипертрофии левого желудочка.
- Повышение инсулиночувствительности тканей.
- Увеличение активности тканевого активатора плазминогена.
Одним из главных преимуществ сочетанного использования амлодипина и аторвастатина является их синергичный эффект, направленный на улучшение функции эндотелия сосудов. В экспериментальной работе на клетках эндотелия человека было доказано, что амлодипин с аторвастатином увеличивал образование NO почти в 2 раза больше, чем каждый из них в отдельности, что также сопровождалось уменьшением образования цитотоксичного пероксинитрита на 50% [54].
Применение амлодипина и аторвастатина у пациентов с АГ приводило к достоверному снижению в плазме крови воспалительных маркеров – Среактивного белка (СРБ), фактора некроза опухоли и интерлейкина-6 (ИЛ-6) [55, 56]. В свою очередь доказана взаимосвязь увеличения маркеров воспаления (ИЛ-6, высокочувствительный СРБ) в крови у пациентов с развитием инфаркта миокарда (Ridker P.M. и соавт., 2000–2001), инсульта (Ford E.S.и соавт., 2000) и повышением смертности от всех причин (Enomoto M. и соавт., 2008).
Использование амлодипина и аторвастатина сопровождается дополнительным эффектом в виде снижения инсулинорезистентности тканей и повышения их инсулиночувствительности, что положительно влияет на углеводный обмен у пациентов, особенно с сопутствующим ожирением, метаболическим синдромом и сахарным диабетом [57, 58].
Доказано улучшение фибринолитических свойств крови при совместном применении амлодипина с аторвастатином у пациентов с АГ, дислипидемией и нарушениями углеводного обмена [59]. При этом увеличение активности тканевого активатора плазминогена было более значимым при приеме двух препаратов в сравнении с приемом одного амлодипина.
Влияние аторвастатина в сочетании с амлодипином на уменьшение размера и кальцификации атеросклеротической бляшки было установлено в ряде экспериментальных работ, причем дополнительное воздействие амлодипина увеличивало степень достигаемого эффекта [60–62].
Комбинированная терапия амлодипином с аторвастатином может способствовать также регрессу массы миокарда ЛЖ, что было получено в 4месячном рандомизированном испытании у пациентов с АГ и гиперхолестеринемией [56]. Достоверно большая редукция индекса массы миокарда ЛЖ у пациентов отмечалась при совместном использовании амлодипина с аторвастатином (от 121,6 до 103,2 г/м2) в отличие от лечения одним амлодипином (от 115,8 до 110,6 г/м2).
Протективное влияние на органы-мишени cочетанной терапии амлодипина с аторвастатином у 688 пациентов с АГ и дислипидемией было также показано в исследовании AVALON Arterial Wall Compliance Trial [63]. После 28 недель у пациентов, получавших комбинированное лечение, показатели эластичности мелких артерий достоверно улучшились в большей степени, чем при монотерапии амлодипином или аторвастатином.
Таким образом, комбинированное использование у пациентов амлодипина и аторвастатина дает ряд преимуществ с позиции потенцирования и суммации полезных протективных свойств каждого из них с положительным влиянием на эндотелиальную функцию, атеросклеротические процессы, эластические свойства артерий, фибринолитическую систему, гипертрофию ЛЖ, тканевую инсулиночувствительность.
Фармакокинетические свойства комбинированного препарата «Кадуэт» с фиксированными дозами амлодипина и аторвастатина в виде единой таблетки были тщательно изучены в клиническом рандомизированном исследовании [64]. Показано, что в сопоставимых дозах биодоступность каждого компонента препарата не отличалась от биодоступности амлодипина и аторвастатина отдельных таблетированных форм. Длительные периоды полувыведения амлодипина с аторвастатином дают возможность их использования однократно в день. Более того, совместное применение амлодипина и аторвастатина не оказывает значимого влияния на фармакокинетические особенности каждого их них. Лечение амлодипином с аторвастатином как в виде отдельных таблетированных форм, так и в комбинированном варианте сопровождалось хорошей переносимостью у пациентов [43–45,47–49]. Наиболее частыми побочными явлениями у пациентов были периферические отеки, головная боль, респираторные инфекции, астения, головокружение, боль в животе и миалгия. На фоне приема комбинированной терапии амлодипина с аторвастатином ни у одного из пациентов, участвовавших в этих исследованиях, не было зарегистрировано случаев рабдомиолиза.
На основании описанных результатов клинических исследований можно констатировать, что назначение пациентам комбинированного препарата «Кадуэт» (амлодипин с аторвастатином в фиксированной дозе) позволяет врачу решить сразу несколько основных задач:
1. Проводить эффективную одновременную коррекцию двух факторов сердечно-сосудистого риска: повышенного АД и дислипидемии, в том числе у лиц с нарушениями углеводного обмена.
2. Использовать его протективные свойства в предотвращении поражения органов-мишеней.
3. Увеличить практически вдвое приверженность пациентов к обоим видам лечения за счет удобства в приеме, сокращения количества таблеток и уменьшения стоимости.
Таким образом, в современных условиях профилактическая стратегия должна быть направлена на снижение абсолютного риска развития сердечнососудистых заболеваний и осложнений с акцентом на проведение одновременной коррекции модифицируемых факторов сердечно-сосудистого риска, имеющихся у конкретного больного.
ЛИТЕРАТУРА
1. Kannel W.B. // Am. J. Hypertens. – 2000. – Vol. 13. – P. 3S–10S.
2. Halperin R.O., Sesso H.D., Ma J. et al. // Hypertens. – 2006. – Vol. 47. – P. 45–50.
3. Paulava V., Nechesova T., Liventseva M. et al. // J. Hypertens. – 2010. – Vol. 28, suppl., abstr.484.
4. Ferdinand K.C., Kleinpeter M.A. // Curr. Hypertens. Rep. – 2006. – Vol. 8. – P. 489–496.
5. Pereira M., Lunet N., Azevedo A., Barros H. // J. Hypertens. – 2009. – Vol. 27(5). – P. 963–975.
6. Estoppey D., Paccaud F., Vollenweider P., Marques-Vidal P. // BMC Public Health. – 2011. – Vol. 11. –P. 114.
7. McAlister F.A., Wilkins K., Joffres M. // CMAJ. – 2011. – Vol. 183(9). – P. 1007–1013.
8. Cífková R., Skodová Z., Bruthans J. et al. // J. Hypertens. – 2010. – Vol. 28(11). – P. 2196–2203.
9. Mindell J., Aresu M., Zaninotto P.Endocrinol. (Oxf). – 2011. – May, 16. et al. // Clin.
10. Шальнова С.А. Факторы риска сердечно-сосудистых заболеваний и показатели ожидаемой продолжительности жизни населения России (по результатам обследования национальной представительной выборки): автореф. дис. … д-ра мед.наук. – М.,1999.
11. Шальнова С.А., Деев А.Д., Оганов Р.Г. // Кардиоваск. терапия и профилактика. – 2005. – Vol. 4(1). – С. 4–9.
12. Zheng Y., Stein R., Kwan T. et al. // Clin. Cardiol. – 2009. – Vol. 32, N 9. – P. 491–497.
13. Wong N.D., Lopez V., Tang S., Williams G.R. // Am. J. Cardiol. – 2006. – Vol. 98(2). – P. 204–208.
14. Félix-Redondo F.J., Fernández-Bergés D., Fernando Pérez J. et al. // Atension Primaria. – 2011. –Vol. 43(8). – P. 426–434.
15. Davidson M.H., Maki K.C., Pearson T.A. et al. // Am. J. Cardiol. – 2005. – Vol. 96(4). – P. 556–563.
16. Welch V., Tang S.S.Drugs. – 2007. – Vol. 7(5). – P. 381–389. // Am. J. Cardiovasc.
17. Оганов Р.Г., Масленникова Г.А. // Кардиология. – 2007. – Vol. 1. – P. 4–7.
18. Collins R., Peto R., MacMahon S. et al. // Lancet.– 1990. – Vol. 335(8693). – P. 827–838.
19. Messerli F.H., Pinto L., Tang S.K. et al. // Am. J. Cardiol. – 2008. – Vol. 10. – P. 319–325.
20. Wong N.D., Pio J.R., Franklin S.S. et al. // Am. J. Cardiol. –2003. – Vol. 91(12). – P. 1421–1426.
21. Guidelines for the Management of arterial hypertension, task force of the European Society of Hypertension and the European Society of Cardiology // J. Hypertens. – 2007. – Vol. 25, № 6. – P. 1105–1187.
22. Reappraisal of European guidelines on hyperetension management: a European Society of Hypertension Task Force document // J. Hypertens. – 2009. – Vol. 27, № 11. – P. 2121–2158.
23. Golomb B.A., Dimsdale J.E., White H.L. et al. // Arch Intern Med. – 2008. – Vol. 168(7). – P. 721–727.
24. Glorioso N., Troffa C., Filigheddu F. et al. // Hypertens. – 1999. – Vol.34(6). – P.1281–1286.
25. Terzoli L., Mircoli L., Raco R., Ferrari A.U. // J. Cardiovasc. Pharmacol. – 2005. – Vol. 46(3). – P. 310–315.
26. Prasad G.V., Ahmed A., Nash M.M., Zaltzman J.S. // Kidney Int. – 2003. – Vol. 63(1). – P. 360–364.
27. Strazzullo P., Kerry S.M., Barbato A. et al. // Hypertension. – 2007. – Vol. 49(4). – P. 792–798.
28. Morgado M., Rolo S., Macedo A.F., Castelo-Bran-co M. // J. Cardiovasc. Dis. Res. – 2011. – Vol. 2(1). –P. 44–49.
29. Cifkova R., Nilsson P. // ESH scientific newsletter. – 2008. – Vol. 9. – P. 35.
30. Wolfrum S., Jensen K., Liao J.K. // Arterioscler. Thromb. Vasc. Biol. – 2003. – Vol. 23. – P. 729–736.
31. Wassmann S., Faul A., Hennen B. et al. // Circ. Res. – 2003. – Vol. 93(9). – P. 98–103.
32. Ide H., Fujiuya S., Aanuma Y., Agishi Y. // Clin. Ther. – 1990. – Vol. 12. – P. 410–420.
33. Shige H., Dart A., Nestel P. // Atherosclerosis. – 2001. – Vol. 155. – P. 245–250.
34. Ferrier K.E., Muhlmann M.H., Baguet J.P. et al. // J. Am. Coll. Cardiol. – 2002. – Vol. 39. – P. 1020–1025.
35. Blank R., Hobbs F.D., Zamorano J., Girerd X. // Drugs Today (Barc). – 2007. – Vol. 43(3). – P. 157–177.
36. Curran M.P. // Drugs. – 2010. – Vol. 70(2). – P. 191–213.
37. Schwartz G.G., Olsson A.G., Ezekowitz M.D. et al. // JAMA. – 2001. – Vol. 285. – P. 1711–1718.
38. Koren M.J., Hunninghake D.B. // J. Am. Coll. Cardiol. – 2004. – Vol. 44. – P. 1772–1779.
39. Pitt B., Waters D., Brown W.V. et al. // N. Engl. J. Med. 1999. – Vol. 341. – P. 70–76.
40. Athyros V.G., Papageorgiou A.A., Mercouris B.R. et al. // Curr. Med. Res. Opin. 2002. – Vol. 18. – P. 220–228.
41. Sever P.S., Poulter N.R., Dahlof B., Wedel H. // J. Hypertens. – 2009. – Vol. 27(5). – P. 947–954.
42. Sever P., Dahlöf B., Poulter N. et al. // Eur. Heart J. – 2006. – Vol. 27(24). – P. 2982–2988.
43. Messerli F.H., Bakris G.L., Ferrera D. et al. // J. Clin. Hypertens (Greenwich). –2006. – Vol. 8(8). – P. 571–583.
44. Preston R.A., Harvey P., Herfert O. et al. // J. Clin. Pharmacol. – 2007. – Vol. 47(12). – P. 1555–1569.
45. Neutel J.M., Bestermann W.H., Dyess E.M. et al. // J.Clin. Hypertens. – 2009. – Vol. 11(1). – P. 22–30.
46. Ferdinand K.C., Flack J.M., Saunders E. et al. // J. Clin. Hypertens. – 2009. – Vol. 11(10). – P. 585–593
47. Blank R., LaSalle J., Reeves R. et al. // J. Clin. Hypertens. – 2005. – Vol. 7(5) – P. 264–273.
48. Erdine S., Ro Y.M., Tse H.F. et al. // J. Hum. Hypertens. – 2009. – Vol. 23(3) – P. 196–210.
49. Hobbs R., Gensini G., Mancini J. et al. // Eur. J. Cardiovasc. Prev. Rehabil. – 2009. – Vol. 16(4) – P. 472–480.
50. Ho P.M., Rumsfeld J.S., Masoudi F.A. et al. // Arch. Intern. Med. – 2006 – Vol. 166(17) – P. 1836–1841.
51. Munger M.A., Tassel B. W., LaFleur J. // Med. Gen. Med. – 2007. – Vol. 9(3) – P. 58.
52. Patel B.V., Leslie R.S., Thiebaud P. et al. // Vasc. Health. Risk. Manag. – 2008 – Vol. 4(3) – P. 673–681.
53. Zamorano J., Erdine S., Pavia A. et al. // Curr. Med. Res. Opin. – 2011. – Vol. 27(4) – P. 821–833.
54. Mason R.P., Kubant R., Heeba G. et al. // Pharm. Res. – 2008. – Vol. 25(8) – P. 1798–1806.
55. Charbonneau F., Anderson T.J., Title L. et al. // Atherosclerosis. – 2008. – Vol. 197(1) – P. 420–427.
56. Ge C.J., Lu S.Z., Chen Y.D. et al. // Heart Vessels. – 2008. – Vol. 23(2) – P. 91–95.
57. Fogari R., Preti P., Zoppi A. et al. // Eur. J. Clin. Pharmacol. – 2006. – Vol. 62 (10) – P. 817–822.
58. Koh K.K., Quon M.J., Han S.H. et al. // Int. J. Cardiol. – 2011. – Vol. 146 (3) – P. 319–325.
59. Fogari R., Derosa G., Lazzari P. et al. // Am. J. Hypertens. – 2004. – Vol. 17(9) – P. 823–827.
60. Martin-Ventura J.L., Munoz-Garcia B., Blanco-Colio L.M. et al. // Kidney Int. Suppl. – 2008. – Vol. 111. –P. S71–74.
61. Delsing D.J., Jukema J.W., van de Wiel M.A. et al. // J.Cardiovasc. Pharmacol. – 2003. – Vol. 42 (1) – P. 63–70.
62. Trion A., de Maat M., Jukema W. et al. // J. Cardiovasc. Pharmacol. – 2006. – Vol. 47 (1) – P. 89–95.
63. Сohn J.N., Wilson D.J., Neutel J. et al. // Am. J. Hypertens. – 2009. – Vol. 22 (2) – P. 137–144.
64. Chung M., Calcagni A., Glue P. et al. // J. Clin. Pharmacol. – 2006. – Vol. 46 (9) – P. 1030 –1037.
Источник: Медицинские новости. – 2012. – №1. – С. 62-68.









Комментировать