В.В. Иванова, М.В. Иванова, А.С. Левина, А.А. Закина, О.В. Тихомирова, Г.Ф. Железникова, О.А. Аксенов, Е.В. Комелева, НИИ детских инфекций Росздрава, Санкт-Петербург
В результате проведенного исследования определены клинико-лабораторные особенности течения перинатальных герпесвирусных инфекций у детей раннего возраста. Обоснована необходимость и предложен способ комплексной диагностики, а также схема диспансерного наблюдения за детьми. Определена эффективность иммуномодулирующей терапии детей с перинатальными герпесвирусными инфекциями ликопидом и вифероном.
Ключевые слова: дети, перинатальная герпесвирусная инфекция, диагностика, иммуномодулирующая терапия, ликопид, виферон.
Актуальность изучения перинатальных герпесвирусных инфекций обусловлена широкой циркуляцией вирусов герпеса в популяции и высокой частотой передачи их ребенку от матери [1—3]. Наряду с острым течением инфекции у ребенка может наблюдаться длительная персистенция возбудителя с формированием медленно текущего хронического инфекционного процесса. Исследованиями последних десятилетий установлено, что у детей раннего возраста нарушения иммунного реагирования в значительной мере обусловлены инфицированием вирусами семейства Herpesviridae. Перинатальные герпесвирусные инфекции, часто протекающие субклинически, приводят к формированию патологических изменений у детей в более старшем возрасте [4, 5].
Целью работы явилось определение клинико-лабораторных критериев для дифференцированной терапии детей раннего возраста с диагностированным перинатальным инфицированием вирусами герпеса.
Характеристика детей и методы исследования
Осуществлено вирусологическое исследование ретроплацентарной крови от 96 плацент с морфологическими признаками инфекций, вызванных ДНК-содержащими вирусами, которые были обнаружены при стандартном патологоанатомическом исследовании последа (кафедра анатомии Санкт-Петербургской государственной педиатрической медицинской академии при участии ассистента кафедры канд. мед. наук Е.П. Федотовой) [6, 7].
Выявление герпесвирусной инфекции в ретроплацентарной крови, сыворотке крови ребенка и матери осуществляли в вирусологической лаборатории НИИ детских инфекций с помощью модифицированной реакции связывания комплемента [8]. Определяли антигены вируса простого герпеса 1-го и 2-го типов, цитомегаловируса и вируса Эпштейна—Барр, специфических иммунных комплексов с наличием антигенов, специфических антител различных подклассов (IgM, IgG1-2 , IgG3, IgG4) к данным вирусам.
В дальнейшем при подтверждении герпесвирусной природы плацентита мать с ребенком вызывали в поликлинику НИИ детских инфекций, где проводилось вирусологическое обследование матери и ребенка (в возрасте 1 мес).
Диагноз перинатальных герпесвирусных инфекций устанавливали при наличии в сыворот�е крови ребенка иммуноглобулина M в титре >1:20; специфических иммунных комплексов с антигеном >0,06 ОЕ; антигенов вируса >0,01 ОЕ; одного из иммуноглобулинов (IgG3, IgG , IgG4) в титрах в 2—4-кратном увеличении по сравнению с титрами тех же подклассов иммуноглобулина G у матери, а также при обнаружении в крови ребенка одного из перечисленных подклассов иммуноглобулина G в титре > 1:20, а в крови матери другого из иммуноглобулинов IgG3, IgG , IgG4. Выявление в сыворотке крови детей специфических иммуноглобулинов M, G3, G1-2 в титре > 1:20, вирусного антигена и специфических иммунных комплексов с антигеном свидетельствовало об остроте инфекционного процесса (активная фаза), а определение только специфических иммуноглобулинов G4 мы расценивали как латентную фазу инфекции или носительство материнских антител.
Комплексное клинико-лабораторное обследование детей в возрасте 1, 3, 6, 9 и 12 мес проводилось в поликлиническом отделении института и включало осмотр инфекциониста и невропатолога, ультразвуковое исследование головного мозга, вирусологическое и иммунологическое исследования.
При иммунологическом исследовании определяли абсолютное и относительное количество лейкоцитов, лимфоцитов, субпопуляционный состав лимфоцитов, концентрацию иммуноглобулинов классов M, A, G. Фенотипирование лимфоцитов проводили в лимфотоксическом тесте с использованием моноклональных антител серии ИКО («Медбиоспектр» Москва): анти-CDЗ, анти-CD4, анти-CD8, анти-CD16, анти-CD20, анти-CD25, анти-CD71, анти-CD95. Концентрацию иммуноглобулинов определяли методом радиальной иммунодиффузии по Mammm (1965) с использованием моноспецифических антисывороток предприятия по производству бактерийных препаратов Нижегородского НИИ эпидемиологии и микробиологии. Определение общего пула циркулирующих иммунных комплексов проводили методом осаждения полиэтиленгликолем [9]. Исследование пролиферативной активности Т-лимфоцитов осуществляли в иммунологической лаборатории (реакция бласттрансформации на фитогемагглютинине) [10]. Уровень α-, γ-интерферона определяли в лаборатории этиологических методов диагностики методом количественной гемадсорбции [11].
Проведена оценка эффективности использования у детей иммуномодулирующих препаратов: ликопида (регистрационный № ЛС-001438) и виферона (регистрационный № 000017/01).
Статистическая обработка полученных результатов осуществлена с помощью пакета прикладных программ Microsoft Excel 2000, Stat Soft Statistika v 6,0 с использованием параметрических и непараметрических методов вариационной статистики [12].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Герпесвирусная природа плацентита была подтверждена при исследовании 70 (72,9%) из 96 плацент с морфологическими признаками ДНК-инфекции. Эпштейна—Барр вирусная и цитомегаловирусная инфекции были установлены в 10,4% каждая, вирусом простого герпеса были инфицированы 18,7% плацент, а сочетанные герпесвирусные инфекции выявлены в 33,4% последов.
При вирусологическом обследовании пар мать — ребенок в возрасте 1 мес (случаи плацентитов с подтвержденной герпесвирусной инфекцией, n=70) маркеры той или иной герпетической инфекции были выявлены у 60 (85,7%) детей. В дальнейший анализ вошли дети (n=45) с маркерами активной инфекции (рис. 1). Группу сравнения составили 12 здоровых детей того же возраста, в сыворотке крови которых не были обнаружены маркеры герпесвирусной инфекции.
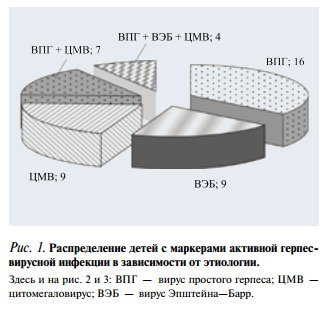
Анализ антенатального развития детей с герпетической моноинфекцией показал, что более чем в половине случаев имело место осложненное течение внутриутробного периода (табл. 1).
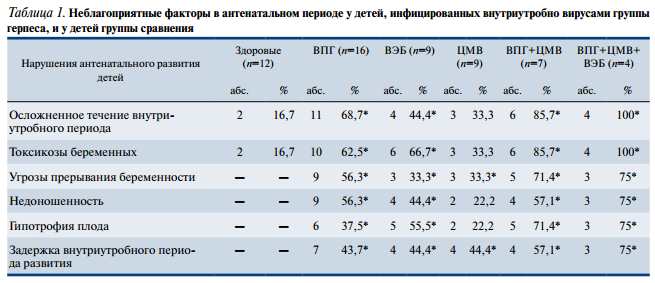
Так, в группе детей с инфекцией, обусловленной вирусом простого герпеса, преобладали гестозы и угрозы прерывания беременности у матери. Как следствие, 9 из 16 новорожденных родились недоношенными на сроках 33—36 нед гестации, у 6 — выявлялись признаки внутриутробной гипотрофии, у 7 — задержка внутриутробного развития по диспластическому типу. В группе детей с изолированной Эпштейна—Барр вирусной инфекцией обращала на себя внимание высокая частота гестозов (у 6 из 9 матерей), следствием чего явилась также высокая частота недонашивания, гипотрофии и задержки внутриутробного развития. Однако степень выраженности указанных изменений была меньшей, чем при инфицировании вирусом простого герпеса. В группе детей с цитомегаловирусной инфекцией только в 1/3 случаев наблюдалось осложненное течение внутриутробного развития. Среди детей с сочетанной герпетической инфекцией осложненное течение внутриутробного периода отмечалось с наибольшей частотой: у 10 из 11 детей. Наиболее тяжело протекала беременность у 4 матерей, дети которых имели сочетание вирусов простого герпеса, цитомегаловируса и Эпштейна—Барр вируса. У всех наблюдались тяжелые токсикозы первой и второй половины беременности, у 3 из них — угрозы выкидышей, как правило, с ранних сроков беременности. Трое детей родились недоношенными, причем 2 из них в срок 33—34 нед гестации, 3 — с малой массой тела и с признаками задержки внутриутробного развития.
При изучении акушерского анамнеза обнаружено, что выкидыши и мертворождения у матерей в прошлом отмечались чаще в группе с инфекцией, обусловленной вирусом простого герпеса и сочетанной герпесвирусной инфекцией (43,7 и 54,5%1 против 8,3% в группе сравнения). По возрасту, наличию хронических заболеваний до беременности матери изучаемых групп достоверно не различались.
Анализ соматического статуса детей с перинатальными герпесвирусными инфекциями в возрасте 1—2 мес (табл. 2) показал, что наиболее часто наблюдались гипотрофия, гиперемия и зернистость зева, а также лимфопролиферативный синдром. Наибольшая частота данных симптомов отмечена при сочетанных герпетических инфекциях. Из моноинфекций наиболее выраженный лимфопролиферативный и катаральный синдромы наблюдались при Эпштейна—Барр вирусной инфекции. У каждого 5-го ребенка отмечался невыраженный субфебрилитет (37,0— 37,2°С). Данный симптом был одинаково характерен для всех групп, за исключением детей с моноинфекцией вирусом простого герпеса (6%).
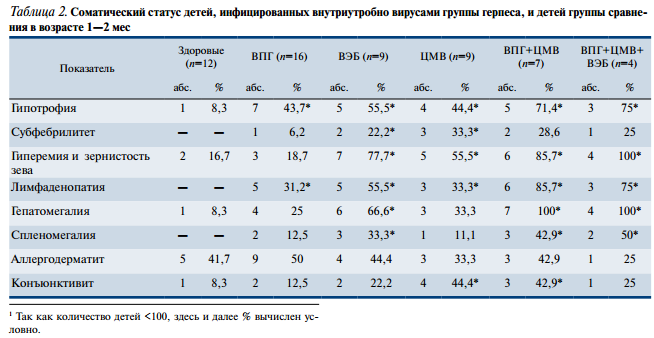
Неврологическая симптоматика во всех группах детей проявлялась синдромом двигательных нарушений, а также гидроцефальным синдромом. У 3 пациентов с герпетической моноинфекцией при рождении выявлялись признаки задержки развития мозга в виде сохранности эмбриональных ликворных пространств, вентрикулодилатации. Более тяжелые неврологические изменения выявлялись у детей с сочетанным инфицированием вирусами простого герпеса и цитомегалии. При нейросонографии на первом месяце жизни у 2 из них определялись ишемические изменения в перивентрикулярных зонах.
При лабораторном обследовании у 12 из 45 детей с перинатальными герпесвирусными инфекциями было отмечено повышение активности трансаминаз в 1,5—2 раза по сравнению с нормой, без достоверных различий между группами. У 7 детей отмечалась затяжная желтуха новорожденных (2 ребенка из группы с вирусом простого герпеса, 1 — с цитомегаловирусом и 4 — из группы сочетанной герпесвирусной инфекции).
Изучение иммунного статуса проводилось в те же сроки, что и клиническое обследование, и позволило выявить ряд изменений в состоянии иммунной системы детей (рис. 2). У всех пациентов отмечалось увеличение циркулирующего пула лимфоцитов с возрастанием абсолютного содержания всех основных субпопуляций лимфоцитов и снижением относительной доли СБ8+ клеток. Наименее выраженные отклонения от «нормы» отмечались при моноинфекции вирусом простого герпеса. При нормальном относительном количестве CD4+, CD3+ и CD16+ клеток у этих детей отмечалось нарастание количества В-клеток (CD20+ и СD21+) и активация Т-клеточных реакций по содержанию CD25+, CD71+ и CD95+ клеток.
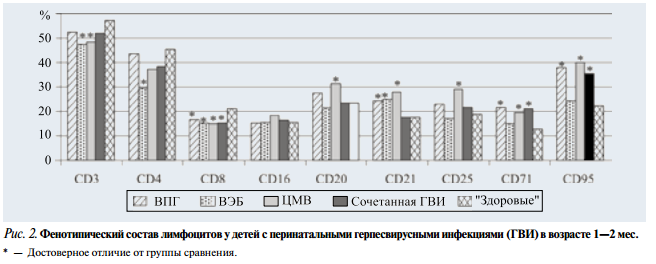
У детей с Эпштейна—Барр вирусной моноинфекцией отмечено угнетение Т-клеточного звена (снижение относительного количества CD3+, CD4+, СD8+ клеток) и некоторое увеличение числа В-клеток (CD21+ клеток). При этом количество активированных клеток (CD25+, CD71+, CD95+) оставалось на уровне «нормы», что свидетельствует об отсутствии активации Т-клеточных реакций в ответ на вирусную инфекцию.
При цитомегаловирусной инфекции, несмотря на снижение относительного числа Т-лимфоцитов (CD3+, CD8+), отмечалось значительное увеличение числа клеток с маркерами активации CD25, CD71, CD95, что указывает на интенсивность клеточных реакций. При сочетанной герпесвирусной инфекции наблюдалось значительное нарастание относительного количества клеток с маркерами активации CD71 и CD95 при низком уровне «позитивно» активированных лимфоцитов с рецептором для интерлейкина-2 (CD25).
Сниженный уровень α-интерферона и повышенный — γ-интерферона обнаруживали у детей при всех перинатальных герпесвирусных инфекциях.
Учитывая хронически персистирующий характер инфекций, вызываемых представителями семейства Herpesviridae, клинические проявления которых напрямую связаны с состоянием иммунной системы, в терапии детей мы использовали иммуноориентированные средства: полусинтетический аналог фрагмента пептидогликана бактериальной клеточной стенки — ликопид и препарат рекомбинантного α2-интерферона — виферон.
Терапию ликопидом получали 15 детей. Доза препарата составляла 1 мг 1 раз в день в течение 10 дней с 10-дневным перерывом и повторным приемом в последующие 10 дней. Комплексную терапию из 2 препаратов ликопида и виферона получали также 15 детей. Ликопид применялся по той же схеме, а виферон по 1 свече (150 000 ЕД) 2 раза в день в течение 10 дней и еще по 1 свече на ночь в течение последующих 10 дней. Группу контроля составили 15 детей, не получавших иммунокорригирующую терапию. Группы были сходны по возрасту, этиологии заболевания, клиническим и иммунологическим показателям. На рис. 3 представлено распределение детей в группах в зависимости от этиологии герпесвирусной инфекции.
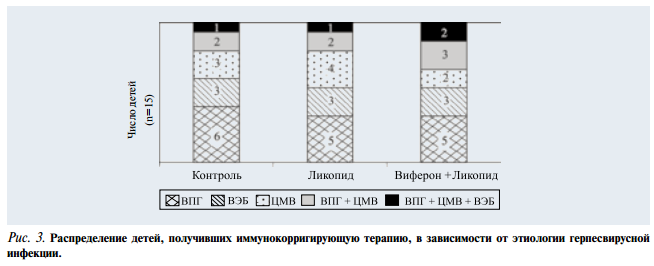
При обследовании детей в возрасте 3—4 мес было установлено, что на фоне лечения снижалась частота выявления лимфопролиферативного синдрома и субфебрилитета (табл. 3). Среди детей, получивших терапию ликопидом, в 2 раза снизилась частота лимфаденопатии и гепатоспленомегалии, а среди детей, получивших сочетанную терапию ликопидом и вифероном, после лечения ни у одного ребенка не была выявлена спленомегалия и в 3 раза реже встречалась гепатомегалия. Из 4 детей с субфебрилитетом, получивших сочетанную терапию, только у одного после терапии сохранялись периодические повышения температуры до субфебрильных цифр.
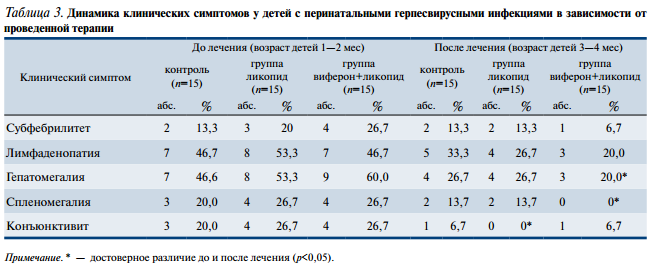
При наблюдении за детьми в течение первого года жизни была отмечена значительно меньшая заболеваемость ОРВИ среди пациентов, получивших иммуностимулирующую терапию, по сравнению с пациентами из группы контроля (табл. 4). Дети, получившие сочетанное лечение ликопидом и вифероном, достоверно реже переносили обструктивный бронхит, чем больные из группы контроля.
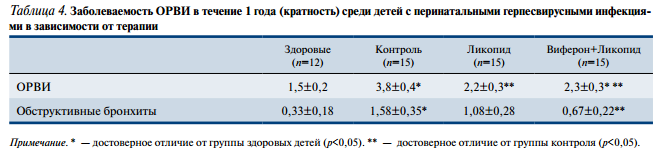
Анализ иммунологических характеристик (табл. 5) показал, что у детей, получивших иммуностимуляторы, абсолютное число лимфоцитов уменьшилось, тогда как в контроле оставалось на прежнем высоком уровне. Использование ликопида приводило к достоверной мобилизации В-лимфоцитов (CD21), относительное количество которых составило 34,4+1,6% против 27,1+2,2% в группе сравнения. Относительный лимфоцитоз сопровождался увеличением количества рецепторов активации CD25 и CD95 (CD25 — 24,9+3,3% против 17,4+3,2%, СD95 — 36,8+3,5% против 28,7+3,1% в группе контроля). Активация гуморального звена подтверждалась достоверным нарастанием концентрации общего иммуноглобулина G до 7,29+0,33 г/л против 4,87+0,35 г/л в группе контроля.
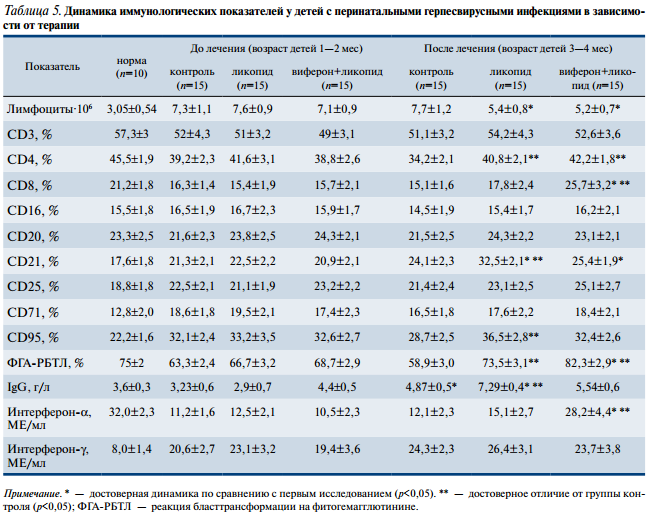
У детей, получавших ликопид и виферон, достоверно увеличивалось количество CD4+ (до 42,2+1,8% против 34,2+2,1% в контроле). Повышалась концентрация CD8+: относительное количество 25,7+3,2% (против 15,1+1,6% в группе больных, не получивших иммуностимуляторы), абсолютное количество — 1797+188 (против 879+164). Выявлялась выраженная функциональная активация Т-лимфоцитов, оцениваемая реакцией бласттрансформации на фитогемагглютинине (82,3+2,9% против 58,9+3,0%). Повышалось содержание α-интерферона до 28,2+4,4 МЕ/мл против 12,1+2,3 МЕ/мл в группе сравнения (p<0,05).
При сравнении влияния двух предложенных схем терапии на иммунный статус детей с перинатальными герпесвирусными инфекциями установлено, что назначение ликопида в большей мере способствовало стабилизации гуморального звена иммунного ответа, а использование комплексной терапии ликопидом и вифероном оказывало нормализующее воздействие преимущественно на клеточно-опосредованный иммунитет.
Вирусологическое обследование детей в возрасте 6 мес показало, что в группе контроля маркеры активной вирусной инфекции сохранялись у 2/3 пациентов (табл. 6). Среди детей, получивших иммуностимулирующую терапию, частота выявления маркеров активной инфекции меньше, чем в группе контроля. Однако существенная положительная динамика была отмечена только у детей, получивших сочетанное лечение ликопидом и вифероном.
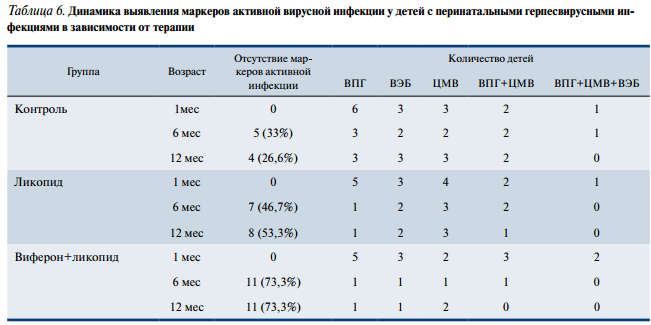
Активный вирусный процесс через 3—4 мес после лечения в этой группе был выявлен лишь у 4 детей (около 1/4). При вирусологическом обследовании через 8—9 мес отсутствие маркеров герпесвирусной инфекции у 3/4 детей, получивших ликопид с вифероном, и у 1/2 детей, получивших монотерапию ликопидом, подтвердило положительный эффект иммуностимулирующего лечения.
Полученные результаты позволили разработать дифференцированные подходы к иммунотерапии детей с перинатальными герпесвирусными инфекциями (см. схему).
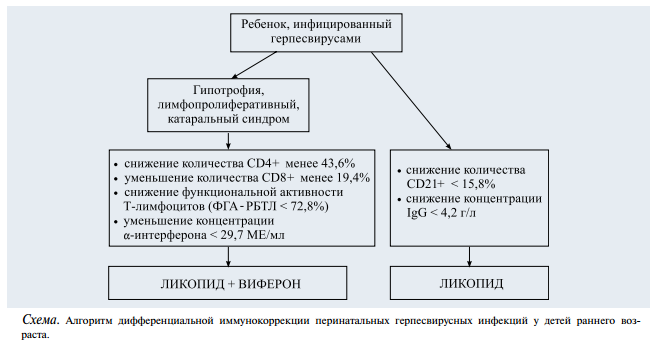
При вирусологическом подтверждении инфекции у детей с выраженными отклонениями в соматическом (гипотрофия, лимфопролиферативный, катаральный синдромы) и неврологическом статусе, а также при значительных изменениях в иммунограмме мы рекомендуем включение в комплексную терапию сочетание ликопида и виферона. При невыраженных отклонениях в соматическом, неврологическом и иммунологическом статусе (сниженном количестве В-лимфоцитов CD20, CD21, уменьшении концентрации иммуноглобулина G) достаточно проведения монотерапии ликопидом.
ВЫВОДЫ
- Комплексное вирусологическое обследование ретроплацентарной крови, сыворотки крови ребенка и матери с учетом морфологических изменений в последе способствуют повышению точности и специфичности этиологической диагностики внутриутробных герпесвирусных инфекций у детей. Определение специфических маркеров (выявление антигенов, специфических иммунных комплексов с антигенами вирусов, антител IgM, IgG3, IgG1-2) позволяет диагностировать активный инфекционный процесс.
- Перинатальные герпесвирусные инфекции протекают у детей субклинически и чаще проявляются гипотрофией, гиперемией и зернистостью зева, субфебрилитетом и лимфопролиферативным синдромом, а также отклонениями в неврологическом статусе и изменениями при нейросонографии.
- Реакция иммунной системы на внутриутробное герпесвирусное инфицирование сопровождается изменениями клеточного и гуморального звеньев иммунитета. Отмечаются увеличение циркулирующего пула лимфоцитов с возрастанием абсолютного содержания всех основных субпопуляций лимфоцитов, снижение относительной доли Т-лимфоцитов (CD3+, CD4+, CD8+), уровня α-интерферона и нарастание относительного количества клеток с маркерами активации CD71, CD95 и уровня γ-интерферона.
- Наличие клинико-иммунологических изменений у детей раннего возраста с перинатальными герпесвирусными инфекциями обусловливает необходимость проведения диспансерного наблюдения в течение первого года жизни с использованием вирусологических, иммунологических и инструментальных методов исследования.
- Дети с установленными внутриутробными герпесвирусными инфекциями нуждаются в иммуномодулирующей терапии, которую следует назначать дифференцировано в зависимости от клинических и иммунологических показателей.
ЛИТЕРАТУРА
- Анохин В.А., Бикмухамедов Д.А. Вирус простого герпеса и онкологические заболевания. Инфекционные болезни 2004; 2: 2: 59—64.
- Белозеров Е.С., Буланьков Ю.И. Болезни герпесвирусной группы. Элиста: АПП Джангар 2005; 64.
- Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека: руководство для врачей. Ст-Петербург 2006; 302.
- Шабалов Н.П. Неонатология. Учеб. пособие, 3-е изд., испр. и доп. М.: МЕДпресс-информ 2004; 1: 635: 2: 640.
- Kimberlin D.W. Herpes simplex virus infections in neonates and early childhood. Semin Pediat Infect Dis 2005; 16: 4: 271—281.
- Цинзерлинг В.А., Мельникова В.Ф. Перинатальные инфекции. Вопросы патогенеза, морфологической диагностики и клинико-морфологических сопоставлений: практическое руководство. Ст-Петербург: Элби 2002; 351.
- Аксенов О.А., Родионова О.В., Закина А.А и др. Характеристика поражения плаценты, обусловленного вирусами группы герпеса. Научно-практическая конференция «Современные научные и практические проблемы инфекционной патологии у детей»: Материалы. Ст-Петербург 2003; 13—14.
- Аксенов О.А., Осипова З.А., Закина А.А., Тихомирова О.В. Способ диагностики внутриутробных вирусных инфекций у детей: патент на изобретение №2006109653/15 (010496) от 27.03.2006.
- Digeon M., Laver M, Riza J. Detection of circulating immune complexes in human sera by simplified assays with polyethyleneglycol. J Immunol Methods 1977; 16: 165—183.
- Новиков Д.К., Новикова В.И. Оценка иммунного статуса. М — Витебск 1996; 282.
- Finter N.B. Quantitative haemadsorption, a new assay technique. I. Assay of interferon. Virology 1964; 24: 589—597.
- Григорьев С.Г., Юнкеров В.И.Математико-статистическая обработка данных медицинских исследований. Ст-Петербург 2002; 268.







Комментировать