Механизмы образования, методы диагностики и лечения фибромиомы матки у женщин. Выбор метода терапии.
Д.Г. Коньков, О.О. Процепко Винницкий национальный медицинский университет им. Н.И. Пирогова
Резюме. В статье рассматриваются механизмы образования, методы диагностики и лечения фибромиомы матки у женщин. Показано, что к выбору метода терапии следует подходить дифференцировано с учетом всех показаний и рисков развития нежелательных осложнений у таких пациенток.
Миомы — это доброкачественные опухоли матки, которые выявляются у 15–50% женщин детородного возраста, а в структуре гинекологических заболеваний данная патология составляет 27% случаев. Хотя в большинстве случаев миома— медленно растущая опухоль, у 20–40% женщин в возрасте 35 лет и старше миомы достигают значительных размеров и обусловливают выраженную клиническую симптоматику [11, 13, 30].
Развитие миомы матки представляет собой доброкачественную, контролируемую гормонами диффузную или очаговую гиперплазию миометрия и характеризуется многообразием факторов патогенеза и системных нарушений, хотя причины возникновения миомы до сих пор неизвестны [11, 21, 27]. Отсутствие единой точки зрения на механизмы образования миомы матки значительно снижает эффективность ее лечения и диктует необходимость более углубленного исследования механизмов, звеньев патогенеза и закономерностей течения данной патологии, поиск новых возможностей диагностики и путей повышения эффективности лечения. Прогрессирующее развитие миоматозного узла можно остановить, блокируя размножение миогенных элементов периферической зоны узла и процессы гипертрофии созревших миоцитов, объединенных в гладкомышечные пучки, при этом стимулируя процессы апоптоза миоцитов в центральных отделах узла. Отнюдь не все лекарственные препараты, которые сегодня применяются при лечении миомы матки и оказывающие выраженное лечебное воздействие на симптоматику, сопровождающую ее развитие, и способны влиять на процессы гиперплазии и гипертрофии ее клеточных элементов [13, 21, 25, 30].
Поэтому подход к лечению этого заболевания во многом зависит от правильной клинической классификации патологии. Существующие на настоящий момент классификации (гистологическая и по локализации) неприемлемы в практической гинекологии и фактически не несут никакой тактической информации. Широко применяющиеся сегодня показания к проведению гистерэктомии на практике дают возможность наблюдать больных до определенного рубежа в 12 недель, то есть допускают пассивность в отношении пациенток с меньшим размером миом. Поэтому необходима классификация, объединяющая такие характеристики, как: размер, количество узлов, локализация и репродуктивные планы пациентки и, таким образом, позволяющая врачу сразу же прогнозировать тактику лечения [19, 25, 27].
На сегодня можно выделить 4 подхода к лечению миомы матки:
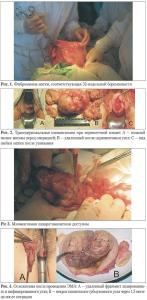
1) радикальный — гистерэктомия — наиболее простой метод с точки зрений технического исполнения. Лечение по принципу «нет органа — нет проблемы». Этот метод неприемлем для женщин, желающих сохранить матку и реализовать репродуктивную функцию. В современной классификации лечебных подходов гистерэктомия должна быть рекомендована только при наличии гигантских миом и невозможности использования других методов лечения (рис. 1);
2) консервативно-пластический — миомэктомии — целью этого метода лечения является восстановление репродуктивной функции. К некоторым относительным ограничениям использования данного подхода можно отнести отсутствие технической возможности выполнить подобную операцию (большое количество узлов, неудачное их расположение). В ряде случаев этот метод комбинируется с эмболизацией маточных артерий или назначением аГнРГ, что используется в качестве подготовительного этапа;
3) стабильно-регрессионный — эмболизация маточных артерий, лапароскопическая окклюзия маточных артерий — эти методы позволяют нивелировать симптомы заболевания, уменьшить в размере миоматозные узлы, в ряде случаев вызвать их экспульсию из матки. Данные методы могут быть использованы при лечении женщин, имеющих репродуктивные планы. Использование высокочастотного фокусированного ультразвукового воздействия, к сожалению, имеет слишком много ограничений (особенно в отношении локализации, множественности и размеров узлов) для более или менее широкого его применения;
4) временно-регрессионный — агонисты и антагонисты гонадотропин-рилизинг-гормона (ГнРГ), блокаторы рецепторов прогестерона и другие — роль этих методов лечения существенна у пациенток с наличием маленьких миоматоз-в качестве профилактики рецидивов после конных узлов в составе двухэтапной схемы, участии сервативной миомэктомии [2, 7, 11, 13, 19].
Консервативно-пластический метод терапии
Традиционно оптимальной органосохраняющей операцией при субмукозной локализации миомы матки (ММ) считают трансцервикальную миомэктомию с использованием механических, электро-и лазерохиругических способов удаления новообразований (гистерорезектоскопия).
Возможность проведения трансцервикальной миомэктомии зависит от величины узла, его формы и локализации. Возможно удаление субмукозных узлов 0-типа, продолговатой формы и мягковатой консистенции и размером до 10 см в диаметре, механическим способом. Электрохирургическая миомэктомия безопасна при субмукозных узлах размерами до 5 см в диаметре. Для удаления подслизистых узлов 2-го типа с выраженным интерстициальным компонентом размерами свыше 5 см в диаметре, необходимо проведение предоперационной подготовки агонистами Гн-Рг. После второй инъекции препарата Гн-Рг происходит уменьшение миоматозных узлов на 35–40% по сравнению с исходными показателями. Помимо этого, у ряда пациенток происходит переход 2-го типа субмукозного узла в 1-й, а также снижение перфузии крови в маточных артериях и возникновение медикаментозной атрофии эндометрия, что, в целом, значительно снижает хирургический риск и интраоперационную кровопотерю. Наряду с положительными моментами воздействия агонистов Гн-Рг на матку, следует отметить и ряд недостатков. Неблагоприятным фактором является миграция субмукозных узлов 2_го типа межмышечно, что затрудняет их поиск во время оперативного вмешательства. В таких случаях удаление субмукозных узлов невозможно. У молодых женщин также наблюдают возникновение тяжелых климактерических проявлений, связанных с дефицитом эстрогенов [1, 13, 26, 36].
В результате, электрохирургическая трансцервикальная миомэктомия противопоказана при неэффективности воздействия агонистами Гн_Рг, величине миоматозных узлов свыше 5 см, длине полости матки более 10 см, при сочетанном расположении субмукозных миоматозных узлов с узлами другой локализации (особенно перешеечных) и аденомиозом. Также нецелесообразно проведение электрической резекции миоматозных узлов трансцервикальным доступом с помощью гистерорезектоскопа при наличии рубца после кесарева сечения или миомэктомий, маленькой и ригидной шейке матки у нерожавших пациенток.
Допустимым, хотя и технически сложным способом удаления фиброматозных узлов, особенно перешейка матки, задней или передней стенок матки, является трансвагинальный. В случаях единичных узлов любого типа, но доступных после цервикотомии или кульдотомии (как передней, так и задней) именно подобный подход позволяет при противопоказаниях к гистерорезектоскопии выполнить органосохраняющую операцию (рис. 2).
Рассматривая вопрос о проведении органосохраняющих операций при субсерозных миоматозных узлах, основным критерием эффективности миомэктомий следует считать формирование полноценного рубца на матке, который должен быть состоятельным при последующей беременности [5].
Субсерозные узлы 0_ и 1_типов и небольших размеров не представляют сложности для проведения миомэктомий. Методом выбора в таких ситуациях является лапароскопический доступ. В тех случаях, когда интерстициальный компонент узла выражен, для уменьшения ложа узла и снижения кровопотери во время операции показано проведение предоперационной подготовки агонистами Гн-Рг. Уплотнение и утолщение псевдокапсулы миоматозного узла облегчают его энуклеацию и позволяют осуществить миомэктомию менее травматично и бескровно, а ложе удаленного субсерозного узла должно быть тщательно ушито [7].
Существует мнение, что лапароскопический доступ не всегда позволяет провести адекватное сопоставление краев раны, нередко при энуклеации субсерозного узла образуется обширная зона коагуляционного некроза, которая приводит к формированию неполноценной рубцовой ткани и наличию дефекта в слоях миометрия. Ошибка в топографической диагностике и переоценка технических возможностей в использовании лапароскопического доступа чревата несостоятельностью рубца на матке во время беременности и ее разрывом во время беременности и родов [3, 4]. Исходя из этого, определены некоторые противопоказания к проведению миомэктомий лапароскопическим доступом у пациенток, желающих сохранить репродуктивную функцию. Не следует производить лапароскопическую миомэктомию при больших размерах матки (более 12 нед. беременности), наличии множественных интерстициальных миоматозных узлов, низком расположении (шеечно-перешеечном) миоматозного узла, особенно по задней стенке, а также общем количестве миоматозных узлов свыше 4 опухолевых новообразований. Безальтернативным доступом у таких пациенток при выполнении миомэктомий может быть лапаротомия, а в отдельных случаях — трансвагинальная миомектомия (рис. 3) [24, 38].
Наличие противопоказаний к выполнению миомэктомий при субмукозных и субсерозных миоматозных узлах ранее не оставляло выбора в тактике, и большинство пациенток подвергалось гистерэктомии. С появлением эндоваскулярных методов лечения опухолевых образований и возможности проведения эмболизации маточных артерий (ЭМА) у больных с ММ появился новый безоперационныйорганосохраняющий метод лечения [36].
Стабильно-регрессионный метод терапии
Данный метод подразумевает проведение эмболизации маточных артерий (ЭМА), лапароскопическу. Окклюзию маточных артерий. Клиническая эффективность ЭМА для ММ различной локализации заключается, прежде всего, в уменьшении размеров матки и нормализации менструальной функции. Меноррагия купируется с момента проведения ЭМА, объем кровопотери во время менструации уменьшается в 3–4 раза, что приводит к быстрому восстановлению показателей красной крови. Этот эффект обусловлен рядом факторов, среди которых выделяют снижение перфузии крови в бассейне маточных артерий в 2 раза, частичную закупорку мелких радиальных и базальных ветвей и полную редукцию артериального кровотока в миоматозных узлах [10, 14, 28]. Уменьшению кровопотери, безусловно, способствует восстановление сократительной способности миометрия вследствие уменьшения размеров миоматозных узлов, а также восстановление анатомических параметров полости матки после экспульсии или энуклеации субмукозных узлов. Объем матки и миоматозных узлов в течение 1-го года наблюдения сокращается в 2,5 и 3 раза соответственно.
При субмукозной локализации миоматозных узлов, интерстициальной локализации с центральным и центрипетальным направлением роста выявлено несколько вариантов исхода. Возможна самопроизвольная экспульсия миоматозных узлов, миоматозные узлы могут выделяться в виде фрагментов некротизированной ткани или некротизированного детрита (рис. 4).
При миграции узлов в полость матки после ЭМА и невозможности их самостоятельной экспульсии целесообразно проведение трансцервикальной миомэктомии механическим способом или методом резекции под контролем гистероскопии или УЗИ. Возможна миграция миоматозных узлов межмышечно. Но более подробно хотелось бы остановиться на ситуациях, когда ЭМА проводить не рекомендуется. В первую очередь, это гигантские миомы матки (более 20–25 нед. беременности) с множеством разнокалиберных узлов, практически полным отсутствием неизмененного миометрия.
Эффект от такой эмболизации будет недостаточным, а матка существенно не уменьшится. ЭМА не следует проводить при наличии единичных субсерозных узлов на тонком основании — эти узлы уменьшатся, но, как правило, в будущем пациентку могут волновать периодически возникающие боли от оставшихся узлов. Такие узлы лучше всего удалять. Итрамуральные, но не субмукозные узлы, размер которых приближается к 10 см и более при эмболизации уменьшаются несущественно, поэтому эмболизировать такие узлы можно либо перед консервативной миомэктомией, либо при настойчивом желании пациентки.
Любые пограничные и злокачественные процессы в гениталиях, безусловно, также являются противопоказанием для ЭМА. Недостаточный эффект дает эмболизация при изначально плохом кровоснабжении миоматозных узлов, поэтому допплерометрия является важнейшим методом обследования перед решением вопроса о проведении ЭМА. В тех случаях, у пациентки отмечается непереносимость йода,ЭМА не может быть рекомендована, так как для проведения этой процедуры используется йодосодержащий контраст [19, 25, 26, 28]. К побочным эффектам применения данного вида лечения можно также отнести риск преждевременного наступления климакса, развитие серьезной инфекции, возникновение кровотечения и блокировки других артерий.
Первые три-четыре после проведения ЭМА у пациенток часто отмечаются сильно выраженные боли [47].
При больших и гигантских размерах ММ и миоматозных узлов у пациенток детородного возраста ЭМА выполняют как самостоятельный метод или как этап перед лапаротомической миомэктомией. Эндоскопическая окклюзия маточных артерий также позволяет снизить объем циркулирующей крови в миометрии, однако не приводит в полной редукции артериального кровотока в миоматозных узлах.
Данный метод целесообразно использовать перед выполнением эндоскопической миомэктомии, поскольку в значительной степени снижается объем кровопотери в момент энуклеации узлов, а сокращение миометрия после окклюзии обусловливает выделение миоматозных узлов в брюшную полость и уменьшение размеров их ложа [18].
Высокочастотный фокусированный ультразвук или дистантная тепловая коагуляция миоматозных узлов — это сфокусированные ультразвуковые волновые колебания высокой энергии, способные нагревать маленький участок миомы матки до температуры 85 oC. Во время ультразвукового импульса, продолжительностью около 15 секунд, врач контролирует процесс, просматривая изображения, чувствительные к температуре. Поскольку каждый импульс обрабатывает очень небольшой участок опухоли, эта процедура повторяется до тех пор, пока не будет уничтожен заранее определенный объем. Как правило, для этого требуется 50 импульсов, продолжительность процедуры — около 3 ч (в зависимости от размера и количества обрабатываемых узлов миомы) [35, 47].
Также существуют методики электромиолиза, криомиолиза (внутриполостная деструкция узлов) и лапароскопической радиочастотной абляции. Суть данных методик заключается в локальном и непосредственном воздействии на ткань миоматозного узла различными физическими силами — лазером или холодом. Доступ к узлу осуществляется лапороскопическими инструментами. Под воздействием физических сил происходит уменьшение размеров миоматозного узла, на который это воздействие направлено [22, 25].
Временно-регрессионный метод терапии
На протяжении длительного времени в терапии пациенток с ММ использовались гестагены (норколут, премолют-нор, дюфастон и др.). Но по прошествии времени, можно сказать, что лечение данными препаратами было малоэффективно. В проведенных исследованиях ни разу не было зафиксировано существенного преимущества использования только гестагенов [19, 21, 31]. Женщинам репродуктивного возраста с размерами опухоли до 8 недель беременности при сочетании с гиперпластическими процессами эндометрия данные препараты можно назначать в циклическом режиме: с 11-го по 25-й день — дюфастон по 10–20 мг/сут. или с 16-го по 25-й день — норколут по 0,5 мг/сут., прерывистыми 6-месячными курсами. При использовании такой схемы эндометрий претерпевает секреторные изменения. Женщинам пременопаузального возраста целесообразней назначать гестагены в непрерывном режиме: с 5-го по 25-й день цикла в той же дозировке (длительность курса — 6–8 месяцев); в данном случае происходит торможение овуляции и децидуальная трансформация эндометрия.
Медроксипрогестерона ацетат (МПА), выпускаемый в виде препаратов провера и депопровера (депонированная форма), подавляет секрецию гонадотропинов, блокирует эстрогенные рецепторы матки, вызывает состояние выраженной гипоэстрогении, что приводит к атрофическим и псевдодецидуальным изменениям в эндометрии. МПА назначают в циклическом или непрерывном режиме в течение 3–9-ти месяцев [8, 9].
Применение данной группы препаратов оправдано именно при сочетании миомы матки с гиперпластическими процессами эндометрия, так как прогестерон и его производные подавляют митотическую активность в эндометрии и, напротив, в узлах миомы данные препараты могут индуцировать пролиферацию. Применяя данный метод лечения, зачастую достигается более четкое отграничение узлов от окружающих тканей (что существенно облегчает выделение узлов при последующей миомэктомии, если она необходима) и нормализация состояния эндометрия [9, 40, 43]. Одним из возможных путей решения поставленной задачи является определение алгоритма комплексной консервативной терапии с включением препарата пролонгированного действия, угнетающего патогенетические механизмы и обеспечивающего стойкий стабилизационный эффект. С этой целью предложено использовать высокоэффективное контрацептивное средство Мирену® (левоноргестрел-рилизинг-систему — ЛРС), которое представляет собой Т-образный контрацептив, содержащий левоноргестрел, ежедневно поступающий в количестве 20 мкг и сохраняющийся на этом уровне в течение 5-ти лет. Результаты многочисленных исследований свидетельствуют о крайне высокой эффективности Мирены® при лечении меноррагии. В ряде исследований приводятся данные о том, что данное средство по эффективности при лечении меноррагии сравнима с гистероскопической абляцией эндометрия, а также с наиболее эффективными лекарственными веществами (аГнРГ, антигонадотропинами, другими гестагенными препаратами). Кроме того, приводятся данные о том, что применение ЛРС может быть альтернативой проведению гистерэктомии у пациенток с тяжелой меноррагией [16, 20]. На основании 3-летнего исследования были получены результаты, заключающиеся в стойкой стабилизации или уменьшении размеров миомы матки и миоматозных узлов, на фоне применения Мирены® у 99 (86%) пациенток из всех представленных групп. При этом в процессе исследования не выявлено зависимости эффективности использования Мирены® от принадлежности пациентки к определенной группе.
Последние 20 лет медицина использует аналоги ГнРГ, что является одним из значительных достижений фармакотерапии [14, 19, 26, 31, 39]. При непрерывном применении этих препаратов развивается гипоэстрогения, коррелирующая с уменьшением размеров матки и опухолевых узлов (в среднем — на 52,6%). Подавление гонадотропной функции гипофиза, помимо снижения уровня эстрогенов, вызывает блокаду продукции прогестерона, что играет важную роль в механизме действия аГнРГ. Эти препараты уменьшают продукцию инсулиноподобного фактора роста-1 и эпидермального фактора роста, являющихся медиаторами эстрогена и прогестерона. При применении аГнРГ возникает стойкая аменорея, приводящая к повышению уровня гематокрита, гемоглобина, концентрации сывороточного железа и возрастанию плотности стенок микрососудов, что является очень важным при анемии.
Непрерывное введение данных препаратов характеризуется двухфазностью их действия:
- первая фаза характеризуется непродолжительной стимуляцией функции гипофиза («эффект вспышки»), быстрым подъемом выделения ГнРГ и, соответственно, образованием эстрогенов в яичниках в течение 7–10-ти дней. Обычно эта фаза не имеет клинических последствий, после чего, вследствие блокады рецепторов ГнРГ, выделение гонадотропинов и эстрогенов снижается до базального уровня и ниже. В ответ на падение уровня эстрогенов, как правило, появляются кровяные менструальноподобные выделения, самостоятельно прекращающиеся в течение 3–7-ти дней. Такие кровотечения являются предвестниками окончания первой фазы;
- вторая фаза — так называемая медикаментозная кастрация — это блокада гонадотропной функции гипофиза и, соответственно, эстрогенов яичников. Данное состояние вызывает «климактерические» эстрогендефицитные эффекты (потливость, депрессия, головная боль, сухость во влагалище, снижение либидо). При длительном лечении (более 6_ти месяцев) снижается плотность костной ткани, особенно у женщин пременопаузального возраста.
Прекращение терапии аГнРГ приводит к восстановлению менструального цикла примерно через 60–90 дней. У женщин репродуктивного возраста наблюдаются рецидивы роста миомы, следовательно, в этом возрастном периоде данные препараты целесообразно использовать как подготовку для последующего оперативного лечения.
Выделяют несколько способов введения препаратов аГнРГ:
- интраназальный (бусерелина ацетат — 0,2% раствор, 300 мг/сут.);
- подкожный (декапептил 0,1 мг ежедневно);
- внутримышечный (золадекс, диферелин, депо-декапептил, люрин-депо).
Именно депонированные формы обладают способностью выделять аГнРГ в течение 6–7ми недель, что является наиболее удобной формой для пациенток. Терапия начинается на 2–4-й день менструального цикла. Благодаря использованию аГнРГ в качестве гормональной подготовки к эндохирургическому лечению в большинстве случаев выполнение гистерорезектоскопии производится в один этап, лишь в 10–15% случаев при наличии миоматозных узлов на широком и глубоком основании требуется использование второго этапа электрохирургической резекции опухоли [11, 13, 19, 37].
К одному из новейших направлений в подготовке эндометрия к последующему эндохирургическому лечению относят применение новой группы препаратов, открытых в начале 90-х годов XX века, — антагонистов ГнРГ. По фармакологическому воздействию антГнРГ отличаются от других препаратов. На клеточной мембране гонадотропных клеток гипофиза происходит классическая конкурентная блокада рецепторов эндогенных гонадотропинов без фазы непродолжительной стимуляции. В течение нескольких часов происходит подавление секреции гонадотропных гормонов. Терапия данными препаратами приводит к сокращению сроков лечения и повышению ее эффективности. Отмечено, что уменьшение размеров опухоли происходит уже на 14–28-й день терапии, при этом наблюдается более быстрое восстановление функции яичников после окончания лечения.
Один из препаратов антГнРГ — цетрореликс. Начальная доза инъекции — 60 мг, которая вводится на 2-й день менструального цикла, а вторая инъекция (30–60 мг) — на 21–28-й день цикла (под контролем уровня эстрадиола и УЗИ мониторинга в динамике). Применение антГнРГ способствует быстрому уменьшению размеров миомы матки, снижению интенсивности кровоснабжения узлов, благодаря чему оптимизируется проведение миомэктомий [14, 19].
Сегодня проводятся исследования, направленные на изучение и разработку новых групп препаратов, ингибирующих факторы роста, влияющих на апоптоз и продукцию межклеточного вещества гладкомышечных клеток, а также пролиферацию и миграцию эндотелиоцитов. В отличие от лечения ГнРГ, введение мифепристона в течение 3-х месяцев и более снижает размеры миомы, не влияя на минеральную плотность костной ткани, поскольку показатели сывороточного эстрадиола остаются на уровнях, соответствующих ранней фолликулиновой фазе. Murphy и соавторы изучили эффективность использования более низких доз мифепристона (RU-486). При суточной дозе 25 мг снижение объема миомы происходило с такими же темпами, которое наблюдалось даже при снижении суточной дозы до 5 мг, однако при такой дозе размеры миомы снижались лишь на 25%. Механизм подобного действия RU_486 до конца невыяснен. В своем исследовании Harrison-Woolrych и соавторы (1994) продемонстрировали присутствие мРНК, кодирующей синтез эпидермального ростового фактора (ЭФР) в образцах нормального миометрия и миомы матки, как у нелеченных женщин, так и после терапии ГнРГ. Уровни ЭФР-мРНК в миометрии у здоровых женщин не отличались во время пролиферативной и секреторной фаз цикла. У пациенток с миомой уровень ЭФР-мРНК был значительно выше, причем это повышение наблюдалось только в середине секреторной фазы цикла за счет секреции прогестерона и его влияния на матку в течение нескольких дней. У пациенток, получавших лечение ГнРГ, уровень ЭФР-мРНК был ниже, при этом на 40% снижалось кровоснабжение миомы матки [14, 32, 43].
Нет никаких сомнений в необходимости дифференцированного подхода к лечению ММ, не сопровождающейся симптомами гипоэстрогении, такими как приливы жара, потливость, сухость влагалища, снижение минеральной плотности костной ткани. Поэтому антипрогестины являются многообещающим классом препаратов, но их изучение тормозится иными причинами, поскольку основным показанием к их применению на сегодняшний день является медикаментозный аборт. О лечении других эстрогензависимых состояний, таких как эндометриоз, сообщается во многих работах, однако данных о влиянии антипрогестинов на миому матки недостаточно [40].
Даназол — это производное синтетического стероида 17-альфа-этинилтестостерона. У женщин репродуктивного возраста даназол обратимо подавляет активность гипоталамогипофизарно-яичниковой системы. Предполагается несколько механизмов действия даназола. Данный препарат связывается с рецепторами прогестерона, андрогена и глюкокортикоидов. Он подавляет гипоталамо-гипофизарный ответ в ответ на сниженный уровень эстрогенов, уменьшая содержание ФСГ и ЛГ. Даназол ингибирует ферменты стероидогенеза в яичниках и надпочечниках, действует на прогестерон как агонист и антагонист, а на рецепторы к андрогенам и глюкокортикоидам — как агонист. Также препарат снижает синтез СССГ и вытесняет тестостерон из данного глобулина, повышая сывороточную концентрацию свободного тестостерона (Rock и Moutos, 1992). В эндометриальной и эндометриоидной тканях даназол связывается с рецепторами прогестерона и андрогенов, вызывая подавление клеточной пролиферации и атрофию. При лечении пациенток с эндометриозом обычная рекомендуемая суточная доза составляет 800 мг в течение 4-х месяцев и более. Однако, из_за его андрогенного и слабого метаболического побочных эффектов, целесообразность
Влияние Даназола на миому матки отмечено в 1983 году DeCherney и соавторами (1983). По данным предварительных исследований, уменьшение размеров миомы, отмеченное на УЗИ, происходило через 3 месяца терапии, однако окончательные результаты не были опубликованы. В расширенном проспективном исследовании Ueki и соавторы (1995) сравнивали эффекты применения Даназола (400 мг/сут. в течение 4–6-ти мес.) у 164 пациенток и Бусерелина (900 мкг/сут. интраназально в течение 4–6-ти мес.) у 83 больных. Отмечена более высокая эффективность применения Бусерелина в плане уменьшения размеров миомы по сравнению с Даназолом (76 и 57%, случаев соответственно), а сывороточные концентрации эстрадиола и прогестерона при приеме Бусерелина были ниже, чем при использовании Даназола [44, 46].
В исследовании Takebayashi и соавторов (1995) вводили суспензию Даназола в канал шейки матки 16 женщинам с миомой и 6 пациенткам с аденомиозом. 10 мг Даназола вводили каждые 2 недели в течение 12-ти недель. Авторы обнаружили, что, несмотря на уменьшение среднего объема матки лишь на 13%, начиная с 4-й недели терапии, наблюдалось постепенное улучшение клинической картины (уменьшалась тазовая боль, дисменорея, гиперменорея).
Авторы сделали вывод, что интрацервикальное введение Даназола является эффективным при лечении миомы и аденомиоза, поскольку из_за малой дозы вводимого препарата достигается значительное нивелирование проявлений заболевания без нарушения менструального цикла и иных побочных эффектов [42].
Гестринон — синтетическое производное этинил-нортестостерона с антиэстрогенным, антипрогестероновым и слабым андрогенным эффектами. Доказана его эффективность при лечнии других эстрогензависимых состояний, таких как доброкачественные опухоли молочной железы (Countinho и соавт., 1984) и эндометриоз (Kettel и соавт., 1997). В проспективном исследовании Countinho и Goncalves (1989) назначали 100 пациенткам с миомой больших размеров (объем матки— более 200 см3) Гестринон в дозе 2,5 мг (орально 3 раза в неделю) или 5 мг (вагинально 3 раза в неделю в течение 6–24-х мес.). Они обнаружили, что препарат вызывает такое же уменьшение размеров миомы, как и ГнРГ, при этом не у пациенток отсутствуют нежелательне реакции в виде симптомов искусственной менопаузы. Замедление роста опухоли с сохранением объема матки более малых размеров, чем до начала терапии, у 89% больных отмечалось в течение 18-ти месяцев. Из 44 пациенток, имевших к началу лечения бесплодие, 26 сохранили желание и возможности выносить беременность, 13 из них забеременели. Эти данные поддерживают целесообразность применения Гестринона в случаях, когда желательны резкое уменьшение объема матки и сохранение менструальной функции, а женщина согласна терпеть андрогенные побочные эффекты. Основное преимущество Гестринона перед ГнРГ — отсутствие быстрого рецидивирования заболевания[8,43].
Everitt и соавторы (1995) описали линию крыс с высокой частотой спонтанного роста миомы. В клеточной культуре, полученной из ткани лейомиомы этих животных, авторы зафиксировали стимуляцию клеточной пролиферации эстрадиолом и ее торможение Тамоксифеном [33]. Обнаружено, что тамоксифен in vitro ингибирует пролиферацию 3 из 5 клеточных культур, полученных из лейомиомы крыс.
Способность Тамоксифена тормозить рост миомы коррелировала с экспрессией ИПФР-1 опухолевыми клетками.
Такая экспрессия может служить прогностическим фактором чувствительности миомы матки к тамоксифену (Burroughs и соавт., 1997). В другом исследовании та же группа авторов показала, что, несмотря на то, что Тамоксифен уменьшает количество клеток и останавливает клеточную пролиферацию в миоме и не усиливает апоптоз. В отличие от влияния на клетки рака молочной железы и рака простаты, регуляция роста миомы происходит независимым от апоптоза способом. Эти данные могут объяснять ребаундэффект рецидивирования миомы после отмены терапии ГнРГ. Le Bouedec и соавторы (1995) описали 11 случаев, когда во время лечения Тамоксифеном размеры миомы увеличивались настолько, что потребовали гистероскопического вмешательства. Таким образом, результаты исследований подтверждают, что Тамоксифен действует как агонист эстрогенов на миому матки и, следовательно, не может быть рекомендован для ее лечения [39, 43].
В открытом рандомизированном исследовании Thomas и соавторы (1994) изучали влияние Фазлодекса на концентрацию гормонов в плазме и пролиферацию эндометрия. 17 менструирующих женщин принимали Фазлодекс по 12 мг в сутки в течение 7-ми дней во время фолликулиновой фазы перед планируемой гистерэктомией по поводу меноррагии или миомы матки. Результаты сравнивались с таковыми в группе контроля (11 человек), при этом не было зафиксировано различий в плазменных уровнях ЛГ и ФСГ в группах, а средний уровень эстрадиола плазмы был выше в основной группе. При этом показатели фолликулогенеза не имели различий. Увеличения толщины эндометрия в основной группе не отмечалось, в то время как в контрольной группе толщина эндометрия значительно увеличилась. Побочных эффектов не наблюдалось. Данные результаты показывают, что Фазлодекс может оказаться полезным при лечении эстрогензависимых состояний, в том числе, больных с ММ.
Преимуществом данного препарата перед ГнРГ является отсутствие сопутствующей гипоэстрогении [43]. Однако использование более длительного курса приема Фазлодекса пока не изучалось, и делать выводы о его терапевтической значимости пока рано.
Оральные формы ингибиторов ароматазы, такие как фадрозол. ворозол, летрозол и, особенно, анастрозол, обладают высокой специфичностью и минимальным количеством побочных эффектов. У них отсутствует также эстрогенный эффект, что очень важно при лечении гормональнозависимых опухолей. Анастрозол и Фадрозол станут доступными для использования женщинами в постменопаузе с метастатическим гормонально зависимым раком молочной железы после последней, третьей фазы клинических испытаний [45]. Изучаются новые вещества этой группы, например Аримидекс, ингибирующий ароматазу в 97–99% случаев, по сравнением с Фадрозолом, ингибирующим только 85–95% ароматизации in vivo (Lonning, 1996). С другой стороны, сегодня неизучены исходы длительного применения ингибиторов ароматазы на минеральную плотность костной ткани и липидный спектр крови. Также неизвестна эффективность ингибиторов ароматаз у женщин в пременопаузе.
Вряд ли ингибиторы ароматазы могут быть использованы при лечении миомы матки изза своих системных антиэстрогенных эффектов. Однако может оказаться эффективной комбинация селективного ингибитора ароматазы с низкими дозами эстрогенов и прогестерона [23, 43].
Проведенные экспериментальные исследования показали, что сократительная реактивность маточных артерий in vitro к адренергическим, серотониновым и ангиотензиновым стимулам уменьшается с увеличением миомы, а холинергический сосудорасширяющий эффект увеличивается. Эти изменения более выражены при сочетании миомы с патологическими маточными кровотечениями. В то же время, экспериментальные исследования показали, что Изотурон (ингибитор NOсинтетазы) существенно повышает адренергическое, серотониновое и ангиотензиновое вазоконстрикторное действие на уровне маточных артерий и существенно понижает вазодилататорный эффект ацетилхолина. На основе полученных результатов был разработан новый метод лечения маточных кровотечений и болевого синдрома, сопровождающих миому матки, с использованием Изотурона, который был апробирован в республике Молдова (вагинальные свечи по 100 мг). Терапия Изотуроном способствовала остановке маточных кровотечений в 87,8% случаев и болевого симптома — в 100%. Данные свидетельствуют о том, что использование Изотурона — это эффективный метод лечения симптоматической миомы матки, позволяющий разработать новый алгоритм ведения таких больных [29].
Многообещающим направлением в лечении миомы является использование антифибротической терапии. Основанием для проведения такого лечения является тот факт, что миомы содержат большое количество внеклеточного матрикса, состоящего из коллагена, протеогликана и фибронектина, отличаются повышенным уровнем экспрессии мРПК коллагена типов I и ПГ. Препарат Пирфенидон, который используется для лечения пациентов с фиброзом легких, ингибирует клеточную пролиферацию, вызванную основным ФРФ, тромбоцитарным фактором и ТФР-Р и оказывает выраженное дозозависимое антипролиферативное действие на ГМК миом и миометрия, угнетая продукцию коллагенов в ГМК [14].
Хотя митотическая активность миом матки, как правило, низкая, клетки миомы экспрессируют онкобелки пролиферации (Ki-67) и белки, снижающие процесс апоптоза (bcl-2, bax). По этим причинам группа исследователей рекомендуют применение имитаторов опухолевых антигенов, входящих в состав вакцины Ресан, с целью коррекции системы иммунитета для лечения больных с фибромиоматозом. Согласно результатам иммунотерапии миом матки и их сочетанных форм с эндометриозом с помощью ксеногенной вакцины Ресан, у больных отмечалась регрессия или полное исчезновение миоматозных узлов, очагов эндометриоза и кистозных образований яичников [34].
Полученные данные указывают на необходимость проведения иммуномодулирующей терапии при лечении лейомиомы матки. В этой связи вызывает интерес препарат с оригинальным механизмом действия Эрбисол® производства НПЦ ООО «Эрбис» (г. Киев, Украина), который представляет собой комплекс природных небелковых низкомолекулярных соединений негормонального происхождения, полученный из животной эмбриональной ткани. Препарат содержит гликопептиды, пептиды, нуклеотиды, аминокислоты, способствует ускорению обновления поврежденных и уничтожения аномальных клеток и тканей, в первую очередь, вследствие активизации макрофагов, Т-и натуральных киллеров (NK-клеток).
Иммуномодулирующий эффект Эрбисола® связан с нормализацией активности Th1- и Th2-лимфоцитов, что способствует восстановлению баланса цитокинов. Проведенные исследования показали высокую эффективность комплексного лечения лейомиомы матки с использованием препарата Эрбисол® в комбинации с аналогами Гн-Рг, антистрессорной и допаминергической терапией, что позволило получить более быстрый выраженный и стойкий эффект, уменьшить частоту возникновения синдрома «вспышки» и побочных гипоэстрогенных реакций, а также положительно повлиять на иммунологические показатели, что проявилось в активизации клеточного иммунитета (увеличение секреции ИЛ-2, ИЛ-12, количества рецепторов к ИЛ-2, функционального резерва моноцитов, усиления процессов внутриклеточного метаболизма, способствующего повышению их бактерицидности) [17].
В зарубежных работах встречаются описание двух активных химических соединений (веществ) — Indol-3-carbinol и Epigallocatechin-3Gallate, которые обладают определенным корригирующим влиянием на молекулярнобиологические процессы. В данном аспекте заслуживают внимания препараты, синтезированные на основе этих химических соединений, — Индинол (Indol-3-carbinol) и Эпигаллат (Epigallocatechin-3Gallate) производства фармфирмы «Миракс Фарма» — в виду выявленных подходов фармакологической коррекции молекулярно-биологических процессов. Если коротко охарактеризовать свойства Индинола, то можно сказать, что это сильнейший антиэстроген, антиоксидант, лиганд к AhRрецептору, а также блокатор COX2, обладающий мощными антипролиферативными свойствами [2]. Простое перечисление его характеристик показывает, что его активность распространяется на различные клеточные структуры, и подобное комплексное воздействие на сигнальные пролиферативные пути является уникальным свойством перапарата. Однако спектр активности.
Индинола не ограничивается перечисленными свойствами, так как он обладает способностью избирательно индуцировать в опухолевых клетках эпителиального происхождения процессы программируемой клеточной гибели (апоптоз).
Препарат Эпигаллат оказывает влияние на ряд других молекулярных процессов, а именно: вызывает избирательный апоптоз опухолевых клеток посредством усиления прооксидантной активности; блокирует неоангиогенез; ингибирует инвазивные процессы при заболеваниях опухолевого и неопухолевого генеза. Так, 59 пациенткам до или после оперативного вмешательства проводился курс терапии с использованием препаратов Индинол и Эпигаллат («Миракс Фарма»). За время терапии в 94% случаев не было зарегистрировано ни одного случая увеличения миоматозного узла.
Также, принимая во внимание, что при быстрорастущей (митотически активной) миоме матки после консервативной миомэктомии возможен рецидивирующий рост новых узлов, у 24 женщин после операции был проведен 6-месячный курс терапии препаратами Индинол и Эпигаллат Заслуживает внимания тот факт, что ни у одной из них в течение 1-го года после проведенной терапии не было обнаружено рецидивирующего увеличения и образования новых узлов [15].
Возможно, перспективными окажутся препараты, ингибирующие факторы роста, влияющие на апоптоз и продукцию межклеточного вещества ГМК, а также на пролиферацию и миграцию эндотелиоцитов. К ингибиторам ангиогенных факторов роста относится RG13577 — производное гепарина, оказывающее антипролиферативное действие на ГМК сосудов. Этот препарат препятствует связыванию фактора роста фибробластов с его рецептором и угнетает синтез ДПК в культуре ГМК миомы. К этой же группе препаратов относится и интерферон-А, который в значительной степени ингибирует стимулированную ростовыми факторами пролиферацию нормальных клеток и клеток миомы. Применение интерферона-А при лечении 20 пациенток способствовало уменьшению объема лейомиомы уже после 1-й недели приема препарата [14].
Традиционная китайская терапия использует различные виды трав для лечения многих гинекологических заболеваний. К сожалению, наши знания о механизмах воздействия на организм больной при такой терапии очень ограничены. В научной литературе имеются некоторые сведения о применении трав при лечении женщин с миомой матки. Kue-chin-fu-ling-man (KBG) — традиционное китайское лекарство, которое способно влиять на синтез ДНК в матке неполовозрелых крыс как агонист ГнРГ и слабый антиэстроген. Sakamoto и соавторы (1992) изучали действие KBG у 110 у таких пациенток в пременопаузе. Было выявлено, что клинические симптомы гиперменореи и дисменореи уменьшались у более чем 90% больных, а размеры миомы уменьшались у 60% женщин. Sun (1995) описал 38 случаев успешного лечения миомы матки. Frucella и соавторы (1997) опубликовали обещающие результаты лечения миомы матки во время беременности с использованием витамина Е в дозе 300 мг/сут., начиная с 6–12 недель гестации (в зависимости от времени установления диагноза), у 25 беременных. Механизмы успешного использования методов нетрадиционной медицины не до конца изучены, а рандомизированных исследований на Западе, сравнивающих эффект традиционной и альтернативной медицины, не проводилось. Повышенный интерес специалистов к этим методам терапии требует проведения соответствующих исследований с целью изучения эффективности их использования при лечении больных с ММ [12, 43].
Таким образом, консервативные методы лечения оправданны в случае отсутствия симптомов, во время беременности и при желании больной избежать операции. Достижения фундаментальных наук позволили расширить наши представления о механизмах развития лейомиомы матки и способствовали появлению новых перспективных направлений лечебного воздействия, основанного на блокаде гонадотропной функции гипофиза и «отключении» функции яичников, а также торможении действия специфических факторов роста и цитокинов, которые регулируют пролиферацию, неоангиогенез и стимулируют апоптоз. Гн-Рг эффективно уменьшает выраженность симптомов у определенной группы больных перед операцией в перименопаузе или в случаях, когда операция противопоказана, их можно использовать более 3-х месяцев с дополнительной терапией. Эмболизация маточной артерии — это методика, которая обеспечивает нивелирование проявлений данного заболевания у 85% пациенток, но такое вмешательство повышает риск развития инфаркта матки, инфекции и гистерэктомии. Кроме того, отдаленные исходы ЭМА малоизученны. Миомэктомию следует предлагать женщине с симптоматической фибромиомой матки в том случае, если она желает сохранить фертильность или оставить матку по другим причинам. Гистероскопические операции — это лечение выбора при субмукозных фибромиомах.
Доказательная медицина рекомендует хирургическое лечение миомы матки как наиболее эффективный метод. Однако для многих пациенток привлекательным остается медикаментозное лечение. Очень важен поиск лекарственных средств, приближающихся по эффективности к хирургической операции и ,желательно, не вызывающих побочных эффектов, с учетом варианта размеров и локализации узлов, соматической патологии, возраста и ряда других особенностей пациентки.
Литература
- Myers E.R., Barber M.D., Gustilo_AshbyT. et al. Management of uterine leiomyomata: what do we really know? // Obstet Gynecol. — 2002. — V.100. — P. 8—17.
- Ming_Huei Cheng, Peng_Hui Wang. Uterine myoma: a condition amendable to medical therapy? // Expert Opinion on Emerging Drugs. — 2008. —V. 13 (Is. 1). — P. 119—133.
- LASSO Project. http://www.vision.ee.ethz.ch/projects/Lasso/start.html, 2001.
- Kolankaya A. Myomas and assisted reproductive technologies: when and how to act? // Obstet. Gynecol. Clin. North. Am. — 2006. — V. 33 (Is. 1). — P. 145—152.
- Friptu, V., Ghicavii V., Sofroni D. et al. Utilizarea bromurii de S-etilizotiouroniu (izoturon) in calitate de preparat uteroton pentru tratamentul hemoragiilor uterine in cazul miomului uterin / Int. F1: A 61 K 31/00, 31/155; A 61 P 15/04 // Republica Moldova, Brevet de inventie nr. 2323, BOPI 12/2003.
- Ficikova Z., Mara M., Maskova J. Embolization of uterine arteries during myoma treatment from the patient’s point of view // Czeska Gynecol. — 2005. — V. 70 (Is. 5). — P. 383—388.
- Ferenczy A. Pathophysiology of adenomyosis // Hum. Reprod. Update. — 1998. — V. 4 (Is. 4). — P. 312—322.
- Eldar_Geva T., Healy D.L. Monash. Other medical management of uterine fibroids // Baillieres Clin Obstet Gynaecol. — 1998. — V. 12, № 2. — P. 269—288.
- Edward E. Wallach, Nikos F. Vlahos. Uterine Myomas: An Overview of Development, Clinical Features, and Management // Obstetrics & Gynecology. — 2004. — V. 104. — P. 393—406.
- Brandner P., Neis K., Diebold P. Hysteroscopic resection of submucous myomas // Contrib Gynecol Obstet. — 2005. — V. 20. — P. 81—90.
- Татарчук Т.Ф., Зданович И.Е., Косей Н.В. и др. Клинико-иммунологические аспекты применения Эрбисола в комплексном лечении лейомиомы матки // Здоровье женщины. — 2005.— № 4 (24). — С. 93—96.
- Столярова У.В., Степанова Н.Н. Использование внутриматочной системы «Мирена» у больных с начальными формами эндометриоза мышц матки: Сб. науч. тр. «Современные проблемы организации и оказания специализированной медицинской помощи». — Саратов: Изд_во СГМУ, 2005. — С. 40.
- Сидорова И.С., Унанян, А.Л., Коган Е.А. и др. Клинико-патогенетические особенности разных гистотипов миомы матки и пути их фармакологической коррекции // Эффективная фармакотерапия в акушерстве и гинекологии. — 2007. — № 1.— С. 6—11.
- Самойлова Т.Е. Миома матки. Обоснование неоперативного лечения (обзор литературы) // Проблемы репродукции. — 2003. — № 3. — С. 32—36.
- Савицкий, Г.А., Савицкий, А.Г. Миома матки: проблемы патогенеза и патогенетической терапии. — 3_е изд. — СПб.: ЭЛБИ-СПб, 2003. — 236 с.
- Почос Е.В., Богданкевич Н.В. Лечение миомы матки сочетанием фитотерапии и КВЧтерапии // Медицина в Кузбассе (спецвыпуск). — 2004. — № 11. — С. 62—63.
- Миома матки (современные проблемы этиологии, патогенеза, диагностики и лечения) / Под ред. И.С. Сидоровой. — М.: Моск. мед. акад. им. И.М. Сеченова, 2003. — 234 с.
- Ланчинский В.И., Ищенко А.И., Ищенко А. Новые подходы к хирургическому лечению миомы матки // Вопросы гинекологии, акушерства и перинаталогии. — 2004. — Т. 4, № 4. — С. 64—69.
- Кулагина Н.В., Кустаров В.Н. Результаты консервативного лечения больных миомой матки // Рос. семейный врач. — 2005. — Т. 9, № 2. — С. 49—52.
- Коротких И.Н., Кураносова И.Ю. Прогнозирование рецидивов миомы матки у пациенток, перенесших консервативную миомэктомию //Науч._мед. вест. Центрального Черноземья. — 2006. — № 26. — С. 73—76.
- Коротких И.Н, Кураносова И.Ю. Оценка репродуктивного здоровья женщин после консервативной миомэктомии // Журн. теор. и практ. медицины. — 2007. — Т. 5, № 1. — С. 38—40.
- Вихляева Е.М. Руководство по диагностике и лечению лейомиомы матки. — М., 2004. — 400 с.
- Барсегян Г.О., Литвинцева Н.Г., Кроткова Л.Л. Применение препарата «Бусерелин» с целью подготовки к гистероскопическому удалению субмукозных миоматозных узлов / В кн.: Современные технологии в диагностике и лечении гинекологических заболеваний. — М., 2006. — С. 113—114.
- Кроткова Л.Л. Гистерорезектоскопическая миомэктомия как рациональный метод органосохраняющей операции у больных с субмукозной миомой матки // Анналы хирургии. — 2008. — № 1. — С. 54—58.
- Кроткова Л.Л., Исамова У.Ш. Эффективность применения препарата «Диферелин» в подготовке больных к гистерорезектоскопической миомэктомии // Врач. — 2008. — № 1. — С. 44—46.
- Кроткова Л.Л., Саркисов С.Э. Комплексный подход в подготовке больных к гистероскопическим миомэктомиям // Трудный пациент. — 2007.— Т. 5, № 9. — C. 7—10.
- Кулагина Н.В. Миома матки: алгоритм комплексного консервативного лечения в амбулаторных условиях // Стационарозамещающие технологии. Амбулаторная хирургия. — 2005. — № 1.- С. 83—86.
- Татарчук Т.Ф., Косей Н.В., Альтман И.В. Опыт применения эмболизации маточных артерий у женщин с лейомиомой матки // Репродуктивное здоровье женщины. — 2007. — № 1. — С. 25—34.
- Тихомиров А.Л. Органосохраняющее лечение миомы матки. Современные достижения // Трудный пациент. — 2007. — Т. 5, № 9. — С. 4—6.
- Тихомиров А.Л., Залеева Е.В. Применение левоноргестрел-рилизингсистемы в комплексном лечении миомы матки // Гинекология. — 2005. — Т. 7, № 1. — С. 7—10.
- Тихомиров А.Л., Лубин Д.М. Миома матки. — М.: ООО «Медицинское информационное агенство», 2006. — 176 с.
- Bergamini V., Ghezzi F., Cromi A. et al. Laparoscopic radiofrequency thermal ablation: A new approach to symptomatic uterine myomas // American Journal of Obstetrics and Gynecology. — 2005. — V.192. — P. 768—773.
- Bodle J., Duffy S., Binney D. Susceptibility of uterine myomas and endometrium to cryosurgery using a carbon dioxide cryosurgical probe in vitro // Journal of Minimally Invasive Gynecology. — 2002. —V. 13 (Is. 6). — P. 500—504.
- Gordon P/ Flake, Janet Andersen, Darlene Dixon. Etiology and pathogenesis of uterine leiomyomas: a review // Environ Health Perspect. — 2003. — V. 111 (Is. 8). — P. 1037—1054.
- Grabo Theresa N., Fahs Pamela Stewart, Nataupsky Lindsay G. et al. Uterine Myomas: Treatment Options // Journal of Obstetric, Gynecologic, & Neonatal Nursing. — 2006. — V. 28 (Is. 1). — P. 23—31.
- Harrison_Woolrych M.L., Charnock_Jones D.S., Smith S.K. Quantification of messenger ribonucleic acid for epidermal growth factor in human myometrium and leiomyomata using reverse transcriptase polymerase chain reaction // J. Clin. Endocrinol. Metab. — 1994. — V. 78. — P. 1179—1184.
- Howe S.R., Gottardis M., Everitt J. et al. Estrogen stimulation and tamoxifen inhibition of leiomyoma cell growth in vitro and in vivo // Endocrinology. — 1995. — V. 136. — Р. 4996—5003.
- http://www.anticancer.net/resan/rmyoma.html#literatur.35. Hudson S.B.A., Stewart E.A. magnetic resonance-guided focused ultrasound surgery // Clinical Obstetrics & Gynecology. — 2008. —V. 51 (Is. 1). — P. 159—166.
- Ischenko A.I., Rukhadze T.N., LanchinskyV.I. Combined endoscopic myomectomy: indications and results / Endoscopic surgery: its subsidiaries and alternatives. 12-th Annual Congress of the European Society. — Luxemburg, 2003. — P. 81.
- Stewart Elizabeth A. Uterine fibroids // The Lancet. — 2001. — V. 357 (Is. 9252). — P. 293—298.
- Takebayashi T., Fujino Y., Umesaki N. et al. Danazol suspension injected into the uterine cervix of patients with adenomyosis and myoma. Preliminary study // Gynecol. Obstet. Invest. — 1995. — V. 39 (Is. 3). — P. 207—211.
- Talia Eldar_Gevaa, David L. Healyb. 7 Other medical management of uterine fibroids // Bailliere’s Clinical Obstetrics and Gynaecology. — 1998. — V. 12 (Is. 2). — P. 269—288.
- Ueki M., Okamoto Y., Tsurunaga T. et al. Endocrinological and histological changes after treatment of uterine leiomyomas with danazol or buserelin // J. Obstet. Gynaecol. — 1995. — V. 21 (Is. 1). — P. 1—7.
- Varelas F.K., Papanicolaou A.N., Vavatsi-Christaki N. et al. The Effect of Anastrazole on Symptomatic Uterine Leiomyomata // Obstet. Gynecol. — 2007. — V. 110 (Is. 3). — P. 643—649.
- Vincenzo De Leo, Antonio la Marca. Giuseppe morgante short-term treatment of uterine fibromyomas with danazol // Gynecol. Obstet. Invest.— 1999. — V. 47 (Is. 4). — P. 258—262.
- Zowall H., Cairns J.A., Brewer C. et al. Cost_effectiveness of Magnetic Resonance-guided Focused Ultrasound Surgery for Treatment of Uterine Fibroids // BJOG. — 2008. — V. 115. — P. 653—662.









Комментировать