Стимуляция функции яичников лекарственно и психологически. Результаты проведенных исследований.
Дмитриев Д.В.
Возможно, специалист в области репродукции как никто другой ощущает себя «свободным художником», проводя стимуляцию функции яичников для программ вспомогательных репродуктивных технологий (ВРТ). Слишком много очень разных задач требуется решить, выполняя фармакологическую стимуляцию, слишком большой спектр препаратов существует на сегодняшний день и слишком много различных «гениальных» идей стимуляции витает в научном мире. Добавляется искушение использовать для клинического применения неразрешенные в Российской Федерации для репродукции препараты только потому, что о них появились публикации в зарубежных научных журналах.
Очень важно соблюдать деликатный баланс между правилами применения гормональных препаратов и индивидуальными особенностями пациента. Стандартные схемы и дозы специалист применяет только на начальном этапе формирования его личного опыта. Для сокращения такого периода формирования появилась необходимость в формулировке понятия «индивидуальная контролируемая стимуляция функции яичников»;. Это понятие означает подбор для каждой конкретной пациентки такой стратегии лечения, которая направлена как на снижение частоты отмены цикла или недостаточного ответа яичников, так и на уменьшение необходимости применения интенсивного лечения в связи с развитием синдрома гиперстимуляции яичника (СГЯ) средней и тяжелой степени и одновременно на максимальное повышение вероятности наступления беременности (с перспективами ее вынашивания) в каждом цикле стимуляции.
Конечно, самым важным результатом, к которому мы стремимся, является беременность с последующим рождением здорового ребенка. Именно эти характеристики от врача требуют все «инстанции», начиная от пациента и заканчивая различными контролирующими и статистическими органами. Это действительно то, ради чего все и затевается, однако целесообразно весь этот некороткий путь клинически разделить на этапы, в каждом из которых есть свои победы и поражения. Одним из таких этапов и является стимуляция функции яичников.
Существующие лекарственные средства для стимуляции клинически и даже психологически разделяют на оральные и парентеральные.
При проведении стимуляции очень важна управляемость процессом. К сожалению, оральные средства в настоящее время не обладают нужной нам управляемостью. Почти 50 лет с этой целью используют только один препарат – кломифена цитрат. Полностью механизм действия препарата до сих пор не изучен, он является комплексным; основа действия – его способность связываться с рецепторами эстрогенов на всех уровнях. Конкурируя с эстрогенами организма (и не вызывая их биологического эффекта), он по механизму отрицательной обратной связи вызывает (либо имитирует) резкое падение уровня эстрогенов, что усиливает выработку гонадотропного рилизинг-гормона (ГнРг), который стимулирует секрецию гонадотропинов – лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). Гонадотропины обеспечивают рост и созревание фолликулов в яичниках и, следовательно, синтез эстрогенов клетками гранулезы растущего фолликула [1].
Кломифена цитрат назначают по 50 мг орально, 1 р./сут, начиная со 2-го по 5-й день менструального цикла (МЦ) в течение 5 дней подряд [1, 7]. По сути, мы «бросаем» своеобразную «бомбу» в организм и смотрим после 5 дней применения, что будет. Это не приводит к необходимой управляемости процессом стимуляции. Мы превращаемся в пассивных свидетелей процесса. У нас только появляется опыт для следующего цикла стимуляции. В большинстве случаев все происходит безопасно, что позволяет препарату существовать до сих пор. Однако применение кломифена цитрата вызывает большое количество проблем: увеличение риска онкологических заболеваний яичников при применении от 6 циклов стимуляции в течение жизни женщины, значительную кумуляцию в организме, периферический антиэстрогеновый эффект, значительные колебания эффективности – от кломифен-резистентности до развития тяжелых форм СГЯ [1, 7]. И, несмотря на то, что доза 50–100 мг/сут уже исторически выверена (отвечают более 50% женщин), до сих пор врачи манипулируют дозой от 12,5 до 250 мг/сут, пытаясь достичь нужной цели [1, 7]. Такие условия можно скорее назвать «лотерейными», особенно, когда кломифена цитрат используют в группе старшего репродуктивного возраста и когда врачи не проводят ультразвуковой мониторинг состояния яичников в цикле стимуляции. Исправить ситуацию пытаются, сочетая применение кломифена цитрата с гонадотропинами.
Начало эры применения препаратов гонадотропинов обозначило новый виток эффективного использования методов ВРТ, и, несмотря на то, что сама группа препаратов уже не нова, внутри нее происходит много интересных изменений. Отмечается стремление довести препарат до совершенства, что, несомненно, очень выгодно для конечного потребителя.
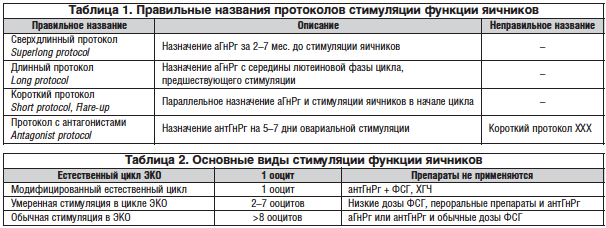
К сожалению, до сих пор, в основном среди отечественных врачей, происходит путаница в терминах, что приводит к подмене понятий и в дальнейшем к ошибкам [6]. Поэтому начнем с рекомендаций по употреблению терминов (табл. 1, 2).
Использование прямого стимулятора позволяет получить максимально возможную управляемость процессом, однако настоящей управляемости удается добиться с появлением у врача достаточного опыта.
Использование только гонадотропинов в цикле стимуляции выделяют в так называемый чистый протокол. Со 2–3 дня МЦ начинают ежедневное введение только гонадотропина – фоллитропина (ФСГ или ФСГ+ЛГ / хорионический гонадотропин человека (ХГЧ)). Однако применение такой схемы для программ экстракорпорального оплодотворения (ЭКО) рискованно, т. к. с ростом множества фолликулов возрастает риск преждевременной их лютеинизации (примерно в 20% случаев). Такая схема возможна, когда нет надобности собирать ооциты и необходима овуляция в брюшную полость, т. е. для программ естественного зачатия, внутриматочной инсеминации. В этих случаях нужно вырастить 1–2, может быть, 3 фолликула, и в таком случае будут наиболее удобны именно гонадотропины, особенно имеющие возможность гибкого и плавного ежедневного дозирования с минимально клинически приемлемым шагом. В «чистых» протоколах периодически пропадает необходимость использовать триггер для овуляции в связи с тенденцией к самостоятельной лютеинизации подобным образом стимулированных фолликулов. Все же триггер часто необходим – как минимум для планирования даты инсеминации или коитуса [1, 7].
Для программ ЭКО необходима полная управляемость лютеинизацией и овуляцией. Это становится возможным только благодаря использованию препаратов – аналогов ГнРг: агонистов ГнРг (аГнРг) и антагонистов ГнРг (антГнРг).
В качестве аГнРг в настоящее время используют трипторелин, гозерелин, бусерелин и лейопрорелин. Воздействие аГнРг в конечном итоге приводит к десенситизации гипофиза и блокаде функциональной активности яичников. На таком «чистом» фоне можно не бояться активности собственных (эндогенных) гонадотропинов [1].
Использовать аГнРг можно в режиме ежедневного введения внутрикожно (по 0,05–0,1 мг) или в виде специального назального спрея, а также в виде депо-форм на 30 или 90 дней. Цель – ежедневное поступление в организм дозы, достаточной для десенситизации гипофиза. Доза вводится и в день введения триггера [1, 7].
АнтГнРг применяется несколько иначе. Используют препараты цетрореликса и ганиреликса. Наиболее гибким и удобным является режим ежедневного введения. Препарат в дозе 0,25 мг вводят ежедневно внутрикожно. Начинают протокол как «чистый». Далее – «главное правило» – начинать введение антГнРг не позднее (!) достижения лидирующим фолликулом диаметра 14 мм [1, 4, 7].
При использовании протокола с антагонистами часто можно слышать претензии по поводу произошедшей лютеинизации (овуляции) к моменту пункции. Неудачную ситуацию начинают связывать с определенным фармакологическим видом антагониста. Здесь надо запомнить второе правило: если ≥6 фолликулов достигло диаметра 11–13 мм, следует уже начать введение антГнРг. Не надо бояться начинать введение антагониста несколько раньше, надо бояться ввести его позже. 14 мм – предельный диаметр, при котором мы сохраним управляемость, и дожидаться этого размера стоит только для снижения стоимости стимуляции.
Получив возможность контролировать овуляцию, мы сможем свободно стимулировать яичники гонадотропинами и стремиться получить достаточное количество ооцитов для успешной программы ЭКО.
От чего зависят ежедневная и суммарная дозы? В подавляющем большинстве пациенткам молодого репродуктивного возраста не требуется доза фоллитропина более 150 МЕ/сут. При низком овариальном резерве (предполагаемом «бедном» ответе) использовать дозу более 300 МЕ/сут нецелесообразно. Еще большие дозы оказываются также неэффективны [5]. Имеет смысл при предполагаемом «бедном» ответе получить от пациента информированное согласие о возможной неэффективности стимуляции.
Старт. При отсутствии противопоказаний стимуляция функции яичников начинается со 2–3 дня МЦ. Прописывают дозы приблизительно на 5 дней, далее ультразвуковой мониторинг роста и развития фолликулов проводят примерно через день [1, 7].
Самым клинически эффективным критерием оценки овариального резерва следует считать подсчет количества антральных фолликулов на 2–3 день МЦ. Другие биохимические маркеры являются вспомогательными и больше нужны для современных научных исследований. Приблизительно 10 антральных фолликулов в каждом яичнике – овариальный резерв выражен; более 10 – чрезмерно выражен, мультифолликулярные яичники; 5–10 – умеренно выражен; менее 5 – низкий овариальный резерв [1, 5, 7].
Следует признать, что разные варианты гонадотропинов разных производителей не унифицированы по международным единицам действия (МЕ), вернее, унифицированы несколько условно, несмотря на маркировку дозы препарата в этих МЕ. Прежде всего это касается мочевых гонадотропинов, у которых выявляется достаточно большая вариабельность дозы в упаковке препарата. Еще больше (в сторону ослабления активности) это проявляется у мочевых гонадотропинов высокой степени очистки. Это надо учитывать. Большую стабильность доз и соответствие МЕ нам обеспечивают рекомбинантные гонадотропины, особенно те, которые дозированы для использования по чистой массе, а не на основании биологических проб [3].
До сих пор не утихают дискуссии о необходимости использования для стимуляции чистого ФСГ, комбинаций ФСГ+ЛГ, ФСГ+ЛГ+ХГЧ (мочевые), а также о режиме их введения: сразу ФСГ+ЛГ или добавлять ЛГ только в финальную стадию фолликулогенеза? И, вообще, зачем нам ЛГ? И без него все стимулируется [2].
Оставим в стороне дискуссии и вспомним, как осуществляется естественное гормональное обеспечение воспроизводства человека в яичниках женщины. Если очень упрощенно, то процесс, на который мы можем влиять, начинается с ЛГ, который стимулирует продукцию андрогенов в тека-клетках. Далее ФСГ индуцирует воспроизведение клеток гранулезы и стимулирует систему ферментов ароматазы, которая переводит андрогены тека-клеток в эстрогены. Природный синергизм налицо. Важно помнить и периоды наибольшей активности ЛГ и ФСГ в зависимости от фазы цикла. ЛГ – вторая половина фолликулогенеза и вторая фаза цикла. ФСГ – с самого начала цикла. Законы природы мы не можем поменять, но мы можем их использовать. Сами воссоздадим, возможно, идеальную схему использования гонадотропинов: начало стимуляции со 2–3 дня МЦ только ФСГ, затем, по достижении фолликулом диаметра 14 мм, добавление препаратов ЛГ. Это общий принцип. Кстати, именно использование препаратов ЛГ оправдывают при предполагаемом «бедном» ответе, когда каждый ооцит на вес золота [9]. Почему же не может быть стремления их использовать и при хорошем овариальном резерве [2]?
Индивидуально, в зависимости от овариального резерва, рассчитываем старт на первые 5 дней стимуляции. При выраженном резерве доза рекомбинантного ФСГ (рФСГ) не должна быть выше 150 МЕ/сут, даже меньше (100 МЕ/сут); при умеренно выраженном – 150–175 МЕ/сут; при низком резерве – 200–300 МЕ/сут. Далее ультразвуковой мониторинг приблизительно через день выявляет для нас необходимость манипулировать дозами в сторону увеличения, уменьшения или оставить их без изменений [1, 7]. Здесь оказывается очень важным способ введения препарата. Использование современных ручек-инжекторов позволяет гибко манипулировать дозами в любую сторону с минимальным клинически важным шагом. Например, для ручки Гонал-Ф этот шаг – 12,5 МЕ [3]. Для обеспечения большей медицинской точности желательно одноразовое использование пластиковой ручки в цикле стимуляции. Используемый для производства ручек пластик гарантирует точность дозирования практически однократно на цикл. Пока намного дешевле обходятся одноразовые ручки-инжекторы. Использование более качественных материалов для увеличения срока службы привело бы к ненужному удорожанию лечения.
Сколько добавлять рекомбинантного ЛГ (рЛГ) в финальной стадии фолликулогенеза? На сегодня рекомендуется доза 75 МЕ/сут [2]. Уверен, что можно использовать и дозу 150 МЕ/сут, особенно проводя для снижения риска развития СГЯ средней или тяжелой степени отсроченное на 1 и даже 2 дня введение триггера. В эти дни при отсутствии введения рФСГ вводится только рЛГ [1, 7].
Стимуляция продолжается до достижения доминантными фолликулами диаметра 17–18 мм. Имеет смысл стремиться проводить стимуляцию функции яичников так, чтобы день пункции фолликулов приходился именно на середину МЦ стимулируемой женщины.
Овуляцию придется вызвать специально, для этого понадобится триггер. Природным, естественным триггером является ЛГ. Существующий в настоящее время препарат рЛГ пока невозможно применить в этом качестве ввиду крайне высокой стоимости полной овуляторной дозы рЛГ. Поэтому пока можно успешно использовать ЛГ-активность ХГЧ. Овуляция происходит через 36 ч после введения триггера. Пункцию фолликулов целесообразно назначить за 1 ч до этого момента, позже произойдет овуляция фолликулов в брюшную полость, что приведет к потере практически всех ооцитов. Если есть техническая возможность и полный контроль за точной явкой пациента на пункцию, возможно ее осуществить ровно через 36 ч после введения триггера [1, 7].
Доза ХГЧ в качестве триггера. В настоящее время можно уже считать догмой дозу ХГЧ 10 000 МЕ. Такая доза считалась оптимальной в период преобладания мочевых гонадотропинов и обеспечивала прогнозируемый результат у препарата с немалым колебанием его стабильности. Однако риск развития средней и тяжелой степени СГЯ напрямую зависит от ХГЧ и его дозы. Поэтому триггерную дозу гибко изменяли: 8000 либо 5000 МЕ. С появлением рекомбинантного ХГЧ (рХГЧ) (Овитрель) гарантированное адекватное воздействие на ооциты во время их финального созревания обеспечивается дозой в 250 мкг, что эквивалентно (условно) 6500 МЕ мочевого ХГЧ. Ниже терапевтически эффективная доза ХГч – ниже риск развития СГЯ тяжелой степени [8, 10].
Связь развития средней и тяжелой степени СГЯ с ХГЧ породила желание заменить его чем-то другим. Прямым триггером может быть только ЛГ или ХГЧ – более ничего. Был придуман обходной маневр: использовать стимулятор продукции собственного ЛГ. Таким стимулятором является аГнРг. Подобная смена триггера возможна исключительно в протоколе с антагонистами. АГнРг используется в триггерной дозе 0,2–0,3 мг. Результатом является достоверное снижение риска развития СГЯ средней и тяжелой степени [1, 4, 7]. Однако за это придется заплатить определенную цену из-за невозможности контроля адекватности выработки ЛГ гипофизом. Мы получим значительно более короткий период воздействия на дозревающие ооциты и значительный дефект лютеиновой фазы, что будет сопровождаться более низкой частотой наступления беременности. Поэтому смену триггера целесообразнее использовать у доноров ооцитов или отменять перенос эмбрионов (что чаще всего и происходит, т. к. триггер меняют при созревании очень большого количества фолликулов – 20 и более) [7]. Если возможность переноса не отметается категорически для конкретного пациента, то лучше использовать в качестве триггера 250 мкг рХГч. Такая доза рХГч также способствует профилактике развития СГЯ и не создает дефект лютеиновой фазы [8, 10].
Хотелось бы надеяться, что данная статья позволит выработать понимание принципов врачебного воздействия на функцию яичников с целью достижения беременности и отойти от механистического использования схем и протоколов.
Литература
- Назаренко Т.А. Стимуляция функции яичников. 3-е изд., доп. М.: МЕДпресс-информ, 2011. 272 с.
- Bühler K.F., Fischer R. Recombinant human LH supplementation versus supplementation with urinary hCG-based LH activity during controlled ovarian stimulation in the long GnRH-agonist protocol: a matched case–control study // Gynecological Endocrinology. May 2012. Vol. 28. No. 5. P. 345–350.
- Driebergen R., Baer G. Quantification of follicle stimulating hormone (follitropin alfa): is in vivo bioassay still relevant in the recombinant age? // Current Medical Research & Opinion. Jan 2003. Vol. 19. No. 1. P. 41–46.
4. Lainas T.G., Sfontouris I.A, Zorzovilis I.Z. et al. Flexible GnRH antagonist protocol versus GnRH agonist long protocol in patients with polycystic ovary syndrome treated for IVF: a prospective randomised controlled trial (RCT) // Hum. Reprod. 2010. Vol. 25 (3). P. 683–689. - La Marca A., Sunkara S.K. Individualization of controlled ovarian stimulation in IVF using ovarian reserve markers: from theory to practice // Hum. Reprod. Update. January/February 2014. Vol. 20 (1). P. 124–140.
- Nargund G., Fauser B.C.J.M., Macklon N.S. et al. The ISMAAR proposal on terminology for ovarian stimulation for IVF // Hum. Reprod. 2007. Vol. 22 (11). P. 2801–2804.
- Ovarian stimulation / ed. M. Aboulghar, B. Rizk. Cambridge University Press, 2011. 271 p.
- Papanikolaou E.G., Fatemi H., Camus M. et al. Higher birth rate after recombinant hCG triggering compared with urinary-derived hCG in single-blastocyst IVF antagonist cycles: a randomized controlled trial // Fertility and Sterility. 2010. Vol. 94 (7). P. 2902–2904.
- Sunkara S.K., Rittenberg V., Raine-Fenning N. et al. Association between the number of eggs and live birth in IVF treatment: an analysis of 400135 treatment cycles // Hum. Reprod. 2011. Vol. 26 (7). P. 1768–1774.
- The European Recombinant Human Chorionic Gonadotrophin Study Group. Induction of final follicular maturation and early luteinization in women undergoing ovulation induction for assisted reproduction treatment-recombinant HCG versus urinary HCG // Hum. Reprod. 2000. Vol. 15 (7). P. 1446–1451.









Комментировать