Нейрогенные дисфункции мочевого пузыря: важность ранней диагностики. Состояние энергетического обмена у детей с ГАМП в зависимости от тяжести заболевания и установить в динамике состояние митохондриальных маркеров энергетического метаболизма после проведенной энерготропной терапии.
С.Л. Морозов, Е.И. Шабельникова, В.В. Длин, Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова
В настоящее время все более значимое положение занимает учение о полисистемных нарушениях клеточного энергообмена (митохондриальная патология). Ключевая область этого раздела медицины — наследственные синдромы, в основе которых лежат мутации генов, ответственных за митохондриальные белки (синдромы Кернса — Сейра, MELAS, MERRF, Пирсона, Барта и др.) [1].
Однако класс состояний, характеризующихся митохондриальной недостаточностью, отнюдь не ограничивается этими «первичными» митохондриальными заболеваниями. Громадное количество болезней включает в себя нарушения клеточного энергообмена в качестве «вторичных» звеньев патогенеза. Среди них: синдром хронического утомления, кардиомиопатии, гликогенозы, болезни соединительной ткани, рахит, тубулопатии, гипопаратиреоз, функциональные нарушения мочеиспускания [2].
Для практической медицины особое значение имеет изучение указанных нарушений в связи с наличием достаточно эффективных возможностей терапевтической коррекции. Однако при этом следует принять во внимание, что спектр патологических нарушений клеточного энергообмена чрезвычайно велик (повреждения различных звеньев цикла Кребса, дыхательной цепи, бета-окисления и др.) [3].
Нейрогенная дисфункция мочевого пузыря по-прежнему остается актуальной проблемой. У детей она обусловлена высокой социальной значимостью, приводящей к выраженному ограничению психической и физической активности пациента, затрудняющей его социальную адаптацию в обществе, что приводит к проблемам в общении со сверстниками, отставанию в учебе, конфликтным ситуациям в семье [4-6]. Распространенность нейроген-ной дисфункции мочевого пузыря среди детского населения составляет в среднем 10-30%, что обусловливает не только научный, но и медико-социальный характер данной проблемы [7-10]. Нейрогенная дисфункция мочевого пузыря способствует развитию и поддержанию вторичных изменений мочевой системы, в частности может вызывать серьезные и необратимые повреждения почек и мочевого пузыря [8-11].
Ранняя диагностика и эффективная своевременная терапия нейрогенной дисфункции мочевого пузыря позволяет снизить риск повреждения верхних и нижних мочевых путей [11].
Проблема причин возникновения нейрогенных дисфункций мочевого пузыря еще далека от окончательного решения. Патогенез заболевания имеет полиэтиологический характер и в большой мере связан с дисфункцией вегетативной регуляции. Однако в последнее время все больше внимания уделяется нарушению биоэнергетики детрузора и ее связи с холинергическими системами организма [12].
Одним из основных нейромедиаторов вегетативной нервной системы является ацетилхолин. В последнее время появились данные о существовании ацетилхолина в крови, который не связан с синапсами и играет большую роль в обеспечении общей устойчивости организма [12]. В работах K. Tracey (США) [13] и K. Kawashima (Япония) [14] показано ключевое стимулирующее действие ацетилхолина, образующегося внутри тканей, а не в синапсах, на общую устойчивость организма. Было обнаружено присутствие ацетилхолина во многих не нейрональных клетках и тканях — иммунных клетках, клетках дыхательного эпителия и эндотелия сосудов, половых органах, мочевого пузыря и других [14]. Показано регуляторное действие внутриклеточного ацетилхолина на функции и биохимические превращения в клетках. Таким образом, возникло представление, что соматические клетки обладают холинергической системой, которая участвует в их функции, а холинергическая дисфункция связана с патологическими сдвигами в органах [13].
В работах Кондрашовой М.Н. и соавт. (2009) показано, что реципрокное влияние симпатического и парасимпатического отделов вегетативной нервной системы имеет в митохондриях соответствующих представителей, а именно такие ферменты, как сукцинатдегидрогеназа и альфа-кетоглутаратдегидрогеназа [15]. Эти ферменты и их субстраты, сукцинат и альфа-кетоглутарат, являются уникальными метаболическими парами, которые связывают митохондрии с симпатической и парасимпатической нервной системой через своих посредников — адреналин/норадреналин и ацетилхолин [1516]. В частности, в экспериментальных работах на животных Кондрашовой М.Н. и соавт. показана взаимосвязь уровня сукцинатдегидрогеназы и состояния холинергических систем организма. Так, при низких уровнях сукцинатдегидрогеназы преобладала активность парасимпатической нервной системы, основным медиатором которой является ацетилхолин.
Целью работы было определить состояние энергетического обмена у детей с ГАМП в зависимости от тяжести заболевания и установить в динамике состояние митохондриаль-ных маркеров энергетического метаболизма после проведенной энерготропной терапии.
Клиническая характеристика групп и методы обследования. Было обследовано 35 детей с ГАМП (25 девочек — 72% и 10 мальчиков — 28%) в возрасте от 5 до 14 лет (средний возраст 8 ± 2 лет). Диагноз ГАМП ставился на основании данных анамнеза, клинической картины заболевания. Для оценки степени выраженности нарушений мочеиспускания использовалась квалиметрическая таблица Е.Л. Вишневского, в которой перечислены основные симптомы ГАМП, оцененные в баллах. Дети с клиническими проявлениями ГАМП были разделены на три группы в зависимости от тяжести нарушений мочеиспускания. Первая группа включала 13 (37%) детей с легкой степенью нарушений мочеиспускания (менее 20 баллов), вторая группа — 14 (40%) детей со средней степенью нарушения мочеиспускания (от 30 до 20 баллов) и третья группа — 8 детей (23%) с выраженным нарушением мочеиспускания (от 30 до 40 баллов). Всем больным проводилась функциональная оценка состояния нижних мочевых путей на уродинамической установке (Medtronic DUET, США). По данным уродинамического обследования оценивались: цистометрический объем мочевого пузыря, внутрипузырное давление покоя, порог чувствительности мочевого пузыря, детрузорное пороговое давление потери мочи.
Для диагностики митохондриальной недостаточности у детей с ГАМП проводилось определение активности дегидрогеназ лимфоцитов: СДГ, альфа-ГФДГ, ЛДГ по методу AG. Averson Pears в модификации Р.П. Нарцисова с последующей визуальной и компьютерной морфометрией. Ферментативная активность оценивалась в условных единицах, соответствующих среднему числу гранул формазана, являющимся продуктом цитохимических реакций. У детей с ГАМП до приема терапии исследовалась исходная оценка уровня цитохимических ферментов, далее в течение 3 месяцев дети получали терапию L-карнитином (препарат Элькар®, ООО «ПИК-ФАРМА») в дозировке 30-50 мг/кг/сут, с последующей оценкой уровня ферментов в динамике. Кроме того, оценивался уровень активности ферментов через 3 месяца после окончания терапии.
Результаты. При оценке исходного уровня ферментов клеточного энергообмена у детей с гиперактивным мочевым пузырем (1-я точка) уровень СДГ варьировал от 10 до 22 усл. ед. (17,4 ± 2,01, норма 18-23) и был снижен у 63% обследуемых, причем достоверно более выраженное снижение уровня СДГ отмечалось у детей из II и III групп больных (табл. 1).
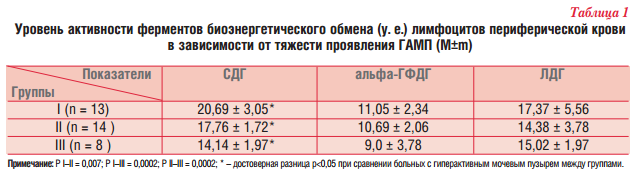
Уровень альфа-ГФДГ варьировал от 7 до 15 усл. ед. (10,1 ± 2,1, норма 11-14) и был снижен у 57% обследуемых и достоверно не зависел от тяжести проявления ГАМП. Снижения уровня ЛДГ у больных с ГАМП не отмечалось, и ее уровень составил 15,1 ± 4,1 (норма 10-17) усл. ед.
Все дети с гиперактивным мочевым пузырем получали в течение 3 месяцев терапию Элькаром в дозировке 30-50 мг/кг/сут, с последующей оценкой уровня активности ферментов в динамике (2-я точка). Кроме того, оценивались показатели активности ферментов через три месяца после окончания терапии (3-я точка).
В динамике через 3 месяца терапии L-карнитином уровень СДГ в лимфоцитах крови был достоверно выше исходного уровня (Р = 0,00012) и составлял 20,9 ± 1,13 усл. ед. (рис. 1).
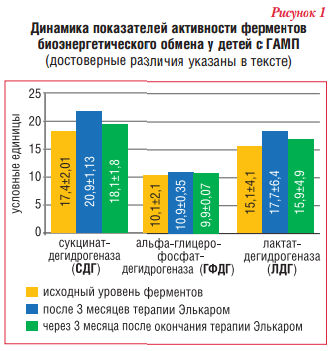
Значительное увеличение уровня СДГ наблюдалось у всех больных, и у 92% пациентов его уровень находился в пределах нормы. Кроме того, на фоне терапии отмечалось достоверное увеличение (р = 0,004) уровня альфа-ГФДГ, который составлял 10,9 ± 0,35 усл. ед. (рис. 1).
Через 3 месяца после отмены терапии уровень СДГ достоверно снижался (р = 0,0006), но был выше исходных значений. Динамика уровней альфа-ГФДГ и ЛДГ была менее значимой, а через 3 месяца после отмены терапии их уровень соответствовал исходному (рис. 1).
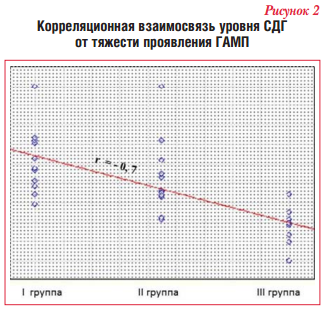
При оценке показателей активности ферментов клеточного энергообмена установлена обратная корреляционная взаимосвязь уровня СДГ (г = -0,7; p<0,05) в зависимости от степени выраженности ГАМП (рис. 2), тогда как корреляционная связь с уровнями альфа-ГФДГ и ЛДГ не установлена.
Следовательно, у большинства детей с ГАМП выявляются нарушения энергетического метаболизма, преимущественно в виде снижения уровня СДГ и альфа-ГФДГ, что обосновывает более широкое применение энерготропных препаратов.
При оценке клинических результатов у детей с гиперактивным мочевым пузырем применение Элькара в качестве монотерапии в дозировке 30-50 мг/кг/сут показало высокую эффективность.
У детей I группы полностью купировались клинические признаки ГАМП, эффект от терапии сохранялся на всем периоде наблюдения за детьми. Во второй группе у 70% детей симптомы ГАМП полностью исчезали, при этом у 30% детей наблюдался частичный эффект в виде снижения количества эпизодов недержания мочи в ночное и дневное время, уменьшение выраженности императивных позывов на мочеиспускания. В третьей группе уменьшение клинических признаков ГАМП отмечалось у 40% детей, тогда как у 60% клинического эффекта не отмечалось или он был незначительный.
Применение энерготропных препаратов при нарушениях мочеиспускания у детей показало свою эффективность в ряде исследований [17]. Одним из основных энерготропных препаратов, применяемых при нарушениях мочеиспускания, является Элькар®, представляющий собой L-стереоизомер карнитина, который оптимально подходит для коррекции процессов биоэнергетического обмена. Учитывая, что за последнее десятилетие значимую роль в патогенезе многих заболеваний приобрели нарушения клеточного энергообмена, то такая терапия вполне оправдана. Показана ее эффективность при различных патологических состояниях и заболеваниях детского возраста, в том числе и при нарушениях мочеиспускания у детей [2].
Выводы. Таким образом, у большинства детей с ГАМП выявляются нарушения энергетического метаболизма преимущественно в виде снижения уровня СДГ и альфа-ГФДГ.
Показано, что уровень активности ферментов биоэнергетического обмена нормализуется после проводимого лечения, однако спустя 3 месяца после окончания терапии снижается, при этом не достигая исходного уровня ферментов. Снижение уровня активности данных ферментов через 3 месяца после окончания терапии обосновывает назначение повторных курсов препаратов L-карнитина.
В результате проведенного исследования установлена сильная обратная корреляционная зависимость тяжести ГАМП от уровня СДГ. Корреляционной связи уровней альфа-ГФДГ и ЛДГ с тяжестью ГАМП не выявлено.
Установлено, что применение препаратов L-карнитина (Элькара) показано для детей со средней и легкой степенью нарушения мочеиспускания в качестве монотерапии в дозировке 30-50 мг/кг/сут и в составе комплексной терапии у детей с тяжелой степенью расстройств мочеиспускания.
Список литературы:
- Николаева Е.А. Эффективность патогенетической терапии митохондриальных заболеваний у детей // Вестник педиатрической фармакологии и нутрициологии, 2004; 1: 54-59.
- Брин И.Л. Элькар в педиатрии. Научный обзор. НЦЗД РАМН, 2006; 28.
- Сухоруков В.С., Ключников С.О. Энерготропная терапия в современной педиатрии. Вестник педиатрической фармакологии и нутрициологии, 2006; 6: 34-38.
Кольбе О.Б., Моисеев А.Б., Сазонов А.И. и др. Оценка эффективности применения препарата оксибутинин у детей с гиперактивным мочевым пузырем // Русский медицинский журнал, 2006; 14: 895-901. (Kol’be O.B., Moiseev A.B., Sazonov AI. Evaluating the 1. effectiveness of the drug oxybutynin in children with overactive bladder // Russkij medicinskij zhurnal, 2006; 14: 895-901.)
- Козлова Т.В. Анализ особенностей болезней почек у новорожденных и детей первых месяцев жизни. Нефрологический семинар — 2001. Сб. тр. IX ежегод. Санкт-Петерб. нефрол. семинара. СПб, 2001; 177-179. (Kozlova T.V. Analysis of the features of kidney disease in neonates and young infants. Nephrology Seminar — 2001. sb. tr. IX ezhegod. Sankt-Peterb. nefrol. seminara SPb, 2001; 177-179.)
- Fan Y.H., Lin A.T., Wu H.M., Hong C.J., Chen K.K. Psychological profile of female patients with dysfunctional voiding // Urology, 2008; 71: 4: 625-629.
- Вишневский Е.Л. Гиперактивный мочевой пузырь. Мат. пленума Рос. общества урологов. Тюмень, 2005: 322-351. (Vishnevskij E.L. Overactive bladder. Materials plenum Ros. Soc. of Urology. Tyumen, 2005: 322-351.)
- Зоркин С.Н., Гусарова Т.Н., Борисова С.А. Нейрогенный мочевой пузырь у детей. Возможности фармакотерапии // Лечащий врач 2009; 1: 37-39. (Zorkin S.N., Gusarova T.N., Borisova S.A. Neurogenic bladder in children. The possibilities of pharmacotherapy // Lechashhij vrach, 2009; 1: 37-39.)
- De Sousa A, Kapoor H., Jagtap J., Sen M. Prevalence and factors affecting enuresis amongst primary school children // Indian J. Urol., 2007; 23: 4: 354-357.
- Athanascopoulos A., Gyftopoulos K., Giannitsas K. et al. Combination treatment with an blocker plus an anticholinergic for bladder outlet obstruction: a prospective, randomized, controlled study // J. Urol., 2003; 169: 2253-2256.
- Вишневский Е.Л. Диагностика и лечение нейрогенных дисфункций мочевого пузыря у детей // Педиатрия 1997; 3: 13.
- Zakharchenko M.V., Zakharchenko A.V., Khunderyakova N.V. et al. Burst of succinate dehydrogenase and альфа-ketoglutarate dehydrogenase activity in concert with the expression of genes coding for respiratory chain proteins underlies short-term beneficial physiological stress in mitochondria // Int. J. Biochem. Cell Biol., 2013; 45: 1: 190-200.
- Tracey K.J. Reflex control of immunity. Nat Rev. Immunol., 2009; 9: 6: 418-428.
- Kawashima K., Fujii T. The lymphocytic cholinergic system and its biological function. Life Sci 2003; 72: 18-19: 2101-2109.
- Kondrashova M., Zakharchenko M., Khunderyakova N. Preservation of the in vivo state of mitochondrial network for ex vivo physiological study of mitochondria // Int. J. Biochem. Cell Biol., 2009; 41: 2036-2050.
- Кондрашова М.Н., Федотчева Н.И. Субстратно-гормональная система регуляции физиологического состояния. Условия ее выявления. Использование в практике. Горизонты биофизики от теории к практике. Пущино, 2003; 147-154.
- Белоусова И.С., Вишневский Е.Л., Сухоруков В.С., Шабельникова Е.И. Обоснование и эффективность применения L-карнитина в лечении детей с гиперактивным мочевым пузырем // Российский вестник перинатологии и педиатрии, 2004; 1: 51-55.









Комментировать