Этиопатогенез. Клиническая картина, диагностика и лечение.
И.Б. Манухин, М.А. Геворкян Кафедра акушерства и гинекологии лечебного факультета МГМСУ
Представлены современные данные об этиопатогенезе, клинике, диагностике и лечении синдрома поликистозных яичников.
Сокращения:
СПКЯ – синдром поликистозных яичников; ИПФР – инсулиноподобный фактор роста; ГИ – гиперинсулинемия;ИР – инсулинорезистентность;ПССГ – половые стероиды, связывающие глобулины; ЛПНП – липопротеины низкой плотности;ЛПОНП – липопротеины очень низкой плотности; ЛПВП – липопротеины высокой плотности;ФКМ – фиброзно-кистозная мастопатия; АГС – адреногенитальный синдром;ДМК – дисфункциональные маточные кровотечения; ИМТ – индекс массы тела;МФЯ – мультифолликулярные яичники;КОК – комбинированные оральные контрацептивы; СГЯ – синдром гиперстимуляции яичников.
Синдром поликистозных яичников (СПКЯ) – патология структуры и функции яичников, основными критериями которых являются хроническая ановуляция и гиперандрогения. Частота СПКЯ составляет около 30% среди пациенток гинекологов-эндокринологов, а в структуре эндокринного бесплодия достигает 75%.
Структурные изменения яичников при этой патологии хорошо изучены и характеризуются:
• Двухсторонним увеличением размеров яичников в 2–6 раз.
• Гиперплазией стромы.
• Гиперплазией клеток тека с участками лютеинизации.
• Наличием множества кистозно-атрезирующихся фолликулов диаметром 5–8 мм, расположенными под капсулой в виде «ожерелья».
• Утолщением капсулы яичников.
Патогенез Спкя
Суммируя основные современные представления об этой патологии можно выделить следующие основные положения патогенеза. Но сначала напомним основы стероидогенеза в яичниках. Синтез андрогенов происходит в клетках тека фолликулов определенной стадии зрелости диаметром 5–8 мм и в строме. Регулируют синтез андрогенов ЛГ инсулиноподобный фактор роста-I (ИПФР-I) и энзим (цитохром Р450с17). В превращении андрогенов (тестостерона и андростендиона) в эстрогены (эстрадиол и эстрон), так называемый процесс ароматизации андрогенов, участвует цитохром Р450с17. Синтез энзима регулируется ФСГ.
В ПКЯ гиперандрогения является следствием:
• Повышения уровня ЛГ в результате нарушения цирхорального ритма выделения ГнРГ и гонадотропинов, формирующегося в пубертатном возрасте, в период становления гормональной функции репродуктивной системы. Возможной причиной являются генетические факторы. Гиперстимуляция ЛГ нарушает фолликулогенез в яичниках, формируется кистозная атрезия фолликулов с гиперплазией тека-клеток, стромы и увеличением синтеза андрогенов. В результате дефицита ФСГ, необходимого для синтеза энзимов, ароматизирующих андрогены в эстрогены, происходит накопление андрогенов и дефицит эстрадиола.
• Важным механизмом гиперандрогении является характерная для СПКЯ инсулинорезистентность (ИР) – уменьшение утилизации глюкозы в организме. В результате возникает компенсаторная гиперинсулинемия. Поскольку имеется дефект рецепторов инсулина, его действие реализуется через рецепторы ИПФР-I. Инсулин и ИПФР-I способствуют усилению ЛГ-зависимого синтеза андрогенов в тека-клетках и строме, а также стимулируя выброс ЛГ.
• Увеличение концентрации свободного биологически активного Т за счет уменьшения образования ПССГ. Синтез ПССГ уменьшается вследствие снижения уровня эстрадиола и гиперинсулинемии.
• Определенная роль принадлежит жировой ткани. При ожирении нарушается толерантность к глюкозе по диабетогенному типу. Развивается инсулинорезистентность и компенсаторная гиперинсулинемия. Вследствие этих метаболических нарушений усиливается синтез андрогенов в адипоцитах (жировых клетках) и соответственно превращение (ароматизация) тестостерона в эстрадиол и андростендиона в эстрон. Этот процесс имеет автономный характер, не зависит от гонадотропной стимуляции. Таким образом, жировая ткань является источником андрогенов и эстрогенов (в основном эстрона) внегонадного происхождения.
Нарушения синтеза половых гормонов при СПКЯ и их клинические проявления представлены на схеме 1.
Основными клиническими проявлениями СПКЯ являются хроническая ановуляция и яичниковая гиперандрогения. Различия в патогенезе, преобладание того или другого механизма, позволяют выделить два основных механизма формирования: СПКЯ с ожирением и СПКЯ без ожирения.
При ожирении имеет место ИР и, как следствие, ГИ, что повышает ЛГ-зависимый синтез андрогенов в текаклетках (как было указано выше). У женщин с нормальной массой тела повышенный уровень гормона роста стимулирует синтез ИПФР в клетках гранулезы, что, в свою очередь, паракринным путем осуществляет эффект ИПФР на тека-клетки. В сочетании с увеличением уровня ЛГ это приводит к гиперпродукции андрогенов по тому же механизму, что и при ожирении. Как видно, различия только в пусковом механизме, результатом является увеличение синтеза андрогенов в яичниках.
Итак, СПКЯ – многофакторная патология, возможно, генетически детерминированная, в патогенезе которой участвуют центральные механизмы гонадотропной функции гипофиза (с пубертатного периода), местные яичниковые факторы, экстраовариальные эндокринные и метаболические нарушения, определяющие клиническую симптоматику и морфологические изменения яичников.
Клиническая картина
Для СПКЯ характерны следующие симптомы:
1. Нарушение менструального цикла по типу олигоаменореи. Поскольку нарушение гормональной функции яичников начинается с пубертатного периода, с момента физиологической активации функции яичников, нарушения цикла начинаются с менархе и не имеют тенденции к нормализации. Следует отметить, что возраст менархе соответствует таковому в популяции – 12–13 лет, в отличие от надпочечниковой гиперандрогении при адреногенитальном синдроме (АГС), когда менархе запаздывает. Примерно у 10–15% пациенток нарушения менструального цикла имеют характер ДМК на фоне гиперпластических процессов эндометрия. Поэтому женщины с СПКЯ входят в группу риска развития аденокарциномы эндометрия, ФКМ и рака молочных желез.
2. Ановуляторное бесплодие. Важно отметить, что бесплодие имеет первичный характер в отличие от надпочечниковой гиперандрогении при АГС, при которой возможна беременность и характерно невынашивание.
3. Гирсутизм, различной степени выраженности, развивается постепенно с периода менархе. Отметим, что при АГС гирсутизм развивается до менархе, с момента активации гормональной функции надпочечников в период адренархе.
4. Превышение массы тела отмечается примерно у 70% женщин при ИМТ 26—30, что соответствует II–III степени ожирения. Ожирение чаще имеет универсальный характер, о чем свидетельствует отношение объема талии к объему бедер (ОТ/ОБ) менее 0,85, характеризующего женский тип ожирения. Соотношение ОТ/ОБ более 0,85 характеризует кушингоидный (мужской) тип ожирения и встречается реже.
5. Молочные железы развиты правильно, у каждой третьей женщины имеет место фиброзно-кистозная мастопатия (ФКМ), развивающаяся на фоне хронической ановуляции и гиперэстрогении.
В последние годы было установлено, что при СПКЯ часто имеет место инсулинорезистетность (ИР) и компенсаторная гиперинсулинемия (ГИ) – нарушения углеводного и жирового обмена по диабетоидному типу. Отмечается также дислипидемия с преобладанием липопротеинов атерогенного комплекса (холестерина, триглицеридов, ЛПНП и ЛПОНП). Это, в свою очередь, повышает риск развития сердечно-сосудистых заболеваний во 2–3-м десятилетиях жизни, которым эти заболевания не свойственны.
Диагностика
Характерный анамнез, внешний вид и клиническая симптоматика облегчают диагностику СПКЯ. В современной клинике диагноз СПКЯ можно поставить без гормональных исследований, хотя они также имеют характерные особенности.
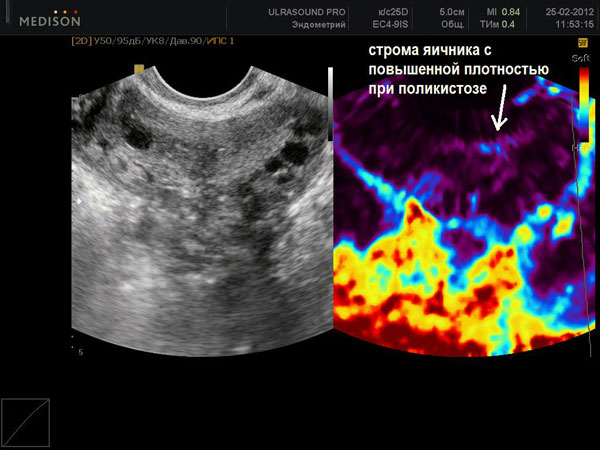
Диагноз ПКЯ может быть установлен при трансвагинальном УЗИ, на основании четких критериев эхоскопической картины: объем яичников более 9 см3, гиперплазированная строма составляет 25% объема, более
10 атретичных фолликулов диаметром до 10 мм, расположенных по периферии под утолщенной капсулой. Объем яичников определяется по формуле: см3 = ДЅ Т Ѕ Ш Ѕ 0,5, где Д, Т, Ш – длина, толщина и ширина яичника, 0,5 – коэффициент. Увеличение объема яичников за счет гиперплазированной стромы помогает дифференцировать ПКЯ от нормальных (на 5–7-й день цикла) или мультифолликулярных (МФЯ). Последние характерны для раннего пубертата, гипогонадотропной аменореи, длительного приема комбинированных оральных контрацептивов. Характерной УЗ-картиной МФЯ является небольшое число фолликулов диаметром от 4 до 10 мм, расположенных по всей строме, и, главное, нормальный объем яичников. М.В. Медведев, Б.И. Зыкин (1997) дают следующее определение МФЯ: «преходящие изменения в структуре яичников в виде множества эхонегативных включений диаметром 5–10 мм, имеющих обратное развитие при отсутствии клинической картины и эхоструктуры поликистозных яичнииков».
Внедрение трансвагинальной эхографии с высокой разрешающей способностью аппаратов значительно улучшило диагностику ПКЯ, приближая ее к морфологической. Последним достижением стало внедрение Dewailly и соавт. (1994) компьютеризированной УЗИ техники для детального исследования стромы и фолликулярного аппарата яичников.
Итак, УЗИ является неинвазивным, высокоинформативным методом, который можно считать золотым стандартом в диагностике СПКЯ.
Гормональная характеристика СПКЯ. Критериями диагностики СПКЯ являются: повышение уровня ЛГ, соотношения ЛГ/ФСГ более 2,5, увеличение уровня общего и свободного Т при нормальном содержании ДЭА-С и 17-ОНП. После пробы с дексаметазоном содержание андрогенов незначительно снижается, примерно на 25% (за счет надпочечниковой фракции). Проба с АКТГ отрицательная, что исключает надпочечниковую гиперандрогению, характерную для АГС. Отмечено также повышение уровня инсулина и снижение ПССГ в крови.
Метаболические нарушения при СПКЯ характеризуются: повышением уровня триглицеридов, ЛПНП, ЛПОНП и снижением ЛПВП. В клинической практике простым и доступным методом определения нарушения толерантности глюкозы к инсулину является сахарная кривая. Определение сахара крови натощак и затем в течение 2-х часов после приема 75 г глюкозы. На основании результатов строится гликемическая кривая. Если через 2 часа уровень сахара крови не приходит к исходным цифрам, это свидетельствует о нарушенной толерантности к глюкозе, т.е. ИР, и требует соответствующего лечения.
Биопсия эндометрия показана женщинам с ациклическими кровотечениями в связи с большой частотой гиперпластических процессов эндометрия.
Таким образом, диагноз СПКЯ ставится на основании следующих данных:
• своевременный возраст менархе,
• нарушение менструального цикла с периода менархе в подавляющем большинстве по типу олигоменореи,
• гирсутизм и у более чем половины женщин — ожирение с периода менархе,
• первичное бесплодие,
• хроническая ановуляция,
• увеличение объема яичников за счет стромы и кистозных фолликулов по данным трансвагинальной эхографии,
• повышение уровня тестостерона,
• увеличение ЛГ и отношения ЛГ/ФСГ.
Дифференциальная диагностика СПКЯ проводится с гиперандрогенией, обусловленной АГС, а также с вирилизирующими опухолями яичников и/или надпочечников.
Лечение
Как правило, пациентки с СПКЯ обращаются к врачу с жалобами на бесплодие. Поэтому целью лечения является восстановление овуляторных циклов.
При СПКЯ с ожирением и с нормальной массой тела последовательность терапевтических мер различается.
При наличии ожирения первый этап терапии – нормализация массы тела. Снижение массы тела на фоне редукционной диеты приводит к нормализации углеводного и жирового обмена. Диета предусматривает снижение общей калорийности пищи до 2000 ккал в день, из них 52% приходится на углеводы, 16% – на белки и 32% – на жиры, причем насыщенные жиры должны составлять не более 1/3 общего количества жира. Важным компонентом диеты является ограничение острой и соленой пищи, жидкости. Очень хороший эффект отмечается при использовании разгрузочных дней, голодание не рекомендуется в связи с расходом белка в процессе глюконеогенеза. Повышение физической активности является важным компонентом не только для нормализации массы тела, но повышения чувствительности мышечной ткани к инсулину. Самое главное убедить пациентку в необходимости нормализации массы тела как первого этапа в лечении СПКЯ.
Вторым этапом в лечении является медикаментозная терапия метаболических нарушений (ИР и ГИ) в случае отсутствия эффекта от редукционной диеты и физических нагрузок. Препаратом, повышающим чувствительность периферических тканей к инсулину, является метформин – из класса бигуанидов. Метформин приводит к снижению периферической ИР, улучшая утилизацию глюкозы в печени, мышцах и жировой ткани, нормализует липидный профиль крови, снижая уровень триглицеридов и ЛПНП. Препарат назначается по 1000–1500 мг/сутки в течение 3–6 мес под контролем глюкозотолерантного теста.
При СПКЯ на фоне нормальной массы тела начинают с лечения бесплодия, т.е. стимуляции овуляции. Стимуляция овуляции проводится после нормализации массы тела, исключения трубного и мужского факторов бесплодия. В настоящее время большинство клиницистов на первом этапе индукции овуляции применяют кломифен. Надо отметить, что длительно применявшийся метод стимуляции овуляции применением эстроген-гестагенных препаратов, основанный на ребаунд-эффекте после их отмены, не потерял своей популярности. При отсутствии эффекта от терапии эстроген-гестагенами, кломифеном, рекомендуется назначение гонадотропинов или хирургическая стимуляция овуляции.
Стимуляция овуляции кломифеном начинается с 5-го по 9-й день менструального цикла по 50 мг в день. При таком режиме повышение уровня гонадотропинов, индуцированное кломифеном, происходит в то время, когда уже завершился выбор доминантного фолликула. Более раннее назначение кломифена может стимулировать развитие множества фолликулов и увеличивает риск многоплодной беременности. При отсутствии овуляции по данным базальной температуры дозу кломифена можно увеличивать в каждом последующем цикле на 50 мг, достигая 200 мг в день. Однако многие клиницисты считают, что если нет эффекта при назначении 100–150 мг, то дальнейшее увеличение дозы кломифена не целесообразно. При отсутствии овуляции при максимальной дозе в течение 3-х мес пациентку можно считать резистентной к кломифену. Критерием эффективности стимуляции овуляции служит восстановление регулярных менструальных циклов с гипертермической базальной температурой в течение 12–14 дней второй фазы цикла, уровень прогестерона в середине второй фазы цикла 15 нг/мл и более, преовуляторный пик ЛГ; а также УЗИ признаки овуляции на 13–15 день цикла – наличие доминантного фолликула не менее 18 мм, толщины эндометрия не менее 8–10 мм. При наличии этих показателей рекомендуется введение овуляторной дозы 7500–10 000 человеческого хорионического гонадотропина – чХГ (профази, прегнил), после чего овуляция отмечается через 36–48 часов. Важно помнить, что раннее назначение чХГ может привести к преждевременной лютеинизации незрелого фолликула, а позднее назначение чХГ – к лютеолитическому эффекту. При лечении кломифеном следует помнить, что он обладает антиэстрогенными свойствами, уменьшает количество цервикальной слизи («сухая шейка»), что препятствует пенетрации сперматозоидов и тормозит пролиферацию эндометрия и приводит к нарушению имплантации в случае оплодотворения яйцеклетки. С целью устранения этих нежелательных эффектов кломифена рекомендуется после окончания приема кломифена принимать натуральные эстрогены в дозе 1–2 мг или синтетические эстрогены (микрофоллин) в дозе 0,05 мг с 10 по 14 день цикла для повышения проницаемости шеечной слизи и пролиферации эндометрия.
При недостаточности лютеиновой фазы (НЛФ) рекомендуется назначить гестагены во вторую фазу цикла с 16 по 25 день. При этом предпочтительнее препараты прогестерона (дюфастон), так как производные норстероидов могут оказывать лютеолитический эффект.
Частота индукции овуляции при лечении кломифеном составляет примерно 60–65%, наступление беременности в 32–35%, частота многоплодной беременности, в основном двойней, составляет 5–6%, риск внематочной беременности и самопроизвольных выкидышей не выше, чем в популяции. При отсутствии беременности на фоне овуляторных циклов требуется исключение перитонеальных факторов бесплодия при лапароскопии.
При резистентности к кломифену назначают гонадотропные препараты – прямые стимуляторы овуляции. Используется чМГ, приготовленный из мочи женщин постменопаузального возраста. Препараты чМГ содержат ЛГ и ФСГ по 75 ЕД (пергонал, хумигон и др.). В последние годы разработан высокоочищенный препарат ФСГ (метродин) для стимуляции овуляции у женщин с высоким ЛГ. Перспективным является клиническое применение рекомбинантного ФСГ, полученного путем генной инженерии. Этот высокоочищенный препарат вводится подкожно, что удобно для использования самой пациенткой. Однако их высокая стоимость не дает возможности широкого применения в практике. При назначении гонадотропинов пациентка должна быть информирована о риске многоплодной беременности, возможном развитии синдрома гиперстимуляции (СГЯ), а также о высокой стоимости лечения. Лечение должно проводиться только после исключения патологии матки и труб, а также мужского фактора бесплодия. В процессе лечения обязательным является трансвагинальный УЗ мониторинг фолликулогенеза и состояния эндометрия. Овуляция инициируется путем однократного введения чХГ в дозе 7500–10 000 ЕД, когда имеется хотя бы один фолликул диаметром 17 мм. При выявлении более 2 фолликулов диаметром более 16 мм или 4 фолликулов диаметром более 14 мм введение чХГ нежелательно из-за риска наступления многоплодной беременности.
При стимуляции овуляции гонадотропинами частота наступления беременности повышается до 60%, риск многоплодной беременности составляет 10–25%, внематочной от 2,5 до 6%, самопроизвольные выкидыши в циклах, закончившихся беременностью, достигают 12–30% и СГЯ наблюдается в 5–6% случаев.
Клиновидная резекция яичников, хирургический метод стимуляции овуляции, предложенный еще в 30-х годах был наиболее распространенным до 60-х годов, до кломифеновой эры. Из-за спаечного процесса, резко снижающего частоту наступления беременности, большинство клиницистов отказались от резекции яичников при лапаротомии. В последние годы интерес к хирургическому лечению возрос в связи с внедрением операционной лапароскопии, преимуществами которой являются минимальное инвазивное вмешательство и снижение риска спайкообразования. Кроме того, преимуществами лапароскопической резекции являются: отсутствие риска гиперстимуляции, наступления многоплодной беременности и возможность ликвидации часто сопутствующего перитонеального фактора бесплодия. Патофизиологические механизмы клиновидной резекции в стимуляции овуляции основаны на уменьшении объема стероидпродуцирующей стромы яичников. В результате чего нормализуется чувствительность гипофиза к ГнРГ и восстанавливаются гипоталамогипофизарно-яичниковые связи.
Помимо клиновидной резекции, при лапароскопии можно производить каутеризацию яичников при помощи различных энергий (термо-, электро-, лазерной), которая основана на разрушении стромы точечным электродом. Производится от 15 до 25 пунктур в каждом яичнике, операция менее травматичная и длительная по сравнению с клиновидной резекцией. При достаточной технической оснащенности и опыте хирурга лапароскопическая резекция яичников занимает 10–15 мин, кровопотеря минимальная. Гемостаз предпочтительнее проводить коагуляцией, так как наложение швов увеличивает риск спайкообразования. Обязательным является тщательное промывание брюшной полости, что снижает риск развития постоперационных спаек. Преимуществами лапароскопии также является косметический эффект и длительность пребывания в стационаре не более 2 суток. При анализе лапароскопических осложнений было показано, что подавляющее большинство их наблюдается на этапах вхождения в брюшную полость. В послеоперационном периоде через 3–5 дней наблюдается менструальноподобная реакция, а через 2 недели овуляция, которая тестируется по базальной температуре. Отсутствие овуляции в течение 2–3 циклов требует дополнительного назначения кломифена. Как правило, беременность наступает в течение 6–12 мес, в дальнейшем частота наступления беременности уменьшается. Отсутствие беременности при наличии овуляторных менструальных циклов диктует необходимость исключения трубного фактора бесплодия.
Частота индукции овуляции после хирургической лапароскопии составляет 84–89%, наступление беременности в среднем отмечается в 72%.
Несмотря на достаточно высокий эффект в стимуляции овуляции и наступлении беременности, большинство клиницистов отмечают рецидив ПКЯ и клинической симптоматики примерно через 5 лет. Поэтому после беременности и родов необходима профилактика рецидива СПКЯ, что важно, учитывая риск развития гиперпластических процессов эндометрия. С этой целью наиболее целесообразно назначение комбинированных оральных контрацептивов (КОК), предпочтительнее монофазных (марвелон, фемоден, диане, мерсилон и др.). При плохой переносимости КОК, что бывает при избыточной массе тела, можно рекомендовать гестагены во вторую фазу цикла: дюфастон 20 мг с 16 по 25 день цикла, медроксипрогестеронацетат (МПА) по 10—20 мг с 16 по 25 день цикла или 17-ОПК 12,5% в/м на 16 и 21 день цикла по 125–250 мг.
У женщин, не планирующих беременность после первого этапа стимуляции овуляции кломифеном, направленного на выявление резервных возможностей репродуктивной системы, также рекомендуется назначение КОК или гестагенов для регуляции цикла, уменьшения гирсутизма и профилактики гиперпластических процессов.
Лечение гиперпластических процессов эндометрия у женщин с СПКЯ. При выявлении гиперплазии эндометрия, подтвержденной гистологическим исследованием, первым этапом проводится терапия эстрогенгестагенными и гестагенными препаратами, при ожирении предпочтительнее гестагены. Гормонотерапия гиперпластических процессов эндометрия предусматривает центральный и местный механизм действия препарата, заключающийся в подавлении гонадотропной функции гипофиза, приводящее к торможению фолликулогенеза в яичниках и, как следствие этого, снижение эндогенного синтеза стероидов; местное действие гормонального препарата сводится к гипопластическим процессам в эндометрии. Из эстроген-гестагенных препаратов применяются биссекурин, марвелон, фемоден, мерсилон, которые назначаются по 1 таблетке в день с 5 по 25 день цикла в течение 6 мес.; из гестагенов – норколут 5–10 мг в день или медроксипрогестерона ацетат– 20 мг в день с 16 по 26 день цикла. При рецидивирующих гиперпластических процессах, аденоматозе показана терапия гестагенами в непрерывном режиме (провера по 250 мг 2–3 раза в неделю) в течение 6 мес с проведением контрольного диагностического выскабливания через 3 и 6 мес от начала лечения. Следует напомнить, что показанием к резекции яичников является не только бесплодие, но и рецидивирующие гиперпластические процессы у женщин с СПКЯ. Перспективным в лечении аденоматоза у женщин репродуктивного возраста, в частности не выполнивших генеративную функцию, является назначение аналогов гонадолиберина (Г.Е. Чернуха, В.П. Сметник, 1998) – золадекс, декапептил и другие в течение 6 месяцев. Однако высокая стоимость лечения ограничивает его широкое применение в практике.
Вторым этапом в лечении гиперпластических процессов является восстановление овуляторных менструальных циклов, что наблюдается часто после отмены гормонотерапии (ребаунд эффект). Можно также назначать кломифен – по общепринятой схеме под контролем базальной температуры.
Непременным условием проведения терапии гиперпластических процессов эндометрия является коррекция метаболических нарушений (гиперинсулинемии, гипергликемии, дислипидемии) на фоне редукционной диеты и медикаментозных препаратов. В противном случае возможен рецидив, что связано с образованием эстрогенов в жировой ткани.
Лечение гирсутизма является наиболее трудной задачей. На уровне волосяного фолликула происходит превращение тестостерона в активный дигидротестостерон под влиянием фермента 5a-редуктазы. Немаловажное значение играет повышение свободного тестостерона, что усугубляет клинические проявления гиперандрогении.
Лечение гирсутизма предусматривает блокирование действия андрогенов различными путями:
• торможение синтеза в эндокринных железах,
• увеличение концентрации ПССГ, т.е. снижение биологически активных андрогенов,
• торможение синтеза дигидротестостерона в ткани-мишени за счет угнетения активности фермента 5a-редуктазы,
• блокада рецепторов к андрогенам на уровне волосяного фолликула.
Непременным условием лечения гирсутизма у женщин с ожирением является нормализация массы тела. Показана четкая положительная корреляция между уровнем андрогенов и ИМТ.
Комбинированные оральные контрацептивы (КОК) широко используются для лечения гирсутизма, особенно при нерезко выраженных формах. Механизм действия КОК основан на подавлении синтеза ЛГ, а также повышении уровня ПССГ, что снижает концентрацию свободных андрогенов. Наиболее эффективны по клиническим исследованиям КОК, содержащие дезогестрел, гестоден, норгестимат.
Одним из первых антиандрогенов был ципротеронацетат (андрокур) – по химической структуре прогестаген, производное медроксипрогестерон ацетата (МПА). Механизм действия основан на блокаде рецепторов андрогенов в ткани-мишени и подавлении гонадотропной секреции. Антиандрогеном также является Диане-35, сочетание 2 мг ципротеронацетата с 35 мкг этинилэстрадиола, обладающий еще и контрацептивным эффектом. Усиление антиандрогенного эффекта Диане можно получить дополнительным назначением Андрокура по 25–50 мг с 5 по 15 день цикла. Длительность лечения от 6 мес до 2 лет и более. Препарат переносится хорошо, из побочных эффектов иногда в начале приема отмечается вялость, отеки, масталгия, прибавка в весе и снижение либидо (полового чувства).
Спиронолактон (верошпирон) также обладает антиандрогенным эффектом, блокируя периферические рецепторы и синтез андрогенов в надпочечниках и яичниках, снижая активность цитохрома Р450с17; подавляет активность фермента 5a-редуктазы, способствует снижению массы тела. При длительном приеме по 100 мг в день отмечается уменьшение гирсутизма. Побочное действие: слабый диуретический эффект (в первые 5 дней лечения), вялость, сонливость. Длительность лечения от 6 до 24 месяцев и более.
Флютамид – нестероидный антиандроген, используемый для лечения рака простаты. Механизм действия основан в основном на торможении роста волоса путем блокады рецепторов и незначительного подавления синтеза тестостерона. Побочного действия не отмечено. Назначается по 250–500 мг в день в течение 6 мес и более. Уже через 3 мес отмечен выраженный клинический эффект без изменения уровня андрогенов в крови. Поскольку не обладает контрацептивным эффектом, можно сочетать с ОК.
Финастерид – специфический ингибитор фермента 5a-редуктазы, под влиянием которого происходит образование активного дигидротестостерона. Основное назначение препарата — лечение доброкачественной гиперплазии простаты. В России флютамид и финастерид для лечения гирсутизма применяются редко.
Агонисты гонадотропных рилизинговых гормонов (а-ГнРГ) (Золадекс, Люкрин-депо, Буселерин, Декапептил) эффективны в лечении гирсутизма при СПКЯ, особенно при высоком ЛГ. Механизм действия основан на блокаде гонадотропной функции гипофиза и, следовательно, ЛГ-зависимого синтеза андрогенов в тека-клетках яичников. Недостатком является появление характерных для климактерического синдрома жалоб в связи с резким снижением функции яичников. Эти препараты для лечения гирсутизма используются редко.
Медикаментозное лечение гирсутизма не всегда эффективно, поэтому широкое распространение получили различные виды эпиляции (электор-лазерной, химической и механической).
Гиперандрогения и хроническая ановуляция наблюдается при таких эндокринных нарушениях, как АГС, нейрообменноэндокринном синдроме, болезнь Кушинга и гиперпролактинемия. При этом в яичниках развиваются морфологические изменения, сходные с СПКЯ. В подобных случаях речь идет о так называемых вторичных ПКЯ и основным принципом лечения является терапия вышеперечисленных заболеваний.








Комментировать