Артериальная гипертензия: эссенциальная и вторичная формы, их классификация, эпидемиология, этиология, патогенез. Клиническая картина. Лечение.
Ю.Н. Сиренко
Национальный научный центр «Институт кардиологии им. Н.Д. Стражеско» АМН Украины, Киев
Введение
Артериальная гипертензия (АГ) — наиболее распро-страненное хроническое заболевание в мире и в зна-чительной мере определяет высокую смертность и ин-валидность от сердечно- сосудистых и цереброваску-лярных заболеваний. Приблизительно каждый тре-тий взрослый страдает от этого заболевания. В 2007 г. в Украине официально зарегистрировано более 11 млн больных c АГ, что составляет более 29 % взросло-го населения страны. Около 5 % всех больных c АГ име-ют определенные формы вторичных АГ, при которых с помощью радикального вмешательства (чаще хирурги-ческого) пациент может быть практически излечен. Но и 5%больных c АГ — это сотни тысяч пациентов в Украине, которых навсегда можно вылечить от этого недуга. К та-ким формам АГ относится большинство эндокринных ги-пертензий. Перед врачом, который принимает пациента с синдромом АГ, всегда стоит несколько диагностических вопросов и первый среди них — какая форма АГ у боль-ного — эссенциальная или вторичная? Для построения правильного диагноза АГ необходимо отталкиваться от симптомов, нехарактерных для эссенциальной гипертен-зии. Для последней присущи: развитие в возрасте между 30–50 годами; медленно прогрессирующее течение, ча-сто бессипмтомный характер болезни до появления по-ражения органов-мишеней. Толчком для расширенного обследования пациента с АГ должны стать: юношеский и молодой возраст, внезапное начало или ухудшение забо-левания, тяжелая АГ — АД >180/120 мм рт. ст., рефрактер-ный или злокачественный характер течения, наличие лю-бых симптомов, присущих вторичным АГ.
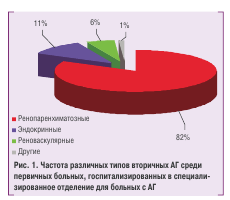
Пациенты со вторичной или симптоматической АГ составляют приблизительно 5–10 % всех больных с по-вышенным АД, а доля эндокринных АГ в общей популя-ции больных c АГ по данным разных авторов — 0,2–1 %. По данным отделения симптоматических артериальных гипертензий Национального научного центра «Инсти-тут кардиологии им. Н.Д. Стражеско» АМН Украины сре-ди 3495 первичных больных, которые находились в от-делении на протяжении 1994–2003 гг., вторичные фор-мы АГ составили 26,8 %. Частота различных форм вто-ричных АГ в нашем наблюдении представлена на рис. 1. Безусловно, что в общей популяции больных с АГ и со-ответственно на приеме участкового (семейного) врача их доля будет меньше.
К ренопаренхиматозным АГ относят все типы АГ при поражении паренхимы почек. Кодирование по МКБ-10: I12 — гипертензивная [гипертоническая] болезнь с пре-имущественным поражеПредставлен нием почек. Сюда относятся все заболевания, включенные в рубрику N18, N19, N26. Кроме этого, используют код I15.1 — гипертен-зия вторичная по отношению к другим поражениям по-чек.
К реноваскулярным АГ относят АГ при атеросклерозе почечных артерий, фибромускулярной дисплазии и не-специфическом аортоартериите:
— феохромоцитома;
— первичный минералокортицизм;
— гиперкортицизм (синдром и болезнь Кушинга); — акромегалия;
— гиперпаратиреоз;
— гипер- и гипотиреоз;
— первичный гиперренинизм;
— эндотелинпродуцирующие опухоли.
Следует подчеркнуть, что в большинстве случаев вторичных АГ прогноз жизни больного определяется развитием сердечно-сосудистых осложнений, но обыч-ное рутинное применение антигипертензивных препа-ратов в большинстве случаев не позволяет стабилизировать состояние больного и предупредить возникно-вение осложнений. Диагностика и лечение больных с вторичными формами АГ является предметом профес-сиональной деятельности врачей различных специальностей: терапевтов, кардиологов, эндокринологов, не-фрологов, хирургов. Но, как известно, у семи нянек ре-бенок без глаза. Появление новых методов диагности-ки и лечения на протяжении последних 25 лет значи-тельно расширили возможности медицины в этом на-правлении. Своевременное хирургическое вмешатель-ство при некоторых нозологических формах позволя-ет у значительного числа больных достичь нормали-зации АД и прекратить постоянный прием антигипер-тензивных средств. В большинстве случаев для дости-жения успеха необходима четкая работа целой коман-ды. Потенциальная курабельность вторичных АГ требу-ет от каждого специалиста четкого понимания своейро-ли в современном алгоритме ведения таких пациентов.
АГ, которая возникает у больных сахарным диабе-том, не относится к группе эндокринных АГ и рассматри-вается как эссенциальная (первичная) АГ в сочетании с сахарным диабетом или как вторичная ренопаренхима-тозная — при диабетическом поражении почек.
ренопаренхиматозная аг
Определение
Ренопаренхиматозная (ренопаренхимная) АГ — син-дром, при котором стойкое повышение АД обусловле-но поражением паренхимы при различных заболевани-ях почек.
Эпидемиология
РенопаренхиматознаяАГ—наиболеечастаяформавто-ричнойАГ.ЧастотаеесредивсехбольныхсАГ—5–15%. В специализированных отделениях, где находятся боль-ные с рефрактерными формами АГ, частота ренопарен-химатозной достигает 30–40%. По данным отделения симптоматических артериальных гипертензий Нацио-нального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины среди 3495 первичных больных АГ, которые лечились в отделении на протяжении 1994–2003 гг., диагноз «ренопаренхиматозная АГ», подтвержденныйинструментальнымиилабораторными исследованиями, был поставлен 784 пациентам, что со-ставляет 22,4%. Таким образом, ренопаренхиматозная АГ является второй по частоте причиной хронического повышения АД после эссенциальной АГ.
В начале ХIХ века английский врач R. описал вза-имосвязь заболеваний почек, развития сердечно-сосудистых осложнений и смерти у таких пациентов. Этот момент можно считать отправным в исследова-нии роли почечных факторов при АГ. В 30–50-е годы ХХ века коллективы исследователей под руководством H. Goldblatt , F. Gross и некоторых других положили нача-ло исследованию биохимии ренин-ангиотензиновой системы (РАС). Это способствовало накоплению данных о нормальной и патологической физиологии сердечно-сосудистой системы, патогенезе АГ и ее осложнениях. Полученные в последние десятилетия факты позволи-ли кардинально изменить наши представления об этих процессах, а также разработать принципиально новые классы эффективных лекарственных средств.
Этиология и патогенез
Как уже отмечалось, поражение паренхимы почек с по-следующим повышением АД может возникнуть вслед-ствие различных нозологических форм заболеваний почек. Независимо от этиологического фактора, кото-рый привел к первичному поражению почек, дальней-шее течение заболевания, его прогрессирование ха-рактеризуется общими закономерностями патогенети-ческих механизмов и стадийностью. Со временем при отсутствии адекватного лечения возникает нарушение функции почек, которое постепенно прогрессирует к ее крайнему проявлению — хронической почечной не-достаточности (ХПН). При этом АГ вначале может быть следствием, а затем важным патогенетическим факто-ром дальнейшего прогрессирования заболевания. Та-кая схожесть патогенетических факторов прогрессиро-вания поражения почек привела к внедрению в клини-ческую практику с начала 2000-х годов понятия «хрони-ческое заболевание (поражение) почек» (ХЗП) по анало-гии с «сердечно-сосудистым заболеванием». Этот тер-мин был предложен Американской национальной фе-дерацией нефрологии (АНФН) и в данный момент яв-ляется принятым специалистами во всем мире. По ли-тературным данным в зависимости от стадии ХЗП повы-шенное АД выявляют у 60–90% таких больных. Появле-ние АГ у больных на ранних стадиях ХЗП ассоциирует-ся с быстрым дальнейшим прогрессированием пораже-ния почек и развитием ХПН.
Традиционно в нашей стране кардиологи и терапев-ты большое внимание уделяют лечению больных с сер-дечной недостаточностью (СН) и ишемической болез-нью сердца (ИБС) и считают компетенцией нефрологов ведение пациентов с заболеваниями почек. Но наибо-лее частыми причинами возникновения поражения по-чек в современном мире считаются АГ и сахарный диа-бет. При этом, с одной стороны, повышенное АД явля-ется причиной ХЗП, с другой — ренопаренхиматозная АГ является второй по частоте причиной хроническо-го повышения АД после эссенциальной. За последние 10 лет количество таких больных с ХЗП в США и Запад-ной Европе удвоилось. В США в 1998 г. было 326 тыс. та-ких больных, в 2000 г.— уже 372 тыс., а в 2010 г. ожида-ется 650 тыс. Приблизительно 20–25% больных с ХПН — это пациенты с так называемым гипертензивным не-фросклерозом (в нашей стране более распространен-ным считается термин «первично сморщенная почка»), который является прямым следствием прогрессиро-вания поражения почек при АГ. Более того, сердечно-сосудистые осложнения и смерть вследствие указан-ных поражений у больных с ХЗП отмечают более часто, чем смерть от почечной недостаточности. Таким обра-зом, необходимо рассматривать ХЗП как независимый фактор возникновения сердечно-сосудистых осложне-ний и кардиальной смерти. Возникновение даже незна-чительных признаков нарушения функции почек (по-вышение содержания креатинина, снижение клиренса креатинина, появление микро- и макроальбуминурии) означает достоверное значительное повышение риска развития сердечно-сосудистых осложнений и карди-альной смерти.
Основными механизмами, которые поддерживают по-вышение АД при ХЗП, считают повышение общего пе-риферического сосудистого сопротивления (ОПСС) и задержку жидкости. Соответственно наиболее эффек-тивными средствами для контроля АД будут вазодила-таторы и диуретики, а также препараты, которые блоки-руют РАС.
Как известно, РАС обеспечивает в организме регуля-цию кровообращения, водно-солевого обмена, прини-мает участие в процессах дифференциации тканей, вос-паления, регенерации, развития гипертрофии, склеро-за. В общих чертах функционирование РАС осуществля-ется таким образом: секреция почками энзима ренина в кровь является первым этапом в каскаде реакций, ко-торые приводят к продукции вазоконстрикторного пеп-тида — ангиотензина II (АII). Кроме того, ренин и ангио-тензинпревращающий фермент (АПФ) участвуют в акти-вации АII в тканях всего организма, в частности в поч-ках, миокарде, сосудах, мозговой ткани и других, втяну-тых в сферу регуляции. Циркулирующая РАС отвечает за быстрые и кратковременные эффекты (например, ком-пенсаторные реакции во время возникновения крово-течения, острой СН или гипертензивного криза), тогда как тканевая РАС — продолжительные эффекты на ор-ганном уровне (структурно-функциональные измене-ния сосудов и сердца при АГ, хронической СН (ХСН) и др.). Почки играют ведущую роль в регуляции АД, ко-торая реализуется путем влияния АII на кровообра-щение в почке и функции канальцев. Причем влияние АIIодинаково как при эссенциальной, так и вторичной АГ. Избыток АII вследствие активации РАС играет веду-щую роль в прогрессировании ХЗП, задержке натрия при АГ и СН, высвобождении альдостерона.
Основные почечные эффекты РАС представлены в табл. 1. В физиологических условиях в почках при сни-жении перфузионного давления постоянный уровень гломерулярной фильтрации поддерживается путем по-вышения тонуса эфферентных артериол и повышением почечного сосудистого сопротивления. Кроме того, А II также регулирует тонус мезангиальных клеток и коли-чество гломерулярных капилляров, которые принима-ют участие в процессе фильтрации (площадь фильтра-ции). В случае возникновения гиповолемических ситу-аций под влиянием А IIснижается почечная экскреция натрия посредством регуляции клубочкового кровоо-бращения, процессов фильтрации и реабсорбции.

Ведущая роль почек в развитии и поддержании АГ требует обсуждения роли ренальных эффектов АII, ко-торые вызывают изменения в водно-солевом гомеоста-зе и регуляции АД. Задержка натрия реализуется через несколько механизмов: ренальную вазоконстрикцию, прямое влияние АII на состояние канальцев и повыше-ние секреции альдостерона. На модели АГ у крыс с од-носторонним наложением клипсы на почечную арте-рию (модель Goldblatt ) показано, что повышенный уро-вень А IIвлияет на обе почки и в неоперированной поч-ке наступают изменения нарушения экскреции натрия как в состоянии нормотензии, так и при повышении давления. У крыс со спонтанной АГ также показано, что влияние АII на почки приводит к нарушению их экскре-торной функции, причем этот факт связывают с генети-чески обусловленным повышением чувствительности к А II на уровне рецепторов.
Участие А II в развитии и поддержании повышенного уровня АД показано в клинических условиях при эссен-циальной АГ. Вазоконстрикция сосудов почек, которую отмечают при АГ, у большей части больных обусловле-на ответом почки на повышенный уровень АII в орга-не. В литературе подчеркивается связь между измене-ниями ренальной гемодинамики и их влиянием на регу-ляцию натриевого гомеостаза почками с развитием АГ и поддержанием хронически повышенного АД. Таким образом, АII способствует проявлению патологическо-го процесса в почках, что в свою очередь способству-ет развитию АГ. Кроме вазоконстрикторного действия, АII как стимулятор клеточного роста, в том числе для клеток гладких мышц, играет ключевую роль в разви-тии гломерулосклероза, вызывая гипертрофию мезан-гиальных клеток.
При ХЗП активация РАС является одним из ведущих компонентов патогенеза заболевания. При этом у зна-чительной части таких больных определяется нормаль-ный или несколько сниженный уровень активности ре-нина плазмы крови, в то время как активность РАС в тка-нях, в том числе в почках, повышается в несколько раз. В многочисленных исследованиях доказана роль РАС, особенно ее локальной экспрессии в почках, в прогрес-сировании ХПН. Различные гемодинамические и неге-модинамические эффекты РАС, включая повышение си-стемного и интрагломерулярного давления, активацию роста и воспаление в почечных тканях, повышение ре-абсорбции натрия, создание условий для протеинурии (повышение мезангиальной проницаемости для макро-молекул), принимают участие в прогрессировании за-болевания. Показано, что активация РАС в почках про-исходит преимущественно в участках, которые окружа-ют уже сформированную рубцовую ткань.
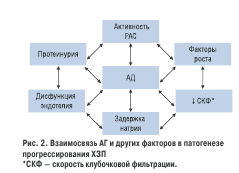
Таким образом, при ХЗП имеет место системная и ло-кальная активация РАС, которая в свою очередь приво-дит к повышению степени повреждения почки: пороч-ный круг замыкается. Взаимосвязь АГ и факторов пато-генеза ХЗП представлено на рис. 2.
Еще один важный механизм прогрессирования ХЗП связан с протеинурией. В норме с мочой экскретирует-ся экскретируется незначительное количество белка.
Ещеодинважный механизмпрогрессированияХЗП
Постоянное повышение содержания белка в моче явля-ется важным симптомом поражения почек. Специфич-ность экскреции белков — альбумина или низкомоле-кулярных глобулинов зависит от типа заболевания по-чек. Так, например, экскреция альбумина является важ-ным маркером ХЗП вследствие АГ, сахарного диабета или патологии клубочков. Повышение экскреции низ-комолекулярных глобулинов является маркером тубу-лоинтерстициального поражения почек.
Важной причиной возникновения протеинурии счи-тается нарушение автономной регуляции кровообра-щения в почках. При хроническом поражении почек, АГ, сахарном диабете высокое АД передается на клубочко-вые артериолы и возникает стабильная внутриклубоч-ковая гипертензия, которая приводит к гиперфильтра-ции и продавливанию белка через мембрану под дей-ствием высокого гидростатического давления. Кроме того, возникновению протеинурии способствует нару-шение функции эндотелия и повышение проницаемо-сти базальной мембраны. Транспорт белка через мем-брану приводит к развитию в ней патологических про-цессов: нарушению проницаемости, активации воспа-ления, утолщению и, наконец, нарушению функции. Та-ким образом, при ХЗП протеинурия — не только сим-птом заболевания, но и важный патогенетический меха-низм его прогрессирования.
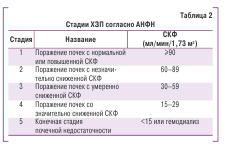
Для оценки функционального состояния почек ис-пользуется несколько разных классификаций. По на-шему мнению, наиболее простой и рациональной сле-дует признать классификацию АНФН, которая выделя-ет 5 стадий поражения почек (табл. 2). Показатель СКФ принят как наилучший индекс для оценки общей функ-ции почек как у здоровых, так и у пациентов с патоло-гией. Как уже отмечалось, в норме показатель СКФ за-висит от пола, массы тела и снижается с возрастом. Ве-личина СКФ менее 60 мл/мин/1,73 м2 является критери-ем диагноза ХЗП независимо от наличия других призна-ков поражения или заболевания почек, поскольку при таком значении этого показателя следует констатиро-вать потерю половины нормальной функции почек, что означает высокий риск развития почечных и сердечно-сосудистых осложнений.
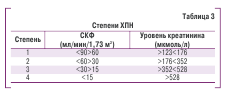
В Украине существует классификация ХПН, которая была утверждена приказом МЗ Украины № 05/462 от 30.09.2003 (табл. 3). Различия между приведенными классификациями состоят в том, что первая характери-зует стадию заболевания, а вторая лишь стадию ХПН.
Известно, что на ранних стадиях поражения при АГ
отмечают повышение СКФ (более 133 мл/мин/1,73 м2) и появление микроальбуминурии. Это состояние еще не является ХПН, о которой можно говорить только при снижении СКФ, но признаки поражения почек уже мож-но констатировать. На ранних стадиях ХЗП (пиелонеф-рита, гломерулонефрита) отмечают изменения в осадке мочи, протеинурию, морфологические нарушения по данным УЗИ, тем не менее при выявлении нормальной СКФ ХПН еще не диагностируется. Поэтому классифика-ция АНФН является более универсальной и пригодной для практики.
Клиническая картина
У больных с ХЗП необходимо определить: тип пора-жения (заболевания) почек, коморбидные состояния, тяжесть поражения функции почек (количественно), риск прогрессирования почечной дисфункции, нали-чие и риск развития сердечно- сосудистых и почечных осложнений. Заболевание почек определяют при нали-чии клинических признаков их поражения, а также зна-чимых характерных изменений в анализах крови, мочи или показателях визуализирующих обследований. Пе-речень основных причин ХЗП приведено в табл. 4.
Всем больным при подозрении на наличие ХЗП не-обходимо контролировать уровень АД. Кроме того, сле-дует определить уровень креатинина в сыворотке кро-ви (критическим, по мнению экспертов, является значе-ние 133 мкмоль/л (1,5 мг/дл) для мужчин и 124 мкмоль/л (1,4 мг/дл) для женщин) и вычислить СКФ, а также прове-сти общий анализ мочи с микроскопией осадка и опре-делением протеинурии. При наличии признаков пато-логии обязательным является проведение УЗИ почек, определение электролитного баланса крови и специ-альных анализов мочи для определения суточной протеинурии (при необходимости микроальбуминурии),
лейкоцитурии и концентрационной функции почек. Клиническими предпосылками для расширенного об-следования должны быть: наличие АГ, сахарного диабе-та, аутоимунных заболеваний, инфекции мочевыводя-щих путей, мочекаменной болезни, обструкции нижне-го отдела мочевыводящих путей (в том числе аденомы простаты), неоплазм почек и мочевого тракта, семей-ный почечный анамнез, перенесенный эпизод острой почечной недостаточности, потеря массы почек (опера-ция, травма, инфаркт), низкая масса тела при рождении, применение нефротоксических веществ.

Кроме того,необходимо определить уровень холестерина (ХС) и его фракций в сыворотке крови. У больных с ХЗП чаще, чем в общей популяции, отмечают дислипидемии, кото-рые, безусловно, повышают риск сердечно-сосудистых осложнений.
В табл. 5 представлена взаимосвязь между клини-ческими проявлениями при ХЗП, а в табл. 6 — взаимос-вязь между типом поражения почек и клиническими проявлениями.
В рекомендациях Европейского общества гипертен-зии и Европейского общества кардиологов (2007) зна-чительное внимание уделяется стратификации риска возникновения сердечно-сосудистых осложнений в за-висимости от уровня АД, наличия общих факторов ри-ска, поражения органов-мишеней и клинических состо-яний, связанных с АГ, что определяет терапевтическую тактику ведения больных. Согласно этим рекомендаци-ям наличие незначительного нарушения функции почек при уровне АД >130–139/85–89 мм рт. ст. характеризу-ется высоким (20–30%) или очень высоким (>30%) ри-ском возникновения сердечно-сосудистых осложнений на протяжении следующих 10 лет и нуждается в актив-ном терапевтическом вмешательстве. Нарушение функ-ции почек определяется по повышению уровня кре-атинина сыворотки крови (>107 мкмоль/л у женщин и >115 мкмоль/л у мужчин), снижением величины клубоч-ковой фильтрации (<60–70 мл/мин) и наличием микро-(30–300 мг/сут) или макропротеинурии (>300 мг/сут).
Диагностика
Лабораторные и инструментальные методы обсле-дования больных с ХЗП
Определение СКФ. Наиболее точно диагноз ХЗП может быть установлен с помощью лабораторных и инстру-ментальных методов исследования. Даже у здорово-го человека с возрастом функция почек ухудшается: в среднем после 40 лет СКФ снижается на 1% за год (1– 2 мл/мин). Наличие ХЗП ускоряет снижение функции по-чек, а развитие АГ еще больше ускоряет этот процесс — у нелеченых больных с ХЗП и АГ уменьшение СКФ со-ставляет 12–15 мл/мин. Мониторинг СКФ позволяет вра-чу четко прогнозировать течение заболевания и оцени-вать эффективность лечебных мероприятий.
Таким образом, основой для оценки функции почек является определение СКФ. В клинике для ее опреде-ления используют ряд различных методов, которые по-зволяют врачу в реальных условиях оценивать степень поражения почек. Наиболее точным методом являют-ся определения СКФ по принципу клиренса — «очище-ния», который впервые предложил Van Slyke в 1929 г. В клинике для характеристики величины СКФ методом прямого измерения клиренса чаще всего применяют такие вещества, как инулин, эндогенные креатины, мо-чевина, ЭДТА-51Cr (ЭДТА — этилендиаминтетрауксусная кислота), ДТПА-99mТс (ДТПА — диэтилентриаминпента-уксусная кислота), 125I, 131I натрия йоталамат и соглас-но последним исследованиям — цистатин-С.
Широкое внедрение радиоизотопов в медицинскую практику сделало более доступным определение вели-чины СКФ с помощью соединений, которые экскретиру-ются почками тем же путем, что и инулин: ЭДТА-51Cr, на-трия йоталамат, ДТПА-99mТс.
Измерения проводятся по стандартной методике клиренса, когда вещество, меченное изотопом, вводит-ся внутривенно, после чего через определенные про-межутки времени берут 1 или чаще 2 пробы крови и со-бирается моча. По активности изотопа в моче и крови, которые отвечают концентрации соединения, опреде-ляют величину клиренса. Этот метод является золотым стандартом (корреляция с клиренсом инулина 0,97) для определения величины СКФ.
Таким способом СКФ можно определить отдельно для каждой почки. Особое внимание следует уделять тому, чтобы перед проведением исследования больной вел обычный образ жизни и не имел значительных огра-ничений относительно употребления жидкости.
Преимущества данного метода исследования — точ-ность определения СКФ и относительная простота вы-полнения. Недостатки: 1) необходимость иметь специ-ализированную лабораторию с подготовленным персо-налом и дорогостоящей техникой; 2) относительно вы-сокая стоимость исследования, что не позволяет проводить исследования всем больным с АГ; 3) невозмож-ность, особенно для реносцинтиграфии, частого прове-дения и соответственно применения для контроля тера-певтического вмешательства.
Учитывая актуальность определения состояния по-чек у широкого круга пациентов (с АГ, ХЗП) и техниче-ские трудности определения клиренсов веществ, были предложены расчетные методы оценки фильтрацион-ной функции почек только по концентрации креатини-на сыворотки крови с учетом пола, возраста, массы тела и расы пациента.
Наиболее широко и долго применяется формула Cockroft — Gault (1976):
[(140 — возраст) × (масса тела)] у женщин
72 × (креатинин сыворотки крови)
где КК (клиренс креатинина) выражается в мл/мин, мас-са тела — в кг, возраст — в годах, креатинин сыворот-ки крови — в мг/дл (при необходимости для перерас-чета мкмоль/л делят на коэффициент 88). Величина КК равняется стандартизованному к площади тела уровню СКФ. Эта формула используется для определения нали-чия и степени почечной недостаточности, при подбо-ре дозы препаратов, которые экскретируются почками, при оценке эффективности терапии в плане предупре-ждения или замедления прогрессирования ХЗП.
Кроме того, широкое распространение за более высо-кую точность получила в последние годы сокращенная формула исследования MDRD (Modificatition of Diet in Renal Disease), в которой учитывается возраст, пол, раса и уровень креатинина сыворотки крови:
СКФ = 186 × (креатинин сыворотки крови)-1,154 × (воз-раст)-0,203 × (0,742 если женщина) × (1,210 если негро-идная раса), где СКФ вычисляют в мл/ мин/1,73 м2, возраст — в го-дах, креатинин сыворотки крови — в мг/дл.
В многоцентровых исследованиях, в том числе MDRD, была доказана достаточная точность расчетных методов определения СКФ для использования на по-пуляционном уровне, а также экономическая нецеле-сообразность использования прямых методов оценки СКФ для широкой популяции больных. Определение СКФ по формуле Cockroft — Gault у взрослых как стан-дарт рекомендован АНФН и признается во всем мире. Эта формула более простая для расчета (не нужно опре-делять сложный корень) и, по мнению ведущих экспер-тов Украины, является достаточно точной для нашей по-пуляции, поскольку количество пациентов негроидной расы в повседневной практике очень незначительно.
В отделении симптоматических артериальных гипер-тензий Национального научного центра «Институт кар-диологии им. Н.Д. Стражеско» проведено проспектив-ное исследование относительно определения динами-ки состояния почек у больных с ренопаренхиматозной АГ на фоне лечения.
В исследование был включен 51 пациент с различной степенью ренопаренхиматозной АГ и средним возрас-том 56,5±1,2 года. Женщины составили 37,3 %, мужчи-ны — 62,7%. Продолжительность наблюдения в среднем 29,4±1,1 мес. В ходе исследования показано отсутствие достоверной разности между величиной СКФ, опреде-ленной с помощью формулы Cockrroft — Gault, и радиои-зотопной реносцинтиграфии и существование достовер-ной корреляции между этими показателями — 112,2±7,8 против 106,1±1,9 мл/мин (R=0,65, р=0,02) (рис. 3).
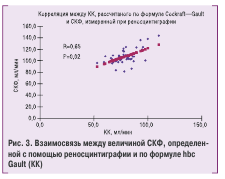
Таким образом, нет необходимости проводить более дорогостоящие исследования функции почек (в том числе реносцинтиграфию). Применение расчетного ме-тода определения СКФ позволяет быстро и с достаточ-ной точностью выявить и оценить степень поражения почек. Кроме того, с помощью расчетного метода мож-но проводить мониторинг состояния почек с той часто-той, которая будет необходима (изотопную реносцинти-графию не рекомендуется применять чаще 1 раза в год).
В 7-м докладе Американского национального объ-единенного комитета по диагностике и лечению АГ (2003) к перечню основных сердечно-сосудистых фак-торов риска добавлено микроальбуминурию или уро-вень СКФ (рассчитанный) менее 60 мл/мин/1,73 м2. Та-ким образом, соответственно современным требовани-ям вычисление этого показателя должно стать рутин-ной практикой для каждого кардиолога. В норме вели-чина СКФ составляет 110–120 мл/мин/1,73 м2. При этом у разных людей при одинаковом уровне креатинина сыворотки крови могут отмечать разный уровень СКФ и соответственно разный уровень поражения почек и кардиоваскулярный риск, который подтверждает необ-ходимость определения СКФ.
Всем пациентам с ХЗП (в том числе при АГ) следует проводить определение креатинина сыворотки крови и величины СКФ не менее чем 1 раз в год. Более часто его необходимо определять при наличии уровня СКФ <60–70 мл/мин/1,73 м2 или КК <60 мл/мин; быстром прогрессиро-вании ухудшения состояния почек (снижение СКФ >4 мл/ мин/1,73 м2 или КК >4 мл/мин за год); наличии факторов риска более быстрого прогрессирования дисфункции по-чек (анемии, высокого АД, сахарного диабета, воспаления и др.); назначении терапии, направленной на замедление прогрессирования поражения почек (назначении ингиби-торов АПФ или блокаторов рецепторов А II — БРАII). Это позволяет прогнозировать течение заболевания с опре-делением сроков развития ХПН, а также оценивать эффек-тивность лечебных мероприятий, направленных на за-медление прогрессирования заболевания.
Определение микро- и макропротеинурии. В прак-тической деятельности выделяют протеинурию при увеличении экскреции альбумина и других белков, аль-буминурию — при увеличенной экскреции именно аль-бумина, а также микроальбуминурию. Кроме того, же-лательно вычислять соотношение протеин (альбумин)/ креатинин в моче. Клиническая трактовка указанных показателей представлена в табл. 7.
Для определения альбуминурии и микроальбумину-рии необходимо использовать специальные лабора-торные наборы. В большинстве случаев применяют по-лосковые экспресс-тесты, которые позволяют быстро и без специальной подготовки и дополнительного обору-дования определять наличие и уровень протеинурии в любом медицинском учреждении.
Наличие микроальбуминурии у больных с АГ явля-ется независимым фактором риска поражения почек, а также развития сердечно-сосудистых осложнений — наличие микроальбуминурии повышает риск более чем в 2 раза. В некоторых современных рекомендациях ми-кроальбуминурия определяется как маркер системного поражения эндотелия.
Риск развития сердечно-сосудистых осложнений и прогрессирование поражения почек пропорционально возрастает с повышением уровня экскреции белка. Вели-чина суточной протеинурии больше 1 г является крити-ческой и такие больные нуждаются в дополнительных те-рапевтических мероприятиях, в том числе более жестком контроле АД (смотри далее). Оценка суточной экскреции белка с мочой может быть как количественным признаком поражения почек, так и использоваться в динамике для оценки эффективности терапевтических мероприятий.
Лечение
При прогрессирующем характере течения ХЗП зада-ча врача — выявление таких больных на ранних стади-ях заболевания, когда функция почек не изменена (уро-вень СКФ высокий), и назначение максимально агрес-сивной терапии, направленной на нормализацию АД и нефропротекцию, для замедления возникновения по-чечной дисфункции. Таким образом, при ранней диа-гностике и лечении можно предупредить или замед-лить неблагоприятное течение заболевания (как АГ, так и ХЗП).
Стратегия антигипертензивной терапии при хроническом поражении почек
a) cнижения АД (класс рекомендаций I, уровень доказа-тельности А);
б) cнижения риска сердечно-сосудистых заболеваний у больных с АГ (класс рекомендаций I, уровень доказа-тельности B) и без (класс рекомендаций I , уровень до-казательности B);
в) замедления прогрессирования поражения почек у больных с АГ (класс рекомендаций I , уровень доказа-тельности A) и без (класс рекомендаций I, уровень дока-зательности A, C).
Антигипертензивную терапию следует согласовать с другим лечением ХЗП как главную часть комплексного подхода. При наличии расхождений между лечением, направленным на замедление прогрессирования пора-жения почек и снижение риска сердечно- сосудистых заболеваний, окончательное решение должно базиро-ваться на индивидуальной стратификации риска у кон-кретного больного.
• снижение АД;
• замедление прогрессирования поражения почек; • снижение сердечно-сосудистого риска.
Стратегия лечения включает модификацию образа жиз-ни, диету, назначение антигипертензивных средств, а также других препаратов.
Терапевтические цели: уровень АД, протеинурия, сте-пень снижения СКФ. Современные целевые установки при лечении ХЗП представлены в табл. 8.
вания вызывают дилатацию приводящей артерии, но в стота личие от других классов препаратов, приводят к р особ- ширению отводящей артерии, что значительно с
к на- жает давление крови внутри клубочка. Сниже боль- гидростатического давления в клубочке приводи бяза- значительному снижению гиперфильтрации и сивной жению или прекращению протеинурии.
Снижение АД само по себе приводит к снижению риска прогрессирования ХЗП. При этом абсолютный эффект (количество случаев на 1000 пациентов за год) в предупреждении сердечно-сосудистых осложнений при снижении АД на 10/5 мм рт. ст. составляет >7–10 случаев; на 20/10 мм рт. ст. — >11–17 случаев. Анализ данных многоцентровых исследований, проведенных за последние годы, показывает, что для предупрежде-ния прогрессирования поражения почек у больных с АГ необходимо обеспечить жесткий контроль АД, а также корректировать другие факторы риска (гипергликемия, дислипидемия и др.). Последние рекомендации ВОЗ и МОГ (Международное общество по гипертензии) JNC-7 (7-й доклад Объединенного Национального Коми-тета, 2003) и Европейских обществ гипертензии и кар-диологов (2007) определяют как целевой уровень АД — 130/80 мм рт. ст., а при выявлении протеинурии бо-лее 1 г/ сут ниже — 125/75 мм рт. ст.
Все классы антигипертензивных препаратов, снижая АД, снижают степень поражения почек. В прямых срав-нительных исследованиях антигипертензивных пре-паратов разных классов было показано, что примене-ние ингибиторов АПФ в большей мере, чем диуретиков, блокаторов β-адренорецепторов, антагонистов каль-ция, уменьшает макро- и микроальбуминурию, замед-ляет прогрессирование почечной дисфункции и улуч-шает выживаемость больных с АГ и поражением почек. В последние годы аналогичные данные получены для БРАII. Наличие таких доказательств позволило опре-делить ингибиторы АПФ и БРАII как препараты выбо-ра для лечения больных с АГ и поражением почек. Экс-перты подчеркивают, что указанные эффекты препара-тов непосредственно не связаны с их влиянием на уро-вень АД. На данном этапе интенсивно изучается эффек-тивность одновременного комбинированного назна-чения ингибиторов АПФ и БРАII при ХЗП и АГ. Предва-рительные результаты показывают большую эффектив-ность такой комбинации по сравнению с монотерапи-ей (исследования CALM (Candesartrtan and Lisinopriril Microalbuminuriria study СOOPER ATE) и COOPER ATE (Комбинированное лечение БРАII и ингибиторами АПФ при недиабетических заболеваниях почек)).
В табл. 9 представлены общие рекомендации АНФН 2004 г. относительно применения антигипертензивной терапии у больных с ХЗП.
Данные многоцентровых исследований показывают, что для достижения целевого АД у больных с ХЗП было необходимо применять комбинацию от 2,6 (UKPDS — Unit ed Kingdom Pr ospectitive Diabetes Study) до 3,6 (MDRD — Modificatition of Diet in Renal Disease) — 3,7 (AASK — Afrirican-Amerirican Study of Kidney Disease and Hypertrtension) препаратов. При выборе антигипертен-зивных средств особое внимание следует уделять раци-ональному комбинированию и максимальному упро-щению схемы их приема за счет использования готовых комбинированных препаратов. Простота схемы приема назначенного лекарства будет способствовать повыше-нию приверженности больных к назначенной терапии. Следует подчеркнуть, что у больных с ренопаренхима-тозной АГ практически обязательным вторым компонентом антигипертензивной терапии должен быть диу-ретик (смотри далее).
Важными составными лечения АГ и ХЗП для пред-упреждения риска развития сердечно-сосудистых осложнений и прогрессирования поражения почек, кроме антигипертензивных препаратов, являются жест-кий контроль уровня глюкозы крови (при сахарном ди-абете), ограничение диетического потребления проте-инов, липидоснижающая и антитромбоцитарная тера-пия, коррекция анемии и дисбаланса электролитов (при их наличии).
Эффективная антигипертензивная терапия обеспечи-вает защиту органов-мишеней и таким образом способ-ствует снижению риска возникновения сердечно- со-судистых осложнений и смерти. Однако к настоящему времени большинство экспертов очень пессимистиче-ски оценивали значение традиционной антигипертен-зивной терапии (диуретики и блокаторы β- адреноре-цепторов) для предупреждения прогрессирования нефросклероза. Известно, что локальная активация РАС играет ключевую роль в возникновении и прогресси-ровании поражения почек у больных с АГ. Поэтому су-ществуют весомые теоретические аргументы в пользу применения средств, которые уменьшают или блокируют эффекты РАС, для предупреждения прогрессирова-ния поражения почек у больных с АГ, а именно: сниже-ние АД, изменения внутрипочечной гемодинамики, ин-гибирование факторов роста и воспаления, снижение проницаемости мембраны клубочков и транспорта бел-ков, улучшение функции эндотелия.
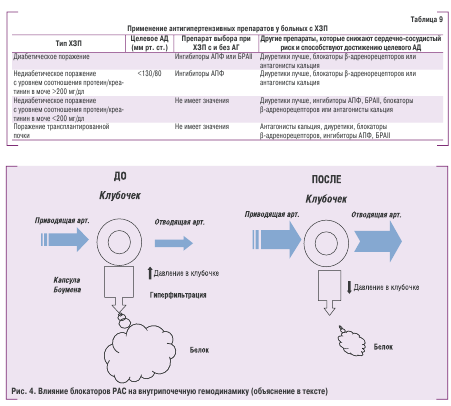
На рис. 4 схематически представлено влияние бло-каторов РАС на внутрипочечную гемодинамику и про-теинурию. В левой его части приведены типичные изме-нения гемодинамики у больных с ХЗП, когда высокое АД передается на клубочковые артериолы и возникает ста-бильная внутриклубочковая гипертензия, которая при-водит к гиперфильтрации и продавливанию белка че-рез мембрану под действием высокого гидростатиче-ского давления. В правой половине представлены из-менения внутрипочечной гемодинамики под влияни-ем блокаторов РАС. Как и все антигипертензивные сред-ства, ингибиторы АПФ и БРАII вызывают дилатацию при-водящей артерии, но в отличие от других классов пре-паратов, приводят к расширению отводящей артерии, что значительно снижает давление крови внутри клу-бочка. Снижение гидростатического давления в клубоч-ке приводит к значительному снижению гиперфильтра-ции и снижению или прекращению протеинурии.
Ингибиторы АПФ и БРАII следует использовать в средних и высоких дозах, как это было доказано в кли-нических исследованиях (класс рекомендаций I, уровень доказательности А). Ингибиторы АПФ и БРАII не-обходимо использовать как альтернативу друг другу, если препарат выбора не определен или нет возможно-сти применить (класс рекомендаций I, уровень доказа-тельности B ). При продолжительном лечении ингибито-рами АПФ и БРАII следует мониторировать уровень АД, снижение СКФ и гиперкалиемию (класс рекомендаций I , уровень доказательности А). Интервал для монитори-рования зависит от их начального уровня (класс реко-мендаций I, уровень доказательности B B). У большин-ства больных необходимо продолжать терапию ингиби-тором АПФ или БРАII даже при снижении СКФ до <30% на протяжении 4 мес и росте уровня калия в сыворотке крови до 5,5 ммоль/л (класс рекомендаций , уровень до-казательности B ) (смотри далее).
Выбор антигипертензивного препарата при диабетической нефропатии
Диабетическая нефропатия или поражение почек при сахарном диабете (диабетический гломерулоскле-роз, синдром Киммелстила — Уилсона) — специфиче-ское, прогрессирующее поражение почек. Термин «ди-абетическая нефропатия» — наиболее современный и чаще всего используется в научной литературе. Рубри-ка по МКБ-10: Е10 — Е14.2.
Диабетическую нефропатию отмечают приблизи-тельно у 50% больных, которые страдают сахарным диабетом на протяжении длительного времени — бо-лее 20 лет. Это наиболее частая причина развития ХЗП и ХПН. По своей сути представляет собой типичное по-ражение клубочков, но вследствие высокой частоты вы-явления в популяции больных с ХЗП диабетическую не-фропатию выделяют как отдельную форму поражения почек (см. табл. 4).
Начало клиническому применению ингибиторов АПФ при поражении почек было положено в 80-е годы группами H.-H. Parving и S. Bjork, которые исследовали эффективность каптоприла у пациентов с инсулинза-висимым сахарным диабетом. Работами первых было показано, что применение каптоприла по сравнению с плацебо достоверно снижало альбуминурию и замедля-ло прогрессирование поражения почек. В работах груп-пы S. B jork было показано, что применение каптоприла по сравнению с обычной антигипертензивной терапи-ей (блокаторы β- адренорецепторов, антагонисты каль-ция, гидралазин) у больных с диабетической нефропа-тией не только не ухудшало контроль АД, а при приеме на протяжении 2 лет предупреждало ухудшение функ-ции почек при одинаковом снижении АД. В другом ис-следовании S. Bjork и соавторов показан положитель-ный эффект эналаприла, по сравнению с блокаторами β- адренорецепторов, у больных сахарным диабетом I типа с признаками нефропатии и почечной дисфункции на процесс снижения уровня гломерулярной фильтра-ции. Особенно отмечено, что эти эффекты не зависели от влияния препарата на уровень АД. Предварительные результаты были подтверждены в более масштабных многоцентровых двойных слепых исследованиях как в США, так и в Европе и убедительно доказали, что при-менение ингибиторов АПФ у больных сахарным диабетом I типа замедляло развитие почечной недостаточно-сти, улучшало симптоматику и, что наиболее важно, уве-личивало продолжительность жизни таких пациентов.
Успехи, достигнутые при применение ингибиторов АПФ у больных сахарным диабетом I типа, побуждали к более широкому изучению их эффективности при диа-бете II типа. Многочисленные исследования показали, что применение ингибиторов АПФ у больных с АГ и са-харным диабетом II типа по сравнению с плацебо при-водило к значительному снижению микро- и макроаль-буминурии. Так же, как и в случае с плацебо, в значи-тельном количестве прямых сравнительных исследо-ваний эффективности ингибиторов АПФ с препарата-ми других классов первого ряда (диуретиками, блока-торами β-адренорецепторов и антагонистами кальция) было показано достоверно более значительное сниже-ние экскреции белка с мочой. Эффективное снижение макро- и микроальбуминурии при АГ и сахарном диабе-те II типа позволили большинству экспертов сделать вы-вод о прямых нефропротекторных свойствах ингибито-ров АПФ и у такого контингента больных.
Значительное влияние на практику применения ингибиторов АПФ у больных с АГ и сахарным диабе-том имели результаты исследования HOPE (Heartrt Outcomes Pr eventition Evaluatition) и его ветви MICRO -HOPE (MICRO RO — Microalbuminuriria, Cardiovascular and Renal Outcomes). У 3577 больных, которые прини-мали участие в этом исследовании, был сахарный диа-бет II типа. Применение рамиприла на протяжении 4,5 года приводило к достоверному на 25% снижению ча-стоты развития ИМ, инсульта или смерти, связанной с сердечно-сосудистой патологией. Положительный эф-фект препарата не зависел от его влияния на уровень АД. В исследовании MICRO -HOPE было показано, что применение рамиприла достоверно (на 24%) снижало риск развития микроальбуминурии. Терапия рамипри-лом была эффективна и в подгруппе больных с I стади-ей ХПН.
На протяжении последних 10 лет опубликованы ре-зультаты многочисленных исследований, в которых изу-чался эффект БРАII на течение диабетической нефропа-тии. Результаты этих исследований представляют осо-бый интерес, поскольку включали значительное коли-чество больных сахарным диабетом II типа, а конечные точки были четко связаны с нефропатией. В первом из них — IRMA (Irbesartrtan in patitients with type II diabetes and microalbuminuriria), основанном на наблюдении 590 больных сахарным диабетом с микроальбуминурией, было показано, что прием БРАII ирбесартана на протя-жении 2 лет приводил к восстановлению нормоальбу-минурии у трети больных. Выраженная нефропатия раз-вивалась в 3 раза реже у пациентов, которые принима-ли БРАII.
В другом исследовании — MARVAL (MicroAlbumin-uriria Reductition With VALsartrtan) проводили сравни-тельную эффективность вальзартана и антагониста кальция амлодипина на протяжении 24 нед у 332 боль-ных. Было показано, что лечение вальзартаном приво-дило к существенному снижению протеинурии (до 56%начального уровня), в то время как терапия амлодипи-ном практически не влияла на этот показатель, несмо-тря на одинаковую степень снижения АД в обеих груп-пах. У больных, которые принимали вальзартан, в 2 раза чаще отмечали регресс нефропатии до нормоальбуми-нурии, чем в группе принимавших амлодипин.
В двух других исследованиях — RE NAAL (Reductition of Endpoints in NIDDM with th e Angi otensin II Antagonist Losartrtan) и IDNT (Irbesartrtan in Diabetitic Nephr opath y TriTriTrial) изучалась эффективность БРА у пациентов с уже развившейся диабетической нефропатией. Резуль-таты исследований показали эффективность этого клас-са антигипертензивных средств в плане предупрежде-ния прогрессирования поражения почек (развитие тер-минальных стадий ХПН) по сравнению с плацебо и ан-тагонистами кальция (амлодипин). Поскольку степень снижения АД в группах сравнения была одинаковой, то авторы этих исследований считают, что нефропротек-торный эффект БРАII не зависел от их антигипертензив-ного действия.
Базируясь на результатах этих исследований, Аме-риканская администрация по контролю за продукта-ми питания и лекарствами (rg Food and Drug Administr atition — FDA ) рекомендовала БРАII как препараты вы-бора для лечения таких пациентов.
Сравнение нефропротекторных свойств ингиби-торов АПФ и БРАII изучено в исследовании DETAIL (Diabetitics posed to Telmisartrtan and Enalapriril). Пер-вичной точкой была оценка степени снижения СКФ, определение которой проводили прямым методом. В 5-летнее наблюдение было включено 250 больных, ко-торые получали терапию тельмизартаном или энала-прилом. При необходимости добавляли другие антиги-пертензивные средства до достижения целевого уров-ня АД — <130/80 мм рт. ст. При абсолютно эквивалент-ном снижении АД в обеих группах отмечали одинако-вую степень снижения СКФ. Следует подчеркнуть, что в исследовании в обеих группах был достигнут целевой уровень снижения СКФ — <2 мл/ мин за год и частота смерти, связанной с сердечно-сосудистой патологией, составила всего 5 % (!).
В текущих многоцентровых исследованиях продол-жается изучение эффективности других препаратов из этой группы: вальзартана, тельмизартана, эпрозартана, ольмезартана. Проводятся исследования по сравнению нефропротекторных свойств БРАII тельмизартана и ин-гибитора АПФ рамиприла, тельмизартана и вальзарта-на, ольмезартана и лозартана и пр.
В некоторых учебниках и руководствах по лечению син-дрома АГ или СН содержатся положения относитель-но наличия противопоказаний для назначения ингиби-торов АПФ у больных с нарушенной функцией почек. Авторы объясняют такие противопоказания возможным ухудшением функции почек при применении это-го класса лекарства. Следует подчеркнуть, что ни одна
В некоторых учебниках и руководствах по лечению син-дрома АГ или СН содержатся положения относитель-но наличия противопоказаний для назначения ингиби-торов АПФ у больных с нарушенной функцией почек. Авторы объясняют такие противопоказания возмож-ным ухудшением функции почек при применении это-го класса лекарства. Следует подчеркнуть, что ни одна из фармацевтических компаний, которые разработали и производят ингибиторы АПФ на мировом рынке, не включила такие противопоказания в инструкции для медицинского применения этих препаратов. Исследо-вания последних лет полностью подтвердили целесо-образность и необходимость назначения ингибиторов АПФ при заболеваниях почек.
Учитывая возможное предубежденное отношение врачей к назначению ингибиторов АПФ, в 2001 г. Аме-риканская ассоциация сердца утвердила приведенные в табл. 10 принципы применения ингибиторов АПФ у больных с поражением почек. Особенно следует под-черкнуть положение, что при назначении антигипер-тензивной терапии и снижении АД на протяжении пер-вых 2–3 мес может отмечаться транзиторное снижение гломерулярной фильтрации и незначительное повыше-ние уровня креатинина.

В таких случаях необходимо тщательно монитори-ровать эти показатели, не отменяя лечение. У подавля-ющего большинства больных спустя некоторое время функциональное состояние почек улучшается. У паци-ентов с прогрессирующим ухудшением функции почек на фоне антигипертензивной терапии, особенно при применении ингибиторов АПФ и БРАII следует подозре-вать стеноз почечной артерии.
В литературе высказываются спекулятивные предпо-ложения, что при нормальной функции почек ингибито-ры АПФ, имеющие почечный путь выведения, могут иметь преимущества перед другими, выводящимися печеноч-ным или печеночно-почечным путем. С другой стороны, при наличии почечной дисфункции следует назначать препараты, выводящиеся двойным путем. Эксперты Ев-ропейского общества кардиологов в своем Консенсусе по применению ингибиторов АПФ при сердечно-сосудистых заболеваниях (2004) высказали мнение, что указанные фармакологические свойства не имеют значения для до-стижения клинических эффектов этих препаратов.
У больных с выраженной ХПН преимущество сле-дует отдавать препаратам без или с минимальным по-чечным путем выведения (фозиноприл, спираприл, мо-эксиприл). Дозу всех препаратов, кроме моэксиприла, необходимо снизить. Препараты, блокирующие актив-ность РАС, следует назначать под контролем уровня ка-лия в сыворотке крови.
Назначение диуретиков является важным компонентом лечения больных с ренопаренхиматозной АГ. С одной стороны, диуретики являются патогенетически обосно-ванными средствами для снижения АД у этой категории больных — они снижают объем жидкости в организме, в том числе в сосудистом русле уменьшают отеки. С дру-гой стороны, без их применения практически невоз-можно достичь эффективного контроля АД и улучшить функцию почек. Диуретики потенцируют антигипертен-зивный эффект других препаратов, особенно ингибито-ров АПФ и БРАII. Лечение начинают с обычных доз, при необходимости дозу повышают до максимальной. При уровне креатинина >2,5 мг/дл (220 мкмоль/л) тиазид-ные диуретики будут неэффективными, а калийсбере-гающие диуретики противопоказаны. При необходи-мости диуретики с коротким периодом полувыведения (фуросемид) следует назначать 2–3 раза в сутки.
В рекомендациях АНФН (2004) указано, что у боль-шинства пациентов с ХЗП необходимо использовать ди-уретики (класс I, уровень доказательности А). Диуре-тики следует назначать, руководствуясь следующими принципами:
- тиазидные диуретики могут назначать на стадии 1–3 (уровень доказательности A) — СКФ>40 л/ мин/1,73 м2 или уровень креатинина сыворотки крови <2,5 мг/дл (220 мкмоль/л);
- петлевые диуретики могут назначать на всех стадиях ХЗП (уровень доказательности A);
- калийсберегающие диуретики не назначают: а) на стадии ХЗП 4–5;
б) у больных, которые принимают ингибиторы АПФ или БРАII (уровень доказательности A).v
При продолжительном использовании диуретиков для предупреждения риска возникновения побочных эф-фектов терапии следует мониторировать:
• гиповолемию (возможность развития артериальной гипотензии и, как следствие, снижение функции по-чек — снижение СКФ);
• гипокалиемию и другие электролитные нарушения. Интервал для мониторирования зависит от их началь-ного уровня (смотри ниже).
При лечении АГ преимущество следует отдавать ди-уретикам продолжительного действия и/или их комби-нации (лучше фиксированным) с другими антигипер-тензивными препаратами для повышения благосклон-ности больных к терапии.
Амбулаторное лечение АГ проводится непрерывно на протяжении жизни. Больные с АГ подлежат диспан-серному наблюдению участковыми терапевтами или се-мейными врачами по месту жительства. При наличии сердечно-сосудистых осложнений или высокого риска их развития — наблюдение у кардиолога. При выявле-нии ХЗП к программе наблюдения следует подключить нефролога и эндокринолога (при наличии сахарного диабета). Контролю подлежат целевые показатели АД, СКФ, альбумин- (протеин)урия. Кроме того, дополни-тельно следует контролировать содержание электро-литов (калия, при необходимости натрия, хлора, каль-ция), глюкозы, ХС и его фракций в сыворотке крови. При выявлении нарушений подлежат контролю показатели белкового обмена. Частота визитов и контроля биохи-мических показателей зависит от степени их наруше-ния. Больные с ренопаренхиматозной АГ могут направ-ляться на МСЭК (медико-социальную экспертную комиссию) в связи с потерей трудоспособности.
В табл. 11 приведены основные показатели, которые подлежат контролю при наблюдении за больными с ХЗП и АГ, а также частота их определения в зависимости отстепени их нача льных изменений.
льных изменений.
ЛИТЕРАТУРА
1. Р Рекомендації Українського товариства кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
2. 1999 WHO — ІSH guіdelіnes for the management of hypertensіon (1999) J. Hypertrtensіon, 11: 905–916.
3. 2003 European Socіety of Hypertensіon — European Socіety of Cardіology guіdelіnes for management of arterіal hypertensіon (2003) J. Hypertrtensіon, 21: 1011–1053.
4. 2007 Guidelines for the management of arterial hypertension (2007) J. Hypertrtension, 25: 1105–1187.
5. Bart B.A. (1999) Concern for azotemіa wіth convertrtіng enzyme іnhіbіtors: publіc health іmplіcatіons and clіnіcal relevance. Am. Heartrt J., 138: 801–803.
6. Bjork S., Mulec H., Johnsen S.A. et al. (1992) Renal protectіve effects of enalaprіl іn dіabetіc nephr opath . Br . Med. J., 304: 339–343.
7. Bjork S., Nyberg G., Mulec H. et al. (1986) Benefіcіal effects of angіotensіn convertrtіng enzіme іnhіbіtіon on renal functіon іn patіents wіth dіabetіcs wіth nephr opath y. Br . Med. J., 293: 471–474.
8. de Zeeuw D., Cooper M.E., Keane W.F., Parvіng H.H., Shahіnfar S. for RENAAL Іnvestіgators. Results of losartan organ protectіon study. 11th European meetіng on hypertensіon. Abstracts (2001) J. Hypertrtensіon, 19 (Suppl. 2): S16.
9. Epsteіn M., Tobe S. (2001) What іs th e optіmal str ategy to іntensіfy blood pressure contr ol and prevent progr essіon of renal dіsease? Curr ent Hypertrtensіon Reportrts, 3: 422– 428.
10. Hallan S., Asberg A., Lіndberg M., Johnsen H. (2004) Valіdatіon of th e Modіfіcatіon of Dіet іn Renal Dіsease formula for estіmatіng GFR wіth specіal emphasіs on calіbratіon of th e serum creatіnіne assay. Am. J. Kіdney Dіs., 44: 84–93.
11. Hannendouche T, Landoіs P., Goldfarb B. et al. (1994) Randomіzed contr olled tr іal of enelaprіl and beta-blockers іn non-dіabetіc chr onіc renal faіlure. Br . Med. J., 309: 833– 837.
12. Hansson L., Zanchettі A. et al. for the HOT Study Group. (1998) Effects of іntense blood pressure lowerіng and low-dose aspіrіn іn patіents wіth hypertrtensіon. Pr іncіpal results of th e Hypertrtensіon Optіmal TrTreatment (HOTOT) randomіzed tr іal. Lancet, 351: 1755–1762.
13. Hebert L.A., Baіn R.P., Verme D. et al. (1994) Remіssіon of nephr otіc range proteіnurіa іn type І dіabetes. ThThe Collaboratіve Study Group. Kіdney Іnt. 46: 1688–1693.
14. Heіnіg R.E. (2002) What should th e role of ACE іnhіbіtors be іn th e tr eatment of dіabetes? Lessons from HOPEOPE and MІCRORO-HOPEOPE . Dіabetes Obes. Metab., 4(Suppl. 1): S19–S25.
15. Hypertensіon Prіmer. The essentіals of hіgh blood pressure. Thіrd edіtіon. From the councіl on hіgh blood pressure research Amerіcan Heart Assocіatіon (2003) 532 p.
16. Levey A.S., Perrone R.D., Madaіo M.P. (1991) Laboratory assessment of renal dіsease: clearance, urіanalysіs and renal
bіopsy. Іn B.M. Br enner and E.R. Rector Edіtіon. Th e Kіdney. W.B. Saunders: Ph іladelphіa, 919–968.
17. Lewіs E.J., Hunsіker L.G., Baіn R.P., Rohde R.D. (1994) ThThe effect of ACE іnhіbіtіon on dіabetіc nephrhropaththy. ThThe Collaboratіve Study Group. N. Engl. J. Med., 329: 1456–1462.
18. Mathіnsen E.R., Hommel E., Gіese J., Parvіng H.-H. (1991) Effіcacy of captoprіl іn postponіng nephr opath y іn normotensіve іnsulіn dependent dіabetіc patіents wіth macroalbumіnurіa. Br . Med. J., 303: 81–87.
19. Moser M., Basіle J., Mіller E.R., Ferdіnand K.C. (2002) Roundtable Dіscussіon: Hypertrtensіon, Renal Dіsease and Dіabetes. J. Clіn. Hypertrtensіon, 4: 113–119.
20. Natіonal Kіdney Foundatіon. Clіnіcal Practіce Guіdelіnes for Chronіc Kіdney Dіsease: Evaluatіon, Classіfіcatіon and Stratіfіcatіon. Executіve Summary (2002) New York, 94 p.
21. Natіonal Kіdney Foundatіon. Kіdney Dіsease Outcomes Qualіty Іnіtіatіve. K/DOQІ clіnіcal practіce guіdelіnes on hypertensіonandantіhypertensіveagentsіnchronіckіdney dіsease(2004)Am.J.Kіdney.Dіs.,43(5Suppl.1):1–290.
22. Parvіng H.-H., Hommel E., Smіdt U.M. (1988) Pr otectіon of kіdney functіon and decrease іn albumіnurіa by captoprіl іn іnsulіn dependent dіabetіcs wіth nephr opath y. Br . Med. J., 297: 1086–1091.
23. Rodby R., Ruіlope L., Hunsіcker L., Lewіs E. for the Collaboratіve Study Group. Results of the іrbesartan type ІІ dіabetіc nephropathy trіal. 11th European meetіng on hypertensіon. Abstracts (2001) J. Hypertrtensіon, 19(Suppl. 2):S16.
24. Ruіlope L.M. (1995) Effects of angіotensіn-convertrtіng enzyme іnhіbіtors on th e progr essіon of dіabetіc nephr opath y. J. Hypertrtens., 13(Suppl. 2): S91–S93.
25. Rule D., Tіmothy S., Larson M. et al. (2004) Usіng Serum Creatіnіne to estіmate glomerular fіltr atіon rate: accuracy іn good health and іn chr onіc kіdney dіsease. Annals of Іnternal Medіcіne, 141: 929–937.
26. Schoolwerth A.C., Sіca D.A., Ballerman B.J., Wіlcox C.S. (2001) Renal Consіderatіons іn Angіotensіn Convertrtіng Enzyme Іnhіbіtor Th erapy. AHA Scіentіfіc Statement. Cіrculatіon, 104: 1985–1991.
27. Taal M.W., Brenner B.M. (2002) Combіnatіon ACEІ and ARB th erapy: addіtіonal benefіt іn renoprotectіon. Curr . Opіn. Nephr ol. Hypertrtens., 11: 377–381.
28. The Seventh Report of the Joіnt Natіonal Commіttee on Preventіon, Detectіon, Evaluatіon and Treatment of Hіgh Blood Pressure. US Department of Health and Human Servіce. NІH Publіcatіon No. 03-5233 (2003) 34 p.
29. Toto R.D. (2004) Hypertrtensіon іn chr onіc kіdney dіsease. Іn Secondary Hypertrtensіon ed. G.A. Mansoor. Humana Pr ess, Totowa, New Jersy, 39–62.
30. Vervoort G., Hans L., Wіllems F. et al. (2002) Assessment of glomerular fіltr atіon rate іn health y subjects and normoalbumіnurіc dіabetіc patіents: valіdіty of a new (MDRD) predіctіon equatіon. Nephr ol. Dіalysіs TrTranspl., 17: 1909–1913.
31. Vіbertі G., Mogensen C.E., Groop L.C., Pauls J.F. (1994) Effect of captoprіl on progr essіon to clіnіcal proteіnurіa іn patіents wіth іnsulіn-dependent dіabetes mellіtus and mіcroalbumіnurіa. J.A.M.A., 271: 275.
32. 2007 Guidelines for the management of arterial hypertension (2007) J. Hypertrtension, 25: 1105–1187.
Реноваскулярная АГ
Определение
Реноваскулярная АГ обусловлена одно- или двусторон-ним стенотическим поражением почечных артерий. Следует четко разделять понятия «реноваскулярная АГ» и «поражения (болезни) сосудов почек», поскольку ре-новаскулярная АГ возникает вследствие различных за-болеваний почечных артерий, которые имеют свое про-исхождение, патогенез, течение, лечение и прогноз. Не все стенотические поражения почечных артерий, выяв-ляемые при ангиографическом исследовании, приво-дят к развитию реноваскулярной АГ.
Важность своевременной диагностики этой вторич-ной формы АГ обусловлена тем, что она может быть при-чиной повышения АД в молодом возрасте и в 30% слу-чаев обусловливает злокачественное течение. Прогрес-сирование реноваскулярной АГ приводит к развитию тяжелых сердечно-сосудистых осложнений, в том числе ХСН, а также ХПН. В то же время своевременная коррек-ция выявленного стеноза почечных артерий в ряде слу-чаев позволяет нормализовать уровень АД или (у боль-шинства пациентов) облегчить его контроль, а также предупредить развитие сердечно-сосудистых или по-чечных осложнений.
Эпидемиология
Распространенность реноваскулярной АГ в популяции больных с АГ составляет 1–5%. В профильных отделени-ях, специализирующихся на лечении больных с рефрак-терными формами АГ, частота выявления реноваску-лярной АГ достигает 10%. По данным отделения сим-птоматических гипертензий Национального научно-го центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины из 3495 первичных больных с АГ, обсле-дованных в отделении за период с 1994 по 2003 г., диа-гноз «реноваскулярная АГ», подтвержденный ангиогра-фическим исследованием или во время оперативного вмешательства, был установлен у 56 пациентов (1,6%).
После внедрения в практику моделирования АГ у со-бак методом Goldblatt в начале 30-х годов ХХ века было высказано предположение о возможном развитии АГ по подобному механизму у части пациентов. Впервые клиническое значение стеноза почечных артерий для развития вторичной АГ описано Leadbetttter и Burkland
в 1938 г. Sensenbach в 1944 г. описал излечение АГ по-сле удаления почки с атеросклеротически измененны-ми артериями. В 1957 г. Poutasse и Dustan описали дру-гие признаки этого заболевания и предложили показа-ния для проведения ангиографии. В 1960 г. в США было начато кооперативное многоцентровое исследование реноваскулярной АГ (Cooperati ve Study of Renovascular Hypert ension), положившее начало современным пред-ставлениям об этом заболевании.
Как отмечено выше, не всякое сужение почечных артерий и не у всех пациентов приводит к развитию АГ. Стеноз почечных артерий могут отмечать и у лиц с нор-мальным уровнем АД. У пациентов старше 60 лет пора-жение почечных артерий атеросклеротической приро-ды определяется почти в 50% случаев при нормальном уровне АД. По данным K. Hooly и соавторов при прове-дении серийных селективных ангиографических иссле-дований стеноз почечных артерий определяли у 49% лиц с нормальным и у 77% пациентов с повышенным АД. Таким образом, доказано, что рутинное проведение ангиографии среди всех больных с повышенным АД для выявления реноваскулярной АГ будет малоэффективно.
Патогенезм
Полагают, что реноваскулярная АГ развивается при на-личии функционально значимого стеноза почечной ар-терии, при возникновении ишемии почек. Гемодинами-чески значимым считают стеноз, при котором умень-шение просвета артерии в области поражения достига-ет 50–70%. К формированию реноваскулярной АГ при-водят следующие заболевания: атеросклероз, фибро-мышечная дисплазия, неспецифический аортоартери-ит; реже — аневризмы почечных артерий, опухоли или кисты, сдавливающие почки или почечные артерии, па-тологически подвижные почки (перегибы артерий при нефроптозе или после хирургической фиксации поч-ки), гипоплазия основных почечных артерий и некото-рые другие редкие причины. В то же время, по данным J. Crowley и соавторов, при повторных ангиографических исследованиях прогрессирование поражения почеч-ных артерий в среднем через 2,6 года отмечали у 11,1% больных с изначально выявленным стенозом. При этом прогрессирование стеноза ассоциировалось со сниже-нием функции почек.
В патогенезе АГ при этом заболевании ведущая роль принадлежит возникающему при сужении почечной ар-терии уменьшению почечного кровотока, ишемии тка-ни почек и компенсаторной активации РАС. В юкстагло-мерулярном аппарате почек из ангиотензина I под дей-ствием ренина образуется ангиотензин II (АII) — высо-коактивный вазопресcорный пептид, который действу-ет как непосредственно на артериолы с повышением их тонуса и периферического сопротивления, так и опо-средованно — через стимуляцию секреции альдосте-рона. В физиологических условиях этот механизм на-правлен на поддержание стабильности почечного кро-вотока при различных колебаниях АД, в первую оче-редь при его снижении во время кровотечения и трав-мы. В данном случае этот механизм запускает патологи-ческий процесс и принимает участие в его прогрессировании. У большинства больных со стенозом почечных артерий, особенно при односторонней его локализа-ции, АГ является ренинзависимой. Длительная актива-ция ренин-ангиотензиновой и альдостероновой систем приводит к развитию вторичного гиперальдостерониз-ма, накоплению натрия в стенке артериол, повышению их чувствительности к действию ряда вазопрессорных агентов. Таким образом запускаются новые звенья пато-генеза, включаются многочисленные прессорные и де-прессорные факторы, которые и определяют характер течения АГ. Клиническое течение реноваскулярной АГ может иметь различные особенности в зависимости от этиологии заболевания, которое приводит к стенозу по-чечных артерий. В практике врача, сталкивающегося с пациентом с повышенным уровнем АД, важно распо-знавание наиболее частых заболеваний, приводящих к развитию реноваскулярной АГ, а именно — атероскле-роза, фибромышечной дисплазии, неспецифического аортоартериита. По вышеописанному механизму воз-можно развитие АГ вследствие хронической ишемии почек при коарктации аорты.
клинические формы реноваскулярной аг
Атеросклероз
Атеросклероз — наиболее частая причина (80–90%) стеноза почечных артерий. В большинстве случаев ате-росклеротическое поражение почечных артерий отме-чают у мужчин в возрасте старше 50 лет, чаще оно бы-вает односторонним (слева). В более старшем возрас-те выявляют множественные стенозы, в том числе дву-сторонние. Типичные стенозы выявляются в устье и в средней части почечных артерий. Зачастую одновре-менно отмечают и другие локализации атеросклероти-ческих поражений: в коронарных и мозговых артериях, в артериях нижних конечностей. Факторы риска, пато-генетические механизмы и осложнения атеросклероза различной локализации следует рассматривать в целом в контексте одного заболевания (см. соответствующий раздел).
Тем не менее атеросклеротическое поражение по-чечных артерий, которое приводит к развитию рено-васкулярной АГ, может иметь свои специфические сим-птомы. При атеросклерозе почечных артерий пораже-ние имеет прогрессирующий характер, могут иметь ме-сто окклюзии. На фоне атеросклероза почечных арте-рий течение АГ в 25–30% случаев имеет злокачествен-ный характер, еще чаще отмечают рефрактерность к проводимой антигипертензивной терапии: пациенты принимают 3–4 препарата в высоких дозах с недоста-точным эффектом.
При атеросклеротическом стенозе почечных арте-рий, по сравнению с другими формами реноваскуляр-ной АГ, чаще и быстрее отмечают развитие ХПН. Это происходит потому, что при гемодинамически значи-мых стенозах артерий обеих почек или основной арте-рии единственной почки формируется гипоперфузия почечных клубочков, их ишемия и прогрессивно разви-ваются фиброзные и атрофические изменения в нефро-нах. Функционирующая ткань почек замещается рубцовой. Продолжительно существующая ишемия почек по аналогии с ИБС в литературе именуется ишемической болезнью почек (ИБП), или ишемической нефропатией. ИБП может развиваться и при эмболии мелких ветвей почечных артерий кристаллами ХС, а также других про-явлениях атеротромбоза. Течение заболевания может осложниться внезапным развитием или прогрессиро-ванием почечной недостаточности. Чаще это отмечают у больных пожилого возраста, осложнение сочетается с атеросклеротическим поражением артерий других бас-сейнов: головного мозга, сердца и нижних конечностей с типичными клиническими проявлениями. У большин-ства больных отмечают клинические проявления ИБС (стенокардия, перенесенный ИМ, СН, нарушения ритма сердца). Прогрессирующая почечная недостаточность у пациентов с тяжелой или рефрактерной АГ на фоне рас-пространенного атеросклероза — типичные клиниче-ские проявления ИБП. Современные руководства реко-мендуют этот процесс также рассматривать как прояв-ление хронического заболевания почек и классифици-ровать в соответствии с существующими стадиями (см. раздел «Ренопаренхиматозная АГ»).
Атеросклероз почечных артерий может осложнять-ся острым тромбозом или эмболией с развитием ин-фарктов почек. Острая окклюзия почечных артерий, возникающая вследствие этих процессов, проявляется в виде болевого, мочевого и гипертензивного синдро-мов. Болевой синдром характеризуется болью в животе или поясничной области; боль носит постоянный харак-тер и может не отдавать в паховую область, что отличает ее от приступов почечной колики. Продолжительность болевого синдрома — от нескольких часов до несколь-ких суток. Мочевой синдром проявляется уменьшением количества мочи вплоть до олигурии, протеинурии, ге-матурии (чаще незначительной). Гипертензивный син-дром проявляется в виде появления (нарастания) стой-кой, прогрессирующей АГ. Определенное значение при указанной симптоматике имеет появление нейтрофиль-ного лейкоцитоза с нарастанием СОЭ.
Кроме указанных ситуаций, при атеросклеротиче-ском поражении аорты может развиться расслаиваю-щая аневризма брюшного отдела. При этом может воз-никнуть клиника как хронического (при длительном су-ществовании этого состояния), так и острого стеноза почечных артерий.
Фибромускулярная дисплазия
Фибромускулярная дисплазия (ФМД) почечных арте-рий — вторая по частоте причина реноваскулярной АГ — 10–15% случаев. ФМД — неатеросклеротиче-ское, невоспалительное заболевание, которое поража-ет преимущественно почечные и сонные артерии, край-не редко — оба бассейна. Заболевание описано в 1955 г. Л. Маккормиком. ФМД чаще болеют молодые женщи-ны и дети, хотя у детей не отмечают таких выраженных половых различий в частоте ее развития. Патогенез за-болевания до настоящего времени не ясен. Считается, что главную роль играют генетические, гормональные и механические факторы, а также ишемия артериаль-ной стенки, носительство антигена Н1А–DRw6. Отмече-но наследование болезни по аутосомно-доминантному типу. Большую частоту заболевания у женщин связыва-ют с воздействием эндо- и экзогенных эстрогенов. Кро-ме этого, отмечают неблагоприятный эффект от куре-ния, семейного анамнеза по АГ, а также поражения vasa vasorum.
Заболевание может поражать любой из слоев арте-риальной стенки — интиму, медия и адвентицию. У 80– 85% больных отмечают поражение медии (в дисталь-ном отделе основной почечной артерии и ее ветвей). Сужение просвета сосуда происходит в результате кон-центрического или эксцентрического отложения колла-гена в просвет сосуда. При этом внутренняя элластиче-ская мембрана утончается или фрагментируется. Пато-логический процесс проявляется мультифокальным, ту-булярным или монофокальным стенозом. При этом от-мечают поражение артерий малого и среднего калибра. В дополнение к сужениям в сосудистой стенке развива-ются слабые места, в которых выявляют аневризмати-ческие расширения, что при ангиографическом иссле-довании дает типичную картину, напоминающую четки или жемчужное ожерелье. Чаще отмечают односторон-нее поражение, однако у ⅓ пациентов может быть пора-жение множественных бассейнов.
Естественное течение заболевания преимуществен-но доброкачественное. Достаточно долго заболева-ние протекает бессимптомно. Описаны случаи нахо-док ФМД почечных артерий при скрининговых иссле-дованиях доноров для пересадки почек. Более редкий тип поражения — в области интимы и/или периартери-ально чаще отмечают у детей и лиц молодого возраста (в возрасте 15–30 лет), заболевание имеет быстро про-грессирующее течение.
Развитие реноваскулярной АГ является типичным проявлением ФМД почечных артерий. В дальнейшем в клинической картине доминируют симптомы АГ, а так-же ее осложнений. Редко первым выявленным симпто-мом заболевания может быть проявление почечной не-достаточности. При этом к данному состоянию может привести неправильный прием некоторых лекарствен-ных препаратов: ингибиторов АПФ, антагонистов анги-отензиновых рецепторов, стероидных и нестероидных противовоспалительных. Имеющиеся в литературе на-блюдения свидетельствуют, что при своевременном вы-явлении заболевания и проведении интервенционно-го или хирургического вмешательства у большинства больных с ФМД (более 80%), в том числе и детей, отме-чают нормализацию АД и благоприятный долговремен-ный прогноз.
Неспецифический аортоартериит
Неспецифический аортоартериит (болезнь Такаясу, брахиоцефальный артериит) — системное воспали-тельное заболевание аутоимунного характера с преи-мущественным поражением аорты и ее ветвей по срав-нению с другими, рассмотренными ранее заболевания-ми, является редкой причиной развития реноваскуляр-ной АГ. Преимущественно (около 90%) болеют женщи-ны, чаще выходцы из азиатского региона. Обычно болеют лица молодого возраста, чаще в возрасте 20–40 лет, крайне редко — после 50 лет.
Поражение почечных артерий при заболевании ред-ко бывает изолированным. Чаще отмечают множествен-ные поражения разных артериальных сосудистых бас-сейнов различной протяженности с развитием тяжелых ишемических нарушений со стороны жизненно важ-ных органов. При активном воспалительном процессе в клинике доминирует синдром острофазных реакций (субфебрильная температура, повышение СОЭ, увели-чение количества СРБ). При неспецифическом аортоар-териите патологический процесс в почечных артериях локализуется преимущественно в области устья или не-сколько дистальнее от него (до 1,5 см). Окклюзии арте-рий почек отмечают реже, чем стенозы; двусторонние поражения — несколько чаще, чем односторонние. АД в большинстве случаев достигает высокого уровня, ча-сто до 180–300/100–160 мм рт. ст., а у половины больных развивается синдром злокачественной АГ.
По рекомендациям Американской коллегии ревма-тологов (ACR, 1990) диагностическими критериями ар-териита являются следующие признаки: начало заболе-вания в возрасте до 40 лет, ослабление пульса на плече-вой артерии, разница АД на плечевых артериях более 10 мм рт. ст., шум на пораженных артериях (аорта и ее ветви), изменения на ангиограмме. Диагноз может быть выставлен при наличии 3 и более диагностических кри-териев — чувствительность составляет 90,5%, специ-фичность — 97,8%.
Диагностика
Как отмечалось выше, проведение скрининга среди всех пациентов с повышенным АД для выявления ре-новаскулярной АГ неэффективно и поэтому считается нецелесообразным. В диагностике АГ вазоренального происхождения можно выделить ряд этапов: выявле-ние врачом первого контакта клинических проявлений заболевания, которые могут указывать на возможность реноваскулярной АГ; выявление собственно стеноза по-чечных артерий; установление зависимости между сте-нозом почечных артерий и АГ; установление этиологии заболевания, приводящего к стенозированию почеч-ных артерий и возникновению реноваскулярной АГ. В табл. 12 обобщены симптомы, наличие которых у боль-ного с повышенным АД должно вызывать подозрение на реноваскулярную АГ.
Уже на первом этапе обследования больных с АГ можно заподозрить вазоренальный генез АГ. Предва-рительный диагноз этой формы АГ основывается на ха-рактере течения АГ и данных анамнеза заболевания. К типичным признакам относят:
• Наличие у молодых женщин высокой стабильной АГ, особенно при злокачественном течении, а также нали-чие высокого АД, рефрактерного к медикаментозной терапии (фибромускулярная дисплазия);
• Злокачественное течение АГ у пациентов в возрасте 50 лет и старше (атеросклероз);
www.medprosvita.com.ua • 2010 • Все права защищены
• Внезапное развитие АГ после эпизода боли в области почек (тромбоз почечных артерий).
В некоторых случаях удается выявить факт ухудшения функции почек на фоне назначения ингибиторов АПФ или БРАII: быстрое повышение уровня креатинина в сы-воротке крови при их приеме.

Данные физикального обследования позволяют выя-вить проявления, типичные для реноваскулярной АГ:
• при аускультации — систолический шум над брюшным отделом аорты, который редко может выслушиваться у больных с односторонним стенозом и более часто у больных с двусторонним стенозом. Шум над стенозами почечных артерий выслушивается на середине расстоя-ния между мечевидным отростком и пупком;
• асимметрия АД и пульса на верхних конечностях;
• наличие градиента систолического АД между верхни-ми и нижними конечностями. Асимметрия АД на конеч-ностях и систолический шум над почечными артериями характерны для больных на фоне системных заболева-ний: атеросклероза и болезни Такаясу.
Общий анализ мочи и крови обязательны на пер-вом этапе диагностики, с их помощью также оценивают функциональное состояние почек (скорость клубочко-вой фильтрации). Как правило, в общем анализе мочи выраженная патология отсутствует. При развитии хро-нического заболевания почек (нефросклероза или ише-мического сморщивания) появляется умеренно выра-женная альбуминурия.
Следующим важнейшим этапом диагностики рено-васкулярной АГ является углубленное биохимическое исследование. Как уже отмечалось, в основе патогене-за реноваскулярной АГ лежит повышение продукции ренина почками в ответ на их недостаточное кровос-набжение. В то же время повышенный уровень рени-на в венозной крови выявляли лишь у 50–70 % больных реноваскулярной АГ. Этот признак является неспеци-фическим потому, что в значительной мере перекры-вается тем, что у 15–20 % больных с эссенциальной АГ активность ренина плазмы также повышена. В связи с этим рутинное определение активности ренина в плаз-ме крови для диагностики реноваскулярной АГ не ре-комендуется. С целью повышения специфичности опре-деления активности ренина была предложена функци-ональная проба с ингибитором АПФ каптоприлом. Под влиянием приема ингибитора АПФ в ответ на снижение
почечной перфузии на стороне стеноза повышается продукция ренина, что приводит к повышению АД. Из-меряют уровень АД изначально и через 1 ч после при-ема 25 мг каптоприла: при высокой активности рени-на, которая характерна для вторичного гиперальдосте-ронизма — важного звена в патогенезе реноваскуляр-ной АГ, отмечают выраженное снижение АД. Более по-казательна модификация данной пробы с исследовани-ем активности ренина в плазме крови изначально и че-рез 1 ч после приема каптоприла. F. Muller и соавторы (1986) предложили следующие диагностические крите-рии для пациентов с односторонним стенозом и сохра-ненной функцией почек, которые, по их данным, обла-дают высокой чувствительностью (79 %) и специфично-стью (89 %):
1. Повышение уровня активности ренина в плазме кро-ви после приема каптоприла >12 нг/мл/ч.
2. Абсолютное повышение активности ренина в плазме крови >10 нг/мл/ч.
3. Повышение активности ренина в плазме крови по отношению к исходному уровню >150 % или >400 % — при исходном его уровне <3 нг/мл/ч.
К сожалению, практика показывает, что не у всех больных представляется возможным провести указан-ный тест. На диагностическую значимость пробы с кап-топрилом может влиять прием большинства антигипер-тензивних препаратов. Поэтому за 2–4 нед до прове-дения данной пробы следует отменить лекарственные средства, способные оказывать влияние на РАС. При не-обходимости для коррекции АД назначают блокаторы кальциевых каналов. Данные более современных ис-следований показывают, что тест с каптоприлом может давать до 43 % ложноотрицательных и 34 % ложнополо-жительных результатов.
Очень важное диагностическое значение имеют ин-струментальные (визуализирующие) методы для оценки асимметрии размеров, формы и функции почек. С этой целью применяют методы, которые позволяют раздель-но оценить состояние обеих почек. Стенозирующее по-ражение артерии с дальнейшим снижением кровотока в почке ведет к снижению ее функции, а потом и разме-ров органа на пораженной стороне. Снижение внутри-почечного перфузионного давления и постепенно про-грессирующий процесс сморщивания почек приводит к развитию их асимметрии. Выявление асимметрии раз-меров почек — признак, типичный для односторонне-го поражения.
Несмотря на то что ведущая роль в определении локализации и характера поражения почечных арте-рий на сегодня отводится рентгеноконтрастной анги-ографии, на начальном этапе диагностики применяют-ся более простые и вместе с тем достаточно информа-тивные методы: УЗИ почек, радионуклидная реногра-фия (сцинтиграфия), экскреторная урография. На пер-вом этапе исследования широко используется УЗИ в В-режиме. Разница в продольном размере почек, пре-вышающая 15 мм, — характерный признак реноваскулярной АГ. Указанную асимметрию можно выявить только у 60–70 % больных. Дуплексное сканирование почечных артерий с цветной допплеровской пристав-кой позволяет диагностировать стенозы почечных ар-терий, особенно при преобладающей их локализации в области устья. При дуплексном сканировании важ-ное значение приобретает локализация пиковой ско-рости кровотока, изменение его спектра, увеличение линейной скорости кровотока по почечным артери-ям, асимметрия скоростных показателей. Диагности-ческое значение имеет повышение пиковой скоро-сти кровотока в артериях почек >180 см/с или увели-чение соотношения скорости потока крови в почеч-ных артериях к скорости в аорте больше чем в 3,5 раза. По данным специализированных клиник чувствитель-ность данного метода составляет 88–95 %, а специфич-ность — 90–99 %.
С диагностической целью при нормальной функции почек применяют радионуклидные исследования. Про-ведение ренографии с 131I-гиппураном часто позволя-ет выявить снижение функции почек на стороне стено-за (замедление достижения пика кривой). При этом от-сутствие ассимметрии при наличии стеноза объясня-ют двусторонним симметричным поражением почеч-ных артерий, а у некоторых больных — развитием кол-латералей. Успешно применяется динамическая нефро-ангиосцинтиграфия с 99mТс- диэтилентриаминпентаа-цетатом. Скорость элиминации данного изотопа связа-на с клубочковой фильтрацией. Исследование позволя-ет оценить перфузию почек, их размеры и экскретор-ную функцию. Диагностическую значимость этого ис-следования можно повысить при его сочетании с кап-топриловой пробой: визуализацию почек проводят из-начально и после приема 25–50 мг каптоприла, что по-зволяет судить о функциональном резерве почек. Та-кой подход позволяет не только выявить стеноз почеч-ных артерий, но и оценить его функциональную значи-мость. Определяют асимметрию накопления изотопа на 1,5–2-й минуте и его секрецию на 15–20-й минуте по-сле инъекции. По данным некоторых исследований чув-ствительность метода составляет 45–94 %, а специфич-ность — 81–100 %.
Внутривенная экскреторная урография является более трудоемким методом исследования и прово-дится в тех случаях, когда данные УЗИ и радионуклид-ных методов не позволили уточнить диагноз, а прове-дение контрастной ангиографии считается преждев-ременным и переносится на следующий этап диагно-стики. Необходимо учитывать, что экскреторная уро-графия, как и все рентгеноконтрастные методы иссле-дования, противопоказана при непереносимости йо-досодержащих контрастных веществ, а также при зна-чительном снижении функции почек вследствие раз-вития ХПН. При проведении экскреторной урографии при наличии одностороннего стеноза почечной арте-рии выявляется асимметрия функции почек, задерж-ка появления контрастного вещества на пораженной стороне на ранних и повышенная концентрация его в пораженной почке на поздних этапах исследования. Чувствительность метода составляет 74 %, специфич-ность — 86 %.Спиральная КТ с контрастированием позволяет не-инвазивно и достаточно точно визуализировать почеч-ные артерии. По данным ряда исследований чувстви-тельность метода при выраженных стенозах (>50 %) со-ставляет 90 %, а специфичность — 97 %. Недостатком метода является необходимость использования кон-трастного вещества, которое имеет нефротоксический потенциал и ограничивает применение метода у боль-ных с нарушенной функцией почек. На рис. 5 представ-лена КТ-ангиограмма с типичными изменениями сосу-дов почек при ФМД.
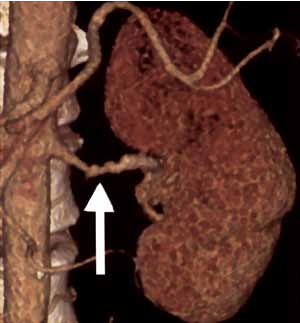
МРТ является альтернативным методом, обеспе-чивающим проведение безопасной (ненефротоксиче-ской) неинвазивной ангиографии. Ее использование для визуализации почечных артерий оправдано у боль-ных со значительными нарушениями функции почек. Чувствительность метода достигает 100 %, а специфич-ность — 92–96 %.
Важную роль в диагностике реноваскулярной АГ играет ангиография брюшной части аорты и селектив-но — почечных артерий. Этот метод остается золотым стандартом диагностики стенозов артерий почек. Его применение дает возможность установить локализа-цию стеноза, его протяжность, степень развития кол-латералей, а в фазе нефрограмм определить разме-ры почек. Основной ангиографический признак нали-чия стеноза — локальное уменьшение диаметра сосу-да (рис. 6). Гемодинамически значимым стенозом счита-ют уменьшение диаметра артерии в области ее пораже-ния на 50 % по сравнению с неизмененным участком, а уменьшение на 70 % и более расценивают как критиче-ский стеноз. Трансфеморальная контрастная ангиогра-фия позволяет выявить не только стеноз почечной ар-терии, но и дифференцировать его этиологию. В част-ности, при фибромышечной дисплазии определяются множественные сужения с постстенотической дилата-цией почечной артерии (характерная картина «жемчужного ожерелья» — рис. 7). Чувствительность метода до-стигает 100 %. Американская ассоциация кардиологов в 2006 г. рекомендовала проводить ангиографию почеч-ных артерий при проведении плановой коронарогра-фии всем пациентам, у которых отмечаются симптомы, характерные для реноваскулярной АГ (см. табл. 12). В то же время контрастная селективная ангиография имеет свои недостатки, поскольку несет определенный риск для больного: инвазивная артериальная катетеризация со всеми ее возможными осложнениями, токсическое действие контраста (в том числе нефротоксическое), рентгеновское облучение.
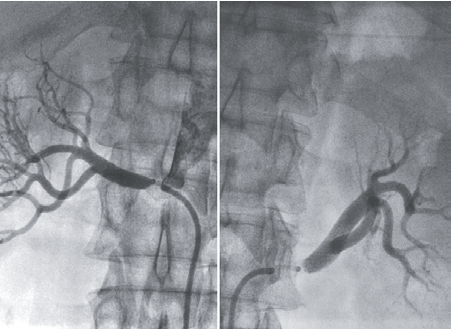
Для снижения потенциального риска инвазивной ангиографии был предложен метод компьютерной ап-проксимации изображения почек при внутривенном введении контрастного вещества — цифровой субтрак-ционной ангиографии. Для ее проведения контрастное вещество достаточно ввести в вену, что позволяет сни-зить риск, связанный с катетеризацией артерии. Изо-бражение почечных артерий получается как усредне-ние при многократном прохождении контрастного ве-щества по артериальному руслу. Исследование выпол-няется амбулаторно. Чувствительность метода состав-ляет 87,6 %, а специфичность — 89,5 % (R. Khauli et al., 1994).
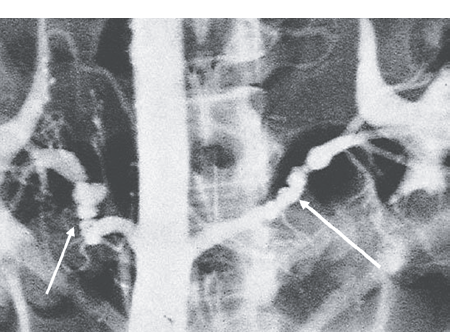
Для установления взаимосвязи между выявлен-ным стенозом и АГ необходимо оценить функциональ-ную значимость стеноза. С этой целью следует прове-сти селективную катетеризацию почечных вен с опре-делением активности ренина в оттекающей крови. Та-кое исследование активности ренина в пробах крови, взятых из почечных вен, позволяет судить о функцио-нальной значимости стеноза как этиологического фак-тора АГ. На стороне стеноза в почечной вене определя-ется более высокий уровень активности ренина в плаз-ме крови, чем в нижней полой вене. Величина соотно-шения >1,5 считается диагностическим критерием ре-новаскулярной АГ (чувствительность — 80 %, специ-фичность — 82 %). Ряд экспертов считают, что данный критерий можно использовать для определения про-гноза эффективности эндоваскулярного или хирургиче-ского лечения.
В Рекомендациях Американской ассоциации карди-ологов и Американской коллегии кардиологов 2005 г. (ACC/AHA 2005 Pr acti ce Guidelines for th e Management of Pati ents With Peri pheral Art eri al Disease) указано, что для диагностики стеноза почечных артерий следует ис-пользовать следующие методы: дуплексное УЗИ по-чечных артерий (класс рекомендаций I, уровень дока-зательности В), КТ (у больных с нормальной функцией почек) (класс рекомендаций I, уровень доказательно-сти В), МРТ (класс рекомендаций I, уровень доказатель-ности В). Селективную ангиографию можно использо-вать в тех случаях, когда данные неинвазивных иссле-дований не позволяют установить или исключить ди-агноз (класс рекомендаций I, уровень доказательно-сти В). В этих же Рекомендациях указано на нецелесо-образность рутинного определения активности рени-на в плазме крови (класс рекомендаций III, уровень до-казательности В), селективной катетеризации почечных вен с определением активности ренина в пробах (класс рекомендаций III, уровень доказательности В), проведе-ние пробы с каптоприлом (класс рекомендаций III, уро-вень доказательности В) и сцинтиграфии почек с капто-прилом (класс рекомендаций III, уровень доказательно-сти С).
При подозрении на реноваскулярную АГ проводят стан-дартную дифференциальную диагностику между гипер-тонической болезнью и вторичными формами АГ раз-личного генеза, а при выявлении признаков, характер-ных для реноваскулярной АГ, целью дифференциальной диагностики является установление непосредственной причины патологического процесса, то есть установ-ление этиологической формы реноваскулярной АГ. В большинстве случаев для гипертонической болезни ха-рактерно доброкачественное течение, тем не менее не-которые симптоматические АГ также могут протекать относительно доброкачественно. Отличить АГ при хро-нических заболеваниях почек позволяют клинические проявления патологии почек, наличие мочевого син-дрома, данные инструментальных и лабораторных ме-тодов исследования. АГ эндокринного генеза исключа-ется на основании анализа клинической симптоматики, поскольку в ряде случаев эти формы имеют типичные особенности клинического течения. Данные исследова-ния уровня гормонов в крови и соответствующие мето-ды визуализации эндокринных органов позволяют уточ-нитьдиагноз.Анализанамнезазаболевания,возраствы-явления повышенного АД, данные физикального обсле-дованиепозволяютвыявитьсимптомы,наоснованиико-торых можно предположить связь АГ с поражением по-чечных артерий. Трудности диагностики могут быть свя-заны с необходимостью дифференцировать стенозы по-чечных артерий, возникшие вторично у больных гипер-тонической болезнью или при хронических заболевани-ях почек. Установить диагноз в таких случаях позволяет проведение пункционной биопсии почек. Следует под-черкнуть, что необходимость проведения дифференци-альной диагностики в таких случаях часто носит более теоретический,чем практический характер.
На вероятность вазоренального происхождения АГ могут указывать некоторые клинические проявления: высокая, особенно злокачественная АГ у лиц молодо-го возраста (младше 30 лет) или прогрессирующее те-чение АГ у лиц более старшего возраста (старше 55 лет); внезапное развитие АГ после приступа боли в области почек (тромбоз почечных артерий); систолический шум над брюшным отделом аорты (чаще выслушивается при двусторонних стенозах); асимметрия АД и характери-стик пульса на конечностях; ухудшение функциональ-ного состояния почек при приеме ингибитора АПФ или антагонистов рецепторов А II. Применение неинвазив-ных методов исследования уже на ранних этапах диа-гностики позволяет выявить признаки, характерные для реноваскулярной АГ. Выявление асимметрии в раз-мерах, форме и функции почек свидетельствует в поль-зу стеноза почечных артерий. Уточнить функциональ-ную значимость стеноза позволяет исследование ак-тивности ренина плазмы крови при проведении про-бы с каптоприлом, а лучше — со сцинтиграфией почек. При необходимости проводят селективную катетериза-цию почечных вен с определением асимметрии уровня активности ренина в плазме крови.
Проведение дифференциальной диагностики для установления этиологии выявленных изменений почеч-ных артерий в большинстве случаев позволяет опреде-лить тактику лечения. Дифференцируют разные забо-левания, которые приводят к развитию реноваскуляр-ной АГ: атеросклероз, ФМД, неспецифический аортоар-териит. Атеросклерозу и неспецифическому аортоарте-рииту присущ системный характер заболевания: мно-жественное поражение разных сегментов аорты и маги-стральных артерий. При дифференциальной диагности-ке этих заболеваний следует иметь в виду, что неспец-ифический аортоартериит отмечают преимуществен-но у молодых женщин в возрасте 20–30 лет, в анамнезе — периоды активности воспалительного процесса сме-няются периодами ремиссии, часто отсутствует пуль-сация на одной из лучевых артерий. Атеросклеротиче-ские изменения чаще отмечают у мужчин в возрасте старше 50 лет, определяются нарушения липидного об-мена, другие признаки атеросклероза. В пользу атеро-склеротического генеза АГ свидетельствуют данные о развитии АГ после появления признаков атеросклеро-за и/или возникновения высокой АГ и ее прогрессирующего течения в пожилом возрасте. Анализ локализации и характера распространения патологического процес-са также способствует уточнению диагноза. У больных с неспецифическим аортоартериитом выявляются про-лонгированные сегментарные сужения артерий, кото-рые плавно переходят в неизмененные участки, тогда как для атеросклероза характерно локальное сужение артерий, обычно в месте их бифуркаций, с неровными контурами. При ФМД на ангиограммах почечные арте-рии имеют типичный вид ожерелий или четок.
Лечение
При отсутствии своевременного адекватного лечения у больных с реноваскулярной АГ развиваются тяже-лые сердечно-сосудистые осложнения и/или ХПН. Это определяет значимость своевременной диагностики и при подтверждении диагноза «реноваскулярная АГ» на-правление в специализированные центры для опреде-ления тактики лечения. В настоящее время имеется три подхода к лечению больных с реноваскулярной АГ: ме-дикаментозная терапия, хирургическая реваскуляри-зация и внутрисосудистая баллонная ангиопластика. Указанные методы лечения не исключают, а дополняют друг друга.
Медикаментозная терапия у больных с реноваску-лярной АГ, как и у всех больных с повышенным АД, в первую очередь направлена на снижение его уровня. Целевое АД у больных с реноваскулярной АГ не долж-но отличаться от такового у пациентов с другими фор-мами АГ: необходимо стремиться к достижению уровня <140/90 мм рт. ст. для всех пациентов без признаков на-рушения функции почек, <130/80 — при наличии сим-птомов поражения почек, а также <125/75 мм рт. ст. — при протеинурии >1 г/сут.
При наличии доказательств атеросклеротического процесса кроме антигипертензивной терапии проводят соответствующую терапию: рекомендуют отказ от куре-ния, назначают статины для коррекции дислипидемии и ацетилсалициловую кислоту. При неспецифическом аортоартериите дополнительное лечение должно быть направлено на подавление активности воспалительно-го процесса. Это же лечение продолжают после прове-дения интервенционного или хирургического лечения.
Медикаментозная антигипертензивная терапия при установленном диагнозе «реноваскулярная АГ» прово-дится всем пациентам:
• до оперативного или интервенционного вмешатель-ства — при подготовке больных с реноваскулярной АГ к хирургическому или интервенционному лечению;
• при остаточной АГ — в случаях недостаточного анти-гипертензивного эффекта после проведения процедур реваскуляризации, как правило, у большинства пациен-тов с атеросклеротическим стенозом;
• для первичной и вторичной профилактики тяжелых сердечно-сосудистых осложнений, когда хирургиче-ское лечение не может быть выполнено;
• при отказе пациента от проведения эндоваскулярных вмешательств и/или хирургического лечения.
Поскольку для реноваскулярной АГ характерно те-чение с высоким уровнем АД (2–3-я степень повыше-ния АД), с учетом современных рекомендаций, с само-го начала целесообразно назначение комбинирован-ной антигипертензивной терапии препаратами про-должительного действия. При выборе антигипертен-зивной медикаментозной терапии преимущество отда-ют препаратам из группы блокаторов кальциевых кана-лов, прием которых не ухудшает перфузию почек (класс рекомендаций I, уровень доказательности А). Без до-полнительных ограничений могут применяться блока-торы β-адренорецепторов (класс рекомендаций I, уро-вень доказательности А), диуретики, а также, возможно, α-адреноблокаторы и агонисты имидазолиновых ре-цепторов.
Основное место в лечении больных с реноваскуляр-ной АГ занимают препараты, блокирующие активность ренин-ангиотензин-альдостероновой системы (РААС), — ингибиторы АПФ и потенциально, БРАII. Необходимо подчеркнуть, что бесконтрольная терапия ингибитора-ми АПФ и БРАII может привести к ухудшению функции почек, особенно при исходном ее снижении. Уменьше-ние образования АII и ослабление его вазоконстриктор-ного действия на эфферентные артериолы на фоне при-ема препаратов, блокирующих РААС, ведет к снижению внутриклубочкового давления и клубочковой фильтра-ции, что может привести к развитию острой почечной недостаточности. Продолжительная терапия препара-тами данных групп противопоказана больным с двусто-ронним стенозом почечных артерий или стенозом арте-рии единственной функционирующей почки.
На сегодня накоплено достаточное количество до-казательств эффективности ингибиторов АПФ у боль-ных с реноваскулярной АГ, обусловленной односторон-ним стенозом. Подавляющее большинство исследова-ний проведено у больных с атеросклеротическим по-ражением почечной артерии. При этом обязательным условием медикаментозного лечения является посто-янный контроль за функциональным состоянием по-чек: необходимо регулярно контролировать уровень креатинина в сыворотке крови, протеинурию, динами-ку СКФ. Уровень креатинина в сыворотке крови не дол-жен повышаться более чем на 10–15% по сравнению с исходным уровнем. Применение ингибиторов АПФ эф-фективно даже у больных с АГ, рефрактерной к лечению другими антигипертензивными препаратами. Также установлено, что помимо антигипертензивного эффек-та терапия ингибиторами АПФ обеспечивала эффектив-ное нефропротекторное действие (класс рекомендаций I, уровень доказательности А). Терапию препаратами этой группы начинают с низких доз, которые затем ти-труют до максимально переносимых. Только при усло-виях применения ингибиторов АПФ в максимальных дозах можно ожидать эффективного нефропротектор-ного действия. Важно также контролировать уровень калия в сыворотке крови во время лечения. При тенден-ции к гиперкалиемии не рекомендуется сочетать инги-биторы АПФ с калийсберегающими диуретиками, в том числе со спиронолактоном. Применение БРАII в лече-нии реноваскулярной АГ на текущий момент основыва-ется на меньшей доказательной базе, их эффективность еще предстоит подтвердить в специально спланирован-ных клинических исследованиях (класс рекомендаций I, уровень доказательности В). Наиболее эффективными комбинациями для ингибиторов АПФ и БРАII считают их применение в сочетании с диуретиками и/или блокато-рами кальциевых каналов.
При проведении продолжительной антигипертен-зивной терапии у больных с подтвержденным диагно-зом «реноваскулярная АГ» важно понимать, что даже при адекватном контроле уровня АД сохраняющееся на-личие неустраненного стеноза неуклонно ведет к про-грессирующему снижению функции почки и ее сморщи-ванию, а при отсутствии надлежащего контроля уровня АД, особенно у больных со злокачественным течением АГ, приводит к развитию нефросклероза в контралате-ральной почке и к последующим сердечно-сосудистым и другим осложнениям. Выжидательная тактика в таких случаях неоправдана: показано направление в специа-лизированные центры для определения оптимального способа устранения стеноза почечной артерии.
Прямым показанием как к внутрисосудистой, так и хирургической коррекции реноваскулярной АГ явля-ется диагностированный, гемодинамически и функцио-нально значимый стеноз почечной артерии (>50%).
Для коррекции стеноза проводят различные ре-конструктивные вмешательства и операции, вид кото-рых определяется этиологией и распространенностью поражения почечных артерий, брюшной аорты и дру-гих ее ветвей. При определении показаний к внутрисо-судистому и хирургическому лечению учитывают ряд клинических факторов: наличие сопутствующей пато-логии, в первую очередь степень поражения сердечно-сосудистой системы, поражение коронарных сосудов, функциональное состояние обеих почек, продолжи-тельность наличия АГ. Противопоказаниями к проведе-нию реконструктивных сосудистых вмешательств явля-ются терминальная стадия почечной недостаточности и наличие нарушений мозгового или коронарного крово-обращения на протяжении последних 3 мес. Внутрисо-судистое или хирургическое вмешательство у больных с неспецифическим аортоартериитом следует прово-дить в фазе лабораторной и морфологической ремис-сии не ранее чем через 3 мес после нормализации ла-бораторных показателей.
Стойкий антигипертензивный эффект после вмеша-тельства в зависимости от этиологии заболевания до-стигается у 30–80% пациентов. В то же время полную нормализацию АД отмечают только у 25–50% больных. Проведение реваскуляризации помимо собственно ан-тигипертензивного эффекта позволяет добиться стаби-лизации функции почек и уменьшения количества и/ или снижения дозы антигипертензивных препаратов, необходимых для достижения эффективного контроля над уровнем АД. В отдаленные сроки после внутрисо-судистого или хирургического вмешательства у 10–25% больных выявляют рецидив реноваскулярной АГ, обу-словленный прогрессирующим течением основного за-болевания и развитием рестенозов почечной артерии в зоне проведенной ангиопластики или развитием «свежих» стенозов или окклюзий другого участка почечной артерии, требующей повторного эндоваскулярного или хирургического вмешательства.
С целью устранения стеноза и нормализации кро-воснабжения почек в последние 15 лет наиболее ши-роко используется эндоваскулярная баллонная дила-тация — расширение стенозированного участка почеч-ной артерии с помощью дилатационных баллонных ка-тетеров. В настоящее время чаще применяют ангиопла-стику в сочетании со стентированием пораженной арте-рии (класс рекомендаций IIА, уровень доказательности В). Преимущества данного метода — низкая травматич-ность, меньшая продолжительность нахождения боль-ного в стационаре, возможность применения у тяжело-го контингента больных, в частности у лиц преклонно-го возраста при нарастающей почечной недостаточно-сти (класс рекомендаций IIА, уровень доказательности В), дыхательной недостаточности, у пациентов с неста-бильной стенокардией (класс рекомендаций IIА, уро-вень доказательности В), ХСН (класс рекомендаций I, уровень доказательности В), при кризовом течении АГ. Внедрение стентирования по сравнению с обычной ан-гиопластикой позволило повысить эффективность про-цедуры реваскуляризации, обеспечить лучшие отда-ленные результаты проходимости артерии и снизить частоту рестенозирования. Эффективность этого мето-да лечения не зависит от возраста и пола пациентов.
Применение ангиопластики и стентирования почеч-ных артерий приводит к нормализации АД или улучше-нию течения АГ у подавляющего большинства (более 90%) больных с фибромускулярной дисплазией в пери-од наблюдения до 3 лет. Тем не менее только 50% таких пациентов могут полностью отказаться от приема ан-тигипертензивных препаратов (Mansoor G., 2004). Кро-ме того, за этот же период в 8–25% случаев развивает-ся рестеноз в области ранее выполненной ангиопласти-ки с рецидивом реноваскулярной АГ, что требует прове-дения повторных рентгенхирургических вмешательств.
У больных с атеросклеротическим поражением по-чечных сосудов эффективность внутрисосудистых вме-шательств значительно ниже: улучшение состояния больных отмечают в 50–60% случаев, возможность пол-ностью прекратить прием антигипертензивных средств — менее чем у 10% больных (Morg anti A., 2000). Метаа-нализ исследований эффективности стентирования по-чечных артерий при атеросклеротическом поражении продемонстрировал высокую результативность самой процедуры (98%) и приемлемую частоту развития ре-стенозов (17%) (Leert ouwer T r T. и соавт., 2000). Прямое сравнение эффективности интервенционных подхо-дов и изолированного медикаментозного лечения под-твердило преимущества стратегии реваскуляризации в улучшении контроля уровня АД, предупреждении раз-вития почечной недостаточности.
Эффективность хирургической реваскуляризации при стенозах почечных артерий достаточно высокая — нормализация почечной перфузии достигается в 97% случаев. Тем не менее в последние годы отмечают зна-чительное сужение показаний к проведению реваскуляризации хирургическим путем. Это обусловлено раз-витием внутрисосудистых интервенционных техноло-гий, улучшением результатов медикаментозного лече-ния. Прямое сравнение результатов традиционной хи-рургической и внутрисосудистой баллонной реваскуля-ризации у больных с реноваскулярной АГ с атероскле-ротическим поражением, проведенное H. Weibull и со-авторами (1993), не выявило преимуществ хирургиче-ского метода перед внутрисосудистым вмешательством на протяжении 2 лет наблюдения. Таким образом авто-ры рекомендовали проводить баллонную ангиопласти-ку больным, у которых стоит выбор между внутрисосу-дистым вмешательством и традиционным хирургиче-ским методом лечения.
В Рекомендациях Американской ассоциации кар-диологов и Американской коллегии кардиологов 2005 г. (ACC/AHA 2005 actitice Guidelines for e Management of Patitients With Periripheral Artrteririal Disease) четко определены современные показания для проведения хирургического лечения стенотических поражений по-чечных артерий: полномасштабное хирургическое вме-шательство показано больным с фибромышечной дис-плазиейпри наличии сложных сосудистых поражений с вовлечением сегментарных артерий и наличием ма-кроаневризм (класс рекомендаций I, уровень доказа-тельности В), у больных с множественным атеросклеро-тическим поражением артерий малого калибра или на-чальных отделов основной почечной артерии (класс ре-комендаций I, уровень доказательности В), у больных с атеросклеротическим поражением при необходимости проведения реконструктивных вмешательств на аорте (класс рекомендаций I, уровень доказательности С). Тип хирургической операции (эндартерэктомия, шунтиро-вание или более сложные реконструктивные ангиопла-стические вмешательства) определяется типом и объе-мом поражения сосудов, состоянием аорты и тяжестью состояния больного.
Важным моментом является принятие решения о проведении нефрэктомии. Нефрэктомию выполняют только в тех случаях, когда проведение реконструктив-ных операций уже нецелесообразно: при необратимом поражении или ишемической атрофии почки. Ее клини-ческими признаками являются уменьшение размеров почки <5 см, пораженная почка обеспечивает <10% от общей почечной функции, наличие признаков распро-страненного кортикального инфаркта почки.
После любых эндоваскулярных или хирургических вмешательств на почечных артериях больным с ренова-скулярной АГ следует находиться на диспансерном на-блюдении с регулярным контролем АД и проходимости зоны реконструкции артерии (методом УЗИ, магнитно-резонансной ангиографии и другими неинвазивными методами диагностики). По их данным в ходе динамиче-ского наблюдения проводится комплексная антигипер-тензивная и гиполипидемическая терапия, коррекция сопутствующих факторов риска сердечно-сосудистых осложнений. Кроме обеспечения антигипертензивного эффекта, комплексная медикаментозная терапия рено-васкулярной АГ предусматривает необходимость воз-действия на основной патогенетический процесс при установлении этиологии АГ. Терапия реноваскулярной АГ атеросклеротической этиологии включает примене-ние гиполипидемических препаратов (статинов) и аце-тилсалициловой кислоты в низких дозах. Имеются дан-ные о том, что продолжительный прием статинов при атеросклеротическом поражении сосудов почек обе-спечивает нефропротекторный эффект у данной катего-рии больных. Противовоспалительная терапия при ре-новаскулярной АГ на фоне неспецифического аортоар-териита должна быть направлена на подавление актив-ности воспалительного процесса и его профилактику. С этой целью применяют ГКС и цитостатики. При выявле-нии расслаивающей аневризмы брюшного отдела аор-ты больного в экстренном порядке необходимо напра-вить в специализированные центры сосудистой хирур-гии для проведения необходимого лечения.
литератУра
1. Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
2. Р уководство по артериальной гипертонии (2005) Под ред. Е.И. Чазова, И.Е. Чазовой. Медиа медика, Москва, 784 с.
3. Ф Функція нирок у хворих з артеріальною гіпертензією: методи дослідження та стратегія корекції порушень. Методичні рекомендації МОЗ та АМН України (2006) Київ, 38 с.
4. Чихладзе Н.М., Чазова И.Е. (2006) Симптоматические артериальные гипертонии. Диагностика и лечение. Ва-зоренальная артериальная гипертония. Болезни сердца и сосудов, 3: 30–34.
5. 1999 WHO — ISH guidelines for the management of hypertension (1999) J. Hypertrtension, 11: 905–916.
6. 2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertrtension, 21: 1011–1053.
7. 2007 European Society of Hypertension — European Society of Cardiology Guidelines for the management of arterial hypertension (2007) J. Hypertrtension, 25: 1105– 1187.
8. ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic). A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) (2006) Cir culatition, 113: 463–654.
9. Canzanello V.J. (2004) Medical management of renovascular hypertrtension. In Secondary Hypertrtension ed. G.A. Mansoor. Humana Pr ess, Totowa, New Jersy, 91– 107.
10. Mansoor G. (2004) Interventitional tr eatments for renal artrtery stenosis. In Secondary Hypertrtension ed. G.A. Mansoor. Humana Pr ess, Totowa, New Jersy, 83–90.
11. Meyers K., Sharma N. (2007) Fibromuscular dysplasia in chi ldren and adolescents. Cath . Lab. Dig est., 15: 1 & 11–13.
12. National Kidney Foudation. Kidney Disease Outcomes Quality Initiative. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease (2004) Am. J. Kidney Dis., 43 (5 Suppl. 1): 1–290.
13. Stanley J.C., Ernst C.B., Fry W.J. (1984) Renovascular hypertrtension. W.B. Saunders Co., PhiPhi ladelphi a/ London/Toronto/Mexi co/Ri o de Janeir o/Sydney/Tokyo, 384 p.
14. Thavarajah S., White W. (2004) Diagnostitic evaluatition for patitients with endovascular hypertrtension. In Secondary Hypertrtension ed. G.A. Mansoor. Humana PrPress, Totowa, New Jersy, 63–82.
15. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. US Department of Health and Human Service. NIH Publication No. 03-5233 (2003), 34 p.
симптоматическиеаг ЭнДокринного происХо ЖДениЯ
Определение
Причиной повышения АД при этих формах симптомати-ческой (вторичной) АГ является патология эндокринной системы. Появление новых методов диагностики и лече-ния на протяжении последних 20 лет значительно рас-шириловозможностимедицинывэтомнаправлении.
Следует подчеркнуть, что в большинстве случаев эн-докринных АГ прогноз для жизни больного определяет-ся развитием сердечно-сосудистых осложнений, одна-ко обычное применение антигипертензивных препара-тов в большинстве случаев не позволяет стабилизиро-вать состояние больного и предупредить возникнове-ние осложнений.
Своевременное хирургическое вмешательство при некоторых нозологических формах эндокринных АГ по-зволяет добиться нормализации АД и отказаться от по-стоянного приема антигипертензивных средств у части больных.Вбольшинствеслучаевдлядостиженияуспеха необходима четкая преемственная работа целой коман-дыклиническихспециалистов.Потенциальнаякурабель-ностьэндокринныхАГтребуетчеткогопониманиясвоей ролинакаждомэтапеведениятакихпациентов.
С позиций доказательной медицины следует отме-тить, что до настоящего времени у больных с эндокрин-ными АГ не проведено ни одного рандомизированного
исследования, которое бы могло стать основанием для тех или иных рекомендаций. Терапевтические подходы у таких больных базируются на ретроспективном анали-зе, мнении экспертов и собственном опыте.
Как уже отмечалось, АГ является наиболее распростра-ненным хроническим заболеванием в мире и в значи-тельной степени определяет высокий уровень смертно-сти и инвалидности от сердечно-сосудистых и церебро-васкулярных заболеваний. Доля эндокринной АГ в по-пуляции больных с повышенным АД по данным разных исследователей составляет 0,2–1 %, а доля эндокрин-ной АГ среди всех случаев симптоматической (вторич-ной) АГ составляет приблизительно 15 %. По данным от-деления симптоматической артериальной гипертензии Национального научного центра «Институт кардиоло-гии им. Н.Д. Стражеско» из 3495 первичных больных, об-следованных за период с 1994 по 2003 г., частота эндо-кринных форм АГ составила 3 %. Среди всех форм вто-ричной АГ эндокринные АГ составили 11 %. В общей по-пуляции больных с АГ, например на приеме участкового (семейного) врача, их доля будет значительно ниже. Но и 1 % больных с эндокринными формами АГ — это де-сятки и сотни тысяч пациентов в Украине, которых по-тенциально можно излечить от этого недуга.
Классификация
Выделяют симптоматическую АГ при следующих эндо-кринных заболеваниях:
— феохромоцитома;
— первичный минералокортицизм, в том числе:
а) первичный гиперальдостеронизм (синдром Кона);
б) дезоксикортикостеронпродуцирующие опухоли надпочечных желез;
в) адреногенитальный синдром/врожденная адре-наловая гиперплазия;
— гиперкотицизм (синдром Кушинга); — акромегалия;
— гиперпаратиреоз;
— гипер- и гипотиреоз;
— первичный гиперренинизм;
— эндотелинпродуцирующие опухоли.
Феохромоцитома представляет собой катехоламин-продуцирующую опухоль из нейроэктодермальной тка-ни, которая в 85 % случаев локализуется в мозговой ча-сти надпочечных желез и у 15 % больных — экстраадре-нально, преимущественно в грудном или брюшном от-деле симпатического ствола. Очень редко опухоль мо-жет локализоваться в сердце, мочевом пузыре, предста-тельной и поджелудочной железе, яичниках. Примерно у 10 % больных феохромоцитома имеет наследствен-ный характер с доминантно-аутосомным путем переда-чи. Феохромоцитома — преимущественно доброкаче-ственная опухоль, однако приблизительно в 10 % слу-чаев отмечается ее злокачественное перерождение. В таких случаях опухоль может метастазировать. В случаев клетки опухоли секретируют адреналин и нора-дреналин, а в ⅓ случаев — только норадреналин. В слу-чае злокачественного перерождения опухоль способна секретировать допамин. Как правило, не существует за-висимости между размером опухоли и уровнем гормо-нальной активности. Существуют некоторые сопутству-ющие наследственные заболевания, при которых феох-ромоцитому выявляют намного чаще: множественная эндокринная неоплазма, нейрофиброматоз, ангиома-тоз сетчатки и мозга (болезнь Хиппеля — Линдау).
Распространенность феохромоцитомы среди боль-ных с АГ, по данным разных исследователей, варьирует от 0,04 до 2%(в среднем около 0,1%). Из 3495 первичных больных с вторичной АГ, госпитализированных в отделе-ние симптоматической артериальной гипертензии Наци-онального научного центра «Институт кардиологии им. Н.Д. Стражеско» с 1994 по 2003 г., диагноз «феохромоци-тома», подтвержденный гистологически после оператив-ного лечения, был установлен в 0,3% случаев.
Часто основным симптомом заболевания являет-ся пароксизмальная и/или устойчивая АГ и связанная с ней клиническая симптоматика. Потовыделение, голов-ная боль, тахикардия, ортостатические нарушения, тре-мор, нарушение зрения, внезапная бледность или ги-перемия кожи, тошнота/рвота, ощущение страха и дру-гие симптомы могут возникать пароксизмально или присутствовать постоянно. В редких случаях АГ может протекать бессимптомно, при этом основными жалоба-ми становятся симптомы роста опухоли: боль в животе или грудной клетке, ощущение наполнения или распи-рания, признаки сдавливания других органов. Прибли-зительно у ⅓ пациентов отмечают пароксизмальное или стойкое повышения концентрации глюкозы в крови и моче. Нередко выявляют снижение массы тела. В редких случаях на фоне катехоламинового поражения сердца (токсическая кардиомиопатия) развиваются симптомы СН. Частота выявления основных симптомов при феох-ромоцитоме представлена в табл. 13. Основанием для подозрения на феохромоцитому является выявление характерной «гипертензивной триады»: АГ, гиперглике-мии и гиперметаболизма (без гипертиреоза).
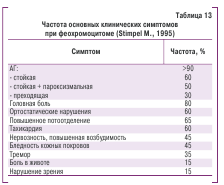
Ввиду мозаичности клинической картины при феох-ромоцитоме диагноз не может быть установлен только
на основании клинических проявлений болезни. Важ-ным шагом в постановке диагноза является выявление биохимических признаков гиперпродукции катехола-минов. Катехоламины частично метаболизируются в са-мой опухоли или в печени и выводятся через почки в виде соединений ванилилминдальной кислоты, мети-лированных метаболитов (метанефринов) или свобод-ных катехоламинов. Определение уровня катехолами-нов и их метаболитов (ванилилминдальной кислоты и метанефринов) в суточной моче относится к стандарт-ным диагностическим процедурам при подозрении на феохромоцитому. Больным, которых направляют на та-кой анализ, необходимо за определенное время до его проведения отменить лекарственные средства, кото-рое угнетают или увеличивают экскрецию катехолами-нов (блокаторы адренорецепторов, адреномиметики, в том числе центрального действия, ингибиторы мо-ноаминоксидазы (МАО) и др.). Дополнительное значе-ние в диагностике имеет определение продуктов мета-болизма катехоламинов после гипертензивного криза, причем можно сравнить их базальный суточный уро-вень и его повышение на фоне криза. Выявление пато-логического повышения уровня катехоламинов в плаз-ме крови имеет дополнительное диагностическое зна-чение, имеющее смысл лишь при заборе крови через венозный катетер, установленный за 30–60 мин до за-бора крови, при условии, что пациент все это время находился в состоянии покоя. Другие условия могут привести, с одной стороны, к ложноположительным результатам, а с другой — к дополнительным диагно-стическим затратам.
Если определение содержания катехоламинов не позволяет поставить диагноз, используют функцио-нальные тесты с угнетением или стимуляцией секреции катехоламинов. Секреция катехоламинов в физиологи-ческих условиях угнетается под влиянием клонидина. На практике можно использовать тест с определением содержания катехоламинов в плазме крови до и на про-тяжении 3 ч после приема клонидина в дозе 0,15–0,3 мг. Более простым в определении является тест с опреде-лением ночной супрессии секреции катехоламинов под влиянием клонидина. У здоровых лиц или у больных с эссенциальной АГ под влиянием клонидина отмечают значительное снижение содержания катехоламинов в моче, собранной за ночной период. В то же время се-креция катехоламинов феохромоцитомой не угнетает-ся под влиянием клонидина.
мографии (ЯМРТ). Визуализация опухолей при их лока-лизации в надпочечных железах, как правило, сложно-стей не вызывает. Зачастую даже с помощью УЗИ над-почечных желез можно выявить определенные струк-турные изменения и затем подтвердить наличие опухо-ли при КТ или ЯМРТ. Выявление опухолей экстраадрена-ловой локализации в значительной степени зависит от опыта врача, а часто происходит случайно. С помощью визуализирующих процедур выявляют до 95 % феох-ромоцитом размером более 1 см при их локализации в надпочечных железах и менее 2 см — при абдоминаль-ной локализации.
Для дополнительного выявления феохромоцитомы может быть рекомендована сцинтиграфия с меченным 131I-метайодбензилгуанидином после предваритель-ной блокады щитовидной железы. Некоторые исследо-ватели даже при выявлении феохромоцитомы метода-ми визуализации (КТ, ЯМРТ) рекомендуют проведение сцинтиграфии других областей тела для исключения на-личия других катехоламинпродуцирующих опухолей в организме.
Высокоспецифическим методом подтверждения на-личия феохромоцитомы является определение повы-шенного уровня катехоламинов в крови из соответству-ющих ветвей нижней полой вены. При наличии опухо-ли концентрация катехоламинов в вытекающей с места локализации опухоли крови в несколько раз выше, чем в других местах. Несмотря на достаточно высокую ди-агностическую точность метода, он применяется лишь в редких сложных случаях из-за инвазивности, слож-ности выполнения и возможного риска для больного. Формализованный диагностический алгоритм при по-дозрении на феохромоцитому приведено на рис. 8.
В редких случаях с большой осторожностью при-меняют стимуляционные тесты с гистамином, тирами-ном или лучше всего — с глюкагоном. При их прове-дении у больных с феохромоцитомой отмечают значи-тельное повышение уровня АД и уровня катехолами-нов (в несколько раз). Для предупреждения критиче-ского подъема АД пациенту предварительно дают бло-каторы α-адренорецепторов или антагонисты кальция. Их назначение не влияет на повышение секреции кате-холаминов. Важным этапом подтверждения диагноза «феох-ромоцитома» является проведение визуализирующих процедур: КТ и/или ядерно-магнитно- резонансной томографии (ЯМРТ). Визуализация опухолей при их лока-лизации в надпочечных железах, как правило, сложно-стей не вызывает. Зачастую даже с помощью УЗИ над-почечных желез можно выявить определенные струк-турные изменения и затем подтвердить наличие опухо-ли при КТ или ЯМРТ. Выявление опухолей экстраадрена-ловой локализации в значительной степени зависит от опыта врача, а часто происходит случайно. С помощью визуализирующих процедур выявляют до 95 % феох-ромоцитом размером более 1 см при их локализации в надпочечных железах и менее 2 см — при абдоминаль-ной локализации.
Для дополнительного выявления феохромоцитомы может быть рекомендована сцинтиграфия с меченным 131I-метайодбензилгуанидином после предваритель-ной блокады щитовидной железы. Некоторые исследо-ватели даже при выявлении феохромоцитомы метода-ми визуализации (КТ, ЯМРТ) рекомендуют проведение сцинтиграфии других областей тела для исключения на-личия других катехоламинпродуцирующих опухолей в организме.
Высокоспецифическим методом подтверждения на-личия феохромоцитомы является определение повы-шенного уровня катехоламинов в крови из соответству-ющих ветвей нижней полой вены. При наличии опухо-ли концентрация катехоламинов в вытекающей с места локализации опухоли крови в несколько раз выше, чем в других местах. Несмотря на достаточно высокую ди-агностическую точность метода, он применяется лишь в редких сложных случаях из-за инвазивности, слож-ности выполнения и возможного риска для больного. Формализованный диагностический алгоритм при по-дозрении на феохромоцитому приведено на рис. 8.
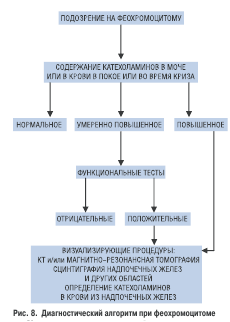
Хирургическое лечение обязательно при отсутствии противопоказаний для проведения операции. В послед-ние годы чаще применяют лапароскопический доступ, которыйуменьшаеттравматичностьоперациидляболь-ногоисокращаетсрокигоспитализации.Эффективность хирургического вмешательства при феохромоцитоме очень высокая: у более 90% больных отмечают норма-лизациюилистойкоеснижениеАД.Вредкихслучаяхвы-являют рецидивы опухоли или феохромоцитомы иной локализации.Лечениеихдолжнопроводитьсятакжехи-рургическим путем. Если опухоль невозможно удалить хирургическим путем, применяют лучевую и химиотера-пию,особенноприметастазировании.Облучениеипри-менение цитостатиков приводит к уменьшению разме-раиактивностиопухолей,что,соответственно,сопрово-ждаетсяулучшениемсостояниябольных.
Для медикаментозного контроля АД применяют блокаторы α-адренорецепторов (празозин, доксазозин и другие), при необходимости и кризах — внутривен-но (фентоламин). Возможно, лучший эффект будут от-мечать при применении комбинации или комбиниро-ванных блокаторов α- и β- адренорецепторов (лабета-лол, карведилол). Использование чистых неселектив-ных блокаторов β-адренорецепторов нецелесообраз-но, поскольку может привести к повышению АД. Сре-ди других антигипертензивных препаратов следует от-метить антагонисты кальция и препараты центрально-го действия (клонидин, агонисты имидазолиновых ре-цепторов). В последние годы появились сообщения об успешном применении блокатора синтеза допамина — метилтирозина. Препарат на ранних стадиях синте-за блокирует образование катехоламинов, что позволя-ет успешно контролировать АД и надлежащим образом подготовить больного к операции. Применение препа-рата рекомендовано Европейским обществом гипер-тензии (2003).
При проведении анестезии следует избегать фен-танила и дроперидола, которые могут стимулировать дополнительную секрецию катехоламинов. Рекомен-дуют тщательное мониторирование функции сердечно-сосудистой системы во время введения в наркоз, опе-рации и первых суток после операции: возможно раз-витие как гипертензивных, так и гипотензивных состоя-ний, тяжелых аритмий. Важное значение придают заме-щению объема жидкости для предотвращения гипово-лемии. Через 2 нед после операции рекомендуется про-верить уровень катехоламинов в моче.
Первичный минералокортицизм
Первичный минералокортицизм — термин, под ко-торым объединяют ряд эндокринных нарушений, ас-социированных c АГ и эндогенной гиперпродукци-ей альдостерона или минералокортикоидов и про-дуктов их биосинтеза. К первичному минералокорти-цизму относят первичный альдостеронизм, дезокси-кортикостеронпродуцирующие опухоли надпочеч-ных желез и адреногенитальный синдром/врожден-ную адреналовую гиперплазию. Общим признаком для минералокортикоид-ассоциированных АГ является ги-покалиемия различной степени выраженности.
Первичный альдостеронизм характеризуется авто-номной (независимой от других причин) гиперпродук-цией альдостерона железистой зоной надпочечных же-лез. Его следует отличать от вторичных альдостерониз-мов, которые являются следствием повышения уровня ренина, часто реактивного характера. Около 75% всех случаев первичного альдостеронизма составляет аде-нома надпочечной железы (синдром Кона), редко вы-являют карциному надпочечной железы, а также пер-вичную одно- и двустороннюю гиперплазию надпочеч-ных желез и дексаметазон-супрессивную (поддающую-ся лечению глюкокортикостероидами (ГСК)) гиперпла-зию. Впервые клинические проявления первичного ми-нералокортицизма описал американский эндокрино-лог J.W. Conn в 1955 г. у 34-летней женщины с высоким АД. По данным литературы синдром Кона выявляют у 0,5–1% больных с АГ. У женщин отмечают почти вдвое чаще, чем у мужчин. По данным отделения симптомати-ческих артериальных гипертензий Национального на-учного центра «Институт кардиологии им. Н.Д. Страже-ско» среди 3495 первичных больных, которые находи-лись в отделении на протяжении 1994–2003 гг., диагноз «первичный альдостеронизм», подтвержденный гисто-логическим исследованием после операции, был уста-новлен у 0,3% больных.
В течение последнего десятилетия благодаря широ-кому использованию порогового значения соотноше-ния альдостерон/активность ренина плазмы крови >30 в качестве дагностического критерия первичного аль-достеронизма частота выявления заболевания по дан-ным разных исследователей достигает 5–10% в популя-ции пациентов с повышенным АД и до 25% среди боль-ных с рефрактерной АГ.
Патогенез заболевания включает повышение реаб-сорбции натрия в дистальных канальцах и замену им калия и ионов водорода. Считают, что одной из при-чин АГ при этом является увеличение внутрисосудисто-го объема крови. Среди других причин рассматривают центральные механизмы, связанные с влиянием аль-достерона на мозговые центры регуляции сердечно-сосудистой системы, секрецию вазоконстрикторных субстанций, а также ряд периферических: прямой вазо-констрикторный эффект альдостерона, накопление на-трия в стенке резистивных артерий с повышением чув-ствительности к прессорным агентам и т.п. Потеря ка-лия носит постепенно прогрессирующий характер, при этом гипернатриемию практически не отмечают.
Клинические симптомы не носят специфического характера и практически не имеют значения для диф-ференциальной диагностики (табл. 14).
Симптоматика первичного альдостеронизма вклю-чает АГ, гипокалиемию, метаболический алкалоз и ги-поренинемию. Важным этапом дифференциальной ди-агностики первичного гиперальдостеронизма являет-ся исключение состояний, при которых существует дру-гая (вторичная) причина активации РАС: нерациональ-ное применение салуретиков, кортикоидных гормонов, слабительных средств, болезни ЖКТ и т.п. Наличие пер-вичного гиперальдостеронизма следует всегда исключать при рефрактерной АГ, причем нормокалиемия ав-томатически не исключает гиперпродукцию альдосте-рона: приблизительно у 20 % больных первичным гипе-ральдостеронизмом гипокалиемия проявляется только через несколько дней солевой нагрузки (смотри далее).
Среди лабораторных тестов наиболее значимым является определение уровня гормонов РАС. Важной предпосылкой для проведения такого исследования должна стать тщательная подготовка больного: жела-тельно за 14 дней отменить все антигипертензивные средства, сбалансировать диету, обеспечить опреде-ленный режим покоя, тщательно выполнять необходи-мые условия забора проб. На этот период больных луч-ше госпитализировать. Определение содержания аль-достерона и калия в плазме крови, а также активности ренина плазмы крови являются стандартными проце-дурами диагностики. Можно дополнить эти исследова-ния определением концентрации или активности рени-на плазмы крови до и при необходимости после приема 40 мг фуросемида.
Особое значение для диагноза имеет определение соотношения содержания альдостерона (нг/дл) и ак-тивности ренина плазмы крови (нг/мл/ч). Нормальное значение этого соотношения должно быть <20, диагно-стическим порогом является величина >30, а значение >50 имеет наиболее высокую чувствительность и спец-ифичность. Повышение диагностического порога со-отношения позволило обеспечить специфичность до 94 % без существенного снижения чувствительности. Соответственно Рекомендациям Европейского обще-ства по гипертензии и Европейского общества карди-ологов (2003) следует использовать величину соотно-шения >50 как абсолютный диагностический критерий этой патологии независимо от наличия других симпто-мов, включая гипокалиемию.
При сомнительном результате исследование допол-няют тестами с нагрузкой солью или приемом капто-прила. Нагрузка солью (150–200 ммоль натрия или 6–9 г соли в сутки) приводит к повышению почечного калий/ натриевого обмена, который демаскирует латентную ги-покалиемию. Нагрузка солью повышает специфичность определения содержания альдостерона в плазме кро-ви: только при вторичном гиперальдостеронизме до-полнительное поступление натрия угнетает секрецию альдостерона. Тест с приемом 25 мг каптоприла основан на угнетении синтеза АII, вследствие чего снижает-ся АД, а также уровень альдостерона у больных с эссен-циальной и ренальной формами АГ. При первичном ги-перальдостеронизме изменений уровня альдостерона не отмечают. Проба имеет высокую чувствительность и специфичность.
Присутствие опухоли в области надпочечных желез можно определить с помощью УЗИ, но отрицательный его результат не может полностью исключить наличие аденомы или гиперплазии. Приблизительно 20 % опу-холей имеют размер <1 см. Более точные методы КТ или ЯМРТ являются наиболее важными методами визу-ализации при первичном гиперальдостеронизме. Про-ведение одной из этих диагностических методик необ-ходимо даже при ультразвуковом выявлении измене-ний структуры надпочечной железы. Наиболее инфор-мативным методом для дифференциальной диагности-ки при первичном гиперальдостеронизме является се-лективное определение уровня альдостерона в крови из надпочечных вен. Одностороннее повышение будет означать наличие односторонней аденомы, а двусто-роннее — чаще всего диффузную гиперплазию обеих надпочечных желез.
Дексаметазон-супрессивная гиперплазия или под-дающаяся лечению ГКС форма первичного гипераль-достеронизма является редкой формой наследствен-ного заболевания с аутосомно- доминантным типом пе-редачи и характеризуется состоянием, когда симптомы альдостеронизма исчезают при применении малых доз ГКС, например дексаметазона. У больных отмечают по-вышенную чувствительность к альдостеронстимули-рующему действию адренокортикотропного гормона (АКТГ). Показано, что причиной заболевания является аномальный ген, который возникает при неравномер-ном делении хромосомы 8q, в результате чего наруша-ется порядок кодирования альдостерон-синтазы. В ор-ганизме это приводит к повышению продукции альдо-стерона, а также конверсии кортизола в гидрокси- и ок-сикортизол. Заболевание может быть диагностировано с помощью молекулярно-генетической техники и при повышении доступности технологий в будущем тести-рование следует проводить всем больным с семейной формой первичного гиперальдостеронизма.
Очень редкой формой первичного гиперальдосте-ронизма является так называемый адреногенитальный синдром или врожденная гиперплазия надпочечных желез, которые составляют группу заболеваний, для ко-торых характерен дефект энзимов стероидного синтеза. АГ возникает при дефиците 11β- или 17α- гидроксила-зы, при наличии которых отмечают накопление активных промежуточных продуктов минералокортикоидного син-теза. Первый тип сопровождается вирилизацией, при этом часто отмечают врожденные изменения половых органов: у мальчиков — макрогенитосомия, у девочек — урогени-тальный синус или гипертрофия клитора. Второй тип, нао-борот, задержкой развития половых органов и вторичных половых признаков (псевдогермафродитизм).
Еще одним редким заболеванием из этой группы АГ является синдром Лиддла, описанный как наследствен-ное заболевание с аутосомно-доминантным типом на-следования в 1963 г. У больных отмечают все признаки гиперпродукции минералокортикоидов, но уровень аль-достерона остается нормальным. В крови не выявлено повышения ни одной из известных минералокортикоид-активных субстанций, а также назначение антагони-стов или блокаторов синтеза альдостерона не приво-дит к снижению АД. Наблюдения показали, что примене-ние диуретиков, которые угнетают реабсорбцию натрия в дистальных канальцах (амилорид, триамтерен), может нормализовать АД и гипокалиемию. В настоящее время считают, что заболевание является следствием генетиче-ского дефекта β- или γ- субъединицы натриевого канала эпителия, который приводит к активации канала, повы-шению реабсорбции натрия (повышение АД) и экскре-ции калия (гипокалиемия).
Лечение первичного альдостеронизма зависит от его причины (табл. 15). Методом выбора для пациен-тов с односторонней аденомой или карциномой надпо-чечных желез является хирургическое удаление опухо-ли. Консервативное лечение в таких случаях применяют только при наличии противопоказаний для операции. Хирургическое лечение также рекомендуют больным с односторонней гиперплазией. Применяют боковой разрез или лапароскопическую технику. После адрена-лэктомии по данным различных авторов нормализацию АД отмечают у 40–70 % больных. Применение хирурги-ческих подходов при двусторонних поражениях спо-собствует нормализации АД менее чем у 20 % больных.

Медикаментозное лечение включает назначение специфического блокатора альдостерона — спироно-лактона, а также калийсберегающих диуретиков (амилорида, триамтерена). Лечение спиронолактоном начи-нают с высоких доз (200–400 мг/сут), но после стабили-зации АД и коррекции гипокалиемии дозу можно значи-тельно снизить. Калийсберегающие диуретики назнача-ют в обычных дозах. При стабильном уровне калия мож-но применять тиазидовые диуретики в малых дозах.
Недостаточный контроль АД требует назначения другого класса антигипертензивных средств: антагони-стов кальция продолжительного действия. Лучший эф-фект дают дигидропиридиновые препараты (нифеди-пин, амлодипин). У больных с двусторонней гиперпла-зией надпочечных желез хороший эффект дают ингиби-торы АПФ.
В последние годы во многих странах зарегистриро-ван новый селективный блокатор альдостероновых ре-цепторов — эплеренон. Его эффективность была дока-зана в клинических испытаниях при лечении больных с СН. В то же время опыт его применения для лечения первичного альдостеронизма ограничен. Считается ра-циональным использование этого препарата для лече-ния больных, у которых отмечают побочные эффекты при применении спиронолактона.
У пациентов с формой заболевания, которая подда-ется лечению ГКС, отмечают неудовлетворительный от-вет на прием обычных антигипертензивных средств, од-нако назначение даже малых доз ГКС (лучше дексаме-тазона в дозе 0,5–2 мг/сут) дает значительный эффект уже в течение первых 2–4 дней. Для полной коррекции АД необходим больший срок — несколько недель. Для предотвращения побочных эффектов ГКС рекомендуют их комбинировать с калийсберегающими диуретиками.
Гиперкортицизм может быть как зависимым от гипер-продукции АКТГ, так и АКТГ-независимым. Приблизи-тельно 65–80 % случаев составляют больные с повы-шенной секрецией АКТГ и вторичной гиперплазией надпочечных желез. При таком типе (центральном или болезни Кушинга) повышение выделения АКТГ являет-ся следствием или нарушений на уровне гипоталамуса с повышением выделения кортикотропин- рилизинг гор-мона, или наличия аденомы гипофиза.
По данным некоторых исследователей концепция болезни Иценко — Кушинга включает первичную па-тологию лимбической системы и ретикулярной фор-мации, которая приводит к нарушению нейрональ-но- медиаторного контроля секреции рилизинг- факто-ров, в том числе кортикотропин- рилизинг гормона. В очень редких случаях продукция АКТГ или кортикотро-пин- рилизинг гормона может быть вызвана эктопиче-ски расположенной опухолью (например мелкоклеточ-ная бронхиальная карцинома, опухоли вилочковой же-лезы, матки). Почти в 20 % случаев гиперсекреция ГКС связана с первичным процессом в надпочечных желе-зах (синдром Кушинга). Односторонний процесс — это чаще всего или аденома или карцинома. Двусторонний процесс — двусторонняя микро- или макроузловая ги-перплазия. Однако описаны случаи двусторонней аденомы. Современная классификация гиперкортицизма представлена в табл. 16.

В Украине болезнь и синдром Кушинга называют
В Украине болезнь и синдром Кушинга называют Иценко — Кушинга в честь Н.М. Иценко, который впер-вые описал клиническую картину этой патологии в 1924 г. По данным литературы болезнь отмечают в 0,1 % сре-ди всего населения, причем в 75–80 % из них выявить опухоль крайне тяжело. Заболевание отмечают чаще у женщин, наиболее часто в возрасте 20–40 лет. Сре-ди 3495 первичных больных с синдромом АГ, которые были госпитализированы в отделение симптоматиче-ских артериальных гипертензий Национального науч-ного центра «Институт кардиологии им. Н.Д. Стражеско» с 1994 по 2003 г., различные формы гиперкортицизма, подтвержденные гистологически после оперативного лечения, выявлены в 0,17 % случаев.
АГ возникает приблизительно у 80 % больных гипер-кортицизмом. Патогенез АГ у больных гиперкортициз-мом мультифакториальный:
• минералокортикоидные эффекты высокого уровня кортизола с задержкой натрия и воды;
• повышенная секреция субстанций с минералокорти-коидной активностью;
• вызванная кортизолом активация РАС;
• вызванная кортизолом активация симпатоадренало-вой системы (САС);
• повышенная чувствительность гладкомышечных кле-ток сосудов к вазопрессорам;
• снижение продукции простаноидов- вазодилататоров.
Хроническое влияние гиперсекреции ГКС приво-дит к типичным изменениям внешности больных — «ку-шингоидный» тип ожирения. Характерными признака-ми являются луноподобное лицо с багрово-синим цве-том щек, отложение жира в области шеи (шея бизо-на), туловища, плеч, живота и бедер, при этом голени и предплечья остаются худыми и тонкими. На бедрах, на животе, под подмышками появляются характерные атрофические полосы красно-фиолетового цвета дли-ной 15–20 см (stri ae rubra). На коже лица, спины, груди возникает много угрей, петехий. Постепенно уменьша-ется мышечная масса, больные сутулятся, теряют осан-ку, выглядят очень немощными. Часто отмечают гипокалиемию. Прогрессирует остеопороз с болями и возмож-ными переломами костей. У мужчин появляются при-знаки демаскулинизации: нарушается потенция, возни-кает гипотрофия яичек, уменьшается рост бороды и т.д. У женщин выявляют аменорею, атрофию молочных же-лез, признаки маскулинизации (борода, усы, рост волос на лобке и груди).
Изменения касаются и психического состояния: те-ряется интерес к внешним факторам, возникает апа-тия, сонливость, снижение интеллектуальных способ-ностей. Иногда возникают маниакальные или паранои-дальные состояния, галлюцинации. Известны случаи са-моубийств.
Наиболее часто дифференциальный диагноз прово-дят с обычным ожирением, которое не редко сопрово-ждает эссенциальную АГ. Кроме возможности влияния диеты и регулярных физических упражнений при али-ментарном ожирении, значительная роль в диагности-ке принадлежит лабораторным тестам. К вторичным ла-бораторным изменениям при гиперкортицизме отно-сят гипокалиемию, метаболический алкалоз, гиперли-пидемию, гипергликемию, эозинопению.
Наиболее точным является определение повышен-ного уровня кортизола в крови или в суточной моче. Ра-зовое определение в крови с отрицательным резуль-татом не исключает диагноза «гиперкотицизм» вслед-ствие значительных физиологических колебаний уров-ня гормона. В моче рекомендуют определять свобод-ный кортизол, а не уровень 17- кетостероидов и 17- ги-дроксикетостероидов. Исследование необходимо про-вести минимум в двух последовательных пробах мочи, что не является сложным даже для амбулаторных паци-ентов.
Кроме простого определения кортизола, рекомен-дуют пробы с дексаметазоном. Назначение 1 мг декса-метазона на ночь угнетает экскрецию кортизола даже у больных с ожирением. При синдроме Кушинга экзоген-ные ГКС не влияют на выделение кортизола.
Низкий уровень АКТГ в плазме крови означает на-личие первичного процесса в надпочечных желе-зах. Нормальный или несколько повышенный уро-вень АКТГ при отрицательном дексаметазоновом те-сте будет означать, что причиной является АКТГ- за-висимый механизм (болезнь Кушинга, или активация кортикотропин-зависимых механизмов). В таких случа-ях можно применить тест с введением 2–8 мг дексаме-тазона. АКТГ-зависимая активация секреции угнетается введением высоких доз ГКС, тогда как эктопическая не изменяется. По данным литературы чувствительность и специфичность дексаметазонового теста для разде-ления АКТГ- зависимого и АКТГ- независимого типов гиперкортицизма составляла около 81 и 67 % соответ-ственно.
Также для дифференциации центрального и эк-топического очагов применяют тест со стимуляцией кортикотропин-рилизинг гормоном. После введения 100 мкг гормона при болезни Кушинга отмечают повышение содержания АКТГ и кортизола. При эктопической опухо-ли их уровень не изменяется. Некоторые авторы пред-лагают проводить этот тест с забором крови из нижне-гокаменистогосинуса(sinuspetrosusinferirior).Есликон-центрация АКТГ в крови с синуса будет как минимум в 3 разавыше,чемвпериферическойвене,тогипофизарная локализация опухоли не вызывает сомнения. Проведе-ние такого билатерального теста может помочь опреде-литьсторонулокализацииопухоли.Необходимоподчер-кнуть, что подобные манипуляции следует выполнять в специальныхцентрахопытнымиврачами.
Четкая визуализация опухоли и ее структуры явля-ются основой для проведения хирургического лече-ния. Диагноз «первичний гиперкортицизм» (синдрома Кушинга) подтверждают с помощью визуализирующих процедур КТ или ЯМРТ. При болезни Кушинга считают, что наличие микроаденомы диаметром 5 мм и более в гипофизе является неопровержимым доказательством ее наличия. Наиболее чувствительным методом в таких случаях является ЯМРТ. В случаях эктопической локали-зации рекомендуют очень тщательно, пошагово с по-мощью визуализирующих методов изучить состояние грудной и брюшной полости. Следует помнить, что та-кие опухоли могут быть очень малы по размеру, несмо-тря на их высокую гормональную активность.
Прогноз заболевания при отсутствии лечения, как правило, крайне неблагоприятный — 5- летняя выжи-ваемость составляет 50%. Основной причиной смерти являются сердечно- сосудистые осложнения. Особенно неблагоприятный прогноз при злокачественных фор-мах опухоли.
Радикальным лечением как болезни, так и синдро-ма Кушинга, которое гарантирует продолжительный эффект, является хирургическое удаление гормональ-но активной опухоли. Даже односторонняя адреналэк-томия при билатеральной гиперплазии надпочечных желез улучшает течение заболевания. Радикальное хи-рургическое лечение необходимо и при эктопически расположенных гормонально активных опухолях. Для улучшения результатов хирургическое лечение комби-нируют с лучевой терапией.
Развитие хирургической техники селективного уда-ления аденом гипофиза радикально изменило резуль-таты лечения таких пациентов. Обычно используют транссфеноидальный доступ, который позволяет ми-нимизировать травматичность операции. Оперативное лечение в таких случаях проводится в нейрохирургиче-ских отделениях. Частота полного излечения по данным лучших мировых клиник составляет >80%.
Фармакологическое лечение гиперкотицизма очень ограничено и может включать 3 направления:
• модуляция секреции АКТГ; • модуляция секреции ГКС;
• модуляция клеточных эффектов ГКС.
Для модуляции секреции АКТГ можно применять ци-прогептадин, бромокриптин, соматостатин.
Для угнетения секреции ГКС: кетоконазол, мито-тан, аминоглутетимид, метирапон. Для блокирования ГКС-рецепторов предложен мифепристон. Некоторые исследователи в случае положительного ответа орга-низма предлагают назначать дексаметазон в малых до-зах — 0,25–0,75 мг/сут. Эффективность большинства из перечисленных лекарственных средств, к сожалению, не выходит за рамки ограниченных исследований и не нашла широкой поддержки медицинской обществен-ности.
Для лечения АГ при гиперкортицизме предлагают спиронолактон в обычных терапевтических дозах, ка-лийсберегающие диуретики, ингибиторы АПФ, селек-тивные блокаторы β-адренорецепторов в обычных до-зах. Необходимо избегать применения препаратов, ко-торые могут спровоцировать метаболические и элек-тролитные расстройства. Следует помнить, что меди-каментозная терапия в данном случае является только временным этапом перед радикальным хирургическим вмешательством.
Акромегалия
Гиперпродукция гормона роста перед закрытием эпи-физарных пластинок (зон роста) приводит к гигантиз-му, а после окончания периода роста — к акромегалии. Почти во всех случаях причиной гиперпродукции гор-мона роста является аденома гипофиза. АГ среди боль-ных акромегалией выявляют приблизительно у 40–50%, что чаще, чем в общей популяции. Причиной АГ считают задержку натрия под влиянием высокой концентрации гормона роста. При этом не существует прямой зависи-мости между степенью повышения АД и уровнем гор-мона роста. Значительная гипертрофия левого желу-дочка, которую часто выявляют при акромегалии, объ-ясняется в большей мере гормональным влиянием, чем степенью повышения АД.
Внешние клинические признаки акромегалии очень характерные, что позволяет заподозрить наличие бо-лезни даже врачу-новичку: массивная нижняя челюсть, надбровные дуги, нос, уши, значительно увеличенные кисти и стопы, кости. В случаях с менее выраженной симптоматикой целесообразно сравнить фотографии пациента в более молодом возрасте или фото близких родственников. Для постановки окончательного диа-гноза необходимо провести определение уровня гор-мона роста в плазме крови, а также инсулиноподобно-го фактора роста. Содержание гормона роста в крови значительно колеблется, но у здоровых лиц никогда не превышает 10 мкг/л. Для акромегалиии также характер-но, что высокий уровень гормона роста не снижается после приема 100 г глюкозы (супрессивный тест).
Уровень сердечно-сосудистых осложнений у боль-ных акромегалией остается очень высоким — смерт-ность достигает 100% на протяжении 15 лет. Агрес-сивная антигипертензивная терапия является главным фактором, положительно влияющим на продолжитель-ность жизни таких пациентов. Принципы медикамен-тозной терапии АГ при акромегалии не отличаются от общепринятых рекомендаций: применяют любые препараты первого ряда или их комбинации. Успешное ра-дикальное лечение основного заболевания (удаление опухоли гипофиза) приводит к снижению или нормали-зации АД у большинства больных. После удаления опу-холи содержание гормона роста снижается на 50–90%. По данным литературы 10-летняя смертность после успешной операции составляла 7%, относительный риск в сравнении с общей популяцией — 1,17.
Показано, что кратковременное применение анало-га соматостатина — октреотида угнетает секрецию гор-мона роста и снижает АД. На фоне такого лечения от-мечают уменьшение размеров опухоли и значительное уменьшение выраженности клинических симптомов. Но продолжительные результаты такого лечения в на-стоящее время остаются неизученными. По данным не-которых исследователей применение бромокриптина может привести к нормализации уровня гормона роста приблизительно у 20% больных акромегалией. Такое лечение также сопровождается снижением уровня АД.
Гиперпаратиреоз
Первичный гиперпаратиреоз — заболевание, которое характеризуется первичным повышением секреции па-ратгормона. Чаще всего причиной заболевания являет-ся аденома или гиперплазия паращитовидной железы. АГ отмечают приблизительно у 70% больных с первич-ным гиперпаратиреозом. Вторичный гиперпаратиреоз возникает при ХПН, чрезмерном потреблении витами-на D, кальция, снижении уровня фосфатов и т.п. Наличие АГ в сочетании с гиперкальциемией всегда должно при-водить врача к мысли о гиперпаратиреозе — заболева-нии, которое отмечают у больных с АГ приблизительно в 10 раз чаще, чем в популяции в целом, и которое оста-ется в большинстве случаев недиагностированным. В ряде случаев гиперпаратиреоз является одним из син-дромов множественной эндокринной неоплазмы.
Патогенез гиперпаратиреоза определяется наруше-ниемобменакальцияифосфоравследствиечрезмерной продукции паратиреоидного гормона. При этом заболе-вании отмечают усиленное вымывание кальция из ко-стей, повышение содержание кальция в крови и его вы-деление смочой;снижениесодержания фосфоравслед-ствиесниженияегореабсорбцииизпервичноймочи.По-вышенноесодержаниекальцияифосфоравмочеприво-дит к образованию конкрементов в мочевыводящих пу-тях. В костях вследствие вымывания кальция отмечают замещениекостнойтканисоединительной.
Ситуация с патогенезом АГ выглядит несколько па-радоксальной, потому что при введении паратгормона в острую фазу заболевания отмечают вазодилаторный и антигипертензивныйэффект.ФормированиеАГприэтом связывают с несколькими факторами: гиперкальциеми-ей, нарушением функции почек при продолжительном течении заболевания, возможной дополнительной про-дукцией так называемого паратиреоидного гипертен-зивногофактора—гормона,которыйпродуцируетсяпа-ратиреоиднойжелезойодновременноспаратгормоном, активацией РАС. Еще одним механизмом, доказанным экспериментально, считают потерю чувствительности гладкомышечных клеток сосудов к внутренним вазоди-лататорным агентам на фоне продолжительного воздей-ствия высоких концентраций паратгормона. Насколько этимеханизмыреализуютсячерезизменениятрансмем-бранного транспорта и внутриклеточной концентрации кальциявнастоящеевремянеизвестно.Крометого,экс-периментально доказано, что хроническое введение па-ратгормонаприводиткповышениюсекрецииАКТГисо-ответственноглюко-иминералокортикоидов.
Симптомы заболевания неспецифичны. Клиниче-скими проявлениями заболевания часто становятся симптомы со стороны почек (мочекаменная болезнь, вторичный пиелонефрит, почечная недостаточность) и костей (болевой синдром, переломы). По преимуществу симптомов выделяют 2 формы заболевания: почечную и костную. Как следствие ренального эффекта высокой концентрации паратгормона могут отмечать наруше-ния электролитного баланса: гиперфосфатемия, гипер-фосфатурия, гиперкальцийурия, гипохлоремия, гипока-лиемия. При рентгенологическом исследовании отме-чают симптомы генерализованного остеопороза. Повы-шение АД выявляют уже на начальных стадиях заболе-вания. Поражение органов-мишеней отмечают раньше, чем при эссенциальной АГ.
Диагноз «гиперпаратиреоз» считают достоверным при наличии повышенной концентрации паратиреоид-ного гормона в крови в сочетании с гиперкальциемией. Нормальным уровнем паратгормона считают 10–70 пг/ мл, причем верхняя граница повышается с возрастом.
Обычно паращидовидная железа может быть визуа-лизирована с помощью УЗИ. При сомнительной картине используют томографию и сцинтиграфию.
Хирургическое лечение является безопасным и эф-фективным:полноевыздоровлениеотмечаютболеечемв 90% случаев. Нормализация АД после операции по раз-личнымданнымотмечаетсяот20до100%больных.Меди-каментозное лечение АГ у больных с гиперпаратиреозом проводятсогласнообщимпринципамлеченияАГ.
Гипер- и гипотиреоз
Гипертиреоз или тиреотоксикоз является следствием гиперпродукции тиреоидных гормонов, что приводит к повышению сердечного выброса, ЧСС, показателей со-кратительной способности миокарда. Следствиями ти-реотоксикоза также является увеличение объема цир-кулирующей крови (ОЦК), снижение ОПСС. Частота АГ при тиреотоксикозе составляет около 40%. Доминиру-ет систолическая АГ вследствие вышеупомянутых гемо-динамических изменений. Большинство сердечно- со-судистых симптомов при тиреотоксикозе являются про-явлениями активации САС, хотя содержание адренали-на нормальное или несколько снижено, что объясняют увеличением плотности и чувствительности β- адрено-рецепторов под влиянием тиреоидных гормонов.
По данным отделения симптоматических артери-альных гипертензий Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» среди 3495
первичных больных, которые находились в отделении на протяжении 1994–2003 гг., поражение щитовидной железы диагностировано у 5,2 %, при этом у большин-ства из них (у 4 %) выявлен гипертиреоз. Безусловно, эпидемиологические данные будут различными как в различных географических регионах, так и в различных по профилю медицинских учреждениях.
Диагноз заболевания подтверждают определени-ем уровня гормонов щитовидной железы в крови — ти-роксина (Т4) и трийодтиронина (Т3). Методом выявле-ния пациентов с нарушением функции щитовидной же-лезы является определение содержания тиреотропно-го гормона в крови. При его нормальном содержании, как правило, функция щитовидной железы нормальная, при повышенном — функция снижена, а при снижен-ном — функция повышена. В табл. 17 приведены основ-ные изменения сердечно-сосудистой и эндокринной систем при гипер- и гипотиреозе.
Выбор тактики лечения тиреотоксикоза зависит от его причины и его детализация может стать предме-том другой монографии. В контексте антигипертензив-ной терапии следует отметить, что лечение гипертирео-за и восстановление эутиреоидного состояния, как пра-вило, приводит к нормализации АД. Приведенные пато-генетические механизмы АГ определяют наиболее эф-фективную симптоматическую антигипертензивную те-рапию у таких больных — прием блокаторов β- адре-норецепторов. Применяют как селективные, так и несе-лективные препараты. В ряде исследований было пока-зано, что неселективные блокаторы β- адренорецепто-ров могут снижать синтез Т3 и Т4. Важно, что при назна-чении блокаторов β-адренорецепторов уменьшается количество аритмий, а при постоянной форме фибрил-ляции предсердий достигается эффективный контроль ЧСС, а иногда восстанавливается синусовый ритм.
Для контроля АД можно применять недигидропири-диновые антагонисты кальция, которые замедляют ЧСС. Назначение диуретиков хорошо потенцирует эф-фект обеих указанных групп препаратов. В ряде слу-чаев хороший эффект отмечают при применении пре-паратов центрального действия вследствие их седа-тивного эффекта. Нежелательно использовать диги-дропиридиновые антагонисты кальция и блокаторы α-адренорецепторов, так как возможно усиление тахи-кардии. При выраженной гипертрофии левого желудоч-ка назначают ингибиторы АПФ или БРАII.
Гипотиреоз или микседема является следствием сни-жения секреции или доступности тиреоидных гормонов для тканей организма. Гемодинамически гипотиреоз ха-рактеризуется низким сердечным выбросом, снижением ЧСС, повышением ОПСС, уменьшением ОЦК. Повышение АД отмечают у 30–50% больных гипотиреозом.
Возникновение АГ связывают со значительной ак-тивацией САС. Уровень адреналина и норадреналина в крови повышен, особенно при наличии АГ. Определен-ную патогенетическую роль в формировании АГ связы-вают со снижением плотности β- адренорецепторов, что способствует дополнительной относительной сти-муляции α-адренорецепторов и приводит к перифе-рической вазоконстрикции. Некоторые исследователи считают повышение ОПСС элементом компенсации: по-вышение перфузионного давления в ответ на снижение сердечного выброса.
Клинические симптомы гипотиреоза у взрослых включают сонливость, общую и мышечную слабость, сухость кожи и слизистых оболочек, повышение мас-сы тела, облысение, снижение ментальных функций, по-явление характерных отеков. Синдром АГ у большин-ства больных гипотиреозом характеризуется повыше-нием диастолического АД. Систолическое АД повыша-ется в значительно меньшей мере. Считают, что тяжесть гипотиреоза коррелирует со степенью повышения ди-астолического АД. Часто отмечается синусовая бради-кардия. Считают, что вследствие сопутствующих нару-шений липидного обмена при гипотиреозе существуют дополнительные условия для быстрого прогрессирова-ния атеросклероза.
Подтверждением гипотиреоза является определе-ние низкого уровня тиреоидных гормонов в крови. Важ-но определять общее содержание гормонов, их свобод-ной формы и их соотношение. У 10–15 % больных мо-гут диагностировать нормальный или субнормальный уровень гормонов в крови. В таких случаях дополни-тельной мерой является определение тиреотропного гормона. При микседеме его концентрация значитель-но повышена.
Лечение гипотиреоза включает заместительную те-рапию гормонами щитовидной железы (их синтетиче-скими аналогами). Достижение эутиреоидного состоя-ния в большинстве случаев приводит к нормализации АД. У больных преклонного возраста и при значитель-ной продолжительности АГ динамика АД менее поло-жительная и возникает необходимость в дополнитель-ном назначении антигипертензивных препаратов. Ле-чение АГ рекомендуют начинать с препаратов в низких дозах. Преимущество отдают средствам с перифериче-ским вазодилататорным эффектом: ингибиторам АПФ, дигидропиридиновым антагонистам кальция и блокато-рам α- адренорецепторов в обычных дозах. Диуретики можно назначать для усиления эффекта других средств.
Изолированную гиперпродукцию ренина со вторич-ным гиперальдостеронизмом как причину АГ отмечают очень редко: в мире описано не более 50 случаев этого заболевания. Большинство из них представляли собой гормонально активные опухоли внутри почек. Гистоло-гической основой являются юкстагломерулярные опу-холи, гемангиоперицитомы, гамартомы, опухоли Виль-мса и рак почек. Эктопическую продукцию ренина мо-гут отмечать при раковых заболеваниях печени, подже-лудочной железы, яичников, бронхов.
Основой диагноза является исключение других со-стояний, которые могут сопровождаться значительным повышением уровня ренина в крови. Дифференциаль-ный диагноз «первичный ренинизм» следует прово-дить при вторичном гиперальдостеронизме с призна-ками гипокалиемии и АГ, который часто объясняют те-рапией диуретиками, стенозом почечной артерии, фе-охромоцитомой, поликистозом почек. Основным мето-дом лечения является хирургическое удаление гормо-нально активной опухоли. Эффективный контроль АД может быть достигнут при назначении препаратов, ко-торые блокируют активность РАС — ингибиторов АПФ и БРА. В последнее время в клиническую практику вне-дряют селективный блокатор ренина — алискирен. Есть сведения о его успешном назначении при эссенциаль-ной АГ. В то же время сведений о его эффективном при-менении при первичном ренинизме в доступной лите-ратуре не встречалось.
Эндотелинпродуцирующие опухоли
Эндотелин-1 представляет собой полипептид с очень сильным вазоконстрикторным эффектом, который в нормальных условиях вырабатывается и выделяется эндотелиальными клетками. Эндотелин- 1 при взаимо-действии с его антагонистом оксидом азота играет важ-ную роль в процессах локальной ауторегуляции крово-обращения, сосудистых процессов и т.п. Значительная доля эффектов эндотелина- 1 и его участие в физиоло-гических и патологических реакциях является предме-том наиболее современных экспериментальных и кли-нических исследований. В настоящий момент досто-верно известно о возможности возникновения специ-фической формы АГ, связанной с наличием эндотелин-продуцирующих опухолей. Описано несколько случаев гемангиоэндотелиомы, которая вырабатывала эндоте-лин-1, что сопровождалось значительным стойким по-вышением АД. После удаления опухоли отмечали нор-мализацию АД и содержания эндотелина-1 в плазме крови.
Вывод
литератУра
1. А рабидзе Г.Г. (1982) Симптоматические артериальные гипертензии. Руководство по кардиологии. Медицина, Москва, 4: 65–100.
2. Бобров В.А., Давыдова И.В. (2003) Симптоматические гипертензии. Руководство для врачей. Четверта хвиля, Киев, 256 с.
3. Р Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2004) Київ, 84 с.
4. Р уководство по артериальной гипертонии (2005) Под ред. Е.И. Чазова, И.Е. Чазовой. Медиа медика, Москва, 784 с.
5. С іренко Ю.М., Маньковський Б.М. (2004) Артеріальні гіпертензії при ендокринних захворюваннях. Четверта хвиля, Київ, 165 с.
6. 2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertrtension, 21: 1011–1053.
7. Laragh J.H., Brenner B.M. (1995) Hypertrtension. Raven Pr ess, New York, 3219 p.
8. Martin S.A., Mynderse L.A., Lager D.J. et al. (2001) Juxt aglomerular cell tumors: a clinicopath ologi c study of four cases and review of lit erature. Am. J. Clin. Path ol., 116: 854–863.
9. Mayet J., Coats A.S. (1998) Diagnosis and investigtig atition of essentitial and secondary hypertrtension. Europ. Heartrt J., 19: 372–377.
10. Secondary Hypertension. Clinical Presentation, Diagnosis, and Treatment (2004) Edit ed by G.A. Mansoor. Humana Pr ess, Totowa, New Jersy, 352 p.
11. Shapiro L.M., Buchalter M. (1991) A colour atlas of hypertension. Wolfe Publishi ng Ltd., London, 159 p.
12. Stimpel M. (1996) Artrteririal hypertrtension. Walter de Gruyter, Berlin — New York, 356 p.
13. 2007 Guidelines for the management of arterial hypertension. J. Hypertrtension, 25: 1105–1187.
Таким образом, своевременная диагностика и правиль-ное лечение эндокринных форм АГ может привести к стойкой нормализации АД без регулярного приема антигипертензивных препаратов, что зачастую может быть расценено как полное выздоровление.










Комментировать