Оценка многолетней эффективности ресинхронизирующей терапии у пациентов с хронической сердечной недостаточностью. Результаты проведенных исследований.
И.Г.Стенин, В.В.Шабанов, А.Н.Туров, Д.А.Елесин, А.А.Якубов, Д.В.Лосик, А.Б.Романов, Д.С.Прохорова, Я.В.Сырцева, Е.А.Покушалов
ФГУ «Новосибирский НИИ патологии кровообращения имени академика Е.Н. Мешалкина Федерального агентства по высокотехнологичной медицинской помощи»
Резюме: С целью оценки многолетней эффективности ресинхронизирующей терапии у пациентов с хронической сердечной недостаточностью обследовано 170 пациентов в возрасте от 16 до 73 лет (средний возраст 62,1±9,5 лет), средний функциональный класс сердечной недостаточности по NYHA —3,2±0,4.
Ключевые слова: хроническая сердечная недостаточность, ресинхронизирующая терапия, эхокардиография, тест шестиминутной ходьбы, выживаемость.
Демографический прогноз предполагает, что самым распространенным заболеванием в человеческой популяции в XXI столетии станет хроническая сердечная недостаточность (ХСН). Современная медицина для данной группы пациентов предлагает следующие виды лечения: трансплантация сердца, хирургическую реваскуляризацию и медикаментозную терапию [1, 2]. Малое количество доноров и высокий риск послеоперационной смертности делают медикаментозную терапию наиболее распространѐнным видом лечения. Однако, несмотря на быстрые темпы развития фармакологической промышленности, смертность от сердечной недостаточности все еще остается на высоком уровне и многие пациенты, особенно с конечными стадиями заболевания испытывают симптомы ХСН, несмотря на оптимальную медикаментозную терапию [3, 4]. Это послужило толчком для разработки альтернативных методов лечения. Около 15 лет назад была предложена технология, названная сердечной ресинхронизирующей терапией (СРТ), которая направлена на восстановление синхронности желудочковых сокращений. Многие клинические исследования доказали, что использование СРТ увеличивает выживаемость, повышает качество жизни и улучшает систолическую функцию по сравнению с медикаментозной терапией при длительном наблюдении [5]. Нами проанализирован 5ти летний опыт использования ресинхронизирующей терапии у пациентов с электромеханической диссинхронией и сердечной недостаточностью рефрактерной к оптимальной медикаментозной терапии.
Цель исследования: оценить многолетнюю эффективность ресинхронизирующей терапии у пациентов с хронической сердечной недостаточностью.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Критерии включения
В период с мая 2004 года по 2010 год в НИИПК была произведена имплантация CRT у 170 пациентов. Средний возраст составил 62,1±9,5 (от 16 до 73) лет. Средний функциональный класс сердечной недостаточности по NYHA был 3,2±0,4. Преобладающей этиологией ХСН была ишемическая кардиомиопатия (n=98; 58%). Средняя продолжительность комплекса QRS составила 159,3±13,2 мс (от 84 до 245 мс). Предоперационная характеристика пациентов представлена в табл. 1. Пациенты, которым выполнялась имплантация ресинхронизирующих устройств, были отобраны по классическим критериям [6-12], а именно: ишемическая или дилатационная кардиомиопатия, функциональный класс ХСН III-IV по New-York Heart Association (NYHA), фракция выброса левого желудочка ≤35%, блокада левой ножки пучка Гиса с шириной комплекса QRS≥120 мс или признаки механической диссинхронии.
Таблица 1. Общая характеристика пациентов
| Пол (М/Ж) | 149/21 |
| Средний возраст, лет | 62,1±9,5 |
| ФВ, % | 24,5 ± 4,2 |
| NYHA, III/IV | 117/53 |
| КСО, мл | 166,3 ± 18,9 |
| КДО, мл | 231,3 ± 18,9 |
| Ширина QRS, мс | 169±31 |
| Диуретики, n (%) | 153 (90%) |
| Ингибиторы АПФ, n (%) | 149 (88%) |
| β-блокаторы, n (%) | 154 (91%) |
| Амиодарон, n (%) | 54 (32%) |
Техника имплантации
Операционный доступ выполнялся в левой подключичной области. Все электроды доставлялись трансвенозным доступом чрез подключичную вену. Предсердный электрод фиксировался в ушко правого предсердия, правожелудочковый электрод в верхушку правого желудочка. Далее к коронарному синусу заводилась система доставки, через которую контрастировались все ветви коронарного синуса, после чего левожелудочковый электрод позиционировался в одну из ветвей коронарного синуса, преимущественно в заднелатеральную область [13].
Послеоперационное наблюдение
Клиническое обследование пациентов проводились через каждые 6 месяцев после операции. У всех пациентов вычислялась общая продолжительность всех госпитализаций (дней в году) в период до и после имплантации ресинхронизирующего устройства. Отдельно проводился анализ критических сердечных событий, к которым относились сердечная смерть (внезапная сердечная смерть, смерть в результате прогрессирования застойной сердечной недостаточности, инфаркта миокарда, тромбоэмболии лѐгочной артерии или фатальных аритмий).
Симптомы сердечной недостаточности оценивались при помощи классификации NYHA [14]. Уровень качества жизни оценивался при помощи опросника Minnesota Living With Heart Failure Questionnaire (MLwHF) score [15]. Во время каждого визита производилась запись поверхностной ЭКГ (12 отведений) и измерение ширины комплекса QRS. Так же проводился тест 6-минутной ходьбы и эхокардиография (ЭхоКГ) с измерением фракции выброса левого желудочка. Оптимизация параметров кардиостимулятора осуществлялась на основании тканевой допплерографии при выписке из стационара, через 6 месяцев после операции и затем каждый раз при изменении кардиального статуса в негативную сторону.
Все ЭхоКГ исследования были выполнены на VIVID 7D GE Vingmed Ultrasound. Функция левого желудочка оценивалась путем измерения конечного диастолического объѐма (КДО), конечного систолического объема (КСО) и фракции выброса (ФВ) на основании алгоритма Симпсона [16], степени и объѐма митральной регургитации. Механическая межжелудочковая задержка определялась как разница предвыброса в легочную артерию и аорту. Задержку на 40 мс и более предложено называть межжелудочковой диссинхронией [17].
Все ЭхоКГ исследования были выполнены на VIVID 7D GE Vingmed Ultrasound. Функция левого желудочка оценивалась путем измерения конечного диастолического объѐма (КДО), конечного систолического объема (КСО) и фракции выброса (ФВ) на основании алгоритма Симпсона [16], степени и объѐма митральной регургитации. Механическая межжелудочковая задержка определялась как разница предвыброса в легочную артерию и аорту.
Задержку на 40 мс и более предложено называть межжелудочковой диссинхронией [17].
В нашем исследовании мы использовали следующие методы тканевой допплерографии. Tissue tracking показывает положение кривых амплитуды продольного движения сегментов миокарда левого желудочка [17]. Методика TSI показывает время задержки сокращения миокардиальных сегментов по отношению к началу комплекса QRS. При значении задержки более 40 мс документируется внутрижелудочковая диссинхрония [16].
Статистический анализ
Статистическая обработка результатов исследования проводилась на компьютере Pentium-IV с помощью системного пакета прикладных программ «STATISTICA for Windows. Версия 6.0». Все результаты выражены как арифметическое среднее ± SD.
В ходе статистического анализа выборочных данных примепонялись методы и средства, относящиеся к следующим основным разделам математической статистики: предварительная обработка данных, описательная статистика (графический анализ данных, исследование законов распределения данных, расчет основных статистических характеристик); статистическая проверка гипотез (t-критерий Стьюдента и F-критерий Фишера для проверки гипотез о равенстве числовых характеристик выборочных распределений данных); анализ таблиц сопряженности (критерий хи-квадрат); выживаемость пациентов выражалась графически по методу Kaplan-Maier. При этом статистически достоверным считалось значение p менее 0,05.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Всем пациентам имплантировалось ресинхронизирующее устройство производства Medtronic Inc., причѐм у 135 пациентов (79%) система имела классический набор электродов (к правому желудочку, левому желудочку и правому предсердию), а у 35 пациентов (21%) в связи с постоянной формой фибрилляции предсердий, имплантировались бивентрикулярные аппараты с установкой электродов к правому и левому желудочку. У 41 пациента (24%) потребовалось выполнение радиочастотной аблации атриовентрикулярного соединения по поводу медикаментозно-рефрактерной пароксизмальной или постоянной формы фибрилляции предсердий. У семнадцати пациентов (10%) до имплантации ресинхронизирующего устройства уже был имплантирован электрокардиостимулятор (5 однокамерных и 12 двухкамерных) по поводу брадипоказаний. У шести пациентов помимо имплантации левожелудочкового электрода, потребовалась замена предсердного или правожелудочкового электрода в связи с высоким порогом стимуляции.
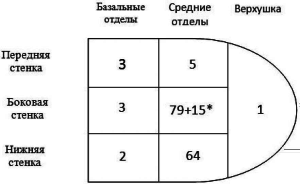
В зависимости от диаметра оптимальной ветви коронарного синуса, использовались различные левожелудочковые электроды: 110 (65%) Attain OTW Bipolar (Medtronic, USA), 42 (24%) Attain OTW (Medtronic, USA), 9 (6%) Starfix (Medtronic, USA). Большинство (77%) эндокардиальных левожелудочковых электродов было имплантировано в задне-латеральную область. Распределение положения электродов к левому желудочку в зависимости от области представлено на рис. 1.
У 15 пациентов (9%) не удалось имплантировать эндокардиальный левожелудочковый электрод. Причинами этого явились тромбоз коронарного синуса, высокий порог стимуляции, либо стимуляция диафрагмы, нестабильное положение электрода, что создавало повышенный риск его дислокации. Всем этим пациентам была выполнена левосторонняя-боковая торакотомия и имплантирован эпикардиальный электрод Capsure-Epi (Medtronic Inc., USA) на задне-боковую стенку левого желудочка. Среднее время имплантации составило 130,3 ±12,3 (от 70 до 178) минут. Среднее время рентгеноскопии составило 23,4 ± 3,2 (от 6 до 45) минуты.
У 37 пациентов (22%) потребовалась имплантация ресинхронизирующего устройства с функцией дефибриллятора (CRT-D, InSync III Protect, Medtronic Inc., USA). Показаниями для CRT-D явились клини¬ческая смерть в анамнезе (n=16; 9%) и пароксизмы устойчивой желудочковой тахикардии (n=22;13%). Остальным пациентам (n=133; 88%) имплантировалось устройство без функции дефибриллятора (CRT-P, InSync III, Medtronic Inc., USA).
Рис. 1. Схематическое изображение местоположения левожелудочковых электродов.
* количество имплантированных эпикардиальных электродов Capsure-Epi (Medtronic, USA).
В раннем послеоперационном периоде наблюдались следующие виды осложнений. У одного пациента на следующий день после имплантации развился левосторонний пневмоторакс, что потребовало установки дренажа в плевральную полость. В четырѐх случаях наблюдались дислокации одного из эндокардиальных электродов (левожелудочковый, n=2; правожелудочковый, n=1; предсердный, n=1). Все электроды были успешно репозиционированы.
Результаты 6-месячного наблюдения
Шесть пациентов (3,5%) умерли от сердечных причин в течение первых пяти месяцев после операции. В трѐх случаях причиной смерти явилась внезапная сердечная смерть, в одном случае острый инфаркт миокарда, в двух случаях прогрессирующая сердечная недостаточность. Одному пациенту была выполнена ортотопическая трансплантация сердца. Таким образом, полугодовое повторное обследование в нашей клинике прошли 163 из 170 пациентов. Сравнительная оценка дооперационных и 6-месячных данных пациентов представлена в табл. 2.
Таблица 2. Сравнительная оценка пациентов до имплантации ресинхронизирующего устройства
и через 6 месяцев после операции
| Параметры | До имплантации | 6 мес. (n 163) | р |
| ФВ, % | 24,5±4,2 | 33,2±7,1 | p=0,037 |
| NYHA | 3,2±0,4 | 2,2±0,7 | p=0,001 |
| КСО, мл | 166,3±18,9 | 122,1±17,5 | p=0,06 |
| КДО, мл | 231,3±18,9 | 207,1±18,4 | p=0,65 |
| Ширина QRS, мс | 159,3±13,2 | 143,2±15,4 | p=0,008 |
| MLwHF, points | 64,9±20 | 39,8±16 | p=0,001 |
| Тест 6-мин. ходьбы, м | 260±23 | 380±19 | p=0,004 |
| Диуретики, n (%) | 153 (90%) | 145 (89%) | p=0,62 |
| Ингибиторы АПФ, n (%) | 149 (88%) | 147 (90%) | p=0,74 |
| β-блокаторы, n (%) | 154 (91%) | 150 (92%) | p=0,91 |
| Амиодарон, n (%) | 54 (32%) | 50 (31%) | p=0,94 |
Средний функциональный класс сердечной недостаточности по NYHA улучшился на 32% с 3,2±0,4 на дооперационном этапе до 2,2±0,7 к 6 месяцам, причем у 19 пациентов (12%) он стал соответствовать первому классу, у 100 пациентов (61%) второму классу, у 38 пациентов (23%) третьему классу и у 6 пациентов (4%) четвѐртому классу NYHA. При тесте 6-минутной ходьбы среднее пройденное расстояние увеличилось на 46% с 260±23 м до 380±19 м. У 119 (73%) пациентов пройденная дистанция увеличилась более чем на 30%. Средняя фракция выброса левого желудочка увеличилась на 38,3% с 24±4,2% до 33,2±7,1%. У 112 пациентов (69%) фракция выброса возросла более чем на 30% (p=0,037).
Отдаленные результаты
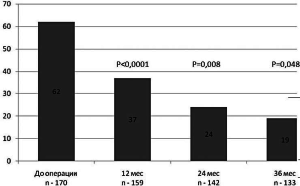
Отдаленный период наблюдения составил 35,2±4,5 (от 8 до 79) месяцев. В течение периода наблюдения зарегистрировано 25 летальных исходов (14%), из них 19 (12%) после 6-ти месяцев. Среди выясненных причин, 8 смертей были вызваны прогрессированием ХСН, 6 внезапной сердечной смертью, 3 острым инфарктом миокарда и две смерти были вызваны внесердечными причинами). Ещѐ одному пациенту была выполнена ортотопическая трансплантация сердца. Таким образом, в отдаленном периоде нами была оценена группа из 133 пациентов. До имплантации ресинхронизирующих устройств среднее количество дней, проведенных пациентами в медицинских учреждениях по поводу декомпенсации сердечной недостаточности составляло 62,1±8,7 дней в год. Через 12 месяцев после имплантации среднее количество дней госпитализации снизилось на 41% до 37,5±6,4 (P=0,0001). В дальнейшем, эта тенденция сохранилась, подробная характеристика показана на рис. 2.
Рис. 2. Динамика сроков госпитализации (дней/год) до имплантации ресинхронизирующего устройства, через 12, 24 и 36 месяцев.
Так же нами был оценен уровень критических сердечных событий (летальный исход или госпитализация по поводу декомпенсации ХСН). У пациентов с фибрилляцией предсердий уровень событий был выше в два раза по сравнению с пациентами, имеющими синусовый ритм (17% и 8% соответственно; p=0,004). В группе пациентов с имплантированными CRT-D устройствами уровень событий составил 9% в сравнении с 15% в группе пациентов, кому была выполнена имплантация CRT-P (p=0,012).
Наличие в прошлом имплантированного ЭКС по поводу бради-показаний повышало риск сердечных событий в два раза (28% и 14% соответственно; p=0,008). В группе пациентов, у которых левожелудочковый электрод был имплантирован в заднебоковую область, уровень событий составил 18% в сравнении с 24% у пациентов с другими локализациями (р=0,02).
«Респондеры»
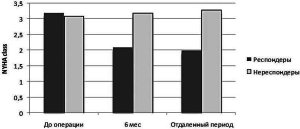
Через 6 месяцев после операции все пациенты были разделены на две группы: ответивших на ресинхронизирующую терапию («респондеры») и не ответивших («нереспондеры»). В группу ответивших на терапию были включены пациенты, у которых функциональный класс сердечной недостаточности по NYHA улучшился как минимум на единицу, КСО или КДО уменьшились не менее чем на 15%, фракция выброса левого желудочка увеличилась не менее чем на 10%. При полугодовом наблюдении обследовано 163 пациента, из них 77% были классифицированы как ответившие на терапию и 23% как не ответившие. До имплантации ресинхронизирующих устройств каких-либо отличий в клиническом статусе в этих группах не наблюдалось (табл.3). До имплантации ресинхронизирующих устройств в группе «респондеров» госпитализация по поводу декомпенсации ХСН составляла 61,2±9,3 дней, после имплантации количество дней госпитализации снизилось до 13,5±2,3 (p<0,0001). В группе «нереспондеров» достоверного снижения количества дней госпитализации не наблюдалось (рис. 3).
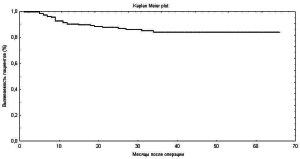
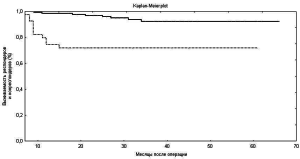
Отдаленный период наблюдения составил 32,3±5,2 месяцев. Среди «респондеров» зарегистрировано 10 (7%) летальных исходов, из них 4 от прогрессирования сердечной недостаточности, 2 от инфаркта миокарда, 3 от внезапной сердечной смерти и 1 от внесердечных причин. Среди «нереспондеров» заре¬гистрировано 9 (24%) летальных исходов, из них 4 от прогрессирования сердечной недостаточности, 1 от инфаркта миокарда, 3 от внезапной сердечной смерти и 1 от внесердечных причин. Общая выживаемость пациентов через 1, 2 и 3 года составила 93%, 90%, 88% соответственно (рис. 4). Отдаленная выживаемость пациентов в группе «респондеров» была значительно лучше и составила 96% и 93% через 2 и 3 года после операции, в сравнении с 81% и 76% в группе «нереспондеров» (рис. 5).
Таблица 3. Сравнительная оценка групп пациентов ответивших и не ответивших на ресинхронизирующую терапию
| Параметры | «Респондеры» (n=125) | «Нереспондеры» (n=38) | ||||
| До операции | 6 мес. | р | До операции | 6 мес. | р | |
| ФВ,% | 22,3±4,2 | 41,1±4,1 | р<0,0001 | 23,7±4,7 | 28,6±4,4 | р=0,062 |
| КСО, мл | 158±22,5 | 122±17,2 | р=0,006 | 156±18,3 | 149±17,5 | р=0,71 |
| КДО, мл | 226±21,4 | 207±16,4 | р=0,01 | 227±16,8 | 224±21,9 | р=0,82 |
| Класс ХСНпо NYHA | 3,1±0,3 | 2,1±0,3 | р=0,001 | 3,1±0,5 | 2,9±0,3 | р=0,78 |
| ШиринаQRS, мс | 161±18 | 135±19 | p<0,0001 | 169±19 | 158±21 | P=0,08 |
| MLwHF, points | 63,7±9,2 | 39,8±8,7 | р=0,001 | 64,2±10,3 | 51,9±7,9 | р=0,09 |
| Тест 6-мин. ходьбы, м | 259±18,3 | 392±23,4 | р<0,0001 | 260±21,3 | 272±14 | р=0,32 |
| Диуретики, n | 113 (89%) | 104 (83%) | р=0,69 | 33 (88%) | 33 (88%) | р=0,91 |
| (%) | ||||||
| ИнгибиторыАПФ, n (%) | 110 (88%) | 107 (86%) | р=0,73 | 34 (89%) | 35 (90%) | р=0,78 |
| βблокаторы, n (%) | 113 (90%) | 106 (85%) | р=0,82 | 35 (91%) | 34 (90%) | р=0,94 |
Рис. 3. Сравнение класса ХСН в группе «респондеров» и «нереспондеров».
Рис. 4. Отдаленная выживаемость пациентов на фоне ресинхронизирующей терапии (кривая Kaplan-Meier).
Рис. 5. Отдаленная выживаемость пациентов в группах «респондеров» и «нереспондеров» (кривая Kaplan-Meier).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты нашего исследования продемонстрировали, что СРТ значительно улучшает клинический и функциональный статус большинства пациентов с застойной сердечной недостаточностью, которые исходно имеют желудочковую диссинхронию. Многие рандомизированные многоцентровые клинические исследования доказали клиническую эффективность СРТ у пациентов через 6 месяцев и более после имплантации ресинхронизирующих кардиостимуляторов [6-12]. Эти исследования продемонстрировали значительное снижение функционального класса ХСН, увеличение ФВ и улучшение качества жизни. В некоторых исследованиях было оценено улучшение клинического статуса через 1 год после СРТ [7]. В исследовании MUSTIC был оценен уровень качества жизни через 12 месяцев после имплантации ресинхронизирующего кардиостимулятора (n=76). А.Auricchio et al. в исследовании PATH-CHF показали на 29 пациентах улучшение функционального класса ХСН по NYHA, улучшение качества жизни, увеличение пройденной дистанции (тест 6-минутной ходьбы) и потребление кислорода через 12 месяцев после имплантации ресинхронизирующего устройства [8].
Помимо улучшения функционального статуса, эффект ресинхронизирующей терапии был оценен путем подсчета количества дней госпитализации по поводу декомпенсации сердечной недостаточности.
В исследовании MIRACLE показано достоверное снижение дней госпитализации по поводу декомпенсации сердечной недостаточности через 6 месяцев после имплантации ресинхронизирующего устройства, в сравнении с группой пациентов с оптимальной медикаментозной терапией [6]. Объединенные данные четырех исследований (CONTAK CD, InSync ICD, MIRACLE and MUSTIC) с общим количеством включенных пациентов 1690 показали снижение уровня госпитализации на 29% через 6 месяцев после имплантации ресинхронизирующего устройства [12]. В нашем исследовании получены идентичные данные о снижении уровня госпитализации при наблюдении более 3 лет. Так, в первый год после имплантации ресинхронизирующего устройства уровень госпитализации снизился с 62,1±8,7 до 37,5±6,4 дней. В дальнейшем эта тенденция сохранилась, показывая продолжающийся ответ на ресинхронизирующую терапию.
Доступные клинические исследования, оценивающие долгосрочную выживаемость после имплантации ресинхронизирующих устройств, очень ограничены во времени наблюдения. В анализе, проведенном D.J.Bradley at al., показано снижение уровня летальности по сравнению с контрольной группой на 51%, однако период наблюдения составил всего 6 месяцев. В исследовании MIRACLE-ICD выживаемость пациентов в полугодовом периоде наблюдения составила 92% [10]. Один из самых длительных периодов наблюдения был получен в исследовании COMPANION, годовая выживаемость пациентов после имплантации ресинхронизирующих устройств составила 85% [11]. В нашем исследовании у 163 пациентов была оценена выживаемость через 1, 2 и 3 года после имплантации ресинхронизирующего устройства, которая составила 93%, 88%, 85% соответственно.
Проблема «респондеров» и «нереспондеров» остается актуальной. В нашем исследовании через 6 месяцев от начала СРТ 23% пациентов не улучшили свой функциональный класс ХСН и были отнесены в группу «нереспондеров». Схожие результаты показало исследование MIRACLE: 20-30% пациентов были отнесены в группу «нереспондеров». Однако, не получены данные о долгосрочном прогнозе у этих пациентов. В настоящем исследовании показано, что пациенты, которые не ответили на ресинхронизирующую терапию через 6 месяцев, не улучшили свой функциональный статус и качество жизни и в отдаленном периоде. Кроме того, в группе «нереспондеров» не было динамики продолжительности госпитализации, а выживаемость была значительно ниже, чем в группе «респондеров». S.Reuter et al. в своем исследовании продемонстрировали, что на дооперационном этапе характеристики пациентов в группе «респондеров» и «нереспондеров» были сопоставимы [18]. В нашем исследовании получены схожие результаты. Существующие на сегодняшний день данные об альтернативных методах повышающих долю «респондеров» противоречивы. Ряд исследований продемонстрировал повышение процента «респондеров» при использовании тканевой допплерографии в качестве критерия механической диссинхронии [19-22]. Однако исследование PROSPECT не выявило «золотого стандарта» в обнаружении диссинхронии, который бы повысил силу ответа на СРТ терапию [23].
CRT—P и CRT-D
Исследование CARE-HF продемонстрировало, что общая смертность пациентов через 29 месяцев после СРТ была снижена до 36% в сравнении с медикаментозной терапией. Хотя CARE-HF не сравнивало непосредственно CRT-P и CRT-D, тем не менее обеспечило убедительные доказательства в поддержку потенциала CRT-P для значительного уменьшения летальности пациентов с сердечной недостаточностью. С другой стороны, остается нерешѐнным вопрос о воздействии CRT-P на жизнеугрожающие аритмии, а риск внезапной сердечной смерти все еще составляет 32% от всех смертельных случаев у пациентов после кардиоресинхронизирующей терапии [24].
Исследование COMPANION продемонстрировало, что СРТ снижает объединенный риск смерти или первой госпитализации у пациентов с застойной сердечной недостаточностью и широким комплексом QRS. Различий в уровне летальности между группами CRT-P и CRT-D не наблюдалось, однако внезапная сердечная смерть была уменьшена на 63% у пациентов с CRT-D устройствами. Хотя исследование COMPANION не было спроектировано для сравнения CRT-P и CRTD, открытия данного исследования демонстрируют уверенную терапевтическую ассоциацию CRT-D с уменьшением риска внезапной сердечной смерти [25]. В настоящем исследовании в группе CRT-D частота смерти или госпитализации по поводу декомпенсации ХСН оказалась в 1,5 раза ниже. Однако, вопрос преимущества CRT-P и CRT-D устройств на сегодняшний день остается открытым.
ЗАКЛЮЧЕНИЕ
Кардиоресинхронизирующая терапия является высокоэффективным методом лечения пациентов с систолической дисфункцией левого желудочка в сравнении с медикаментозной терапией при многолетнем наблюдении. Однако высокий процент «нереспондеров» требует поиска новых методов выявления кандидатов для кардиоресинхронизирующей терапии и повышения ее эффективности.
ЛИТЕРАТУРА
1. Goldman JH, McKenna WJ. The epidemiology of heart failure secondary to coronary artery disease// Coron Art Dis 1998; 9: 625-628.
2. Gheorghiade M, Bonow RO. Chronic heart failure in the United States: A manifestation of coronary artery disease // Circulation 1998; 97: 282-289.
3. O’Connell JB, Bristow MR. Economic impact of heart failure in the United States: Time for a different approach // J Heart Lung Transplant 1994; 13: S107-S112.
4. Cleland JG, Swedberg K, Poole-Wilson PA. Successes and failures of current treatment of heart failure // Lancet 1998; 352: SI19-SI28.
5. Faran A, Lewicka-Nowak E, Dabrowska-Kugacka A et al. Cardiac resynchronisation therapy in patients with endstage heart failure long-term follow-up // Kardiologia Polska 2008; 66: 1
6. Abraham WT, Fisher AWG, Smith AL, Delurgio DB, Leon RA, Loh E, Kocovik DZ, Packer M, Clavell AL, Hayes DL, Ellestad M, Messenger J, for the MIRACLE Study Group: Cardiac resynchronization in chronic heart failure // N Engl J Med 2002; 346: 1845-1853.
7. Linde C, Leclercq C, Rex S. et al. Long-term benefi ts of biventricular pacing in congestive heart failure: Results from the Multisite STimulation In Cardiomyopathy (MUSTIC) study // J Am Coll Cardiol 2002; 40: 111-118.
8. Auricchio A, Stellbrink C, Sack S, Block M, Vogt J, Bakker P, Huth C, Schondube F, Wolfhard U, Bocker D, Krahnefeld O, Kirkels H, for the Pacing Therapies in Congestive Heart Failure (PATHCHF) Study Group. Longterm clinical effect of hemodynamically optimized cardiac resynchronization therapy in patients with heart failure and ventricular conduction delay // J Am Coll Cardiol 2002; 39: 2026-2033.
9. Gras D, Leclercq C, Tang AS et al. Cardiac resynchronization therapy in advanced heart failurethe multicenter InSync clinical study // Eur J Heart Fail 2002; 4: 311-320.
10. Young JB, Abraham WT, Smith AL, Leon R, Lieberman R, Wilkoff B, Canby RC, Schroeder JS, Bing Liem L, Hall S, Wheelan K, Multicenter InSync ICD Randomized Clinical Evaluation (MIRACLE ICD) Trial Investigators: Combined cardiac resynchronization and implantable cardioversion defi brillation in advanced chronic heart failure: The MIRACLE ICD Trial // JAMA 2003; 289: 2685-2694.
11. BristowMR, Saxon LA, Boehmer J, Krueger S, Kass DA, DeMarco T, Carson P, DiCarlo L, DeMets D, White BG, DeVriesDW, Feldman AM, for the Comparison of Medical Therapy, Pacing, and Defi brillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronization therapy with or without an implantable defi brillator in advanced chronic heart failure // N Engl J Med 2004; 350: 2140-2150.
12. Bradley DJ, Bradley EA, Baughman KL et al. Cardiac resynchronization and death from progressive heart failure: A meta-analysis of randomised controlled trials // JAMA 2003; 289: 730-740.
13. Abraham WT, Fisher WG, Smith AI Cardiac resynchronization in chronic heart failure cardiac resynchronization in chronic heart failure // NEJM 2002, V 346, N 24.
14. Dunselman PH, Kuntze CE, van Bruggen A et al. Value of New York Heart Association classifi cation, radionuclide ventriculography, and cardiopulmonary exercise tests for selection of patients for congestive heart failure studies // Am Heart J. 1988 Dec;116 (6 Pt 1):1475-82.
15. Riegel B, Moser DK, Glaser D. et al. The Minnesota Living With Heart Failure Questionnaire: sensitivity to differences and responsiveness to intervention intensity in a clinical population // Nurs Res 2002 Jul-Aug;51(4):209-18.
16. Van de Veire NR, Bleeker GB, De Sutter J et al. Tissue synchronisation imaging accurately measures left ventricular dyssynchrony and predicts response to cardiac resynchronization therapy // Heart 2007;93:1034-1039.
17. Bax J, Abraham T, Barold S et al. Cardiac Resynchronization Therapy: Part 1-Issues before Device Implantation // J Am Coll Cardiol. 2005; 46(12): 2153-2167.
18. Reuter S, Garrigue S, Barold SS et al. Comparison of characteristics in responders versus nonresponders with biventricular pacing for drugresistant congestive heart failure // Am J Cardiol 2002;89:346-350.
19. Bax JJ, Ansalone G, Breithardt OA, et al. Echocardiographic evaluation of cardiac resynchronization therapy: ready for routine clinical use? A critical appraisal // J Am Coll Cardiol 2004; 44: 1-9.
20. Yu CM, Fung JW, Zhang Q, et al. Tissue Doppler imaging is superior to strain rate imaging and postsystolic shortening on the prediction of reverse remodeling in both ischemic and nonischemic heart failure after cardiac resynchronization therapy // Circulation 2004; 110: 66-73.
21. Ansalone G, Giannantoni P, Ricci R, et al. Doppler myocardial imaging in patients with heart failure receiving biventricular pacing treatment // Am Heart J 2001; 142: 881-96.
22. Garrigue S, Reuter S, Labeque JN, et al. Usefulness of biventricular pacing in patients with congestive heart failure and right bundle branch block // Am J Cardiol 2001; 88: 1436-41.
23. Chung ES, Leon AR, Tavazzi L. Results of the Predictors of Response to CRT (PROSPECT) trial // Circulation. 2008; 117(20): 2608-16.
24. Cleland JG, Daubert JC, Erdmann E et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure // N Engl J Med 2005; 14; 352: 1539-49.
25. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, Carson P, DiCarlo L, DeMets D, White BG, DeVries DW, Feldman AM; Comparison of Medical Therapy, Pacing, and Defi brillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronization therapy with or without an implantable defi brillator in advanced chronic heart failure // N Engl J Med. 2004;350:2140-2150.
26. Bigger JT Jr. Prophylactic use of implanted cardiac defi brillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery: Coronary Artery Bypass Graft (CABG) Patch Trial Investigators // N Engl J Med. 1997; 337: 1569-1575.
27. Moss AJ, Zareba W, Hall WJ, et al., Multicenter Automatic Defi brillator Implantation Trial II Investigators. Prophylactic implantation of a defi brillator in patients with myocardial infarction and reduced ejection fraction // N Engl J Med 2002;346: 877-83.
28. Goldenberg I, Moss AJ, McNitt S, et al., for the MADITII Investigators. Time-dependence of defi brillator benefi t after coronary revascularization in the Multicenter Automatic Defi brillator Implantation Trial (MADIT)-II. // J Am Coll Cardiol 2006; 47: 1811-7.
Источник: ВЕСТНИК АРИТМОЛОГИИ, № 61, 2010













Комментировать