Путь введения лекарственных препаратов. Как и в предыдущих рекомендациях, используются два основных доступа для введения препаратов:
- Внутривенный, в центральные или периферические вены. Оптимальным путем введения являются центральные вены — подключичная и внутренняя яремная, поскольку обеспечивается доставка вводимого препарата в центральную циркуляцию. Для достижения этого же эффекта при введении в периферические вены препараты должны быть разведены в 20 мл физиологического раствора.
- Внутрикостный путь — внутрикостная инъекция лекарственных препаратов в плечевую или большеберцовую кость обеспечивает адекватную плазменную концентрацию, по времени сравнимую с введением препаратов в центральную вену. Использование механических устройств для внутрикостного введения лекарственных препаратов обеспечивает простоту и доступность данного пути введения.
Фармакологическое обеспечение реанимации
- Адреналин:
а) при электрической активности без пульса/асистолии (ЭАБП/асистолия) — 1 мг каждые 3–5 минут внутривенно;
б) при ФЖ/ЖТ без пульса адреналин вводится только после третьего неэффективного разряда электрической дефибрилляции в дозе 1 мг. В последующем данная доза вводится каждые 3–5 минут внутривенно (т.е. перед каждой второй дефибрилляцией) столь долго, сколько сохраняется ФЖ/ЖТ без пульса. При этом необходимо отметить, что после восстановления самостоятельного кровообращения даже маленькие дозы адреналина (50–100 мкг) могут вызвать развитие тахикардии, ишемии миокарда, ФЖ/ЖТ без пульса. Поэтому в раннем постреанимационном периоде адреналин больше не вводится, а при необходимости вазопрессорной поддержки используются норадреналин или мезатон.
Мы хотели бы отметить еще один практический момент, который не обсуждается в рекомендациях ERC-2015, но кажется нам важным. Так, в нашей практике с момента начала СЛР и обеспечения венозного доступа мы сразу подключаем вазопрессорную поддержку (обычно мезатоном). После восстановления самостоятельного гемодинамически эффективного ритма в этом случае имеется подпор общего периферического сопротивления сосудов, не допускающий повторной остановки кровообращения вследствие критической гипотензии. А с учетом того факта, что больше чем в половине случаев у пациентов, перенесших остановку кровообращения, в раннем постреанимационном периоде требуется вазопрессорная поддержка, данный подход может повышать эффективность СЛР.
- Амиодарон — антиаритмический препарат первой линии при ФЖ/ЖТ без пульса, рефрактерной к электроимпульсной терапии, вводится после 3-го неэффективного разряда в начальной дозе 300 мг (разведенные в 20 мл 5% раствора глюкозы либо другого растворителя), а после пятого неэффективного разряда повторно однократно вводится еще 150 мг.
- Лидокаин — в случае отстутствия амиодарона (при этом он не должен использоваться в качестве дополнения к амиодарону) — начальная доза 100 мг (1–1,5 мг/кг) в/в, при необходимости дополнительно болюсно вводится по 50 мг (при этом общая доза не должна превышать 3 мг/кг в течение первого часа).
- Бикарбонат натрия — рутинное применение в процессе СЛР или после восстановления самостоятельного кровообращения не рекомендуется.
Остановка кровообращения представляет собой комбинацию респираторного и метаболического ацидоза. Оптимальным методом коррекции ацидемии при остановке кровообращения является проведение компрессии грудной клетки, дополнительный положительный эффект обеспечивается проведением вентиляции.
Рутинное введение бикарбоната натрия в процессе СЛР за счет генерации СО2, диффундирующей в клетки, вызывает ряд неблагоприятных эффектов:
- усиление внутриклеточного ацидоза;
- отрицательное инотропное действие на ишемизированный миокард;
- нарушение кровообращения в головном мозге за счет наличия высокоосмолярного натрия;
- смещение кривой диссоциации оксигемоглобина влево, что может снижать доставку кислорода к тканям.
Показанием для введения бикарбоната натрия являются случаи жизнеугрожающей гиперкалиемии, а также остановка кровообращения, ассоциированная с гиперкалиемией или передозировкой трициклических антидепрессантов в дозе 50 ммоль (50 мл — 8,4 % раствора) или 1 ммоль/кг в/в.
- Хлорид кальция — в дозе 10 мл 10% раствора в/в (6,8 ммоль Сa 2+ ) при гиперкалиемии, гипокальциемии, передозировке блокаторов кальциевых каналов.
Дефибрилляция
Проведение ранней дефибрилляции в течение первых 3–5 минут с момента остановки кровообращения обеспечивает уровень выживаемости, достигающий 50–70 %, что возможно реализовать только при внедрении общественно доступной дефибрилляции. При этом каждая минута задержки проведения дефибрилляции снижает выживаемость пациентов в постреанимационном периоде на этапе выписки из больницы на 10–12 %. При этом необходимо отметить, что ряд проведенных исследований использования AED врачебными бригадами в больничных условиях по сравнению с использованием профессиональных дефибрилляторов показал снижение уровня выживаемости пациентов.
Выделяют трехфазную время-зависимую модель развития фибрилляции желудочков, которая включает в себя последовательно развивающиеся фазы:
— электрическую (первые 4–5 минут), во время которой эффективным методом ее устранения является электрическая дефибрилляция;
— циркуляторную (последующие 5–10 минут — пролонгированная ФЖ), эффективным методом ее устранения является предварительное проведение компрессии грудной клетки и только в последующем электрической дефибрилляции;
— метаболическую — необходимо проведение метаболической терапии.
Следует подчеркнуть, что непрерывная компрессия грудной клетки может быть полезной на ранних стадиях ФЖ, в электрическую и циркуляторную фазу, в то время как дополнительная вентиляция более значимой становится в позднюю — метаболическую фазу ФЖ. Также было установлено, что проведение перед дефибрилляцией компрессии грудной клетки в течение 180 секунд может быть полезным (более короткий — 30–60 с, как и более длинный период > 180 с, неэффективны).
При выявлении на кардиомониторе/дефибрилляторе ФЖ/ЖТ без пульса необходимо немедленно нанести один разряд электрической дефибрилляции. Сразу же после нанесения разряда дефибрилляции следует продолжить компрессию грудной клетки и другие компоненты СЛР в течение 2 минут и только затем провести оценку ритма по ЭКГ и в случае восстановления синусового ритма оценить его гемодинамическую эффективность по наличию пульса на сонной артерии. Поскольку, даже если дефибрилляция будет эффективной и восстановится по данным ЭКГ синусовый ритм, крайне редко сразу после дефибрилляции он является гемодинамически эффективным (т.е. способным генерировать пульс, а значит, и кровообращение). Обычно еще требуется проведение порядка 1 минуты компрессии грудной клетки для восстановления самостоятельного кровообращения (пульса). При этом необходимо подчеркнуть, что в случае восстановления гемодинамически эффективного ритма дополнительная компрессия грудной клетки не приведет к повторному развитию ФЖ. И наоборот, в случае восстановления только организованной биоэлектрической активности сердца, но гемодинамически неэффективной прекращение проведения компрессии грудной клетки неизбежно приведет к рефибрилляции желудочков.
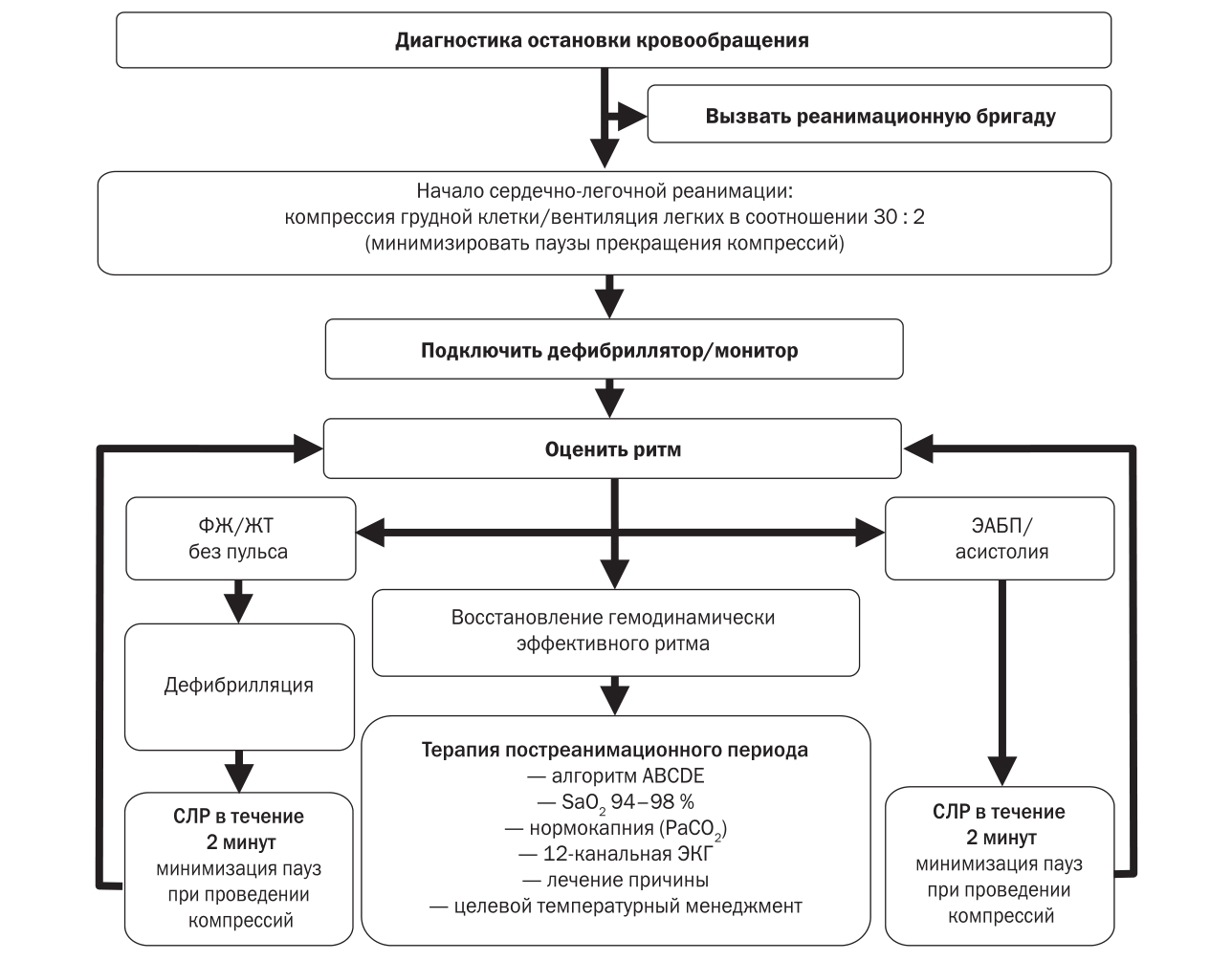
Вышеизложенные факты являются обоснованием немедленного начала проведения компрессии грудной клетки после нанесения разряда дефибрилляции в течение 2 минут и только последующей оценки ритма по ЭКГ, а в случае восстановления синусового ритма — оценки пульсации на сонной артерии.
Промежуток между разрядом дефибрилляции и продолжением компрессии грудной клетки не должен превышать 10 секунд.
Оценка ритма/пульса также не должна превышать 10 секунд — в случае сохранения на ЭКГ ФЖ/ЖТ без пульса, необходимо нанести повторный разряд дефибрилляции с последующей компрессией грудной клетки и компонентами СЛР в течение 2 минут. В случае восстановления синусового ритма по данным ЭКГ-мониторинга, но отсутствия пульса необходимо немедленно продолжить компрессию грудной клетки в течение 2 мин, с последующей оценкой ритма и пульса: разряд СЛР в течение 2 мин → оценка ритма/пульса → разряд СЛР в течение 2 минут…
Монофазная дефибрилляция больше не рассматривается в связи с тем, что дефибрилляторы такого типа уже не выпускаются, а сам принцип, реализованный в старых моделях дефибрилляторов, малоэффективен и вызывает выраженное постдефибрилляционное повреждение миокарда. Результаты исследований показали, что бифазная дефибрилляция, использующая меньшую энергию, значительно более эффективна и в меньшей степени вызывает повреждение и постреанимационную дисфункцию миокарда по сравнению с эквивалентной энергией монофазного импульса.
Начальный уровень энергии для бифазных дефибрилляторов должен составлять 150 Дж, с последующей эскалацией энергии при повторных разрядах. В целом необходимо руководствоваться рекомендациями заводов — производителей бифазных дефибрилляторов.
При проведении электрической дефибрилляции обязательным является выполнение трех основных условий: правильного расположения электродов (один справа по парастернальной линии ниже ключицы, другой слева по среднеподмышечной линии в проекции верхушки сердца). Для стандартных электродов (неадгезивных) в момент нанесения разряда необходимо обеспечить силу приложения на электроды в пределах 8 кг и обязательно использовать специальный электропроводный гель либо в его отсутствие прокладки, смоченные токопроводящим раствором. Недопустимо использование сухих электродов, поскольку это существенно снижает эффективность дефибрилляции (сводя ее практически к нулю) и вызывает ожоги кожных покровов.
В новых рекомендациях рекомендуется преимущественное использование адгезивных (самоклеящихся) электродов по сравнению со стандартными электродами, поскольку было показано, что их использование является более удобным, высвобождает руки и позволяет минимизировать паузы перед проведением дефибрилляции. Все современные модели дефибрилляторов наряду со стандартными электродами комплектуются самоклеящимися электродами.
Во время проведения дефибрилляции никто из участников реанимации не должен притрагиваться к пациенту и/или его кровати.
Если у пациента имеется имплантированный электрокардиостимулятор, то электроды дефибриллятора должны размещаться от него на расстоянии минимум 8 см. В этой ситуации также рекомендуется использование переднезаднего расположения электродов.
Еще раз необходимо подчеркнуть, что при ФЖ/ЖТ без пульса 1 мг адреналина и 300 мг амиодарона в/в необходимо вводить только после третьего неэффективного разряда электрической дефибрилляции. В последующем, в случае персистирующей ФЖ, адреналин вводится каждые 3–5 мин на протяжении всего периода СЛР. Амиодарон повторно однократно вводится в дозе 150 мг после пятого неэффективного разряда дефибрилляции.
Мониторинг во время проведения СЛР
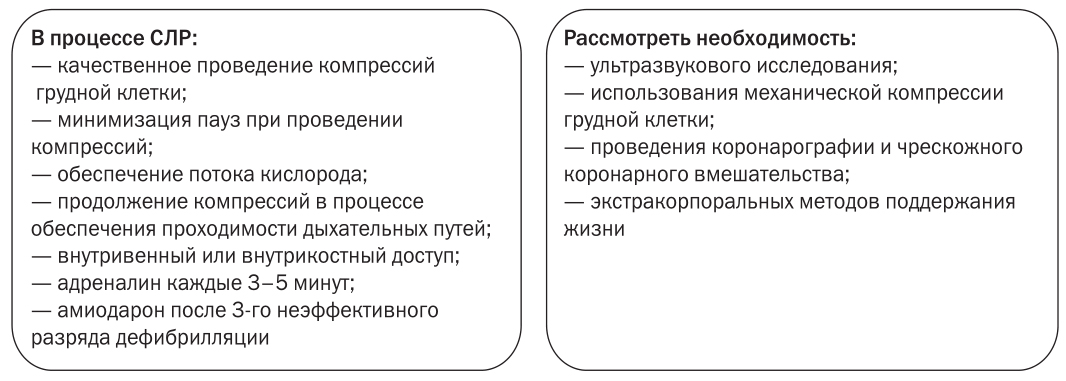
В новых рекомендациях большое внимание уделяется мониторингу, позволяющему оценить качество и эффективность проводимых реанимационных мероприятий. В связи с этим предложен целый ряд технологий для использования в процессе проведения СЛР.
- Применение датчика, оценивающего качество проводимой компрессии грудной клетки по частоте и глубине компрессий, а также проводимой вентиляции по частоте и объему. Данная технология реализована в ряде современных дефибрилляторов и представляет собой устройство, которое располагается на грудной клетке пациента и на которое производится компрессия в процессе СЛР, с последующим отображением на кардиомониторе дефибриллятора вышеуказанных параметров компрессии и вентиляции, при этом существует возможность обратной связи с голосовой подсказкой правильности проведения реанимационных мероприятий. Именно данное устройство позволяет контролировать оптимальную глубину (не менее 5 и не более 6 см) и частоту компрессии и не допускать гипервентиляции.
- Капнографический датчик, который также является опцией дефибриллятора. Капнография в процессе СЛР позволяет верифицировать положение эндотрахеальной трубки, оценить качество проводимой СЛР и является ранним индикатором восстановления самостоятельного гемодинамически эффективного кровообращения.
- Ультразвуковое исследование при СЛР позволяет выявить потенциально обратимые причины остановки кровообращения согласно алгоритму «четыре Г — четыре Т» (тампонада сердца, ТЭЛА, пневмоторакс), а также идентифицировать псевдоэлектрическую активность без пульса.
Потенциально обратимые причины СЛР
Вероятность благоприятного исхода СЛР при ЭАБП/асистолии (как и при рефрактерной ФЖ/ЖТ) можно повысить, только если имеются потенциально обратимые причины остановки кровообращения, поддающиеся лечению. Они представлены в виде универсального алгоритма «четыре Г — четыре Т».

Прекращение реанимационных мероприятий
СЛР необходимо проводить так долго, как долго сохраняется на ЭКГ фибрилляция желудочков, поскольку при этом сохраняется минимальный метаболизм в миокарде, что обеспечивает потенциальную возможность восстановления самостоятельного кровообращения.
В случае остановки кровообращения по механизму ЭАБП/асистолии, при отсутствии потенциально обратимой причины (согласно алгоритму «четыре Г — четыре Т») СЛР проводят в течение 30 минут, а при ее неэффективности прекращают.
СЛР более 30 минут проводят в случаях гипотермии, утопления в ледяной воде и передозировки лекарственных препаратов.
Время прекращения реанимационных мероприятий фиксируется как время смерти пациента.
Проводимые исследования все больше расширяют возможности систем неотложной перфузионной реанимации (EPR — Emergency Perfusion Resuscitation). Данные системы представляют собой портативные аппараты искусственного кровообращения, обеспечивающие экстракорпоральное поддержание кровообращения у пациентов в состоянии клинической смерти, у которых стандартный комплекс СЛР неэффективен, но при этом имеется потенциально обратимая причина, на которую можно воздействовать специфическими методами терапии. Потенциально обратимыми причинами, для которых показано применение EPR, являются: острый коронарный тромбоз — для проведения чрескожного коронарного вмешательства (ЧКВ), массивная ТЭЛА — для проведения тромбэктомии, тяжелое общее переохлаждение — для экстракорпорального согревания пациента. Необходимо подчеркнуть, что указанные аппараты могут, кроме экстракорпорального согревания, обеспечить индукцию терапевтической гипотермии.














Комментировать