В октябрьском номере журнала «Resuscitation» за 2015 г. были опубликованы новые рекомендации Европейского совета по реанимации (ERC-2015), в которых был внесен ряд изменений в алгоритм сердечно-легочной и церебральной реанимации (СЛЦР), представленных в настоящем обзоре.
Частота внезапной смерти в Европе составляет 55–113 случаев на 100 000 человек/год или 350–700 тысяч/год. Организационные принципы оказания помощи базируются на «цепочке выживания», включающей раннее распознавание остановки кровообращения и сообщение соответствующим службам, скорейшее начало СЛР, раннюю дефибрилляцию и специализированную помощь на раннем этапе постреанимационного периода.
Первичным механизмом остановки кровообращения в 20–50 % случаев является развитие фибрилляции желудочков (ФЖ). Причем с момента широкого распространения в США и Европе общественно доступной дефибрилляции с использованием автоматических наружных дефибрилляторов — AED (AutomaticExternalDefibrillator) частота регистрации ФЖ в качестве первичного механизма остановки кровообращения при внезапной смерти увеличилась до 76 %. Этот факт подчеркивает важность обеспечения условий для проведения ранней дефибрилляции в местах значительного скопления людей (торговых центрах, концертных залах, вокзалах, аэропортах, самолетах и т.п.), которая продемонстрировала свою высокую эффективность во всем мире. Хочется надеяться, что общественно доступная дефибрилляция в обозримом будущем сможет стать реальностью и в Украине. При этом необходимо подчеркнуть, что первым шагом в этом направлении должна быть организация функционирования службы скорой медицинской помощи и обучения врачей и фельдшеров навыкам СЛР с обязательной комплектацией всех машин скорой помощи автоматическими дефибрилляторами. Поскольку основной успех СЛР с хорошими неврологическими исходами достигается, согласно данным мировой статистики, именно на догоспитальном этапе, следующим шагом является подготовка диспетчеров службы скорой медицинской помощи, которые по телефону смогут консультировать обратившихся за помощью лиц и инструктировать непрофессионалов по проведению СЛР до момента приезда бригады скорой медицинской помощи, как это уже реализовано за рубежом.
Современный комплекс СЛР (А — airway, В — breathing, С — circulation), начиная с рекомендаций ERC-2010, модифицирован в алгоритм С-А-В, в связи с чем первым этапом после диагностики остановки кровообращения является немедленное начало компрессий грудной клетки и лишь затем восстановление проходимости дыхательных путей и искусственное дыхание.
Согласно новым рекомендациям, основной акцент при обучении непрофессионалов должен быть сделан на таких признаках критического состояния, как отсутствие сознания и нарушение внешнего дыхания, которые должны использоваться в качестве маркеров наступления остановки кровообращения.
При этом необходимо отметить, что агональное дыхание (гаспинг) наблюдается в первые минуты остановки кровообращения у 40 % пациентов и связано с более высоким уровнем выживаемости.
Искусственное поддержание кровообращения.
Компрессия грудной клетки. Фундаментальной проблемой искусственного поддержания кровообращения является очень низкий (менее 30 % от нормы) уровень сердечного выброса, создаваемого при компрессии грудной клетки. Правильно проводимая компрессия обеспечивает поддержание систолического АД на уровне 60–80 мм рт.ст., в то время как АД диастолическое редко превышает 40 мм рт.ст. и, как следствие, обусловливает низкий уровень мозгового (30–60 % от нормы) и коронарного (5–20 % от нормы) кровотока. При проведении компрессии грудной клетки коронарное перфузионное давление повышается только постепенно и поэтому с каждой очередной паузой, необходимой для проведения дыхания рот в рот, оно быстро снижается. Необходимо минимум 20 компрессий, чтобы достигнуть максимально возможного уровня системной гемодинамики. В связи с этим было показано, что соотношение числа компрессий и частоты дыхания, равное 30 : 2, является наиболее эффективным.
Проведенное исследование у интубированных пациентов показало, что при правильно проводимой компрессии грудной клетки дыхательный объем составляет только 40 мл, что является недостаточным для адекватной вентиляции. Это положение является обоснованием, не позволившим включить в новые рекомендации так называемую безвентиляционную СЛР, и по-прежнему рекомендуется обучение непрофессионалов стандартному комплексу СЛР, включающему в себя компрессию грудной клетки и искусственное дыхание рот в рот.
Однако в случаях, когда реаниматор не умеет или не желает проводить искусственное дыхание рот в рот, от него требуется проведение только одной компрессии грудной клетки.
Новым в рекомендациях ERC-2015 стало изменение частоты компрессии, которая должна составлять 100–120 в 1 минуту, а глубина компрессий должна быть не менее 5 см, но не более 6 см. Проведенное среди 9136 пациентов исследование показало, что глубина компрессии в диапазоне 4–5,5 см ассоциировалась с лучшим уровнем выживаемости. Глубина более 6 см была связана с большим количеством осложнений. У 13 469 пациентов с остановкой кровообращения сравнивались различные варианты использованной частоты компрессий грудной клетки (>140/мин, 120–139/мин, <80/мин, 80–90/мин), в результате максимально высокий уровень выживаемости наблюдался у пациентов, которым проводилась компрессия с частотой 100–120/мин.
Основной акцент в современных рекомендациях делается на минимизации любых пауз, прекращающих проведение компрессии грудной клетки, поскольку правильно проводимая компрессия грудной клетки является залогом успеха реанимационных мероприятий.
В целом правила проведения компрессии грудной клетки представлены в следующих положениях:
- Глубина компрессии не менее 5 см, но не более 6 см.
- Частота компрессий должна составлять 100–120 в 1 минуту с минимизацией, насколько это возможно, пауз.
- Обеспечение после компрессии грудной клетки ее полной декомпрессии, не допуская руками сопротивления, при этом руки не должны отрываться от грудной клетки.
- Соотношение числа компрессий и частоты дыхания без протекции дыхательных путей либо с
- протекцией ларингеальной маской или воздуховодом Combitube как для одного, так и для двух реаниматоров должно составлять 30:2 и осуществляться с паузой на проведение ИВЛ (риск развития аспирации!).
- У интубированных пациентов компрессия грудной клетки должна проводиться с частотой 100–120/мин, вентиляция — с частотой 10/мин (в случае использования мешка Амбу — 1 вдох каждые 5 секунд), без паузы при проведении ИВЛ (т.к. компрессия грудной клетки с одновременным раздуванием легких увеличивает коронарное перфузионное давление).
По результатам целого ряда работ были выделены наиболее частые осложнения при проведении компрессии грудной клетки: переломы ребер (13–97 %) и перелом грудины (1–43 %). При этом частота переломов была достоверно более высокой при глубине компрессий более 6 см. Менее часто наблюдались повреждения внутренних органов (легких, сердца, органов брюшной полости).
Хотелось бы также привести интересные данные, полученные при анализе 345 случаев проведения непрофессионалами компрессии грудной клетки пациентам, которые были без сознания, но у которых не было остановки кровообращения. Авторы выявили небольшую частоту осложнений в виде переломов ребер и ключицы (1,7 %), боли в области грудной клетки в месте проведения компрессии (8,7 %). Более серьезных осложнений установлено не было. Указанные данные, по-видимому, могут служить обоснованием разъяснения непрофессионалам признаков, которые должны настораживать в отношении возможной остановки кровообращения, таким как отсутствие сознания и нарушение внешнего дыхания, поскольку гипердиагностика клинической смерти все-таки лучше, чем ее нераспознание и, соответственно, непроведение СЛР у пациентов, которым она в буквальном смысле слова жизненно необходима.
При использовании механических устройств для проведения компрессии грудной клетки не доказана большая эффективность по сравнению со стандартной ручной компрессией, и поэтому их рутинное использование не рекомендуется. Однако механическая компрессия может быть полезна в целом ряде случаев, облегчая проведение СЛР, например, в процессе транспортировки или выноса пациента из помещения, когда неудобно проводить ручную компрессию, а также в случаях длительного проведения СЛР.
Восстановление проходимости дыхательных путей.
Золотым стандартом обеспечения проходимости дыхательных путей является интубация трахеи. При этом необходимо отметить, что, согласно данным исследования, проведение интубации трахеи у пациентов с остановкой кровообращения сопряжено с задержкой компрессии грудной клетки длительностью в среднем 110 секунд (от 113 до 146 секунд), а в 25 % случаев интубация продолжалась более 3 минут. Рекомендуется обучать интубации трахеи без прекращения компрессии грудной клетки. Короткая пауза компрессий допускается в момент проведения эндотрахеальной трубки через голосовые связки, при этом эта пауза не должна быть более 5 секунд.
Однако интубация трахеи является достаточно сложным навыком, требующим длительного обучения и постоянной практики. Так, в одном из исследований было показано, что только после проведения интернами-анестезиологами около 125 интубаций в операционной уровень успешных интубаций начинал достигать 95 %.
В качестве альтернативы эндотрахеальной интубации рекомендуется использование технически более простых в сравнении с интубацией трахеи, но одновременно надежных методов протекции дыхательных путей, таких как ларингеальная маска. Однако необходимо помнить, что в сравнении с интубацией трахеи повышен риск развития аспирации.
В связи с этим с целью уменьшения риска развития аспирации необходимо делать паузу на компрессию грудной клетки при проведении искусственной вентиляции легких (ИВЛ) через ларингомаску. Кроме стандартных ларингомасок, рекомендуется использование ларингомаски I-gel, имеющей повторяющую форму гортани, нераздувающуюся манжетку из термопластичного эластомерного геля, при постановке которой необходимы элементарные навыки. Может быть использован двухпросветный воздуховод Combitube. При данном методе обеспечение проходимости дыхательных путей будет гарантировано при любом расположении трубки воздуховода, как в пищеводе, так и в трахее.
Искусственное поддержание дыхания.
При проведении ИВЛ методом рот в рот каждый искусственный вдох нужно проводить в течение 1 секунды (не форсированно), одновременно наблюдая за экскурсией грудной клетки, с целью достижения оптимального дыхательного объема и предотвращения попадания воздуха в желудок. При этом длительность проведения двух искусственных вдохов рот в рот не должна превышать 10 секунд, после чего необходимо немедленно продолжить компрессию грудной клетки. Дыхательный объем должен составлять 500–600 мл (6–7 мл/кг), частота дыхания — 10/мин с целью недопущения гипервентиляции. Исследованиями было показано, что гипервентиляция во время СЛР, повышая внутриторакальное давление, снижает венозный возврат к сердцу и уменьшает сердечный выброс, ассоциируясь с плохим уровнем выживаемости таких больных.
Путь введения лекарственных препаратов. Как и в предыдущих рекомендациях, используются два основных доступа для введения препаратов:
- Внутривенный, в центральные или периферические вены. Оптимальным путем введения являются центральные вены — подключичная и внутренняя яремная, поскольку обеспечивается доставка вводимого препарата в центральную циркуляцию. Для достижения этого же эффекта при введении в периферические вены препараты должны быть разведены в 20 мл физиологического раствора.
- Внутрикостный путь — внутрикостная инъекция лекарственных препаратов в плечевую или большеберцовую кость обеспечивает адекватную плазменную концентрацию, по времени сравнимую с введением препаратов в центральную вену. Использование механических устройств для внутрикостного введения лекарственных препаратов обеспечивает простоту и доступность данного пути введения.
Фармакологическое обеспечение реанимации
- Адреналин:
а) при электрической активности без пульса/асистолии (ЭАБП/асистолия) — 1 мг каждые 3–5 минут внутривенно;
б) при ФЖ/ЖТ без пульса адреналин вводится только после третьего неэффективного разряда электрической дефибрилляции в дозе 1 мг. В последующем данная доза вводится каждые 3–5 минут внутривенно (т.е. перед каждой второй дефибрилляцией) столь долго, сколько сохраняется ФЖ/ЖТ без пульса. При этом необходимо отметить, что после восстановления самостоятельного кровообращения даже маленькие дозы адреналина (50–100 мкг) могут вызвать развитие тахикардии, ишемии миокарда, ФЖ/ЖТ без пульса. Поэтому в раннем постреанимационном периоде адреналин больше не вводится, а при необходимости вазопрессорной поддержки используются норадреналин или мезатон.
Мы хотели бы отметить еще один практический момент, который не обсуждается в рекомендациях ERC-2015, но кажется нам важным. Так, в нашей практике с момента начала СЛР и обеспечения венозного доступа мы сразу подключаем вазопрессорную поддержку (обычно мезатоном). После восстановления самостоятельного гемодинамически эффективного ритма в этом случае имеется подпор общего периферического сопротивления сосудов, не допускающий повторной остановки кровообращения вследствие критической гипотензии. А с учетом того факта, что больше чем в половине случаев у пациентов, перенесших остановку кровообращения, в раннем постреанимационном периоде требуется вазопрессорная поддержка, данный подход может повышать эффективность СЛР.
- Амиодарон — антиаритмический препарат первой линии при ФЖ/ЖТ без пульса, рефрактерной к электроимпульсной терапии, вводится после 3-го неэффективного разряда в начальной дозе 300 мг (разведенные в 20 мл 5% раствора глюкозы либо другого растворителя), а после пятого неэффективного разряда повторно однократно вводится еще 150 мг.
- Лидокаин — в случае отстутствия амиодарона (при этом он не должен использоваться в качестве дополнения к амиодарону) — начальная доза 100 мг (1–1,5 мг/кг) в/в, при необходимости дополнительно болюсно вводится по 50 мг (при этом общая доза не должна превышать 3 мг/кг в течение первого часа).
- Бикарбонат натрия — рутинное применение в процессе СЛР или после восстановления самостоятельного кровообращения не рекомендуется.
Остановка кровообращения представляет собой комбинацию респираторного и метаболического ацидоза. Оптимальным методом коррекции ацидемии при остановке кровообращения является проведение компрессии грудной клетки, дополнительный положительный эффект обеспечивается проведением вентиляции.
Рутинное введение бикарбоната натрия в процессе СЛР за счет генерации СО2, диффундирующей в клетки, вызывает ряд неблагоприятных эффектов:
- усиление внутриклеточного ацидоза;
- отрицательное инотропное действие на ишемизированный миокард;
- нарушение кровообращения в головном мозге за счет наличия высокоосмолярного натрия;
- смещение кривой диссоциации оксигемоглобина влево, что может снижать доставку кислорода к тканям.
Показанием для введения бикарбоната натрия являются случаи жизнеугрожающей гиперкалиемии, а также остановка кровообращения, ассоциированная с гиперкалиемией или передозировкой трициклических антидепрессантов в дозе 50 ммоль (50 мл — 8,4 % раствора) или 1 ммоль/кг в/в.
- Хлорид кальция — в дозе 10 мл 10% раствора в/в (6,8 ммоль Сa 2+ ) при гиперкалиемии, гипокальциемии, передозировке блокаторов кальциевых каналов.
Дефибрилляция
Проведение ранней дефибрилляции в течение первых 3–5 минут с момента остановки кровообращения обеспечивает уровень выживаемости, достигающий 50–70 %, что возможно реализовать только при внедрении общественно доступной дефибрилляции. При этом каждая минута задержки проведения дефибрилляции снижает выживаемость пациентов в постреанимационном периоде на этапе выписки из больницы на 10–12 %. При этом необходимо отметить, что ряд проведенных исследований использования AED врачебными бригадами в больничных условиях по сравнению с использованием профессиональных дефибрилляторов показал снижение уровня выживаемости пациентов.
Выделяют трехфазную время-зависимую модель развития фибрилляции желудочков, которая включает в себя последовательно развивающиеся фазы:
— электрическую (первые 4–5 минут), во время которой эффективным методом ее устранения является электрическая дефибрилляция;
— циркуляторную (последующие 5–10 минут — пролонгированная ФЖ), эффективным методом ее устранения является предварительное проведение компрессии грудной клетки и только в последующем электрической дефибрилляции;
— метаболическую — необходимо проведение метаболической терапии.
Следует подчеркнуть, что непрерывная компрессия грудной клетки может быть полезной на ранних стадиях ФЖ, в электрическую и циркуляторную фазу, в то время как дополнительная вентиляция более значимой становится в позднюю — метаболическую фазу ФЖ. Также было установлено, что проведение перед дефибрилляцией компрессии грудной клетки в течение 180 секунд может быть полезным (более короткий — 30–60 с, как и более длинный период > 180 с, неэффективны).
При выявлении на кардиомониторе/дефибрилляторе ФЖ/ЖТ без пульса необходимо немедленно нанести один разряд электрической дефибрилляции. Сразу же после нанесения разряда дефибрилляции следует продолжить компрессию грудной клетки и другие компоненты СЛР в течение 2 минут и только затем провести оценку ритма по ЭКГ и в случае восстановления синусового ритма оценить его гемодинамическую эффективность по наличию пульса на сонной артерии. Поскольку, даже если дефибрилляция будет эффективной и восстановится по данным ЭКГ синусовый ритм, крайне редко сразу после дефибрилляции он является гемодинамически эффективным (т.е. способным генерировать пульс, а значит, и кровообращение). Обычно еще требуется проведение порядка 1 минуты компрессии грудной клетки для восстановления самостоятельного кровообращения (пульса). При этом необходимо подчеркнуть, что в случае восстановления гемодинамически эффективного ритма дополнительная компрессия грудной клетки не приведет к повторному развитию ФЖ. И наоборот, в случае восстановления только организованной биоэлектрической активности сердца, но гемодинамически неэффективной прекращение проведения компрессии грудной клетки неизбежно приведет к рефибрилляции желудочков.
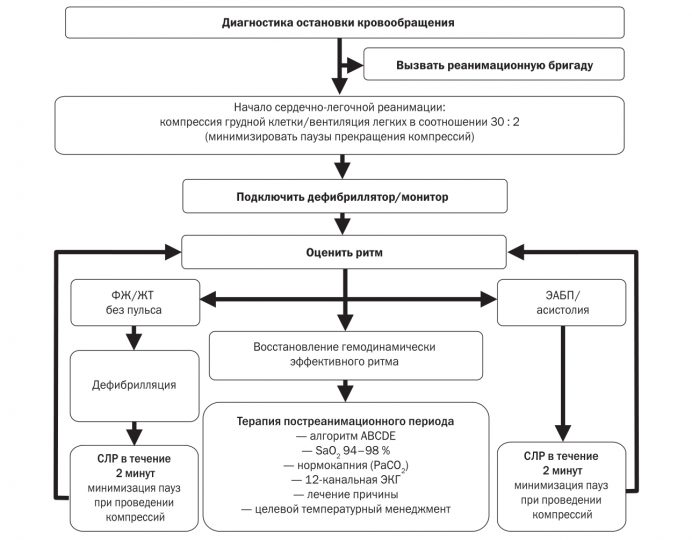
Вышеизложенные факты являются обоснованием немедленного начала проведения компрессии грудной клетки после нанесения разряда дефибрилляции в течение 2 минут и только последующей оценки ритма по ЭКГ, а в случае восстановления синусового ритма — оценки пульсации на сонной артерии.
Промежуток между разрядом дефибрилляции и продолжением компрессии грудной клетки не должен превышать 10 секунд.
Оценка ритма/пульса также не должна превышать 10 секунд — в случае сохранения на ЭКГ ФЖ/ЖТ без пульса, необходимо нанести повторный разряд дефибрилляции с последующей компрессией грудной клетки и компонентами СЛР в течение 2 минут. В случае восстановления синусового ритма по данным ЭКГ-мониторинга, но отсутствия пульса необходимо немедленно продолжить компрессию грудной клетки в течение 2 мин, с последующей оценкой ритма и пульса: разряд СЛР в течение 2 мин → оценка ритма/пульса → разряд СЛР в течение 2 минут…
Монофазная дефибрилляция больше не рассматривается в связи с тем, что дефибрилляторы такого типа уже не выпускаются, а сам принцип, реализованный в старых моделях дефибрилляторов, малоэффективен и вызывает выраженное постдефибрилляционное повреждение миокарда. Результаты исследований показали, что бифазная дефибрилляция, использующая меньшую энергию, значительно более эффективна и в меньшей степени вызывает повреждение и постреанимационную дисфункцию миокарда по сравнению с эквивалентной энергией монофазного импульса.
Начальный уровень энергии для бифазных дефибрилляторов должен составлять 150 Дж, с последующей эскалацией энергии при повторных разрядах. В целом необходимо руководствоваться рекомендациями заводов — производителей бифазных дефибрилляторов.
При проведении электрической дефибрилляции обязательным является выполнение трех основных условий: правильного расположения электродов (один справа по парастернальной линии ниже ключицы, другой слева по среднеподмышечной линии в проекции верхушки сердца). Для стандартных электродов (неадгезивных) в момент нанесения разряда необходимо обеспечить силу приложения на электроды в пределах 8 кг и обязательно использовать специальный электропроводный гель либо в его отсутствие прокладки, смоченные токопроводящим раствором. Недопустимо использование сухих электродов, поскольку это существенно снижает эффективность дефибрилляции (сводя ее практически к нулю) и вызывает ожоги кожных покровов.
В новых рекомендациях рекомендуется преимущественное использование адгезивных (самоклеящихся) электродов по сравнению со стандартными электродами, поскольку было показано, что их использование является более удобным, высвобождает руки и позволяет минимизировать паузы перед проведением дефибрилляции. Все современные модели дефибрилляторов наряду со стандартными электродами комплектуются самоклеящимися электродами.
Во время проведения дефибрилляции никто из участников реанимации не должен притрагиваться к пациенту и/или его кровати.
Если у пациента имеется имплантированный электрокардиостимулятор, то электроды дефибриллятора должны размещаться от него на расстоянии минимум 8 см. В этой ситуации также рекомендуется использование переднезаднего расположения электродов.
Еще раз необходимо подчеркнуть, что при ФЖ/ЖТ без пульса 1 мг адреналина и 300 мг амиодарона в/в необходимо вводить только после третьего неэффективного разряда электрической дефибрилляции. В последующем, в случае персистирующей ФЖ, адреналин вводится каждые 3–5 мин на протяжении всего периода СЛР. Амиодарон повторно однократно вводится в дозе 150 мг после пятого неэффективного разряда дефибрилляции.

Мониторинг во время проведения СЛР
В новых рекомендациях большое внимание уделяется мониторингу, позволяющему оценить качество и эффективность проводимых реанимационных мероприятий. В связи с этим предложен целый ряд технологий для использования в процессе проведения СЛР.
- Применение датчика, оценивающего качество проводимой компрессии грудной клетки по частоте и глубине компрессий, а также проводимой вентиляции по частоте и объему. Данная технология реализована в ряде современных дефибрилляторов и представляет собой устройство, которое располагается на грудной клетке пациента и на которое производится компрессия в процессе СЛР, с последующим отображением на кардиомониторе дефибриллятора вышеуказанных параметров компрессии и вентиляции, при этом существует возможность обратной связи с голосовой подсказкой правильности проведения реанимационных мероприятий. Именно данное устройство позволяет контролировать оптимальную глубину (не менее 5 и не более 6 см) и частоту компрессии и не допускать гипервентиляции.
- Капнографический датчик, который также является опцией дефибриллятора. Капнография в процессе СЛР позволяет верифицировать положение эндотрахеальной трубки, оценить качество проводимой СЛР и является ранним индикатором восстановления самостоятельного гемодинамически эффективного кровообращения.
- Ультразвуковое исследование при СЛР позволяет выявить потенциально обратимые причины остановки кровообращения согласно алгоритму «четыре Г — четыре Т» (тампонада сердца, ТЭЛА, пневмоторакс), а также идентифицировать псевдоэлектрическую активность без пульса.
Потенциально обратимые причины СЛР
Вероятность благоприятного исхода СЛР при ЭАБП/асистолии (как и при рефрактерной ФЖ/ЖТ) можно повысить, только если имеются потенциально обратимые причины остановки кровообращения, поддающиеся лечению. Они представлены в виде универсального алгоритма «четыре Г — четыре Т».

Прекращение реанимационных мероприятий
СЛР необходимо проводить так долго, как долго сохраняется на ЭКГ фибрилляция желудочков, поскольку при этом сохраняется минимальный метаболизм в миокарде, что обеспечивает потенциальную возможность восстановления самостоятельного кровообращения.
В случае остановки кровообращения по механизму ЭАБП/асистолии, при отсутствии потенциально обратимой причины (согласно алгоритму «четыре Г — четыре Т») СЛР проводят в течение 30 минут, а при ее неэффективности прекращают.
СЛР более 30 минут проводят в случаях гипотермии, утопления в ледяной воде и передозировки лекарственных препаратов.
Время прекращения реанимационных мероприятий фиксируется как время смерти пациента.
Проводимые исследования все больше расширяют возможности систем неотложной перфузионной реанимации (EPR — Emergency Perfusion Resuscitation). Данные системы представляют собой портативные аппараты искусственного кровообращения, обеспечивающие экстракорпоральное поддержание кровообращения у пациентов в состоянии клинической смерти, у которых стандартный комплекс СЛР неэффективен, но при этом имеется потенциально обратимая причина, на которую можно воздействовать специфическими методами терапии. Потенциально обратимыми причинами, для которых показано применение EPR, являются: острый коронарный тромбоз — для проведения чрескожного коронарного вмешательства (ЧКВ), массивная ТЭЛА — для проведения тромбэктомии, тяжелое общее переохлаждение — для экстракорпорального согревания пациента. Необходимо подчеркнуть, что указанные аппараты могут, кроме экстракорпорального согревания, обеспечить индукцию терапевтической гипотермии.








Комментировать