Лейоміома матки та аутоімунні механізми: взаємозв’язок. Результати проведених досліджень.
Інститут ПАГ АМН України
Татарчук Т. Ф., Косей Н. В., Сидорик Л. Л., Березовська О. І., Протас Р. В.
Лейоміома матки — одне з найбільш поширених гіперпроліферативних захворювань репродуктивної системи, яке є однією з основних причин гінекологічної за-хворюваності взагалі та хірургічних втручань на статевих органах [1,4,12]. Підвищення інтересу до даної па-тології в останні десятиріччя зумовлене зростанням за-хворюваності на лейоміому матки, незважаючи на розробку сучасних методів лікування, втілення новітніх тех-нологій та збільшенням частоти випадків її виникнення у жінок молодого віку. Прогрес фундаментальних наук останніх десятилітть дав можливість зробити значний крок вперед в розумінні патогенезу даної пухлини. Так, багато досліджень присвячено вивченню ролі гормо-нального гомеостазу, факторів росту, генетичних чин-ників, спадкової детермінації, генітальної інфекції та за-пальних процесів в розвитку лейоміоми матки [1,4,12].
Згідно даним літератури, важливу роль у виникнен-ні захворювань, що супроводжуються підвищеним утворенням фіброзної тканини, відіграють аутоімунні механізми [2,3,5]. Однак, що стосовно лейоміоми матки, то лише поодинокі повідомлення вказують на можливість участі аутоімунних процесів в рості цієї доброякісної пухлини, і роль вказаних ланок у виникненні міоми мат-ки на сьогодні остаточно не з’ясована.
Відомо, що процес передачі інформації, в тому числі реплікація, транскрипція, репарація та рекомбінація, залежить від топології молекули ДНК — її скручування та релаксації. ДНК-топоізомерази — одні з основних ядерних ферментів, які модифікують та регулюють топологію ДНК та контролюють експресію генів, внаслідок чого дані ферменти вважаються ключовими ферментами передачі спадкової інформації [3,5]. Крім того, Топо-І ізоме-раза (Топо-І) — це рекомбіназа, яка за умов розвитку ан-титілогенеза до неї здібна опосередковувати незаконну рекомбінацію, що може призводити до нестабільності геному і онтогенезу або загибелі клітини з активізацією склеротичних процесів. Цей факт підтверджується виявленою нещодавно підвищеною експресією Топо-І в ряді пухлин людини, а також наявністю аутоантитіл проти даного ферменту у пацієнтів із колагенозами, зокрема, склеродермією, у яких вони можуть слугувати навіть серологічним маркером [3,5,6]. Тому Топо-І є об’єктом ретельної уваги як фундаментальних теоретичних наук, так і розробників протипухлинних та протимікробних медикаментозних засобів.
Молекулярні шаперони (білки стресу, або білки «теплового шоку») — це поліфункціональні білки, які відповідають за коректний фолдінг внутрішньоклітинних ор-ганельних протеїнів та попередження формування неправильної їх укладки. Так, різні ендо- та екзогенні білки для виконання належної функції (каталітичної, структурної, регуляторної та ін.) повинні набути притаманну їм третичну структуру, і процес їх укладки контролюється молекулярними шаперонами. Широка різноманітність функцій шаперонів (участь в апоптозі, формуванні стероїдних рецепторів, супресія запальних цитокінів, редукція окислювального стресу, модуляція імунноопосередкованого ураження клітин та органів, синтез колагену і фіброз) роблять шаперони ідеальними кандидатами на ключову регуляторну роль в процесах життєдіяльності клітин та їх загибелі, що контролюють процеси репарації та деградації [7,8,10,11]. Порушення стабільності клітинних білків, які відіграють роль сигнальних молекул, на тлі розвитку аутоімунного процесу до власного шаперону може спричиняти неопластичну трансформацію пухлини. Неправильно укладені в третичну структуру білки, за умов порушення функціонування системи шаперонів, можуть призводити до утворення внутрішньоклітинних агрегатів та порушення багатьох внутрішньоклітинних процесів, що є молекулярною основою багатьох захворювань [7,11]. Даних щодо вмісту антитіл до Топо-І ізомерази І та шаперонів у пацієнток з лейоміомою матки в доступній літературі не виявлено.
Нашими попередніми дослідженнями було встановлено, що ізольована за розвитком лейоміома матки росте повільно і здебільшого безсимптомно, в той час як за умов поєднаних з іншою гіперпроліферативною патологією процесів нерідко супроводжується швидким ростом та клінічною маніфестацією вже при невеликих розмірах. Це вказувало на різниці у механізмах розвитку ізольованого та поєднаного клінічних варіантів розвитку міом матки. Тому, з метою з’ясування ролі аутоімунних процесів та пошуку можливих антигенів ми вирішили дослідити вміст аутоантитіл до Топо-І та шаперону Hsp 60 у жінок з лейоміомою матки за умов ізольованого її росту та при по-єднанні із дисгормональними процесами молочної та щитовидної залози.
З метою вивчення експресії аутоантитіл до Топо-ізомерази І та молекулярного шаперону Hsp 60 було до-сліджено сироватку 103 жінок репродуктивного віку (від 18 до 49 років) з лейоміомою матки, серед них 25 пацієнток з ізольованою лейоміомою матки (І група), 22 жін-ки — з поєднанням міоми та дисгормональних захворювань молочної залози(ІІгрупа),26пацієнток—заумов сполучення лейоміоми та патології щитовидної залози (ІІІ група) та 30 хворих — за умов поєднання вказаної патології матки,молочної та щитовидної залоз (ІVгрупа дослідження. В якості контролю використовували пул сироваток 39 здорових жінок відповідного віку (V гру-па).
Топо-І з лізату ядер плаценти очищували згідно методу трьохстадійної хроматографії на колонках гідроксіапатиту. Концентрацію білку визначали за методом Бредфорда [6]. Чистоту отриманого препарату Топо-І перевіряли в реакції релаксації суперзкрученої плазміди pBR322 з послідуючим аналізом отриманих продуктів релаксації електрофорезом проб в агарозному гелі [9]. Одна одиниця активності препарату Топо-І відповідала кількості ферменту, який релаксує половину препарату pBR322 в інкубаційній суміші. Імунореактивність сироватки крові пацієнтів і пулу сироватки крові здорових донорів визначали методом імуноферментного твердофазного аналізу (ELISA).
Для вивчення концентрації аутоантитіл до Hsp 60 застосовували рекомбінантний шаперон (Hsp 60), що був виділений із лізату клітин E.coli, очищений шляхом гель-фільтрації та іонообмінної хроматографії, який використовували як антиген. Наявність шаперонів у фракціях тестували методом імуноблотінгу, використовуючи поліклональні афінно очищені антитіла проти Hsp 60, які отримували методом імунізації кроликів мікрокількістю антигену (до 25 мкг/тварина). Чистоту отриманих білків тестували електрофоретично за методом Леммі. Концентрацію білків вимірювали за методом Бредфорда [6]. Імунореактивність сироватки крові пацієнтів і пулу сироватки крові здорових донорів також визначали методом імуноферментного твердофазного аналізу (ELISA) з модіфікаціями.
При визначенні імунореактивності проб сироваток антитілпозитивними вважали сироватки пацієнток, в яких рівень антитіл перевищував аналогічний середній показник в групі здорових жінок на 2 стандартних відхилення.
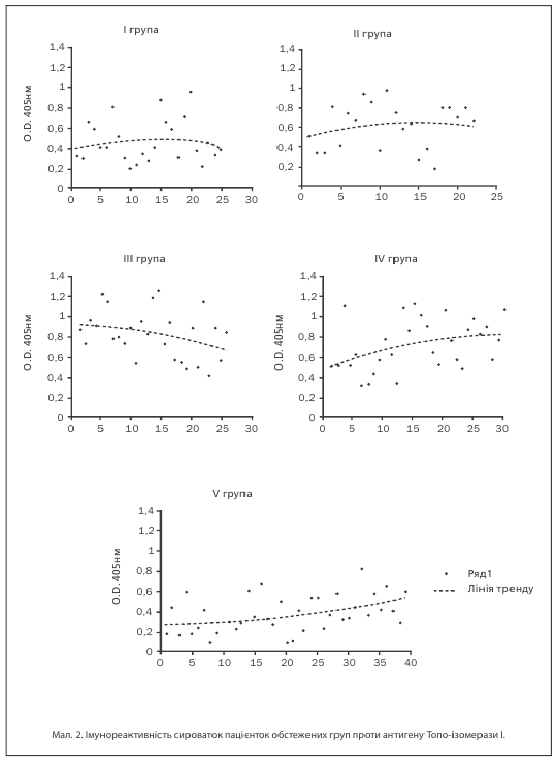
Антитілпозитивними до Топо-ізомерази І виявилися 10 (40%) пацієнток І групи, 17 (77,27%) жінок ІІ групи, 24 (92,3%) жінок ІІІ та 27 (90,0%) хворих ІV груп досліджень. Аналіз середніх показників імунореактивності (мал. 1) показав, що за умов поєднаного розвитку лейоміоми матки вони істотно перевищували відповідний показник у здорових жінок — 0,532±0,09 в ІІ; 0,662±0,08 — в ІІІ та 0,784±0,06 — в ІV групах проти 0,215±0,1 в V групі (p1–4,2–4,3–4<0,05), в той час як в І групі була зазначена лише тенденція (t=1,95) до її збільшення. Значення імунореактивності в І групі коливались від 0,211 до 0,953, в ІІ групі — від 0,178 до 0,797, в ІІІ групі — від 0,329 до 1,24, в ІV групі — від 0,262 до 1,19, в той час як межі коливань показників у здорових жінок були значно меншими — від 0,1 до 0,67 (мал. 2). Найвищий рівень імунореактивності проти Топо-І зазначений за умов сполучення лейоміоми матки, ДЗМЗ і захворювань щитовидної залози.
Слід зазначити, що показники аутоантитіл проти Топо-І в ІІІ і ІV групах, тобто за умов наявності патології щитовидної залози, значно перевищували дані у пацієнток з ізольованою міомою матки.
Проведені дослідження виявили також вищий рівень імунореактивності проти молекулярного шаперону у всіх жінок з лейоміомою матки (мал. 3) в порівнянні з даними здорових жінок.
При цьому середній рівень імунореактивності проти шаперону Hsp 60 був найвищим в І (1,254±0,13) та ІV (1,126±0,17) групах пацієнток, що істотно перевищувало показники у здорових жінок (0,366±0,11; p1–3,2–3<0,05). Антитілпозитивними проти молекулярного шаперону Hsp 60 виявилися 22 (88,0%) жінки І групи, 16 (68,18%) — ІІ; 24 (92,31%) — ІІІ та 28 (71,79%) — ІV групи досліджень, тобто переважна більшість пацієнток всіх дослідних груп. Найбільш широкі межі коливань значень спостері-галися у І групі — від 0,544 до 2,257; в той час як в ІІ групі межи коливань склали від 0,5 до 1,122; в ІІ — від 0,486 до 1,331; в ІV групі — від 0,354 до 1,279.


Підвищений рівень антитіл, як проти Топо-ізомерази І, так і проти молекулярного шаперону Hsp 60, дає можливість припустити важливу роль аутоімунних механізмів в механізмі розвитку лейоміоми матки, особливо поєднаних з ДЗМЗ та патологією щитовидної залози варіантів її розвитку. Оскільки Топо-І є ядерним ферментом, який регулює топологію ДНК, синтез антиядерних антитіл формує імунну відповідь проти ядра клітини і може спричиняти аутоімунні механізми загибелі клітин (переважно шляхом апоптозу) з послідуючим розвитком фіброзу або порушення процесів передачі генетичної інформації з підвищеним ризиком малігнізації.
Збільшений рівень антитілогенезу проти молекулярного шаперону Hsp 60 вказує на наявність імунної відповіді не лише проти ядерних ферментів, але й порушення механізмів клітинного фолдінгу білків як можливої ланки в патогенезі всіх варіантів розвитку лейоміоми матки. Високі рівні антитіл проти Hsp 60 у пацієнток з патологі-єю щитовидної залози (ІІІ і ІV групи) свідчать про важливу роль аутоімунних процесів у механізмі розвитку поєднаного клінічного варіанту розвитку міоми, адже ураження імунними комплексами мітохондріальних та цитоплазматичних шаперонів може призводити до поломки процесів фолдінгу і дефолдінгу білків та інверсії функціонування стероїдних рецепторів.
Вищий показник вмісту антитіл проти Hsp 60 за умов ізольованої лейоміоми матки може бути пов’язаним із імунізацією організму внаслідок хронічної інфекції, яка під час попередніх досліджень частіше виявлялася саме у жінок з ізольованою лейоміомою матки. В той же час відомо, що молекулярні шаперони деяких мікроорганізмів подібні до людських, тому індукція специфічного імунітету проти бактеріальних шаперонів, зокрема, хламідійних, може спровокувати аутоімунний процес з ураженням органу імунними комплексами та індукцією синтезу колагена [2,8]. Саме такі зміни (виражені процеси перицелюлярного фіброзу) були виявлені під час проведених морфологічних та ультраструктурних досліджень за умов ізольованого варіанту розвитку лейоміоми матки.
Такимчином,результатипроведенихдослідженьвказують на значну роль аутоімунних процесів, в тому числі аутоантитілогенеза проти Топо-І ізомерази та молекулярного шаперону Hsp 60,у механізм ірозвитку лейоміоми матки,особливо за умов симультанного розвитку пухлин матки, молочної та щитовидної залоз. Одержані дані відкривають нові перспективи до розкриття молекулярних механізмів розвитку доброякісних гіперпроліферативних захворювань,зокрема лейоміомиматки.
Список використаних літературних джерел.
1.Дубиніна В. Г., Доменюк В. П., Вербицька Т. Г., Бубнов В.В.ПоліморфізмгенівстероїдогенезуCYP19,CYP17,Estra, Er2,Pgrухворихзміомоюматкитаракомендометрію//Ре-продуктивное здоровье женщины—2006—N1(25)
2.Ерко В. Н. Бактериальные шаперонины // Біополімери і клітина — 2001 — т. 17, N 5 —С. 356362.
3.Сидорик Л. Л., Тодуров И. М., Вигонтина О. Г. и соавт. Антитела к ДНК-топоизомеразе І в сыворотке крови при патологических процессах в поджелудочной железе // Experimental Oncology — 2001 — N 23 — С. 153–156.
4.Сидорова И. С., Леваков С. А., Зайратьянц О. В. и соавт. Современный взгляд на патогенез миомы матки // Акушерство та гинекология. — 2006 — Приложение — С. 30–33.
5.Якубовская Е. А., Габибов А. Г. Топоизомеразы. Механизмы изменения топологии ДНК // Молекулярная биология — 1999 — т. 33, N 3 — С. 368–384.
6.Bradford M. M. A rapid and sensitive method for qvantitation of microgram quantities of protein utilizing the principle of proteine binding // Anal Biocem — 1976 — V. 86 — P. 193–200.
7.Cheung J., Smith D.F. Molecular Chaoerone Interactions with Steroid Receptors: an Update // Molecular Endocrinology — 2005 — V. 14, N 7 — P. 939–946.
8.Ciocca D. R., Calderwood S. K. Heart shock proteins in cancer: diagnoctic, prognostic, predictive, and treathment implications // Cell stress & Chaperones — 2005 — V.10, N 2 — P. 86–103.
9.Leammi U. K. Cleavadge of etructural proteins during the assembly of the bacteriofag T4// Nature. — 1970 — N 227. — P. 680–685.
10.Sidoric L., Kyyamova R., Bobyk V. Et al. Molecular chaperone, HSP60, and cytochrome P450 2E1 coexpression in dilated cardiomyopathy // Cell Biology International — 2005 — N 29 — P. 51–55.
11.Shozu M., Murakami K., Segawa T. et al. Decreased expression of early growth response-1 and its role in uterine leiomyoma growth // Cancer Res — 2004 — N 64(13) — P. 4677–4684.














Комментировать