Жерносек В.Ф. Белорусская медицинская академия последипломного образования, Минск
Резюме. Представлен анализ базисной терапии и уровня контроля у 103 детей 3–18 лет жизни с тяжелой персистирующей бронхиальной астмой. Несмотря на комбинированную терапию контролирующими препаратами, у 29,1% из них контроля болезни достичь не удается. С целью оптимизации терапии пациентов с тяжелой частично контролируемой и неконтролируемой астмой на стандартной базисной терапии необходимо внедрение современных лекарственных средств, в том числе ингаляционных глюкокортикостероидов (ИКС), отличающихся большей клинической эффективностью и безопасностью. Как вариант терапии рассматривается лечение циклесонидом.
Ключевые слова: дети, тяжелая бронхиальная астма, базисная терапия, степени контроля, циклесонид.
Бронхиальная астма (БА) – хроническое воспалительное заболевание, ассоциированное с вариабельной обструкцией дыхательных путей и бронхиальной гиперреактивностью, проявляется повторяющимися эпизодами свистящего дыхания, кашля, одышки и чувством сдавления в груди [1].
Длительная поддерживающая (базисная) терапия пациентов с БА строится по ступенчатому принципу в зависимости от степени контроля заболевания [2, 3]:
– 0 ступень (полностью или хорошо контролируемая астма): базисная терапия не проводится.
– I ступень (начальная терапия большинства случаев частично контролируемой и неконтролируемой астмы): 1) ингаляционный глюкокортикостероид (ИКС) в низкой дозе (предпочтительный вариант в большинстве случаев); 2) антилейкотриеновый препарат (альтернативный вариант).
– II ступень терапии (частично контролируемая и неконтролируемая астма в отсутствие контроля болезни на терапии первой ступени в течение 1 месяца): 1) ИКС в средней дозе; 2) ИКС в низкой дозе в комбинации с ингаляционным ß2-агонистом длительного действия или антилейкотриеновым препаратом; 3) допустимо в порядке исключения назначение низких доз ИКС в комбинации с теофиллином длительного действия.
– III-IV ступень (частично контролируемая и неконтролируемая астма в отсутствие контроля болезни на терапии второй ступени в течение 1 месяца): 1) ИКС в высокой дозе; 2) ИКС в средних или высоких дозах в комбинации с ингаляционным ß2-агонистом длительного действия или антилейкотриеновым препаратом; 3) допустимо в порядке исключения назначение ИКС в средних или высоких дозах в комбинации с теофиллином; 4) при IgE -опосредованной астме, которая не контролируется медикаментами, – омализумаб.
– V ступень (контроля невозможно достичь при применении максимальной дозы ингаляционных кортикостероидов и дополнительных препаратов): 1) пероральные кортикостероиды коротким курсом; 2) при IgE -опосредованной астме, которая не контролируется медикаментами, – омализумаб.
Цель лечения БА – достижение полностью контролируемого и контролируемого течения болезни. Наиболее сложной остается задача контроля тяжелой персистирующей астмы [4].
Внедрение новых технологий позволит более успешно добиваться основной цели лечения БА – достижение и поддержание контроля болезни [5] .
В настоящем исследовании представлены анализ реальной практики базисной терапии и перспективные технологии в достижении контроля тяжелой БА у детей.
Выполнен анализ базисной терапии у 103 детей с БА тяжелого персистирующего течения, состоящих на диспансерном наблюдении в детских поликлиниках Республики Беларусь.
Степень тяжести астмы и уровень контроля болезни на момент сбора информации уточняли в соответствии с «Клиническими протоколами диагностики и лечения аллергических заболеваний у детей» (Приказ Министерства здравоохранения Республики Беларусь №829 от 08.08.2014), в основу которого положена классификация БА, утвержденная Международным консенсусом по детской астме [1]. Согласно указанным документам, выделяли полностью контролируемую, контролируемую, частично контролируемую и неконтролируемую БА (табл. 1)
Таблица 1. Уровень контроля астмы [1]
| Параметр | Уровень контроля астмы | |||
| полностью контролируемая | хорошо контролируемая | частично контролируемая | неконтролируемая | |
| Дневные симптомы | Нет | Меньше или равно 2 в неделю | >2 в неделю | Постоянные |
| Ночные симптомы/пробуждения от астмы | Нет | Меньше или равно 1 раза в месяц | >1 раза в месяц | Еженедельные |
| Потребность в средствах неотложной помощи | Нет | Меньше или равно 2 в неделю | >2 в неделю | Ежедневно |
| Ограничение активности | Нет | Нет | Некоторое | Выраженное |
| Функция легких – FEV1/PEF (по отношению к должным или персональным лучшим) | >80% | Больше или равно 80% | 60–80% | <60% |
| Число обострений за год | 0 | 1 | 2 | >2 |
Таблица 2. Реальная практика базисной терапии пациентов с тяжелой БА
| Вариант базисной терапии | Число пациентов | |
| абс. | % | |
| Монотерапия ИКС | 22 | 21,4±4,0 |
| ИКС в сочетании с ингаляционными ß2-агонистами | 45 | 43,6±4,9 |
| ИКС в сочетании с антилейкотриеновыми препаратами | 5 | 4,9±2,1 |
| ИКС в сочетании с ингаляционными ß2-агонистами и антилейкотриеновыми препаратами | 22 | 21,4±4,0 |
| ИКС в сочетании с ингаляционными ß2-агонистами, антилейкотриеновыми препаратами и пролонгированными теофиллинами | 4 | 3,9±1,9 |
| ИКС в сочетании с ингаляционными ß2-агонистами, антилейкотриеновыми препаратами, пролонгированными теофиллинами и системными стероидами | 2 | 1,9±1,4 |
| Комбинированная терапия в сочетании с анти-IgЕ-антителами | 3 | 2,9±1,7 |
Пациенты были сгруппированы по возрасту, объему базисной терапии и уровню контроля БА.
Возраст пациентов. В возрастной структуре пациентов с тяжелой БА превалировали дети 6–15 лет (55,3%), каждый третий пациент с тяжелой астмой был подростком 15–18 лет (33%), дети в возрасте 3–6 лет составили 11,7%. Детей младшего возраста (первых трех лет жизни) в числе детей с тяжелой астмой не было.
Базисная терапия. Соотношение монотерапии ИКС и комбинированной терапии у пациентов с тяжелой БА в реальной клинической практике: монотерапии ИКС –21,4%, комбинированная терапия –78,6%.
Основой базисной терапии были ИКС (флютиказон, будесонид, беклометазон) и комбинированные препараты в виде фиксированной комбинации ИКС с ингаляционным ß2-агонистом (флютиказон/сальметерол, будесонид/формотерол). Монотерапия ИКС проводилась у каждого пятого пациента, у всех остальных – комбинированная. Основу комбинированной терапии составляла фиксированная комбинация ИКС с ингаляционным ß2-агонистом (76 (93,8±2,7%) из 81 пациентов, получавших комбинированную терапию). Редко комбинированная терапия была представлена сочетанием ИКС и антилейкотриенового препарата (только каждый двадцатый пациент). Каждом третьему пациенту (34,6±5,3%), находящемуся на комбинированной терапии, для достижения контроля болезни к фиксированной комбинации ИКС с ингаляционным ß2-агонистом дополнительно назначали еще один или два медикамента. Единичным детям, находящимся на комбинированной терапии, для достижения контроля астмы предлагали короткий курс системных стероидов. У трех пациентов для достижения контроля применяли терапию анти-IgЕ-антителами (омализумаб) (табл. 2). Комбинированная терапия с применением двух-трех препаратов, лечение омализумабом сопряжены с большими расходами на медикаментозное обеспечение этой категории пациентов.
Уровень контроля БА. Более чем у 2/3 (70,9±4,5%) пациентов удалось достичь цели терапии – полностью контролируемое и контролируемое течение БА. Однако у 30 из 103 (29,1±4,5%) астма все же осталась частично контролируемой и неконтролируемой (рисунок). Отсутствие контроля астмы влечет дополнительные материальные расходы, связанные с госпитализацией пациентов, вызовами бригад скорой помощи по поводу приступов астмы, затратами на оплату листков нетрудоспособности по уходу за больным ребенком и прочие косвенные расходы.
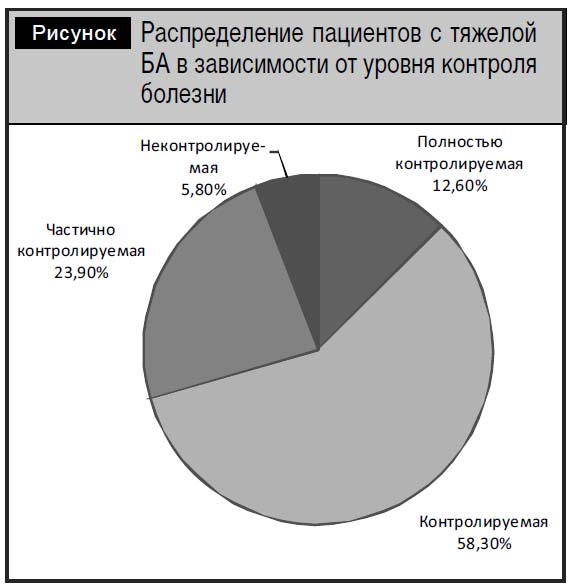
В связи с этим заслуживает внимания внедрение технологий, позволяющих улучшить контроль БА. Перспективно в этом плане внедрение в клиническую практику ИКС с высоким уровнем легочной депозиции. Таким свойством обладает циклесонид. В Республике Беларусь циклесонид зарегистрирован под названием Альвеско®.
Циклесонид (Альвеско®) – ингаляционный кортикостероид новой генерации, является пролекарством и активируется непосредственно в эпителиальных клетках легких в фармакологически активный метаболит дезциклесонид, обладающий высоким сродством к глюкокортикоидным рецепторам и способностью образовывать неактивные эфиры с жирными кислотами, служащими в качестве депо циклесонида. Фармакологические особенности молекулы циклесонида обеспечивают высокую локальную противовоспалительную активность препарата с минимальным риском системных эффектов и возможностью применения один раз в день, что способствует повышению приверженности терапии со стороны пациентов.
Циклесонид (Альвеско®), выпускаемый в виде дозированного аэрозольного ингалятора, генерирует самую большую фракцию мелкодисперсных частиц, что обеспечивает большую легочную депозицию (52% отпущенной дозы) и равномерное распределение препарата в дыхательных путях с некоторой преимущественной депозицией в дистальных бронхах. Благодаря малому размеру частиц (<1,1 микрона) циклесонид достигает мелких дыхательных путей (<2 мм в диаметре). А в силу низких депозиции и активации циклесонида в области рта и глотки частота возникновения нежелательных эффектов со стороны ротоглотки у пациентов, получающих циклесонид, минимальна, что делает его препаратом выбора у пациентов, имеющих высокий риск развития локальных побочных реакций на ИКС и уже отмечавших такие нежелательные явления ранее при применении ИКС. Все это делает Альвеско® препаратом выбора в терапии БА, особенно у детей и пациентов с высоким риском развития нежелательных явлений на фоне терапии другими ИКС [6, 7].
Свойства циклесонида позволяют рекомендовать его всем пациентам с БА, но особенно перспективно использование Альвеско® у больных, плохо отвечающих на терапию ИКС, при тяжелом течении заболевания и частых симптомах в ночные часы [8].
Высокая противовоспалительная активность, минимальное число системных и местных побочных эффектов, однократный прием в сутки делают использование данного препарата предпочтительным в педиатрической практике [9].
В международных исследованиях доказано, что циклесонид обладает высокой клинической эффективностью и минимальными системными и местными побочными эффектами при лечении детей с БА различной степени тяжести. В рандомизированном многоцентровом двойном слепом плацебоконтролируемом исследовании с участием 1018 детей с персистирующей БА в возрасте 4–11 лет оценивали эффективность и безопасность препарата в дозах 40, 80 и 160 мкг один раз в сутки. Применение циклесонида в дозах 80 и 160 мкг в течение 12 недель способствовало статистически достоверному улучшению функции легких – объема форсированного выдоха за первую секунду, показателей утренней и вечерней пиковой скорости выдоха. Также зафиксировано снижение общего балла симптомов астмы, потребности в препаратах скорой помощи и улучшение качества жизни пациентов по сравнению с плацебо. Циклесонид в дозе 40 мкг продемонстрировал статистически достоверную эффективность в отношении утренней пиковой скорости выдоха, симптомов астмы и качества жизни пациентов. Все три режима терапии показали хорошую переносимость и высокую безопасность, что подтверждалось отсутствием подавления функции гипоталамо-гипофизарно-надпочечниковой системы и изменения содержания кортизола в суточной моче (по сравнению с плацебо) [10].
Приводим собственное клиническое наблюдение за пациентом с трудностями в контроле астмы, который с успехом лечился препаратом Альвеско®.
Клиническое наблюдение
Мальчик В., 13 лет. Госпитализирован в пульмонологическое отделение УЗ «Минская областная детская клиническая больница» с жалобами на приступы удушающего кашля 4–5 раз в неделю (из них 1–2 раза в ночное время) и затрудненное дыхание через нос. Приступы облегчались после ингаляции беродуала.
Страдает БА в течение 7 лет. Гипоаллергенный быт дома не поддерживается. Последние 6 месяцев получал базисную терапию серетидом 50/500 по одной дозе два раза в день, к которому на 3 месяца присоединяли сингуляр по 10 мг один раз в сутки. Дополнительно проводили курс лечения системными стероидами в течение 14 дней. Контроля течения болезни достичь не удавалось. По поводу аллергического ринита назначалось повторное лечение фликсоназе по 2 дозы один раз в день по 4–6 недель.
Родился доношенным от первой физиологической беременности и родов в сроке гестации 39 недель с массой тела при рождении 3550. В период новорожденности перенес врожденную пневмонию. В течение 7 суток находился на ИВЛ. Болел ветряной оспой. Генеалогический анамнез по атопии не отягощен. Аллергологический анамнез: пищевая (цитрусовые) и медикаментозная гиперчувствительность (цефазолин, новокаин, сальбутамол) в виде крапивницы.
При госпитализации ребенок повышенного питания, наблюдалось затрудненное носовое дыхание, в легких с обеих сторон в нижних отделах выслушивались крепитирующие хрипы.
Проведено комплексное обследование. Общеклинические анализы крови и мочи без особенностей. В иммунограмме повышен уровень IgE до 1953 МЕ/мл. При проведении аллергологического тестирования методом скарификационных кожных проб выявлена сенсибилизация к кукурузе, луговым и сорным травам. В риноцитограмме эозинофилы 72% от клеточного состава. Исследование функции внешнего дыхания: нарушения по смешанному типу, ОФВ1 59% должного. Выполнены фармакологические пробы на обратимость бронхиальной обструкции: проба с беротеком отрицательная, проба с атровентом отрицательная, проба с беродуалом отрицательная, проба с формотеролом положительная. На рентгенограмме органов грудной клетки определен неравномерно усиленный легочный рисунок, преимущественно в базальных отделах с обеих сторон, с контурированием стенок бронхов, нечеткий. Компьютерная томография органов грудной клетки: легочной рисунок умеренно деформирован, несколько обеднен в среднем этаже легочных полей, отмечается невыраженное уплотнение стенок бронхов. Рентгеноскопия желудка с контрастом: гастроэзофагеальный рефлюкс I ст. Заключение фиброэзофагогастродуоденоскопии: эзофагит А, гастропатия эритематозная. ЭКГ без патологии. При ультразвуковом исследовании сердца выявлена дополнительная хорда полости левого желудочка. Консультация оториноларинголога: искривление перегородки носа влево. Консультация эндокринолога: экзогенно-конституциональное ожирение I-II степени, осложненная форма, стабильное течение. Юношеская гинекомастия, двусторонняя идиопатическая.
Клинический диагноз: Бронхиальная астма, IgЕ-опосредованная, тяжелое персистирующее течение, частично контролируемая. Хроническая дыхательная недостаточность I ст. Экзогенный аллергический альвеолит. Аллергический персистирующий ринит, умеренной степени тяжести. Искривление перегородки носа влево. Астено-невротический синдром. Экзогенно-конституциональное ожирение I-II степени, осложненная форма, стабильное течение. Юношеская гинекомастия, двусторонняя, идиопатическая.
Была назначена следующая контролирующая терапия: серетид 50/500 по одной дозе два раза в день 3 месяца, теопек-300 по 1/2 таблетки два раза в день 3 месяца.
Через 1 месяц пациент обратился повторно. Контроля астмы не наблюдалось.
Предпринята попытка смены терапии. Серетид 50/500 по одной дозе два раза в день 3 месяца в сочетании с теопеком-300 по 1/2 таблетки два раза в день 3 месяца и циклесонидом (Альвеско®) 160 мкг два раза в день 2 недели, с последующей отменой утренней дозы серетида на 2 недели, а затем – полный переход на Альвеско® 160 мкг утром и 320 мкг вечером.
С переходом на терапию Альвеско® в течение 3 месяцев терапии мальчик отмечал улучшение самочувствия, при аускультации не выслушивались хрипы, дыхание оставалось жестким. Удалось отказаться от терапии теопеком, серетидом в пользу Альвеско® (160 мкг утром и 320 мкг вечером). Приступы БА за эти 3 месяца были два раза. Улучшились показатели функции внешнего дыхания по данным повторной спирометрии: ОФВ1 стабильно выше 80% должного. Астма приобрела контролируемое течение.
Таким образом, у 29,1% детей 3–18 лет жизни с тяжелой БА, несмотря на комбированную терапию контролирующими препаратами, не удается достичь контроля болезни. С целью оптимизации терапии пациентов с тяжелой частично контролируемой и неконтролируемой астмой на стандартной базисной терапии необходимо внедрение в клиническую практику современных лекарственных средств, в том числе ИКС, отличающихся большей клинической эффективностью и безопасностью. В качестве такого препарата может рассматриваться циклесонид.
Л И Т Е Р А Т У Р А
- Papadopoulos N.G., Arakawa H., Carlsen K.-H. et al. // Allergy. – 2012. – Vol.67. – P.976–997.
- Жерносек В.Ф., Дюбкова Т.П. Диагностика и лечение аллергических болезней у детей: справочник. – Минск: РИВШ, 2013. – 120 с.
- Жерносек В.Ф. // Семейный доктор. – 2012. – №1. – С.51–56.
- Casale T.B. Severe asthma // Global atlas of asthma. – Zurich, 2013. – P.112–114.
- Papadopoulos N.G. Asthma in childhood // Global atlas of asthma. – Zurich, 2013. – P.57–60.
- Княжеская Н. // Врач. – 2012. – №2. – С.32–35.
- Ненашева Н.М. // Эффективная фармакотерапия. Пульмонология и оториноларингология. – 2012. – №2. – С.24–33.
- Архипов В.В., Архипова Д.Е. // Эффективная фармакотерапия. Аллергология и иммунология. – 2012. – №2. – С.6–11.
- Эфендиева К.Е., Намазова-Баранова Л.С., Левина Ю.Г. и др. // Вопр. соврем. педиатрии. – 2013. – №1. – С.117–122.
- Gelfand E.W., Georgitis J.W., Noonan M., Ruff M.E.// J. Pediatr. – 2006. – Vol.148. – P.377–383.
Медицинские новости. – 2014. – №12. – С. 29-32.
Читайте также: Догоспитальная помощь больным бронхиальной астмой













Комментировать