Костюк С.А., Руденкова Т.В., Демидчик Ю.Е., Третьяк И.Ю. Белорусская медицинская академия последипломного образования, Минск
Резюме. Успех применения системной химиотерапии при раке молочной железы во многом определяется химиорезистентностью тканей опухоли, обусловливаемой фармакокинетической невосприимчивостью, недостаточной васкуляризацией новообразования, приводящей к низкой концентрации препарата в опухолевой ткани, собственно клеточной резистентностью. Изучение индивидуальных особенностей уровней экспрессии некоторых генов глутатион-S-трансферазы и семейства АВС-транспортеров может служить маркером чувствительности опухолевых клеток к химиопрепаратам, поскольку уровень экспрессии того или иного гена дает представление о возможном количестве синтезированного продукта данного гена – белков, которые защищают опухолевые клетки.
Ключевые слова: рак молочной железы, химиорезистентность, гены семейств ABC и GST, TaqMan ПЦР.
Рак молочной железы (РМЖ) занимает одно из ведущих мест в структуре заболеваемости злокачественными новообразованиями в большинстве стран мира, в том числе в Республике Беларусь. За последние 10 лет (2003–2012) отмечено увеличение количества первичных случаев этого новообразования с 61,7 до 76,6 на 100 тыс. женского населения. Следует отметить, что в течение последних лет смертность от рака молочной железы в нашей стране устойчиво занимает первое место в структуре смертности от злокачественных новообразования среди женского населения, составив в 2012 г. 17,8% от числа всех умерших [2].
Согласно современным представлениям, РМЖ представляет собой системный опухолевый процесс, для уменьшения выраженности (либо устранения) которого требуется использование системной химиотерапии [1]. Успех ее применения во многом определяется химиорезистентностью тканей опухоли, обусловливаемой фармакокинетической невосприимчивостью, недостаточной васкуляризацией новообразования, приводящей к низкой концентрации препарата в опухолевой ткани, собственно клеточной резистентностью [9]. Ключевую роль в оценке формирования химиорезистентности опухолевых клеток отводят глутатион-S-трансферазам (GST) и белкам семейства АВС-транспортеров [10, 11].
Ферменты GST участвуют в детоксикации ксенобиотиков, катализируя процесс их конъюгации с глутатионом. Предполагается, что GST участвуют в развитии лекарственной устойчивости с помощью прямого детоксифицирующего действия, а также как ингибитор MAP (митогенактивированные белки) киназного пути [4, 6, 8, 12]. ABC белки (ATP Binding Cassette transporters, АТФ-зависимые транспортеры) принимают участие в формировании химиорезистентности опухолевых клеток на этапе реализации токсического воздействия веществ на клетку, т.е. на уровне проникновения препаратов через клеточную мембрану и накопления внутри клетки эффективных концентраций лекарства. ABC-транспортеры обеспечивают транспорт химиопрепаратов из клетки, что приводит к снижению концентрации препарата внутри клетки [5, 8].
Изучение индивидуальных особенностей уровней экспрессии некоторых генов семейств GST и ABC может служить маркером чувствительности опухолевых клеток к химиопрепаратам, т.к. уровень экспрессии того или иного гена дает представление о возможном количестве синтезированного продукта данного гена – белков, которые защищают опухолевые клетки. Следовательно, чем выше уровень экспрессии гена в опухолевой ткани, тем больше вероятность проявления лекарственной устойчивости клетками данной ткани.
Цель исследования – разработка методики для определения уровней экспрессии генов ABCC2, ABCC5, ABCA12 и GSTP1 в образцах из парафин-фиксированных срезов опухолевой ткани молочной железы.
Материалы и методы
В качестве материала для исследования использовали парафин-фиксированные срезы образцов опухолевой ткани пациенток с диагнозом «рак молочной железы IIIB/IV стадии». Материал нарезали с использованием микротома из парафиновых блоков (FFPE), масса кусочков ткани была эквивалентна меньше или равно 80 μm, для чего брали 4 среза по 20 μm или 8 срезов по 10 μm. Выделяли РНК из парафин-фиксированных срезов образцов опухолевой ткани пациентов с использованием набора реагентов «Recover All Total Nucleic acid isolation kit» (Ambion, США). Выделение проводилось согласно инструкции производителя и включало несколько этапов: 1) отмывка образца ткани от парафина с использованием ксилола и этанола; 2) разрушение протеаз; 3) выделение и отмывка РНК на фильтрах; 4) разрушение нуклеаз и окончательная отмывка РНК; 5) высушивание и элюция РНК.
Для определения концентрации РНК и степени чистоты выделенной нуклеиновой кислоты проводили спектрофотометрические исследования (NanoDrop 1000, Thermo scientific, США) на длине волны ?=230 нм. Степень чистоты выделенной РНК оценивали по соотношениям 260/280 и 260/230. После оценки качества РНК полученный раствор подвергали обратной транскрипции.
Обратную транскрипцию проводили с использованием набора SuperScript III reverse transcriptase, dNTP и Ribonuclease inhibitor (Invitrogen, США). Полученную в результате обратной транскрипции кДНК использовали для постановки TaqMan ПЦР в режиме реального времени с участием Platinum PCR SuperMix (Invitrogen, США), специально подобранных пар праймеров и зондов для каждого гена, включая house-keeping гены.
Результаты и обсуждение
На первом этапе исследования были подобраны пары праймеров (forward и reverse) и TaqMan-зондов для генов ABCC2, ABCC5, ABCA12 и GSTP1 с использованием Vector NTI программного обеспечения.
Далее была изучена возможность использования подобранных пар праймеров и зондов для выявления каждого из исследуемых генов. Амплификацию проводили для каждого гена в трех образцах, пробы ставили в дублях.
Для гена ABCC2 (MRP2):
– forward-праймер: ABCC2-f – TTCAGCGAGACCGTATCAGGTT;
– reverse-праймер: ABCC2-r – TTCTGGTTGGTGTCAATCCTCA;
– зонд: ABCC2-p: FAM-TGCCTTTGAGCACCAGCAGCGATTT- BHQ1.
Длина детектируемого фрагмента гена ABCC2 (MRP2) составляла 99 п.о. Для проведения TaqMan ПЦР в режиме реального времени в качестве метки для зонда использовали FAM, в качестве гасителя – BHQ1.
Для гена ABCC5:
– forward-праймер: ABCC5-f – CCCAGGCAACAGAGTCTAACC;
– reverse-праймер: ABCC5-r – CGGTAATTCAATGCCCAAGTC;
– зонд: ABCC5-p: FAM-TGACGGAAATCGTGCGGTCTTGGT- BHQ1.
Длина детектируемого фрагмента гена ABCC5 составляла 113 п.о. Для проведения TaqMan ПЦР в режиме реального времени в качестве метки для зонда использовали FAM, в качестве гасителя – BHQ1.
Для гена ABCА12:
– forward-праймер: ABCА12-f – CCTCCATTCAGCACCAAAGTCT;
– reverse-праймер: ABCА12-r – TGAGGTCACCCATGCCATT;
– зонд: ABCА12-p: FAM-CCTACCTGTCACTCCTACGGGCACTCG- BHQ1.
Длина детектируемого фрагмента гена ABCА12 составляла 76 п.о. Для проведения TaqMan ПЦР в режиме реального времени в качестве метки для зонда использовали FAM, в качестве гасителя – BHQ1.
Для гена GSTP1:
– forward-праймер: GSTP1-f – CTGCAGATCTCCTTCGCTGA;
– reverse-праймер: GSTP1-r – ACATATGCTGAGAGCAGGGG;
– зонд: GSTP1-p: FAM-CTGCTGGACTTGCTGCTGAT — BHQ1.
Длина детектируемого фрагмента гена GSTP1 составляла 104 п.о. Для проведения TaqMan ПЦР в режиме реального времени в качестве метки для зонда использовали FAM, в качестве гасителя – BHQ1.
Состав амплификационной смеси был универсален для всех генов и различался только вносимыми парой праймеров и зондом. В пробирку объемом 0,2 мл вносили 26 мкл Platinum PCR SuperMix, 1,1 мкл смеси forward-праймер – reverse-праймер – зонд (все компоненты данной смеси в концентрации 3,2 рмоль/мкл) и 3 мкл кДНК.
Так как расчетная температура отжига всех пар праймеров была 60°С, то для амплификации всех генов использовали универсальную программу. Амплификацию проводили с использованием термоциклера «Rotor-Gene-6000» («Corbett research», Австралия) по следующей программе: 1 цикл 95°С – 5 мин, 50 циклов 95°С – 15 с, 60°С – 40 с.
Результаты, полученные в ходе выполнения данного этапа, представлены в табл. 1.
Таблица 1. Значения пороговых циклов генов ABCC2, ABCC5, ABCA12 и GSTP1, полученные при выполнении моноплексной ПЦР
| Ген | Значения пороговых циклов (Ct) | |||||
| образец 1 | образец 2 | образец 3 | ||||
| 1.1 | 1.2 | 2.1 | 2.2 | 3.1 | 3.1 | |
| ABCC2 | 29,6 | 29,21 | 28,47 | 28,66 | 33,74 | 33,25 |
| ABCC5 | 33,51 | 33,02 | 29,01 | 28,84 | 31,86 | 31,79 |
| ABCA12 | 26,15 | 26,24 | 33,19 | 33,31 | 35,71 | 35,42 |
| GSTP1 | 27,01 | 26,83 | 31,05 | 31,11 | 34,24 | 33,76 |
Дополнительно был проведен электрофоретический анализ полученных ампликонов с целью оценки уровня амплификации неспецифических фрагментов ДНК. Во всех образцах присутствовали четкие полоски на уровне детекции специфических фрагментов. ДНК из геля после проведения электрофореза извлекли с использованием набора реагентов QIAquick Gel extraction kit (Qiagen, Германия) для постановки секвенирующей ПЦР с целью анализа нуклеотидной последовательности полученных фрагментов ДНК для оценки специфичности разработанной методики.
Секвенирующую ПЦР проводили с использованием BigDye Terminator Cycle Sequencing kit v3.1 (Applied Biosystems). Отсеквенированные фрагменты ДНК подвергались очистке с использованием DyeEx 2.0 Spin kit (Qiagen) и последующему электрофоретическому анализу на генетическом анализаторе ABI Prism 310. Полученные данные о нуклеотидной последовательности образцов сравнивали с зарегистрированными последовательностями анализируемых генов в on-line поисковой системе BLAST (www.ncbi.nlm.nlm.nih.gov/blast/bl2seq/bl2.html) для идентификации принадлежности той или иной последовательности к определенному гену [7]. Для всех проанализированных образцов совпадение нуклеотидных последовательностей находилось на уровне 100%. Это позволило сделать вывод о том, что специфичность разработанной методики составляет 100% [3]. Анализ всех полученных данных позволил сделать вывод, что подобранные пары праймеров и зонды можно использовать для амплификации изучаемых генов.
Исходя из анализа полученных данных, образец 2 был взят для дальнейшей оценки эффективности ПЦР для генов ABCC2 и ABCC5, а образец 1 – для генов ABCA12 и GSTP1, т.к. значения пороговых циклов амплификации в данных образцах были самыми низкими.

Для оценки эффективности протекания ПЦР проводили амплификацию 10-кратных разведений образцов кДНК с целью построения стандартной кривой. Концентрацию кДНК в неразведенном образце условно принимали за 100 и делали 2 разведения (10, 1). Амплификацию проб проводили в дублях.
Корреляции (R2) между значениями пороговых циклов СТ и log10 условной концентрации кДНК в образце составила от 0,995 до 0,998. Полученные значения эффективности ПЦР находились в пределах от 1,57 (для гена ABCA12) до 1,71 (для гена ABCA12). Все полученные результаты представлены в табл. 2.
Таблица 2. Значения пороговых циклов, эффективности и корреляции для генов ABCC2, ABCC5, ABCA12 и GSTP1
| Ген | Значения пороговых циклов (Ct) | Е | R2 | |||||
| 100 | 10 | 1 | ||||||
| 100.1 | 100.2 | 10.1 | 10.2 | 1.1 | 1.1 | |||
| ABCC2 | 28,47 | 28,66 | 31,18 | 30,99 | 37,26 | 36,78 | 1,58 | 0,997 |
| ABCC5 | 29,01 | 28,84 | 33,21 | 33,5 | 38,4 | 38,87 | 1,63 | 0,997 |
| ABCA12 | 26,15 | 26,24 | 29,68 | 29,92 | 35,11 | 35,6 | 1,57 | 0,995 |
| GSTP1 | 27,01 | 26,83 | 30,42 | 29,99 | 34,87 | 35,02 | 1,71 | 0,998 |
Выбор референсного гена из числа house-keeping генов, таких как HGUS, GAPDH, ß-актин, проводили исходя из расcчитанных значений коэффициента вариации (CV) (формула 1) [3]:
CV = 1 — (рассчитанная концентрация ДНК / известная концентрация ДНК) ×100.
Количественное определение house-keeping генов проводили в тех же образцах, в которых оценивали амплификацию исследуемых таргетных генов (ABCC2, ABCC5, ABCA12 и GSTP1), для оценки концентрации применяли плазмидный стандарт. Амплификацию всех проб проводили в дублях, для расчета коэффициента вариации использовали средние значения концентраций.
В результате анализа полученных данных для нормализации значений уровней экспрессии таргетных генов в качестве референсного был выбран ген HGUS (human ß-glucoronidase), т.к. именно для него было установлено самое низкое значение коэффициента вариации – 6,4%. Для генов GAPDH, ß-актин рассчитанные значения коэффициентов вариации находились на уровне 9,2 и 12,7% соответственно.
Оценка эффективности протекания реакции амплификации для выбранного референсного гена HGUS позволила установить, что при использовании подобранных пар праймеров, зонда, состава реакционной смеси и условий амплификации (которые были использованы и для таргетных генов) рассчитанное значение эффективности составило 1,64. Сравнение эффективностей протекания реакций для референсного гена HGUS и исследуемых генов ABCC2, ABCC5, ABCA12 и GSTP1 позволило сделать вывод о возможности проведения мультиплексной ПЦР для одновременной амплификации таргетного и референсного генов в одной пробирке, т.к. отклонение показателей эффективности не превышало 0,2.
Для амплификации гена HGUS использовали:
– forward-праймер: HGUS-f – CTCATTTGGAATTTTGCCGATT;
– reverse-праймер: HGUS-r – CCGAGTGAAGATCCCCTTTTTA;
– зонд: HGUS-p – JOE-TGAACAGTCACCGACGAGAGTGCTG- BHQ2.
Далее была проведена оптимизация мультиплексной ПЦР, при которой в одной пробирке одновременно амплифицировали один из исследуемых генов (ABCC2 ABCC5, ABCA12 или GSTP1) и референсный ген HGUS. При этом детекцию таргетных генов проводили по каналу «Green», т.к. зонды для данных генов были мечены флуорофором FAM, а детекцию гена HGUS проводили по каналу «Yellow», т.к. зонд для него был мечен флуорофором JOE. В пробирку объемом 0,2 мл вносили 26 мкл Platinum PCR SuperMix, 1,1 мкл смеси forward-праймер – reverse-праймер – зонд одного из исследуемых генов (ABCC2 ABCC5, ABCA12 или GSTP1), 1,1 мкл смеси forward-праймер – reverse-праймер – зонд гена HGUS и 3 мкл кДНК. Праймеры и зонды вносили в концентрации 3,2 рмоль/мкл.
Для выбора оптимального режима амплификации для каждого из исследуемых генов при проведении мультиплексной ПЦР были опробованы 3 режима (табл. 3). Амплификацию проводили с использованием термоциклера «Rotor-Gene-6000» («Corbett research», Австралия).
Таблица 3. Программы амплификации, с изменением температуры отжига праймеров
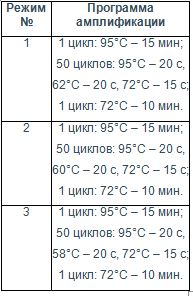
Наилучший результат амплификации для гена ABCC2 был достигнут при использовании режима 2, для гена ABCC5 – при использовании режима 3, для гена ABCA12 – при использовании режима 2, для гена GSTP1 – при использовании режима 3. При этом оценивали результаты амплификации как исследуемого гена, так и референсного гена HGUS.
Для апробирования разработанной методики провели амплификацию и расчет уровня нормализованной экспрессии генов ABCC2, ABCC5, ABCA12 и GSTP1 в образцах из парафин-фиксированных срезов опухолевой ткани при раке молочной железы IIIB/IV стадии. Расчет процента уровня нормализованной экспрессии генов проводился по формуле:
N = 2 – (CT интересующего гена – CT гена HGUS) X 100%,
где CT – пороговый цикл (cycle threshold).
Полученные результаты представлены в табл. 4.
Таблица 4. Значения пороговых циклов и уровни нормализованной экспрессии
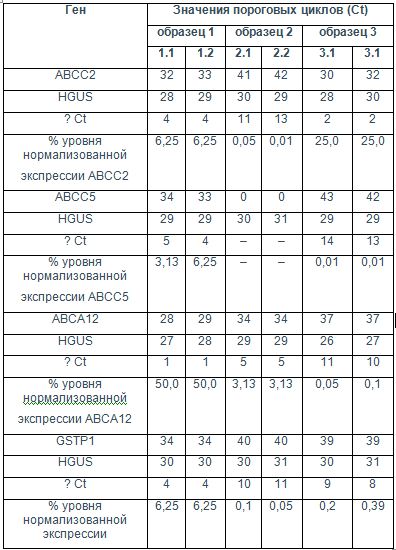
Таким образом, анализ результатов, полученных в ходе проведения моноплексной и мультиплексной ПЦР, позволил сделать вывод о том, что разработанную методику можно использовать для определения уровней нормализованной экспрессии генов ABCC2 ABCC5, ABCA12 и GSTP1 в образцах из парафин-фиксированных срезов опухолевой ткани при раке молочной железы.
Л И Т Е Р А Т У Р А
- Моисеенко, В.М. «Естественная история» роста рака молочной железы / В.М.Моисеенко // Практ. онкол. – 2002. – Т.3, №1. – С.6–14.
- Океанов, А.Е. Статистика онкологических заболеваний / А.Е.Океанов, П.И.Моисеев, Л.Ф.Левин; под ред. О.Г.Суконко. – Минск, 2013. – С.372–373.
- Организация системы контроля качества исследований методом полимеразной цепной реакции / Н.А.Бадыгина [и др.] // Лабор. диагностика. Восточная Европа. – 2012. – № 1. – С.28–38.
- Полиморфизм генов глутатион-s-трансфераз и результаты химиотерапии рака яичников / А.А.Моисеев [и др.] // Вестник российского онкологического научного центра имени Н.Н.Блохина РАМН. – 2008. – Т. 19, №1. – С.59–64.
- Роль белков-транспортеров семейства ABC в развитии химиорезистентности при раке молочной железы / И.Ю.Третьяк [и др.] // Весцi Нац. акад. навук Беларусi. Серыя мед. навук. – 2013. – №3. – С.91–96.
- Роль глутатион-S-трансферазы в патогенезе рака молочной железы / С.А.Костюк, И.Ю.Третьяк, Ю.Е.Демидчик // Весцi Нац. акад. навук Беларусi. Серыя мед. навук. – 2013. – №1. – С.78–90.
- Руденкова, Т. В. Анализ нуклеотидных замен в генах, кодирующих белки цитоадгезии Mycoplasma genitalium / Т.В.Руденкова // Репродукт. здоровье. Восточная Европа. – 2012. – №5. – С.185–188.
- Hannay, J. Molecular mechanisms of escape from chemosensitivity / J.Hannay, D.Yu // J. Med. Sciences. –2004. – Vol. 24, N5. – P.237–242.
- Lage, H. Drug resistance in breast cancer / H.Lage // Cancer Therapy. – 2003. – Vol.1. – P.81–91.
- Stavrovskaya, A. Transport Proteins of the ABC Family and Multidrug Resistance of Tumor Cells / A.Stavrovskaya, T.Stromskaya // Biochemistry (Moscow). – 2008. – Vol.73, N5. – P.592–604.
- Tew, K.D. Glutathione-associated Enzymes in Anticancer Drug Resistance / K.D.Tew // Cancer Research. – 1994. – Vol.54. – P.4313–4320.
- Townsend, D.M. The role of glutathione-S-transferase in anti-cancer drug resistance / D.M.Townsend, K.D.Tew // Oncogene. – 2003. – Vol.22. – P.7369–7375.
Медицинские новости. – 2014. – №12. – С. 55-58.
Читайте также: Спонтанная регрессия немелкоклеточного рака легких после биопсии метастазов в медиастинальных лимфатических узлах: клинический случай








Комментировать