Болевой синдром в клинической врачебной практике: что это такое?
Садовникова И.И.
В русском языке слово «боль» является основой многих других слов, таких как болезнь, больной, заболевание, разболелся. Боль как ощущение человека во многих ситуациях является учебной компонентой в изучении жизни и внешних воздействий. Так, соприкосновение с горячими, холодными, травмирующими предметами, вызывая болевые ощущения, оставляет в памяти информацию, позволяющую в дальнейшем избежать повторения печальной истории. Боль, провоцируемая внутренней средой организма, сигнализирует отклонение от нормального функционирования органов и систем.
Современные концепции боли стали формироваться в середине прошлого века. По мнению Л.В. Калюжного [1], боль как интегративная функция организма является отрицательной биологической потребностью, ответственной за формирование функциональной системы сохранения гомеостаза. Ряд авторов предлагают следующее определение данного понятия: «боль – мультисистемная реакция организма, протекающая в рамках физиологических (защитных рефлексов) или патофизиологических (один из синдромов какого-либо заболевания) процессов и направленная на восстановление гомеостаза или реализацию патологической доминанты» [1, 2].
Определение боли экспертами Международной ассоциации по изучению боли (LASP): «боль – это неприятное ощущение и эмоциональное переживание, связанное с реальным или потенциальным повреждением тканей, или описываемое в терминах такого повреждения». Данное определение свидетельствует о том, что для ощущения боли не обязательно наличие поврежденных тканей. В последнем случае определяющим механизмом является психоэмоциональное состояние пациента [2].
Четкой классификации боли в настоящее время не существует. Параметры деления основываются на продолжительности, локализации болевого синдрома, механизме его образования.
В зависимости от длительности боль может быть острой и хронической. Острая боль – связана с повреждением, устранение которого приводит к исчезновению боли. В других случаях продолжительность болевого синдрома превышает длительность заболевания, переходит в хроническое состояние и вызывает нарушение функции внутренних органов. По данным Европейского эпидемиологического исследования, частота встречаемости хронических неонкологических болевых синдромов в странах Западной Европы составляет около 20%, т. е. каждый пятый взрослый европеец страдает хроническим болевым синдромом [3]
По локализации острой боли выделяют [4]:1) поверхностную (экстероцептивную) боль, возникающую в случае повреждения кожных покровов, слизистых оболочек. Как правило, боль острая, колющая, жгучая, пульсирующая, пронизывающая;) глубокую (проприоцептивную) боль, возникающую при повреждении костно-мышечной системы – раздражение рецепторов мышц, сухожилий, связок, суставов, костей. Ощущение ноющего характера, менее четкой локализации;
3) висцеральную (интероцептивную) боль, возникающую при повреждении внутренних органов. Носит ноющий, неясный характер, сопровождается вегетативными расстройствами – тошнотой, потливостью, снижением АД, брадикардией;
4) отраженную боль, в основе которой лежит феномен зон Захарьина–Геда – проекция боли в дерматомах, иннервируемых теми же сегментами, что и вовлеченные в патологический процесс, глубоко расположенные ткани или внутренние органы. Проявляется локальной гипералгезией, гиперестезией, мышечным напряжением, локальными и диффузными вегетативными феноменами.
Хронические боли в силу своей распространенности стали рассматриваться как самостоятельное заболевание. По определению экспертов Международной ассоциации по изучению боли, хронической считается боль длительностью более 3-х мес. и продолжающаяся сверх нормального периода заживления тканей [3]. По данным исследований, проведенных в различных регионах мира, от 7 до 64% населения периодически испытывают боли, а от 7 до 45% страдают рецидивирующими или хроническими болями [4].
Международная ассоциация по изучению боли приводит следующее распределение 530 болевых синдромов по их локализации: генерализованные болевые синдромы – 36, боли в области шеи и головы – 66, боли в руках – 35, боли в области грудного и шейного отделов позвоночника – 154, боли в поясничной, сакральной и копчиковой области – 136, боли в туловище – 85, боли в ногах – 18 [2, 3].
Основными источниками локальной боли в поясничной области в 70–80% случаев считаются миогенные нарушения (спазм, микротравматизация, ишемизация паравертебральных мышц), дисфункция фасеточных суставов (до 40% случаев) и в 5% случаев – дискогенные боли [5].
Почти половина трудоспособного населения страдает от боли вертеброгенного происхождения, вызванной дегенеративно-дистрофическими процессами позвоночника, с неврологическими проявлениями [6].
В литературе [7] приоритетным является деление боли по механизму возникновения на 2 основных вида – ноцицептивную и нейропатическую. Ноцицептивная боль вызвана активацией ноцицепторов при тканевом повреждении, соответствует степени тканевой депрессии и длительности заживления. Нейропатическая боль – боль, вызванная повреждением периферической или центральной нервной системы (или обеих), сопровождающимся нарушениями чувствительности. К нейропатической боли относятся все болевые синдромы, развивающиеся при заболеваниях и травмах нервной системы (табл. 1) [8].
Наиболее частой локализацией болевого синдрома является спина. Именно здесь острая боль чаще всего переходит в состояние хронической. Основной механизм связан с раздражением ноцицептивных рецепторов [10]. Ноцицепторы представляют собой сеть свободных окончаний, пронизывающих ткани. Рецепторы боли у человека находятся в коже, в оболочках мышц, во внутренних органах, надкостнице, роговице глаза. Болевые импульсы, возникающие в ноцицепторах, поступают в центральные образования нервной системы по тонким миелинизированным волокнам, проводящим быструю боль, или по немиелинизированным С-волокнам, проводящим медленную боль [11, 12]. Одновременно болевые импульсы активируют á- и ã-мотонейроны передних рогов спинного мозга. Активация передних мотонейронов приводит к спазму мышц, иннервируемых данным сегментом спинного мозга. Мышечный спазм стимулирует ноцицепторы самой мышцы, вызывая тем самым локальную ишемию и усиление активации ноцицепторов мышечного волокна.
Создается порочный круг: «боль – мышечный спазм – боль – мышечный спазм».
Наиболее вероятными причинами невертеброгенных болей в спине специалистами считаются следующие [13]:
– болевой миофасциальный синдром (МФС);
– психогенные боли;
– отраженные боли при болезнях внутренних органов (сердца, легких, желудочно-кишечного тракта, мочеполовой системы);
– опухоли интраспинальные, экстраспинальные (невринома, менингиома);
– эпидуральный абсцесс;
– метастатические опухоли;
– сирингомиелия;
– ретроперитонеальные опухоли;
– остеоартриты.
Болевой МФС, как правило, наиболее часто становится причиной обращения к врачу. Название «болевой МФС» имеет несколько синонимов – миалгия, миофиброзит, мышечный ревматизм, миофасцит, миогелез [14]. МФС чаще всего не связан с дегенеративно-дистрофическими изменениями позвоночника и встречается вне зависимости от их наличия. Тем не менее, наличие мышечно-тонического синдрома (МТС) при остеохондрозе создает условия для возникновения триггерных точек (ТТ) на фоне болезненных мышечных уплотнений, что является основой развития МФС [14].
Определяющим признаком МФС является наличие ТТ – локальных зон исключительно высокой чувствительности, расположенных обычно в пределах тугого тяжа заинтересованной мышцы. Активные ТТ представляют собой фокус гиперраздражимости в мышцах или их фасциях, диаметром обычно 1–3 мм, которая проявляется в виде боли [15]. Группа из нескольких ТТ может достигать в диаметре 1 см. Формирование ТТ происходит в результате микротравматизации заинтересованных мышц. Вначале в мышцах возникает остаточное напряжение, затем в межклеточном пространстве формируется локальное мышечное напряжение, в процессе которого межклеточная жидкость трансформируется в миогеллоидное уплотнение. Такие миогеллоидные узелки (мышечные ТТ) и служат источником патологической импульсации в вышележащие отделы ЦНС. Гистологические изменения данных участков неспецифические, но всегда присутствуют признаки локальной гипоксии [16, 17].
ТТ могут находиться в активном и латентном состоянии [16]. В активных ТТ боль возникает в покое и при движениях на ограниченном участке, при стимуляции же (пальпации) фиксируются болевые ощущения в удаленном от давления, но строго определенном месте [16]. Каждая ТТ имеет свою строго специфическую зону отражения болей, как правило, находящуюся в пределах одного склеротома, но не занимает его полностью. В зоне отраженных болей помимо болевых ощущений могут наблюдаться вегетативно-трофические изменения (изменение потливости и сальности кожи, изменения цвета, гипертрихоз) и вторичный спазм мышц с формированием в них вторичных ТТ. В самой мышце никогда не наблюдаются гипо- и/или атрофии. Изменения функционального состояния мышц, связанных с МФС, часто приводят к психологическим и поведенческим нарушениям у пациентов, например депрессии [16]. В момент физикального обследования пациента (при пальпации) фиксируется «симптом прыжка» – при надавливании на активную ТТ пациент бурно реагирует, непроизвольно пытаясь устранить раздражитель, приносящий боль, подпрыгивает на кушетке. При специфических местных воздействиях на напряженную мышцу возможно исчезновение болей и мышечного спазма [16].
Латентная ТТ проявляется только локальной болезненностью при пальпации места расположения триггера, без зоны отраженных болей. Латентные ТТ встречаются гораздо чаще, чем активные. При обследовании 200 молодых людей Д.Т. Тревелл и Д.Г. Симоне [16] обнаружили латентные триггеры у 54% девушек и 45% юношей. Наряду с этим активные ТТ были определены лишь в 5% случаев. Возможен переход ТТ из одного состояния в другое под воздействием различных факторов: из латентного в активное – длительный стресс, избыточная физическая нагрузка, переохлаждение и обратно – покой, тепло, массаж.
В формировании МФС особое значение имеют врожденные аномалии развития или структурные несоответствия опорно-двигательного аппарата [14]: асимметрия нижних конечностей, уменьшение размеров одной половины таза, плоскостопие, длинная вторая плюсневая кость при укороченной первой, короткие плечи при удлиненном туловище.
Разница в длине ног от 1 см становится фактором риска для развития болевого синдрома. Формирование вслед за этим S-образного позвоночника, опущение плеча на стороне короткой конечности, изменение нагрузки на квадратную мышцу спины и мышцы, задействованные в грудинно-ключичном сочленении (лестничные, трапециевидные, поднимающие лопатку), сопровождается жалобами на боли в нижней части спины, шее, верхнем квадранте спины и воротниковой зоне [14].
Длинная вторая плюсневая кость формирует выраженные нарушения позы. В результате постоянного напряжения мышц возникает МФС в пояснице, бедре, колене, голени, стопе.
Короткие плечи – избыточное напряжение мышц плечевого пояса и активация в них ТТ – трапециевидная мышца и мышца, поднимающая лопатку.
Причины, провоцирующие развитие МФС у всех групп населения [13]:
– растяжение мышц – происходит при выполнении «неподготовленного» движения – неудачный прыжок, поворот и т. д. Болевой синдром развивается быстро, и больной помнит, какое движение привело к боли;
– повторная микротравматизация – микротравмы мышц чаще всего возникают при выполнении профессиональных стереотипных движений и хронической перегрузке мышц или при длительной работе нетренированных мышц;
– перенос перенапряжения – так называемое «позное напряжение» возникает при длительном пребывании в антифизиологической позе (работа в неправильной позе за компьютером, использование неудобной мебели, профессиональная деятельность, требующая стационарной позы) и неумении и/или неспособности расслабить мышцы, что формирует и активирует ТТ, а также, как и во время глубокого сна, сохранении одной позы [18];
– переохлаждение мышц – низкая температура окружающей среды способствует мышечному спазму;
– эмоциональный стресс – сопровождается мышечным напряжением и, следовательно, может активировать ТТ [18]. Хронический стресс и психоэмоциональное состояние влияют на активацию ТТ. В этих ситуациях многие мышцы лица, шеи, туловища находятся в сокращенном состоянии, изменяется двигательный стереотип с формированием зон избыточного напряжения ряда мышечных групп. При любых эмоционально-аффективных расстройствах ослабляется антиноцицептивная импульсация на структуры задних рогов, в связи с чем снижается болевой порог и, следовательно, повышается восприятие боли. При тревожных расстройствах могут избыточно активироваться клетки передних мотонейронов, что приводит к мышечному спазму и активации триггеров, сопровождается мышечным напряжением и может активировать ТТ. Мышцы находятся в спазмированном состоянии и после прекращения воздействия стрессорного агента [19];
– бытовые факторы – сдавление мышц ремнями сумки или лямками рюкзака, узкими бретельками лифа, тугим воротником, туго застегнутым ремнем, узкими брюками и т. д.
Для правильной диагностики МФС предлагаются следующие диагностические критерии [19]:
- Большие критерии (необходимо наличие всех 5):
– жалобы на локальную или региональную боль;
– ограничение объема движений;
– пальпируемый в пораженной мышце тугой тяж;
– участок повышенной чувствительности в пределах тугого тяжа (ТТ);
– характерная для данной пораженной мышцы зона отраженной боли.
- Малые критерии (необходимо наличие 1-го из 3-х):
– воспроизводимость боли при стимуляции ТТ;
– вздрагивание при пальпации ТТ пораженной мышцы;
– уменьшение боли при растяжении пораженной мышцы.
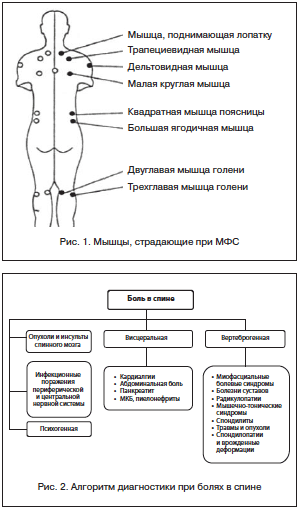
При вторичном характере МФС напряжение мышц является физиологическим обоснованием, следует за болевым синдромом в результате дегенеративных и воспалительных изменений в структурах позвоночника (суставах, связках, межпозвоночных дисках и т. д.), приводит к иммобилизации пораженного участка, созданию мышечного корсета с формированием МТС. При продолжительном МТС развивается мышечная дисфункция с развитием МФС (рис. 1) [19].
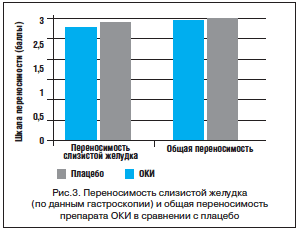
В помощь врачам рекомендуется алгоритм диагностического поиска при дорсалгиях (рис. 2) [20].
Страдающие болями в опорно-двигательном аппарате чаще всего на первом этапе становятся пациентами врачей терапевтического профиля. Диагностика поражения может проводиться по предложенным выше алгоритмам с дальнейшей консультацией узкого специалиста. Однако основная задача врача – облегчить страдания больного. Поэтому назначение терапии при первом посещении амбулаторного звена должно проводиться незамедлительно, до получения данных инструментального обследования.
Лечение болей в спине разделяют в соответствии с 3 периодами: острый, подострый и период ремиссии [21]. Основным критерием периодичности в течении заболевания является наличие и характер болевого синдрома.
Периоды:
- Острый – спонтанные боли или боли и в покое.
- Подострый – боли в покое исчезают и остаются при провокации движением.
- Ремиссия – отсутствие болевого синдрома.
Лечебные мероприятия включают в себя блокады локальными анестетиками, антидепрессантами. Однако в последнее время все больше внимания уделяется нестероидным противовоспалительным препаратам (НПВП) [20]. НПВП представляют собой обширную и разнообразную группу препаратов, в действии которых выделяют следующие основные механизмы: предупреждение повреждения клеточных структур; уменьшение проницаемости капилляров; ограничение экссудативных проявлений; ингибирующее влияние на синтез или инактивацию медиаторов воспаления (гистамина, серотонина, брадикинина, лимфокинов, простагландинов) и др.
Одним из представителей данной группы является препарат ОКИ (кетопрофена лизиновая соль) [24].
Препарат оказывает противовоспалительное, анальгезирующее и жаропонижающее действие. Ингибируя циклооксигеназы (ЦОГ-1 и ЦОГ-2), угнетает синтез простагландинов. Обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны и задерживает высвобождение из них ферментов, способствующих разрушению тканей при хроническом воспалении. Снижает выделение цитокинов, тормозит активность нейтрофилов. Лизиновая соль кетопрофена обладает противовоспалительным, обезболивающим и жаропонижающим свойством, быстрым началом действия (уже через 15–20 мин), продолжительностью действия до 8 ч и хорошей переносимостью. Быстрое начало действия объясняется более высокой растворимостью лизиновой соли кетопрофена по сравнению с неизмененным кетопрофеном. Высокая растворимость способствует более быстрому и полному всасыванию действующего вещества, что приводит к достижению пика концентрации в плазме крови при пероральном приеме уже через 15 мин, тогда как обычный кетопрофен достигает максимума через 60 мин после приема [25, 26]. ОКИ уменьшает боль за счет уникального тройного механизма анальгетического действия: периферического (за счет блокады цикла арахидоновой кислоты) и двух центральных (уменьшение чувствительности рецепторов головного мозга и блокада передачи импульсов в спинном мозге).
Кетопрофена лизиновая соль, в отличие от кетопрофена, является быстрорастворимым соединением с нейтральной рН и за счет этого почти не раздражает ЖКТ. Гастропротективное действие лизиновой соли кетопрофена основано на повышении концентрации гастропротективного протеина, повышении активности оксида азота (NO-синтазы II) в слизистой оболочке желудка и снижении активности провоспалительных медиаторов, что доказано экспериментальным путем [27]. В связи с этим общая и местная переносимость препарата ОКИ (по данным гастроскопии) возрастает по сравнению с кетопрофеном в 1,6 раза. Данные наблюдений 10-дневного курса приема препарата представлены на рисунке 3. По оценке врачей, общая и местная переносимость препарата сравнима с плацебо.
Всасывание. Назначаемый внутрь кетопрофен быстро и достаточно полно всасывается из ЖКТ, его биодоступность составляет около 80%. Максимальная концентрация в плазме крови при приеме внутрь отмечается через 0,5–2 ч, ее величина напрямую зависит от принятой дозы; после ректального применения время достижения максимальной концентрации составляет 45–60 мин. Равновесная концентрация кетопрофена достигается через 24 ч после начала его регулярного приема.
Распределение – до 99% абсорбировавшегося кетопрофена связывается с белками плазмы, преимущественно с альбумином. Объем распределения – 0,1–0,2 л/кг. Легко проходит через гистогематические барьеры и распределяется в тканях и органах. Кетопрофен хорошо проникает в синовиальную жидкость и соединительные ткани. Хотя концентрация кетопрофена в синовиальной жидкости несколько ниже, чем в плазме, она более стабильна (сохраняется до 30 ч).
Метаболизм. Кетопрофен в основном метаболизируется в печени, где подвергается глюкуронидации с образованием сложных эфиров с глюкуроновой кислотой.
Препарат применяется при:
– длительном симптоматическом лечении воспалительных процессов, сопровождающихся жаром и болевыми ощущениями, в т. ч. воспалительных и ревматических заболеваний суставов: ревматоидный артрит, спондилоартриты, остеоартроз, подагрический артрит, воспалительное поражение околосуставных тканей;
– кратковременном симптоматическом лечении болевых воспалительных процессов при таких состояниях, как заболевания опорно-двигательного аппарата, отит, купирование послеоперационных болей.
Наличие в линейке НПВП препарата ОКИ в виде гранул для приготовления раствора для приема внутрь имеет свои преимущества: возможность индивидуального подбора дозы (40/80 мг), быстрое начало действия, высокая безопасность, приятный мятный вкус. Это позволяет врачу подобрать наиболее удобную для применения форму лекарственного вещества, что повышает комплаентность.
Необходимо помнить, что НПВП особенно эффективны на ранних стадиях развития боли в спине [22]. Именно на этапе острой и подострой боли с помощью традиционных НПВП можно воздействовать на выработку периферических медиаторов воспаления. В дальнейшем, когда включаются центральные патофизиологические механизмы боли, эффективность НПВП снижается. При острой боли в спине данные препараты не рекомендуются для монотерапии дольше 10–14 дней. Если недельный курс препарата не купирует болевой синдром, необходимо привлечь невролога и пересмотреть тактику лечения.
Причины неэффективного лечения: плохое кровоснабжение в очаге воспаления или стойкий спазм паравертебральных мышц с формированием порочного круга «боль – спазм – боль» [23].
Дополнительными мерами лечебного воздействия, хорошо зарекомендовавшими себя в практике болевого синдрома, являются методы воздействия на ТТ – прокалывания сухой иглой, разминание, введение в триггер раствора прокаина и аппликации с диметилсульфоксидом + метод постизометрической релаксации [15].
Основные методы профилактики болей в спине, рекомендованные всем пациентам независимо от механизма и вида появления МФС, – сохранение правильного двигательного стереотипа на протяжении всей жизни: комплексы лечебной физкультуры и методы мышечной релаксации [15].

Литература
- Калюжный Л.В. Функциональные механизмы регуляции болевой чувствительности. М.: Медицина, 1987. С. 10–87.
- http://painrussia.ru/publications/fundamental-aspects-of-pain
- Abstracts of the Second International Congress of Neuropathic Pain (New PSIG).
- Алексеев В.В. Принципы лечения болевых синдромов // Трудный пациент. 2007. № 5.
- Баринов А.Б., Жестикова М.Г. Современные методы эффективности терапии дорсалгий // Эффективная фармакотерапия. Неврология. 2015. № 2(13).
- Козелкин А.А., Козелкина С.А. Современные аспекты диагностики и лечения вертеброгенных болевых синдромов. 2006. № 1(5).
- Bennett M.l., Smith B.H., Torrance N., Lee A. J. Can pain be more or less neuropathic? Comparison of symptom assessment tools with ratings of certainty by clinicians // Pain. 2006. Vol. 122. P. 289–294.
- Dworkin R.H., Backonja M., Rowbotham M.C. et al. Advances in neuropathic pain // Arch. Nevrol. 2003. Vol. 60. P. 1524–1534.
- Finnerup N.B., Otto M., McQuay H.J. et al. Algorithms for neuropathic pain treatment / An evidence based proposal // Pain. 2005. Vol. 118. P. 289–305.
- Болевые синдромы в неврологической практике / Под ред. А.М. Вейна. М.: Медицина, 2002.
- Muscle spasms and pain. 1988. http://spasmoblock.ru/pain-syndrome1.html
- Одинак М.М., Живолуков С.А., Самарцев И.Н. Патогенетическое лечение болевых синдромов в неврологической практике: трудности и перспективы // Справочник поликлинического врача. 2006. № 7. С. 52–58.
- Lopez B.C., Hamlyn P.J., Zakrzewski J.M. Systematic review of ablative nevro-surgical techniques for the treatment of trigeminal neuralgia // Neurosurgery. 2004. Vol. 54. P. 973–982.
- Мэнкин Г.Д., Адаиле Р.Д. Боли в области спины и шеи / // Внутренние болезни / Под ред. Е.И. Браунвальда 1997. Т. 1. С.101–123.
- Вознесенская Т.В. Миофасциальный болевой синдром // Consilium medicum. 1989.
- Тревелл Дж.Г., Симонс Д. Г. Миофасциальные боли. М.: Медицина, 1989.
- Черненко О.А. Лечение болевых скелетно-мышечных поясничных синдромов // РМЖ. 2000. Т. 8, № 10. С. 408–410.
- Foley U.M. Opioids and chronic neuropathic pain // N. Engl. J. Med. 2003. Vol. 348. P. 1279–1281.
- Романенко И.В. Центральные и периферические механизмы болевых миофасциальных синдромов: дисс. доктор. мед. наук. М., 1996.
- Шаран М.Н., Степанченко А.В., Фищенко О.Н., Болоткина Г.Д. Миофасциальный болевой синдром лица // Consilium Medicum. 05/08.
- Одинак М.М., Живолуков М.В., Самарцев И.Н. Болевые синдромы в неврологической практике // Журнал неврологии и психиатрии. 2009. № 9.
- http://umedp.ru/articles/nevrologicheskie_aspekty_i_printsipy_kupirovaniya_boli_pri_sheynoplechevom_sindrome_tservikobrakhial.html
- http://umedp.ru/articles/sovremennye_metody_effektivnoy_terapii_dorsalgiy.html
- https://health.mail.ru/drug/oki_
- Fatti F. Summary of product characteristics // Data on file, 1991.
- Fatti F. et al. // Minerva Med.1994. Vol. 85. P. 531–535.
- Cimini A., Brandolini L., Gentile R. et al. Gastroprotective effects of L-lysine salification of ketoprofen in ethanol-injured gastric mucosa // J. Cellular Physiol. 2014.Vol. 6. P. 813–820.









Комментировать