Факторы риска, течение. Классификация и клинические типы. Симптоматика. Исследования, диагностика и лечение.
В.Н. ГУЗЕНКО, профессор, зав. кафедрой урологии и нефрологии, Донецкий национальный медицинский университет им. М. Горького
Б.П. Матвеев и др. (1993) отмечают, что ежегодно в пяти крупных странах Европы регистрируется 80 000 новых случаев заболевания раком предстательной железы (РПЖ). Примерно в 50–60 % случаев заболевание выявляется на поздних стадиях. РПЖ составляет 4 % среди всех онкологических заболеваний. ВОЗ установила, что каждый год впервые диагностируется приблизительно 200 000 случаев этого заболевания. Примерно у 80 % пациентов болезнь прогрессирует.
Смертность от РПЖ за последние 15 лет упала ниже 10 %, что рассматривают как косвенное доказательство положительного влияния программ раннего выявления.
Большинство исследователей придерживаются мнения, что бессимптомное течение РПЖ на ранних стадиях развития опухоли приводит к позднему выявлению болезни. Так, по данным Б.Я. Алексеева и соавт. (2000), только у 30 % больных РПЖ определяются 1-я и 2-я стадии болезни (локализованный процесс), когда возможно проведение радикального противоопухолевого лечения. У 60–80 % больных с первично выявленными злокачественными новообразованиями предстательной железы диагностируют метастазы рака.
М.И. Коган (1999) указывает, что 33 % мужчин старше 50 лет имеют латентный РПЖ. Примерно у 1 % из них заболевание, несмотря на латентное течение, диагностируется ежегодно.
У пожилых людей имеется сочетание двух заболеваний предстательной железы: доброкачественной гиперплазии и карциномы, что значительно затрудняет раннее распознавание злокачественного процесса.
Факторы риска
Заболеваемость РПЖ зависит от географического региона и этнической группы.
1. Возраст. РПЖ обычно диагностируется после 50 лет. В более раннем возрасте заболевание встречается у чернокожих мужчин с отягощенной наследственностью.
2. Наследственность. РПЖ у ближайшего родственника увеличивает риск вдвое. Если РПЖ диагностирован у трех ближайших родственников, риск увеличивается почти в 9 раз. Риск также повышен, если РПЖ больны родственники второй степени.
3. Этническое происхождение. Самая высокая в мире вероятность возникновения РПЖ у чернокожих американцев (почти в 2 раза выше, чем у белых). У азиатов вероятность РПЖ очень низкая, но после переезда в США увеличивается.
4. Диета. Усиленное употребление животного жира повышает риск РПЖ. Напротив, употребление продуктов из сои, которые содержат изофлавоноиды, фитоэстрогены, ингибитор трипсина, предупреждает развитие и прогрессирование РПЖ. Витамин Е и селен уменьшают заболеваемость РПЖ на одну и две трети соответственно. Каротиноиды, например ликопен (ответственный за красный цвет томатов), также уменьшают риск возникновения РПЖ.
5. Вазэктомия. Подавляющее большинство авторов не смогли выявить какой-либо связи между вазэктомией и РПЖ.
Естественное течение
В целом у больных с новообразованиями низкой степени злокачественности вероятность умереть в течение 10 лет составляет не более 10 %. Однако у больных с опухолью высокой степени злокачественности вероятность смерти от РПЖ составляет 60 %. На поздних стадиях заболевания средняя выживаемость составляет от 30 до 33 месяцев; 5-летняя смертность составляет 75 % и 10-летняя смертность — 90 %.
Классификация рака предстательной железы
Региональными лимфатическими узлами являются лимфатические узлы собственно таза, расположенные главным образом ниже бифуркации общих подвздошных артерий
Т-х — первичная опухоль не может быть оценена. Т-0 — нет данных о первичной опухоли.
Т-1 — клинически не проявляющаяся опухоль, не определяемая пальпаторно и лучевыми методами диагностики.
Т-1а — опухоль выявлена гистологически случайно не более чем в 5 % резецированной ткани.
Т-1б — опухоль выявлена гистологически случайно более чем в 5 % резецированных тканей.
Т-1с — опухоль выявлена с помощью биопсии (т.е. в связи с повышенным уровнем простатического специфического антигена (ПСА)).
Т-2 — опухоль ограничена предстательной железой. Т-2а — опухоль вовлекает одну долю.
Т-2б — опухоль вовлекает обе доли.
Т-3 — опухоль распространяется за пределы простатической капсулы.
Т-3а — экстракапсулярное распространение (одностороннее или двустороннее).
Т-3б — опухолевая инвазия семенных пузырьков.
Т-4 — опухоль фиксирована или переходит на смежные структуры, иные, чем семенные пузырьки, или шейку мочевого пузыря, наружный сфинктер, прямую кишку, леваторы и/или стенку таза.
Примечание: инвазия верхушки предстательной железы или в простатическую капсулу (но не за нее) классифицируется не как Т-3, а как Т-2.
N-х — регионарные лимфатические узлы не могут быть оценены.
N-0 — нет метастазов в региональных лимфатических узлах.
N-1 — метастазы в региональные лимфатические узлы (узлах).
М-х — отдаленные метастазы не могут быть оценены. М-0 — нет отдаленных метастазов.
М-1 — отдаленные метастазы.
М-1а — лимфатические узлы, не относящиеся к региональным.
М-1б — кость (и)
М-1с — другие локализации.
Группировка по стадиям:
Стадия 1 —Т-1а N-0 M-0 G-1.
Стадия 2 —Т-1а N-0 M-0 G-2, -3, -4 Т-1б N-0 M-0 любая G Т-1c N-0 М-0 любая G Т-2 N-0 М-0 любая G.
Стадия 3 —Т-3 N-0 M-0 любая G Стадия 4 —Т-4 N-0 M-0 любая G любая Т N-1 М-0 любая G любая Т-1 любая N М-1 любая G.
Если железы однородны, а признаки инвазии отсутствуют или выражены слабо, опухоль может быть отнесена к 1-й или 2-й степени дифференцирования. Криброзный вариант относится к 3-й степени. Опухоли 4-й степени дифференцирования по Глиссону характеризуются большим разнообразием гистологических проявлений и отсутствием сформированных желез. Опухоли 5-й степени с едва различимыми или практически отсутствующими железистыми структурами с крупными полями опухолевых клеток практически без каких-либо просветов.
В этиологии заболевания важную роль играют изменения соотношения между андрогенами с гестагенами и эстрогенами.
Клинические типы рака предстательной железы
Клинически рак предстательной железы может быть разделен на 3 типа: случайно обнаруженный, клинически очевидный и оккультный.
Метастазирование рака из первичного очага включает 4 стадии:
1) выделение опухолевых клеток из первичного очага рака в предстательной железе;
2) распространение злокачественных клеток лимфогенным и гематогенным путем;
3) задержка этих клеток во вторичном очаге рака;
4) экстраваскулярный рост вторичного очага с образованием метастатического фокуса.
Отдаленные метастазы в костях (крестец, грудные и поясничные позвонки, бедренная кость, кости голеней, ребра) обычно остеосклеротического характера. Клинически костные метастазы характеризуются выраженным болевым синдромом. Гематогенное распространение РПЖ во внутренние органы (легкие, печень и почки) вызывает тяжелые нарушения функции этих органов с глубокими метаболическими изменениями в организме.
Симптомы
Клинические проявления РПЖ, как правило, скудные. Возможны обструкция мочевых путей или гематурия, хотя эти признаки чаще вызваны другими причинами. К сожалению, первым симптомом может быть появление боли в костях, которая свидетельствует об отдаленных метастазах.
Скрининговые программы, основанные на определении уровня простатического специфического антигена улучшили выявляемость заболевания. До использования ПСА количество локализованных форм среди впервые выявленных составляло 33 %, а в настоящее время в экономически развитых странах мира этот показатель составляет 60–70 %.
ПСА существует в 3 основных формах: связанный с альфа-1-антихимотрипсином, связанный с альфа-2-макроглобулином и в свободном, не связанном состоянии.
ПСА характеризуется органоспецифичностью, но не канцероспецифичностью, и его умеренное повышение не всегда свидетельствует о наличии злокачественного процесса. Многочисленными исследованиями установлено, что 1 г раковой опухоли продуцирует в 10 раз больше при ПСА, чем 1 г ткани предстательной железы при доброкачественной гиперплазии предстательной железы (ДГПЖ). ПСА-тест не может быть использован как самостоятельный метод для дифференциальной диагностики локализованного рака и ДГПЖ.
Наличие анеуплоидии дезоксирибонуклеиновой кислоты (ДНК) является характерной чертой неоплазии. Примерно 50 % РПЖ содержит анеуплоидную ДНК. Простатическую интраэпителиальную неоплазию (ПИН) можно считать предшественником аденокарциномы. Выявление ПИН высокой степени при первичной биопсии простаты позволяет выявить РПЖ примерно почти у половины пациентов.
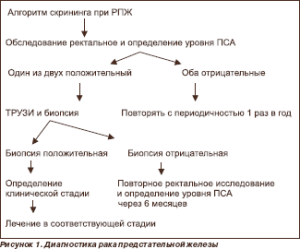
Вариабельность клинического течения рака предстательной железы, а также нередко встречающийся бессимптомный период заболевания осложняют его диагностику (рис. 1) как в ранней стадии развития опухоли, так и в стадии диссеминации.
Быстрое развитие обструктивных симптомов нижних мочевых путей, гематурия, признаки почечной недостаточности, появление болей в пояснично-крестцовом отделе позвоночника относятся к клиническим проявлениям диссеминированного РПЖ.
Методами исследования являются: пальцевое ректальное исследование (ПРИ) предстательной железы (у всех мужчин после 40 лет), трансректальное ультразвуковое исследование (ТРУЗИ), определение уровня простатического специфического антигена. Уточняющим методом является пункционная биопсия предстательной железы.
М.И. Коган (1999) в результате проведенного исследования пришел к выводу, что:
1) пальцевое ректальное исследование, определение уровня ПСА и выполнение трансректального ультразвукового исследования в диагностике РПЖ обладают высокой чувствительностью, при этом чувствительность ПСА-теста достигает 95 %;
2) в исследованиях автора наиболее высокую специфичность продемонстрировал метод ТРУЗИ — 60 %, наименьшую ПСА-тест — 26 %. Комбинации «ПСА — ПРИ» и «ПСА — ТРУЗИ» дают высокий уровень диагностики РПЖ — 83 и 80 % соответственно, причем первая предпочтительнее из-за простоты выполнения.
Комплексный анализ данных исследований дает возможность, с одной стороны, более объективно оценить клиническую значимость различных методов обследования больных с подозрением на РПЖ, а с другой — оценить возможность выявления заболевания при первичной биопсии, которая колеблется от 14,29 % у пациентов с изолированным повышением уровня ПСА— более 4 нг/мл до 80 % у больных с подозрительными в отношении рака, по данным пальцевого ректального исследования, и уровнем концентрации ПСА более 10 нг/мл.
О.Б. Лоран (1999) считает, что исследование ПСА позволяет установить диагноз РПЖ на 5–10 лет раньше его клинических проявлений. Автором установлено, что у 20 % больных с уровнем связанного простатического тканевого полипептид-специфического антигена (ТПСА) до 4 нг/мл имеют морфологически подтвержденный РПЖ. Неблагоприятным считается соотношение ФПСА/ТПСА (свободного и связанного ПСА) — 15 % и меньше.
Наибольшее количество злокачественных новообразований предстательной железы обнаружено у лиц, имевших соотношение уровня ФПСА/ТПСА 15 % и менее (частота выявления рака у таких пациентов составила 4 %). Установлено, что при злокачественных опухолях предстательной железы снижена доля свободной фракции ПСА и увеличена доля антигена, связанная с альфа-1-антихимотрипсином.
Большинство исследователей считают, что в первую очередь уровень свободного ПСА необходимо определять при значениях уровня общего ПСА в пределах «серой зоны», т.е. 4,1–10,0 нг/мл.
Более 25 % больных РПЖ имеют нормальный уровень ПСА в крови (менее 4 нг/мл), в то же время около 25 % мужчин с повышенной концентрацией ПСА не имеют рака. Повышение уровня ПСА в случае отсутствия рака может быть обусловлено простатитом, ДГПЖ, инфарктом простаты, травмой и другими причинами.
Повышенный уровень ПСА находят у 5–8 % исследованных. Концентрация ПСА в сыворотке от 4 до 10 нг/мл соответствует 16–25 % вероятности получить положительные результаты при пункционной биопсии у больных с отрицательными результатами ПРИ. Содержание ПСА в сыворотке более 10 нг/мл соответствует 67 % вероятности получить положительные результаты при исследовании биоптатов.
По данным литературы, диагностика РПЖ может быть почти всегда однозначна, если уровень ПСА выше 30 нг/мл. В тех же случаях, когда уровень ПСА находится в диапазонах от 4 до 10 нг/мл, вероятность РПЖ составляет от 25–30 %, а при уровне от 10 до 30 нг/мл вероятность повышается до 74 %. До 90 % РПЖ, выявляемого с помощью определения уровня ПСА, приходится на поздние стадии заболевания. В то же время необходимо отметить, что 20–40 % всех злокачественных новообразований предстательной железы не сопровождается повышением уровня ПСА. При РПЖ содержание свободного ПСА ниже, чем при ДГПЖ.
Диагностическая значимость почти всех опухолевых маркеров ограничена из-за ложноположительных значений. Уровень ПСА может быть повышен при ректальном исследовании накануне и даже при езде на велосипеде. Установлено, что показатель ПСА значительно повышается через 2–6 часов после пальпации предстательной железы и приходит к первоначальному уровню через 7 дней. После трансуретральной резекции и биопсии простаты определение концентрации ПСА необходимо проводить не ранее чем через 6 недель. В то же время недавние исследования не смогли подтвердить наличие существенного увеличения содержания ПСА после простого пальцевого исследования. Диапазон содержания ПСА от 4 до 10 нг/мл в литературе определяют как «серая зона», показатели которой могут соответствовать показателям как при РПЖ, так и ДГПЖ.
Высокие уровни ПСА с высокой вероятностью свидетельствуют об экстракапсулярном распространении опухоли, инвазии семенных пузырьков, а также о метастазах в тазовые лимфатические узлы или отдаленных метастазах, в первую очередь в скелет. При концентрации ПСА более 200 нг/мл практически все пациенты имеют метастазы в скелет. При уровне ПСА менее 20 нг/ мл вероятность наличия метастазов в костях очень низкая, а при уровне менее 10 нг/мл — практически равна нулю. При концентрации ПСА менее 10 нг/мл при проведении остеосцинтиграфии в скелете могут выявляться метастазы только низкодифференцированных опухолей простаты. Исходя из этого проводить остеосцинтиграфию при уровне ПСА менее 10 нг/мл нецелесообразно, а при уровне 10–20 нг/мл — только при наличии клинической симптоматики.
Плотность ПСА — это отношение уровня ПСА к объему предстательной железы. В норме плотность колеблется до 0,16 нг/мл/см3. Выше этого значения вероятность РПЖ велика. Специфичность этого показателя — около 85 %. Использование показателя плотности ПСА позволяет отказаться от неоправданных биопсий предстательной железы, при этом динамическое наблюдение за пациентом продолжается. Рекомендуется при значении показателя ПСА в пределах «серой зоны» и отсутствии изменений в предстательной железе, определяемых при пальцевом ректальном исследовании и ТРУЗИ, при плотности ПСА менее 0,15 нг/мл/см3 не производить биопсию, а проводить динамические наблюдения путем повторного определения уровней ПСА, ПРИ и ТРУЗИ. При наличии патологических изменений, выявленных при помощи ПРИ или ТРУЗИ, биопсия предстательной железы обязательна.
Плотность ПСА увеличивается с возрастом и у пациентов в 70–79 лет без патологии простаты приближается к 0,13 нг/мл/см3. У пациентов с плотностью ПСА более 0,15 нг/мл/см3 рак предстательной железы выявляют в 3 раза чаще, чем у пациентов с низким ее значением.
Плотность ПСА переходной зоны простаты рассчитывают как соотношение общего ПСА к объему переходной зоны предстательной железы, определяемому при проведении ТРУЗИ. В настоящее время нет единой точки зрения относительно пороговой величины плотности ПСА переходной зоны простаты. Показатель более 0,35 нг/мл характерен для рака и является показанием для выполнения биопсии.
Регулярные контрольные исследования (каждые 3 месяца) позволяют своевременно выявить рецидив заболевания в случае повышения уровня ПСА.
Возрастные нормы показателя ПСА. Уровень ПСА увеличивается с возрастом. Более 90 % этого повышения обусловлено возрастным увеличением объема предстательной железы. У мужчин без признаков поражения простаты среднее ежегодное увеличение концентрации ПСА составляет 0,04 нг/мл, или 3,2 %. Нормальный физиологический уровень ПСА у мужчин в возрасте 40–49 лет составляет 0–2,5 нг/мл; 50–59 лет — 0–3,5 нг/мл; 60–69 лет — 0–4,5 нг/мл; 70–79 лет — 0–6,5 нг/мл.
Скорость изменения уровня ПСА. Злокачественная опухоль быстрее растет и секретирует больше при повышенном уровне ПСА по сравнению с ДГПЖ. Верхняя граница ежегодного прироста уровня ПСА не должна превышать 0,75 нг/мл. Скорость изменения, превышающая 0,75 нг/мл в год, позволяет более надежно отдифференцировать рак от ДГПЖ.
Время удвоения показателя ПСА. Применяется при динамическом наблюдении за больными. Отмечается корреляция между временем удвоения концентрации ПСА и возникновением рецидива заболевания или появлением метастазов. Чем меньше это время, тем большая достоверность метастазирования. Более длительное время удвоения концентрации ПСА позволяет с большей достоверностью высказаться в пользу местного рецидива заболевания. Кроме того, установлено, что частота метастазирования резко возрастает при повышении уровня ПСА в течение первого года после лечения.
Тканевый полипептидный специфический антиген является фрагментом цитокератина-18 и выявляется при помощи моноклональных антител против эпитопа М3 на растворимых фрагментах цитокератина-18. Тканевый полипептидный специфический антиген — маркер агрессивности опухолевого процесса. Агрессивные опухоли даже малого размера могут давать существенное повышение уровня этого маркера в сыворотке крови.
Тканевый полипептидный антиген является смесью цитокератинов с низкой молекулярной массой. Маркер отображает степень пролиферации эпителия. Дискриминационный уровень составляет 1 нг/мл. При РПЖ значительно возрастает уровень тканевого полипептидного антигена.
Тимидинкиназа принадлежит к группе онкофетальных энзимов. Повышение уровня тимидинкиназы в сыворотке крови может быть при активной стадии злокачественных новообразований, в т.ч. и у больных РПЖ.
Преимущества тканевого полипептидного специфического антигена, тканевого полипептидного антигена и тимидинкиназы:
— позволяет контролировать активность опухолевого процесса;
— удобные маркеры метастатической активности независимо от местонахождения метастазов;
— дают более раннюю информацию о состоянии опухолевого процесса, чем общеизвестные маркеры массы опухоли — ПСА, простатическая кислая фосфатаза (КФ) (раннее подтверждение эффективности лечения, раннее выявление рецидивов);
— дают более полную картину, чем только маркеры массы опухоли.
Выявление РПЖ в группе больных, имеющих подозрительные данные ТРУЗИ, не превышало выявляемости среди больных с изолированным повышением уровня концентрации ПСА, а сочетание подозрительных данных ТРУЗИ с повышением уровня ПСА более 10 нг/мл или с подозрительными данными пальцевого ректального исследования статистически достоверно не повышало выявляемости РПЖ в этих группах. Однако, учитывая достаточно высокую чувствительность метода (67,57 %), ТРУЗИ следует рассматривать как один из обязательных методов обследования в алгоритме диагностики РПЖ. При ТРУЗИ типичными признаками РПЖ в режиме серой шкалы являются следующие:
а) узел измененной эхогенности (гипо-, смешаной) или эхоструктуры (с микрокальцинатами) в паренхиме железы, чаще локализующийся в периферической зоне;
б) неровность и нечеткость контуров узла;
в) выбухание или прерывистость собственной капсулы в проекции узла;
г) ригидность узла при сравнении с контралатеральным отделом.
При ТРУЗИ с применением методик ультразвуковой ангиографии типичными признаками васкуляризации при РПЖ являются:
а) асимметричное локальное изменение степени васкуляризации;
б) дезорганизованный тип васкуляризации узла (извитые, прерывистые, разного калибра, хаотично расположенные сосуды);
в) неравномерность распределения сосудов в узле.
При больших размерах опухоли в 65 % случаев определяется неравномерное распределение сосудов: в центральных отделах — значительное обеднение и полное разрушение сосудистого рисунка, по периферии — гиперваскуляризация. При тотальном поражении железы в 100 % случаев сосудистый рисунок железы может быть полностью деформирован, с резким обеднением васкуляризации во всех отделах железы и гиперваскуляризацией в зоне распространения опухоли. Уровень концентрации ПСА менее 4 нг/мл не исключает наличие РПЖ и поэтому не может быть противопоказанием к биопсии при подозрительных в отношении рака данных других методов исследования.
Пальцевое ректальное исследование предстательной железы. Этот метод является важной частью программы обследования больных раком предстательной железы. Специфичность его в выявлении РПЖ составила 37,9 %. Пальцевое ректальное исследование выявляет лишь 30 % рака 1–2-й стадии, тогда как при массовом осмотре мужского населения РПЖ выявляется в 1,3–1,7 % случаев. Первоначальная диагностика РПЖ основана на определяемых при пальцевом ректальном исследовании измененных в консистенции и конфигурации железы, выявлении плотного узла или множественных узлов в задней или боковых ее долях.
Вероятность того, что пальпируемое уплотнение при ПРИ — это рак, составляет 50 %. Напротив, нормальные результаты ПРИ не исключают РПЖ.
К.М. Наули (1998) для раннего выявления РПЖ предлагает свой метод скринингового обследования:
1) пальцевое ректальное исследование. Частота выявления РПЖ при этом исследовании 1–2 %;
2) определение уровня ПСА. При одном только определении показателя ПСА частота выявления РПЖ составляет 3 %;
3) ТРУЗИ проводится при подозрении на РПЖ при пальцевом ректальном исследовании и повышении ПСА.
Точным подтверждением диагноза служит лишь гистологическое исследование биоптата участка ткани, подозрительного в отношении опухолевого процесса. Выявление очага уплотнения в одной из долей предстательной железы всегда требует гистологической верификации. Следует отметить, что хотя в ряде случаев при гистологическом исследовании биопсийного материала не удается выявить признаки малигнизации, однако это не является основанием для исключения рака, поскольку опухолевый очаг мог быть не захвачен в биопсийный материал. Обычно предстательную железу условно разделяют на шесть радиальных частей и берут биоптат из каждой (секстантная биопсия). Однако, согласно последним данным, целесообразно брать большее число биопсий (от 8 до 12).
Широко применяемая методика секстантной пункционной биопсии простаты позволяет выявить только от 1/2 до 3/4 клинически значимых опухолей.
Е.Б. Мазо, В.В. Мешков (1999) выполняли пункционную биопсию простаты под ультразвуковым наведением 106 больным с подозрением на РПЖ.
Показаниями к биопсии являлись: повышение уровня общего ПСА выше 4 нг/мл; плотность ПСА более 0,15; снижение показателя (свободного) общего ПСА менее 15 %; подозрительные данные при ректальном исследовании и ТРУЗИ и их сочетания.
Доступы для проведения биопсии — промежностный, позадилобковый и трансвезикальный. Наибольшее распространение получил промежностный доступ. Пункционная биопсия осуществляется трансректальным или промежностным доступом с помощью специальных игл — троакаров, дающих возможность получить кусочки ткани железы, достаточные для гистологического исследования.
Осложнения трансректальной пункционной биопсии включают травматическое повреждение мочевого пузыря, мочеиспускательного канала, мочеточников, массивную гематурию, гематоспермию, промежностную и позадилобковую гематому. Из других осложнений отмечаются острый простатит, эпидидимит, пиелонефрит, абсцесс предстательной железы, абсцесс промежности, ретроперитонеальный абсцесс, бактериурия, остеомиелит позвоночника. Отчетливой взаимосвязи между методами биопсии (трансректальной и промежностной) и частотой осложнений не отмечается.
Трансуретральная биопсия ткани предстательной железы позволяет получить достаточный материал для гистологического исследования и дает возможность провести исследования методом многоступенчатых срезов, что повышает вероятность выявления рака. Однако необходимо отметить, что в диагностике РПЖ частота ложноотрицательных результатов гистологического исследования кусочков ткани не превышает 20 %.
В связи с внедрением в клиническую практику эхографии появилась возможность с высокой степенью точности установить область предстательной железы, подлежащей биопсии. Точная визуализация пункционной иглы в зоне-мишени устраняет опасность повреждения жизненно важных парапростатических структур и дает возможность корректировать положение иглы до взятия биопсийного материала.
Цитологический диагноз РПЖ устанавливается на основании исследования аспирата или пунктата предстательной железы. Преимуществами аспирационной биопсии являются простота и безопасность метода, не требующего анестезии, и возможность осуществления манипуляции в амбулаторных условиях.
Аспирационная биопсия особенно целесообразна при пальпаторно определяемых небольших опухолевых узлах в задних отделах периферической зоны предстательной железы.
Опухолевые маркеры в диагностике рака предстательной железы
Повышение активности кислой сывороточной фосфатазы у больных РПЖ, особенно при метастазах в кости, определение активности этого фермента в плазме крови является общепризнанным индикатором — опухолевым маркером в крови, который может быть использован для ранней диагностики и контролирования гормональной терапии. В норме концентрация КФ в сыворотке крови составляет 1–8 нг/мл. При локализованных стадиях РПЖ повышение концентрации КФ наблюдается приблизительно у 10 % больных. Повышение активности простатической сывороточной КФ при исследовании ферментологическим методом наблюдались у больных раком предстательной железы с метастазами в кости в 74 %.
Наряду с КФ наиболее распространенным энзиматическим маркером, используемым в диагностике и контролировании лечения больных РПЖ, является щелочная фосфатаза (ЩФ). В норме концентрация ЩФ составляет от 8 до 12 нг/мл. Повышение уровня сывороточной щелочной фосфатазы у больных РПЖ связано с активацией остеобластов в очагах костных метастазов, продуцирующих этот фермент.
Во время лучевой терапии повышение концентрации ПСА говорит о малой чувствительности опухоли к проведенному лечению либо о рецидиве заболевания.
Современные методы выявления метастазов РПЖ в регионарных лимфатических узлах включают нижнюю лимфангиоаденографию, простатическую лимфосцинтиграфию, компьютерную томолимфографию, трансабдоминальную, чрескожную, аспирационную биопсию тазовых лимфатических узлов, тазовую лимфаденэктомию.
Диагностика РПЖ стандартными методами рентгенологического исследования затруднена в связи с особенностями ее топографо-анатомического расположения.
Экскреторная урография у больных РПЖ дает информацию о функциональном состоянии почек, верхних мочевых путей, выявляет изменения мочевого пузыря, связанные с нарастанием сужения в шеечноуретральном сегменте.
При РПЖ на нисходящей цистограмме видна увеличенных размеров предстательная железа с неровными контурами, вдающаяся в просвет мочевого пузыря. Характерным является признак приподнятого дна мочевого пузыря с неровными контурами.
На уретроцистограмме выявляются деформация дна мочевого пузыря и заднего отдела мочеиспускательного канала, удлинение и в некоторых случаях его искривление.
При тазовой венографии происходит смещение и обструкция простатического венозного сплетения. При распространении процесса за пределы капсулы с инфильтрацией окружающих тканей и органов на венограммах выявляется резко выраженная асимметрия сосудов висцеральных и внутренних половых вен, простатическое венозное сплетение смещено книзу.
Компьютерная томография (КТ) и магнитнорезонансная томография (МРТ) — методы, используемые для исследования органов таза, обладают высокой чувствительностью при обнаружении метастазов или определении стадий заболевания.
Томографическое исследование предстательной железы позволяет выявить степень распространения РПЖ, особенно при преимущественном распространении опухоли кпереди в сторону мочевого пузыря, когда при пальцевом ректальном исследовании не удается обнаружить изменений консистенции и конфигурации железы.
Компьютерная томография является более точным диагностическим методом в определении стадии РПЖ по сравнению с другими клиническими исследованиями. Однако КТ не является эффективным методом, она не пригодна для дифференцирования РПЖ и ДГПЖ. Главная задача КТ — оценка состояния тазовых и абдоминальных лимфатических узлов. Наиболее точными признаками диссеминации РПЖ, по данным КТ, являются: внекапсульное распространение опухоли, вовлечение в процесс семенных пузырьков, инфильтрация опухолью параректальной клетчатки, вовлечение в процесс дна мочевого пузыря и костного кольца таза.
Магнитно-резонансная терапия позволяет оценить вовлечение в процесс уретры, различных отделов простаты, мочевого пузыря, клетчатки, мышцы, поднимающей наружный сфинктер прямой кишки, семенных пузырьков и лимфатических узлов. МРТ лучше отражает внутрипростатические изменения, чем КТ.
Ультразвуковая диагностика заболеваний предстательной железы осуществляется с использованием надлобкового, промежностного, трансуретрального и трансректального методов.
Клиническое значение ТРУЗИ при РПЖ определяется возможностью выявления минимальных изменений в структуре железы. Это позволяет дать оценку так называемой фокальной опухоли, которая симптоматически не выявляется и пальпаторно не определяется.
При ТРУЗИ у 15–20 % пациентов, у которых клиническая стадия аденокарциномы предстательной железы установлена другими методами, эхографические изменения отсутствуют. В целом прогностичность положительных результатов при использовании только ТРУЗИ не превышает 40–43 %. Существует ТРУЗИ с использованием цветового допплеровского картирования, позволяющего изучить сосудистую архитектонику простаты. По данным Б.П. Матвеева (1998), число ложноположительных данных ТРУЗИ в скрининговом обследовании 450 больных составило 66 %. По мнению автора, принципиально не изменили ультразвуковую диагностику РПЖ и допплерографические методы исследования. Ведущим допплерографическим признаком заболеваний является гиперваскуляризация опухолевой ткани. Однако этот признак может быть при гранулематозном воспалении.
По данным А.И. Громова (1999), прогностичность положительного результата составляет 43 %, если данные о злокачественном поражении получены только при эхографии и 40 % — при пальцевом ректальном исследовании. Этот показатель повышается до 87 %, если результаты были положительными при обоих исследованиях. Достоверность выявления рака, по данным только ультразвукового исследования, составила 33 %, сочетание методов повышает точность диагноза до 45,5 % (если был положительный результат и при пальцевом ректальном исследовании), а если, кроме того, наблюдался подъем уровня ПСА более 10 нг/мл, то правильность диагностики достигает 77 %. В большинстве случаев (60–97 %) РПЖ определяется на ультрасонограммах как гипоэхогенное образование. При ТРУЗИ только в 35 % случаев рак бывает гипоэхогенным, в 25–30 % может иметь смешанную эхогенность, в 10 % принимает гиперэхогенный вид, а в 10–15 % — изоэхогенный. РПЖ характеризуется значительно деформированным эхографическим рисунком. Эхосигналы от капсулы железы становятся ассиметричными и утрачивают однородность. Наиболее характерными для РПЖ эхографическими признаками являются области, акустическая плотность которых может быть большей или меньшей, чем в прилежащей к ним нормальной ткани. Наиболее сложным вопросом в ультразвуковой диагностике считается дифференциальная диагностика рака, локализующегося в аденоматозно измененной переходной зоне, частота которого, по некоторым данным, достигает 20 %. Гипоэхогенные участки в переходной зоне всегда представляли особый интерес. В данном случае приходится проводить дифференциальную диагностику между узлами при аденоме, раком и застойными участками при простатите. Диагностические возможности обычного ТРУЗИ в описанных выше ситуациях достаточно низки. Появившиеся новые дополнительные методики ТРУЗИ, такие как ультразвуковая ангиография, тканевая и эхоконтрастная гармоники, трехмерная эхография и ангиография, внесли свой вклад в улучшение диагностики заболеваний предстательной железы. Трехмерное изображение сосудов предстательной железы получают с помощью специальной компьютерной программы с использованием режимов цветного допплеровского и энергетического картирования.
Сцинтиграфия костей. Прежде чем участок поражения можно будет заметить на обычной рентгенограмме, опухоль должна разрушить 30–50 % костной массы и размеры метастаза должны составить по крайней мере 10–15 мм.
С целью определения метастазов в костный скелет в последние годы широко используют сцинтиграфию костной ткани.
Дифференциальная диагностика
Одним из ранних признаков РПЖ являются асимметрия ее долей и уплотнение в одной из долей железы, определяемое пальпаторно. Симптомы РПЖ в основном связаны с его распространением на шейку мочевого пузыря, так как постепенно развивающаяся обструкция в шеечно-уретральном сегменте приводит к затруднению мочеиспускания. Наиболее частыми жалобами больных являются затрудненное мочеиспускание, императивные позывы, ослабление струи мочи. В поздней стадии появляются боли в прямой кишке, чувство распирания в области промежности, гематурия. Распространение РПЖ из области шейки мочевого пузыря и семенных пузырьков в сторону мочеточников приводит к гидронефрозу в связи со сдавлением опухолью дистальных отделов мочеточников.
Наиболее часто наблюдаются симптомы поражения спинного мозга и его корешков (47 %), связанные с метастазами в позвоночнике, паравертебральных лимфатических узлах и эпидуральном пространстве спинного мозга.
У больных РПЖ с хронической почечной недостаточностью (ХПН) в связи с выраженными метаболическими нарушениями развивается гепаторенальная энцефалопатия, которая клинически проявляется нарушением сна, симптомами органического поражения мозга, эпилептиформным синдромом.
Метастазы РПЖ в тазовых лимфатических узлах проявляются отеками голеней; при распространенном РПЖ наибольшую частоту составляют метастазы в костях, которые проявляются неврологическими осложнениями и патологическими переломами. Следует также иметь в виду возможность метастазирования РПЖ в молочные железы. Положительная реакция на КФ является специфическим свойством ткани метастаза РПЖ и отсутствует в первичном очаге рака молочной железы.
Аденоз — железистая диспластическая пролиферация в дольках предстательной железы со слабо выраженным ядерным плеоморфизмом и атипичностью развития простатических желез. Дифференциальная диагностика аденоза и РПЖ основывается на данных гистологического исследования. Для аденоза характерно сохранение дифференциации железистых структур, выстланных цилиндрическим эпителием со слабовыраженным атипизмом ядер. В противоположность этому гистологическая картина РПЖ включает железистые структуры с различной степенью дифференциации и ядерным плеоморфизмом.
Туберкулез предстательной железы. Диагностика туберкулеза предстательной железы основывается на выявлении микобактерий туберкулеза в секрете железы, гноя в моче, поражении туберкулезом других органов мочеполовой системы и легких и данных биопсии предстательной железы. Камни предстательной железы сопровождаются болями в области прямой кишки и промежности, нарушением акта мочеиспускания. Диагностика основывается на рентгенологическом исследовании — на обзорной рентгенограмме в проекции лобкового симфиза, т.е. ниже проекции мочевого пузыря, выявляются различной величины тени конкрементов.
Аденома предстательной железы в отличие от РПЖ при пальцевом ректальном исследовании определяется в виде равномерно увеличенного образования эластической консистенции, с гладкой поверхностью и четкими контурами. РПЖ характеризуется неравномерным увеличением железы с участками хрящевой консистенции, бугристой поверхностью и тяжами инфильтратов в окружающей ткани. Ценную информацию для дифференциальной диагностики рака и аденомы предстательной железы представляют эхография и КТ.
Большую диагностическую трудность представляет выявление РПЖ при сочетании его с аденомой. Гистологическое исследование энуклеированных аденоматозных узлов методом ступенчатых срезов является наиболее точным способом выявления сочетания рака и аденомы предстательной железы.
Аденомит — воспаление ткани аденомы предстательной железы. Клинически проявляет себя ноющими болями в надлобковой области и крестце, болями режущего характера в мочеиспускательном канале, учащением позывов на мочеиспускание, ухудшением общего состояния, повышением температуры тела, общей слабостью, потерей аппетита. Гистологические исследования удаленных аденоматозных узлов свидетельствуют о наличии воспалительной инфильтрации диффузного или очагового характера в паренхиме и строме железы и области капсулы.
Гранулематозный простатит — редкое заболевание, которое обусловлено влиянием аллергических и токсических факторов. Пальцевое ректальное исследование при гранулематозном простатите выявляет плотную консистенцию одной из долей железы. В связи с идентичностью подобного характера изменений при РПЖ окончательный диагноз может быть установлен лишь при биопсии.
Хронический простатит. Диагностика хронического простатита основывается на анамнестических данных, микроскопическом исследовании секрета предстательной железы. В сомнительных случаях производится цитологическое исследование, а также гистологическое исследование биоптата предстательной железы.
Склероз предстательной железы. Клиническая картина заболевания характеризуется симптомами расстройства мочеиспускания. При дальнейшем течении заболевания развиваются хроническая задержка мочеиспускания, расширение верхних мочевых путей, присоединяется инфекция и развивается ХПН. При пальцевом ректальном исследовании предстательная железа небольших размеров, плотной консистенции, в то время как при раке отмечается увеличение размеров железы, имеющей плотно-хрящевую консистенцию и неровную поверхность.
Лечение рака предстательной железы
Лечение РПЖ должно быть дифференцированным и проводиться с учетом клинической стадии заболевания, гистологического строения опухоли, общего состояния больного, состояния сердечно-сосудистой системы, легких гормонально-метаболических сдвигов в организме больного.
1) Лечение РПЖ стадии Т-0 — Т-1 N-0 М-0 должно быть активным. В таких случаях показана радикальная простатэктомия, лучевая терапия. Вопрос о последующей гормональной терапии решается в соответствии с выявлением метастазов в регионарных лимфатических узлах.
2) Наиболее эффективным первоначальным методом лечения больных РПЖ стадии Т-1 — Т-2 N-0 М-0 является радикальная простатэктомия даже при наличии микрометастазов в тазовых лимфатических узлах. В послеоперационном периоде проводится эндокринная терапия.
3) Лечение РПЖ клинических стадий Т-3 — Т-4 N-0 М-0 или Т-3 — Т-4 N-1 М-1. При отсутствии признаков метастазов в лимфатических узлах по данным нижней лимфангиаденографии, КТ, аспирационной биопсии лимфатических узлов показано лучевое воздействие на область первичной опухоли в предстательной железе, а при микроскопических метастазах в лимфатических узлах — на область таза. В последующем проводится эндокринная терапия. Предпочтительно начинать эндокринную терапию с субкапсулярной орхиэктомии.
4) Лечение больных РПЖ с отдаленными метастазами включает применение гормональных препаратов антиандрогенного и антиэстрогенного действия, химиотерапию, медикаментозную адреналэктомию, лучевую терапию, облучение гипофиза пучком протонов, при обструкции в шеечно-уретральном сегменте — криодеструкцию РПЖ.
Лечение вторичных эстрогенорезистентных форм РПЖ, развившихся в процессе гормонотерапии, включает применение гормональных цитостатических препаратов (эстрацит), антиандрогенов, химиотерапии.
Эстрогенотерапия рака предстательной железы
Эстрогенотерапия РПЖ основывается на способности препаратов эстрогенного действия оказывать влияние на пролиферативную активность эпителиальных клеток железы. В настоящее время для лечения больных РПЖ используются диэтилстильбэстрол, синэстрол, этинилэстрадиол (микрофоллин), хлортрианизен (ТАСЕ), эстрадурин, фосфэстрол.
Синэстрол вводят по 3–4 мл 2 % раствора ежедневно в течение до 2–3 месяцев. Хлортрианизен в первые 3 дня дают по 0,012 г 3 раза в сутки, на 4–5-й день — по 0,012 г 2 раза в сутки, затем в течение 7 дней — по 0,012 г в сутки, а начиная с 13-го дня — по 0, 005 г в сутки в течение 40 дней.
Эстрадурин вводится внутримышечно один раз в 4 недели в дозе 120– 200 мг или по 40–80 мг 1 раз в 1–2 недели. Поддерживающее лечение эстрадурином проводят по 40–80 мг 1 раз в 1–2 недели или хлортрианизеном.
Фосфэстрол вводится внутривенно по 300–500 мг в течение нескольких дней, при хорошей переносимости препарата суточную дозу повышают до 700–1000 мг; лечение проводится в течение 3–5 недель.
При длительном применении эстрогенов при РПЖ поражается сердечно-сосудистая система (тромбоэмболии); однако часто недооцениваются другие побочные явления: гинекомастия, встречающаяся в 40–50 %, и нарушение водно-электролитного баланса.
Эстрацит может быть рекомендован для лечения диссеминированного рака, а также в случаях эстрогенорезистентной опухоли. Для внутривенного введения суточная доза составляет 300–600 мг, которая достаточно эффективна и минимально токсична. При приеме эстрацита внутрь в капсулах суточная доза 560–840 мг (8–12 мг/кг) достаточно эффективна и минимально токсична при длительном лечении. К ак показали многочисленные исследования, объективный противоопухолевый эффект от применения эстрацита составляет от 24 до 62 %. Препарат может назначаться внутривенно по 300 мг ежедневно в течение 3 недель. А.В. Сивков (1997, 1999) указывает, что при развитии нечувствительности опухоли к гормональной терапии не следует прекращать попыток гормонального лечения, так как в ряде случаев, сменив вид гормонального лечения, можно добиться терапевтического эффекта, пусть и незначительного.
При эстрогенорезистентной опухоли назначают лучевую терапию. Ее можно использовать и при наличии болевого синдрома. Эффективность улучшается при сочетании эстрогенов с кортикостероидными препаратами. Преднизолон в дозе 1 таблетка 4 раза в день в течение 14 дней, затем 1 таблетка 3 раза — 10 дней, 1 таблетка 2 раза — 50 дней, 1 таблетка 1 раз — 20 дней, 0,5 таблетки 1 раз в день — 40 дней. Иммунокоррекция такими препаратами, как БЦЖ, Т-активин, левамизол, метилурацил, ретинол и др., улучшает результаты эстрогенотерапии.
У больных пожилого и старческого возраста следует избегать использования эстрогенов вследствие их значительного токсического влияния на сердечнососудистую систему, изменения метаболизма липидов и свертывания крови. Смертность от сердечнососудистых заболеваний у больных РПЖ, находящихся на эстрогенотерапии, на 36 % выше показателя контрольной группы.
Весьма эффективным для лечения всех стадий является пролонгированный препарат эстрадиола. Назначают его по 100 мг внутримышечно с интервалом от 3 дней до 2 недель.
Мегестрол (синтетический прогестерон) подавляет выработку андрогенов в надпочечниках и блокирует их рецепторы. Назначают по 160 мг в день внутрь.
Антиандрогены в лечении Рпж
Для лечения больных РПЖ с распространенными метастазами используются стероидные антиандрогены — ципротерона ацетат (SH-714). Стероидное соединение ципротерона ацетата андрокур выпускается в таблетках по 50 мг. Принимают по 2 таблетки 4 раза в сут.; лечение проводится в течение месяца с последующей длительной поддерживающей терапией в дозе 150–300 мг/сут.
При лечении распространенного РПЖ применяется нестероидный антиандроген — флутамид, который назначается внутрь по 250 мг 3 раза в сутки. Лечение проводится длительно (от 3 месяцев до 2,5 года, в среднем 10 месяцев), с интервалами. Кроме флутамида, можно использовать флулем, флутакан, ананурон по 250 мг 3 раза в день внутрь; касодекс (бикалутамид) 50, 100 и 150 мг в день внутрь; анандрон по 300 мг/сут в течение 1 месяца, затем 100 мг/сут — длительно; нифтамед (отечественный препарат) по 750–1500 мг/сут (после орхиэктомии). По данным Б.П. Матвеева (1993), эффективность флутамида колеблется от 50,6 до 96,6 %. Побочные действия: потеря либидо и потенции, редко — гинекомастия. Ю. Шульпекова (1999) в лечении больных РПЖ использовала метод «максимальной андрогенной блокады» в виде комбинации флутамида и финастерида. В мультицентровом рандомизированном исследовании (Kirby et al., 1999) назначали флутамид по 250 мг 3 раза в сутки и финастерид по 10 мг в день в течение 24 недель. Такая комбинация позволила снизить уровень ПСА у 97,6 % больных.
Монотерапия нестероидными антиандрогенами весьма эффективна у пациентов с неоперабельным РПЖ без метастазирования. Эта терапия может явиться эффективным методом увеличения срока развития гормональной резистентности. Низкодифференцированные опухоли простаты значительно хуже поддаются гормональному лечению, чем высокодифференцированные.
У 20–30 % больных РПЖ, имеющих андрогензависимую опухоль, орхиэктомия не приводит к положительному эффекту.
Антагонисты лютеинизирующего гормона рилизингфактора: диферелин (трипторелин) — по 3,75 мг; золодекс по 3,6 мл подкожно; декапептил (3,75 мг) вводится внутримышечно 1 раз в 28 дней. Существенным положительным качеством диферелина является то, что он может быть альтернативой орхиэктомии. Побочные действия: потливость (10 %), потеря либидо и потенции. Диферелин снижает уровень тестостерона в сыворотке крови посредством влияния на гипоталамо-гипофизарно-гонадные связи. Диферелин устраняет хирургический риск и психологическую травму, связанную с орхиэктомией. В отличие от эстрогенов диферелин не повышает риск сердечно-сосудистых заболеваний. В последнее время разработан золадекс-депо, содержащий 10,8 мг тозерелина ацетата и вводящийся 1 раз в 3 месяца. Данный препарат назначается подкожно без анестезии.
Антиэстрогены в лечении Рпж
С этой целью используют тамоксифен. Схема лечения тамоксифеном включает прием 10 мг препарата внутрь 2–3 раза в день в течение 12 недель.
Орхиэпидидимэктомия является методом выбора лечения больных РПЖ с сопутствующими заболеваниями сердечно-сосудистой системы, когда необходимо быстрое достижение терапевтического эффекта, а также в случаях непереносимости эстрогенных препаратов и невозможности длительного проведения эстрогенотерапии в связи с проявлением токсического действия эстрогенов. Эффективность орхиэктомии составляет около 90 % и характеризуется признаками объективного и субъективного улучшения: уменьшением размеров первичного очага РПЖ и метастазов, ослаблением интенсивности болевого синдрома, улучшением ряда биохимических показателей, улучшением общего состояния больного. В то же время Б.В. Бухаркин (1987) считает, что рекомендовать орхиэктомию как обязательный компонент комбинированного и комплексного лечения больных РПЖ явно не целесообразно. А.С. Попко и соавт. (1996) указывают, что орхиэктомия является необратимой процедурой, однако у 20–30 % больных РПЖ, имеющих андрогеннезависимую опухоль, орхиэктомия не приводит к положительному эффекту. Б.Я. Алексеев и соавт. (2000) отмечают, что отмена антиандрогенов на фоне прогрессирования опухолевого процесса нередко приводит к снижению уровня ПСА и клинической ремиссии. С этих позиций раннее выполнение орхиэктомии является стратегически неверным решением, так как в дальнейшем проведение интермиттирующего лечения становится невозможным. Некоторые авторы считают, что хирургическая кастрация, выполненная на первом этапе лечения РПЖ, способствует более быстрому развитию гормонорезистентности опухоли и, следовательно, ухудшает результаты лечения. Исходя из этого для начального лечения распространенного РПЖ следует применять не двустороннюю орхиэктомию, а лекарственную гормональную терапию, не уступающую кастрации по эффективности и позволяющую, во-первых, оценить первичную чувствительность опухоли к андрогенам, во-вторых — проводить в дальнейшем интермиттирующее лечение.
Медикаментозная адреналэктомия с использованием аминоглютетимида — ингибитора адренального стероидогенеза в сочетании с заместительной терапией глюкокортикоидными гормонами используется при лечении РПЖ.
При гормональной терапии больных РПЖ определение содержания ПСА должно начинаться с 3-го месяца от момента начала лечения. Определение уровней ПСА осуществляется каждые 3 месяца для выявления случаев неэффективности лечения и его последующей коррекции. Критерием эффективности гормонотерапии считается снижение сывороточного уровня ПСА более чем на 50 % от исходного.
Одним из вспомогательных методов лечения РПЖ является иммунотерапия. К активным методам адъювантной иммунотерапии относятся: парентеральная иммунизация с введением тканевых экстрактов аутологичной опухоли и гетерологичного гамма-глобулина, в основе чего лежит воздействие на противоопухолевый иммунитет, криоиммунизация. Методы пассивной адъювантной иммунотерапии РПЖ включает введение иммунной сыворотки к опухоли, неактивированных и активированных лимфоцитов, экстрактов сенсибилизированных лимфоцитов.
Химиотерапия Рпж
При химиотерапии (ХТ) РПЖ чаще всего применяется один из следующих препаратов: циклофосфамид (при применении его у больных РПЖ 3–4-й стадии заболевания, ранее не получавших лечение, у 26,6 % пациентов зарегистрирована объективная регрессия опухоли), доксорубицин, цисплатина, митомицин-С. Необходимо отметить, что комбинирование химиопрепаратов приводит к значительному повышению токсичности лечения, существенно не увеличивая его эффективность. В целом эффект от полихимиотерапии (ПХТ) можно оценить как недостаточный. Он несколько лучше при метастазах в мягкие ткани и незначителен при метастазах в кости, которые преобладают при РПЖ. При ХТ некоторый эффект получен лишь при комбинации 5-фторурацила с циклофосфамидом, а также от цисплатины в сочетании с доксорубицином.
С этой целью также используют циклофосфан. Препарат выпускается в ампулах по 0,2 г и в таблетках, покрытых оболочкой, по 0, 05 г. Растворы для инъекций готовят непосредственно перед применением (0,2 г растворяют в 10 мл стерильной воды для инъекций).
Можно применять и фторурацил. Препарат выпускается в ампулах по 5 мл 5% раствора (250 мг), вводится внутривенно капельным методом или в виде одномоментной инъекции (медленно). Для проведения химиотерапии используют также винкристин в ампулах по 0,5 мг; метотрексат для внутривенного введения по 100 мг каждые 2 недели. Цисплатина вводится внутривенно однократно в дозе 50 мг на квадратный метр поверхности тела каждые 3 недели. Кроме этого, можно использовать таксол 135–170 мг/кв. м внутривенно 1 раз в сутки; митоксантрон 3– 4 мг/кв. м внутривенно еженедельно; эстрамустина фосфат 14 мг/кв. м в день внутрь 3 раза в день; 5-фторурацил 1000 мг/кв. м в сутки 5 дней внутривенно инфузионно каждые 28 дней; этокозид 50 мг/кв. м внутривенно каждый 21-й день.
Радиофармпрепараты, тропные к костной ткани, способны проникать во все опухолевые клетки в костях одновременно. Из всех исследованных радиофармпрепаратов наиболее предпочтительным оказался метастрон. Препарат выпускается в виде стерильного водного раствора по 4 мл для внутривенного введения. Повторно этот препарат можно применить через 3 месяца. При введении метастрона падает уровень тромбоцитов и метиоцитов, но клинически значительная токсичность встречается очень редко при рекомендованной дозе 150 МБА. Лиазал как блокатор метаболизма ретиноидов воздействует на дифференцировку раковых клеток, «нормализует» фенотип и снижает агрессивность РПЖ. В настоящее время в арсенале средств борьбы с болевым синдромом вследствие костных метастазов имеются:
— фармакотерапия (метастрон);
— медикаментозные блокады (внутрикостная, проводниковые блокады нервных стволов и окончаний, перидуральные и др.;
— холодовые орошения, химические денервации периферических и центральных нервных структур;
— физические воздействия (лазеротерапия, облучение гипофиза, дистанционная лучевая терапия на область метастазов, контактная лучевая терапия);
— электростимуляционные методы обезболивания (чрескожная, перидуральная, центральная электростимуляция и др.);
— хирургические методы (хордотомия, микрохирургические методы);
— методы иглорефлексотерапии.
Лечение нарастающей хронической боли рекомендуется проводить по 3 уровням: первый уровень — при появлении «слабой» боли: ненаркотические обезболивающие препараты, блокирующие синтез медиаторов боли — простаглангдинов; второй уровень — при усилении боли до уровня «умеренной»: неопиоидные препараты и слабые опиоиды; третий уровень (при неэффективности обезболивания и нарастании боли) — неопиоидные препараты и сильные опиоиды.
Для уменьшения болевого синдрома используют и лучевую терапию. В половине случаев лучевая терапия проводится с паллиативной целью у инкурабельных больных. В случаях подтверждения костных метастазов показана дистанционная лучевая терапия в дозах от 20 до 55 Гр на очаги болезненности. Уменьшение болевого синдрома отмечается у 35–70 % больных и полное исчезновение у 36–42 %. Обезболивающий эффект начинает проявляться уже с первых суток.
Лучевая терапия является в настоящее время одним из ведущих консервативных специальных методов лечения РПЖ при локализованном (Т-1 — Т-2) — в случае невозможности выполнения радикальной простатэктомии и местно-распространенном (Т-3 — Т-4) процессе. Суммарная очаговая доза (СОД) составляет 100–160 Гр. Полное исчезновение опухоли, по данным ряда авторов, достигается в 100 % случаев.
Методика. В ОНЦ РАМН облучение первичной опухоли и зон регионарного метастазирования проводят методом суперфракционирования. Разовая очаговая доза (РОД) составляет 1,2 Гр, суточная — 2,4 Гр, перерыв между фракциями облучения — 4–6 часов, СОД — 45 Гр. После перерыва в 2–3 недели и стихания явлений лучевого цистита и ректита облучение продолжается локально на первичную опухоль с РОД 3 Гр, через день до СОД 65–70 Гр.
В последнее время части больным на втором этапе вместе с облучением проводится локальная микроволновая электромагнитная гипертермия 2 раза в неделю, через 3 часа после облучения. Температура в опухоли поддерживается на уровне 42–43 ° С в течение 60 мин. Количество процедур колеблется от 2 до 6.
В ОНЦ РАМН термолучевая терапия РПЖ получила широкое распространение; непосредственная эффективность данного метода составляет 73,9 % при термолучевой терапии по сравнению с 49 % при стандартном облучении, что на 24 % больше. В.П. Александров (1999) предлагает комплексное гормонолучевое лечение больных РПЖ 4-й стадии, что позволяет получить более благоприятные результаты в сравнении с группами пациентов, получавших одно гормональное лечение.
Б.П. Матвеев (1993) наибольшую эффективность в лечении РПЖ достиг при проведении лучевой и эстрогенотерапии (96 %) и сочетании лучевой, ПХТ и эстрогенотерапии (93,6 %). При этом полное регрессирование опухоли достигнуто 87,1 % больных. У этих же больных (72,6 %) и (53,3 %) наблюдалось трехлетнее безрецидивное течение.
Современные методы лучевой терапии РПЖ включают дистанционную гамма-терапию, при которой лучевому воздействию подвергаются первичный очаг опухоли, парапростатическая клетчатка и семенные пузырьки, тазовые лимфатические узлы.
Критерием эффективности лучевой терапии у больных РПЖ считается снижение уровня ПСА через месяц после ее завершения не менее чем на 50 % от исходной величины.
Роберт К. Нам и др. (1999) указывают, что наиболее популярной формой альтернативной терапии РПЖ представляется витамин Е. Отмечен неожиданно низкий уровень смертности от РПЖ у мужчин, принимавших витамин Е, в сравнении с теми, кто не принимал его. Отмечено замедление развития РПЖ в связи с воздействием ряда средств: цинка, мелатонина, акульего хряща, тиоаллила чеснока и зубчатой пальметто (Saw Palmetto).
Фитотерапия и диетотерапия у больных Рпж
Вегетарианская пища. Следует увеличить потребление лука, чеснока, капусты, красной свеклы, моркови, помидоров и сладкого перца.
В помидорах содержится много ликопена — одного из средств профилактики РПЖ. Противоопухолевая активность красной свеклы связана с азотистыми соединениями — бетаином и бетанином, близким по своей природе к алкалоидам.
Лекарственные растения:
— настой соцветий (сережки) ивы козьей. 1 ст. ложку сухих измельченных соцветий заливают 0,6 л кипятка, настаивают 30–60 мин, процеживают. Принимают по 1 стакану 3 раза в день за 10–15 мин до еды;
— настой листьев иван-чая. 2 ст. ложки измельченного сырья заливают 2 стаканами кипятка, нагревают на слабом огне 15 мин, настаивают 1–1,5 часа, процеживают. Принимают по 1/3–1/2 стакана 3 раза в день за полчаса до еды;
— настой цветков лабазника вязолистного. 1 ст ложку сырья заливают 300 мл кипятка, настаивают 3–4 часа, процеживают. Выпивают настой за 3–4 приема перед едой;
— настой побегов туи. 20 г сухого измельченного сырья заливают 1 л кипятка, нагревают на водяной бане 15 мин, настаивают до охлаждения, процеживают. Принимают по 1 стакану 3 раза в день.
Фитотерапию РПЖ необходимо проводить пожизненно месячными курсами с перерывами в 2 недели.
Оперативное лечение Рпж
В настоящее время единственным методом оперативного лечения рака предстательной железы, позволяющим полностью удалить предстательную железу, является радикальная простатэктомия. Основными осложнениями данной операции, вызывающими отрицательное к ней отношение части урологов, являются кровотечение, недержание мочи, импотенция.
В подавляющем большинстве случаев эта операция выполняется при локализованном раке простаты, в стадии заболевания Т-1 — Т-2 N-0 М-0.
О.Б. Лоран (1997) считает показанным выполнение радикальной простатэктомии в следующих случаях:
— cтадия рака предстательной железы Т-1 — Т-2;
— высокодифференцированные формы рака простаты;
— относительно молодой возраст больных при ожидаемой продолжительности жизни более 5 лет;
— низкодифференцированные формы локализованного рака у мужчин до 50 лет;
— желание избавиться от злокачественной опухоли.
Несмотря на то что эффективность лечения и количество послеоперационных осложнений являются важными составляющими в процессе принятия решения о выполнении радикальной простатэктомии, основными факторами следует считать темп возможного метастазирования опухоли и предполагаемую продолжительность жизни больного. Дискуссионным остается вопрос о целесообразности радикальной простатэктомии при стадии Т-3, который требует дальнейшего изучения и обоснования. В зависимости от метода выделения предстательной железы позадилонная радикальная простатэктомия подразделяется на восходящую (выделение простаты от уретры к шейке мочевого пузыря) и нисходящую (выделение простаты от шейки мочевого пузыря к уретре). При радикальной простатэктомии удаляется предстательная железа совместно с ее капсулой, семенными пузырьками, предстательной частью мочеиспускательного канала, шейкой мочевого пузыря, окружающей тазовой жировой клетчаткой с лимфатическими узлами. Радикальная простатэктомия может производиться промежностным и позадилобковым доступом.
Л.М. Гориловский (2001) указывает, что радикальная простатэктомия остается значительным по объему и травматичности хирургическим вмешательством, летальность при котором прямо зависит от возраста больного, составляя менее 1 % для больных моложе 75 лет, 1,4 % для мужчин 75–80 лет и более 4,6 % для пациентов старше 80 лет. Несмотря на все более широкое внедрение радикальной простатэктомии в практику, данная операция может быть выполнена лишь у 5–10 % больных РПЖ.
После радикальной простатэктомии содержание ПСА должно снизиться до неопределенного уровня.
Осложнения после радикальной простатэктомии:
— эректильная дисфункция — у 59,71 % больных;
— недержание мочи — менее 10 %;
— пациенты с клинической стадией Т-1 — Т-2 старше 65 лет и с наличием стриктуры имеют большой риск развития недержания мочи;
— положительная динамика в удержании мочи наблюдается спустя год после операции и удержание мочи может улучшаться в течение второго года наблюдения;
— инвазивное лечение недержания мочи лучше проводить через год после радикальной простатэктомии.
Интраоперационные осложнения:
— кровотечение из бассейна дорсальной вены. При аккуратной технике выполнения и знании анатомии обычная кровопотеря во время операции равна 1000 мл;
— повреждение запирательного нерва;
— повреждение прямой кишки;
— повреждение мочеточника. Послеоперационные осложнения:
— позднее кровотечение — 0,5 %;
— недержание мочи — 8 %;
— импотенция — 32 % (по данным Л.М. Гориловского (2001)).
Рецидивы рака предстательной железы после радикальной простатэктомии наиболее часто встречаются в течение первого года после операции и в последующем прогрессивно снижаются.
Отсутствие прогрессирования рака после радикальной простатэктомии соотносится с такими клиническими параметрами, как стадия заболевания и степень дифференцирования опухоли в биопсийном образце, уровень ПСА сыворотки крови.
Риск рецидива прогрессивно возрастает по мере увеличения клинической стадии заболевания. При стадии Т-1а рецидив заболевания не обнаруживается в 91–100 % случаев, в то время как в стадии Т-2с — в 69–78 %. Прогноз заболевания становится неблагоприятным при инвазии опухоли в семенные пузырьки или регионарные лимфатические узлы.
Важным критерием радикально выполненной простатэктомии служат также стойкие низкие уровни ПСА при динамическом наблюдении за пациентами. Анализ на содержание ПСА в сыворотке крови проводится не ранее чем через 60–90 дней после операции. Если при мониторинге наблюдается стойкое и последовательное нарастание концентрации ПСА, это должно настораживать относительно рецидива. Рецидив рака можно считать установленным, если два последовательных определения указывают на увеличение уровня ПСА по крайней мере в 2 раза по сравнению с первоначальной концентрацией.
Паллиативные операции при РПЖ включают эпицистостомию, криохирургию и трансуретральную резекцию железы.
РПЖ является причиной смерти у 3 % мужчин старше 50 лет. Это относительно медленно прогрессирующее заболевание. В течение 2–4 лет объем опухоли удваивается. Если пациент моложе 65 лет остается без лечения, то вероятность его смерти от РПЖ равна 75 %.
Литература
1. Аль-Шукри С.Х. и др. Прогнозирование 5-летней выживаемости больных после радикальной простатэктомии // Урология. — 2005. — № 6. — С. 11-12.
2. Александров В.П. Протонная гипофизэктомия и субтотальное облучение тела в комплексном лечении рака предстательной железы 4-й стадии // Урология и нефрология. — 1999. — № 6. — С. 26-28.
3. Алексеев Б.Я., Русаков И.Г. Варламов С.А. Гормонотерапия при первично выявленном раке предстательной железы // Российский онкологический журнал. —2000. — № 5. — С. 22-25.
4. Алиев М.Д. и др. Применение зометы в лечении метастатического поражения скелета (клинический опыт)// Современная онкология. — 2004. — Т. 6, № 3. — С. 3-7.
5. Аляев Ю.Г. РПЖ // Врач. — 2003. — № 10. — С. 24-28.
6. Аляев Ю.Г. Обратно-транскриптазная полимеразная цепная реакция в диагностике микрометастазов при РПЖ // Андрология и генитальная хирургия. —2003. — № 3–4. — С. 10-16.
7. Аляев Ю.Г. О стандартах оказания амбулаторнополиклинической помощи при РПЖ // Врач. — 2006. —№ 6. — С. 79-81.
8. Безруков Е. и др. Новое в диагностике и лечении РПЖ // Врач. — 2006. — № 6. — С. 44-46.
9. Бухаркин Б.В., Русаков И.Г., Шаплыгин Л.В. и др. Сравнительная оценка хирургической кастрации и медикаментозной монотерапии аналогами гонадотропинрилизинг-гормона у больных с впервые выявленным генерализованным РПЖ // Российский онкологический журнал. — 2002. — № 5. — С. 35-38.
10. Бухаркин Б.В., Аксенов А.А. Применение антиандрогенов в монорежиме при лечении РПЖ // Онкоурология. — 2005. — № 3. — С. 2-4.
11. Велиев Е.И., Петров С.Б. Результаты лечения ирритативных симптомов и удержания мочи у пациентов через год после позадилобковой РПЭ // Урология. —2003. — № 1. — С. 14-17.
12. Велиев Е.И. Антибактериальная профилактика бактериурии при трансректальной мультифокальной биопсии предстательной железы // Антибиотики и химиотерапия. — 2002. — Т. 47, № 7. — С. 3-5.
13. Велиев Е.И. Современные подходы к лечению местно-распространенного и диссеминированного РПЖ (обзор) // Терапевтический архив. — 2002. —№ 10. — С. 67-70.
14. Велиев Е.И. и др. Роль позитивного «хирургического края» после позадилонной радикальной простатэктомии в прогнозировании рецидива РПЖ // Урология. — 2005. — № 6. — С. 6-9.
15. Возианов А.Ф., Резников А.Г. Новые направления в гормональной терапии злокачественных опухолей предстательной железы: теоретические и клинические аспекты// Журнал АМН Украины. — 2000. — Т. 6, № 3. — С. 451-459.
16. Возіанов О.Ф., Резніков О.Г. Стероїдні та нестероїдні антиандрогени в лікуванні раку передміхурової залози / Доклад на конференции фирмы Shering AG, посвященной Андрокуру. Киев, май 2003.
17. Возианов С.А., Шамраев С.Н. К вопросу об усовершенствовании диагностики РПЖ // Здоровье мужчины. — 2005. — № 3. — С. 132-137.
18. Возіанов С.О. и др. Використання магнітнорезонансної спектроскопії в диференціальній діагностиці патології передміхурової залози // Здоровье мужчины. — 2005. — № 4. — С. 97-101.
19. Гажонова В.Е. Рак и доброкачественная гиперплазия предстательной железы. Сложности ультразвуковой диагностики при сочетанном поражении // Эхография. — 2001. — Т. 2, № 2. — С. 163-173.
20. Гажонова В.Е., Кислякова М.В., Лозоватор А.Л. и др. Дифференциальная диагностика пальпируемых образований предстательной железы с помощью ультразвуковой ангиографии // Эхография. — 2003. — Т. 4, № 3 . — С. 248-254.
21. Гончаров Н.П. Антиандрогены и их применение при РПЖ //Андрология и генитальная хирургия. — 2002.— № 2. — С. 40-48.
22. Гориловский Л.М., Гориловский М.Л., Гущин Б.Л. Радикальная простатэктомия при раке предстательнойц железы // Клиническая геронтология. — 2001. —№ 5–6. — С. 41-47.
23. Громов А.И., Алифанов Ю.В. Ультразвуковые исследования при заболеваниях предстательной железы// Военно-медицинский журнал. — 1999. — № 4. — С.53-56.
24. Гурина Л.И. Побочные эффекты гормонотерапии РПЖ // Российский онкологический журнал. — 2003. —№ 1. — С. 15.
25. Гурина Л.И. и др. Побочные эффекты нестероидных антиандрогенов у больных РПЖ.
26. Дуднев С.М. Лапароскопическая тазовая лимфаденэктомия больных раком мочевого пузыря и предстательной железы // Урология. — 2000. — № 5. — С. 52-54.
27. Журавчик А.З. Современные возможности диагностики рака предстательной железы // Практическая медицина. — 1998. — № 1–2. — С. 81-87.
28. Каприн А.Д., Подшивалов А.В. Современные аспекты диагностики РПЖ // Андрология и генитальная хирургия. — 2002. — № 1. — С. 39-46.
29. Каприн А.Д. и др. РПЖ: новые возможности в диагностике локализованных и местнораспространенных форм заболевания // Андрология и генитальная хирургия. — 2006. — № 2. — С. 14-19.
30. Каразанашвили Г.Г., Манагадзе Л.Г. Модель скрининга рака предстательной железы у мужчин с умеренно повышенной концентрацией простатспецифического антигена (4–10 нг/мл) в крови // Урология. — 2000. — № 6. — С. 37-41.
31. Клименко И.А., Сакало В.С. Андрокур у лікуванні хворих на прогресуючий рак передміхурової залози // Урологія. — 2001. — № 31. — С. 11-15.
32. Коган М.И., Якимчук Т.П., Шишков А.В. Сравнительный анализ диагностических методов при первичном обследовании больных раком предстательной железы // Урология и нефрология. — 1999. — № 3. — С.38-41.
33. Лесовой В.Н., Хареба Г.Г., Черныш П.Б. Химиотерапия гормонально-резистентного РПЖ на основе комбинированного применения доцетаксела и эстрамустина // Врачебная практика. — 2003. — № 2. — С. 38-40.
34. Лоран О.Б., Пушкарь Д.Ю. Бикалутамид в монотерапии у больных с распространенными формами рака предстательной железы // Урология. — 2001. — № 3. — С. 26-28.
35. Лоран О.Б., Томкевич Б.А. Лечение местнораспространенного рака предстательной железы у пожилых больных // Клиническая геронтология. —2005. — № 3. — С. 4-7.
36. Любимова Н.В. и др. Значение биохимических показателей в качестве маркеров метастазирования у больных раком предстательной железы с поражением скелета // Урология. — 2000. — № 4. — С. 15-19.
37. Мазо Е.Б., Григорьев М.Э., Степенский А.Б. и др. Диагностическая и прогностическая ценность количественного мониторинга ПСА в сыворотке крови и моче больных РПЖ после радикальной простатэктомии // Терапевтический архив. — 2002. — № 10. — С. 65-67.
38. Мазо Е.Б. и др. ТУР простаты в лечении больных РПЖ // Урология. — 2005. — № 2. — С. 70-73.
39. Мазо Е.Б. и др. Субтотальная трансуретральная «простатэктомия» в лечении больных РПЖ // Урология. — 2005. — № 6. — С. 6-10.
40. Мазо Е.Б. и др. Сравнительные значения молекулярных форм ПСА в диагностике РПЖ // Урология. —2006. — № 3. — С. 21-23.
41. Матвеев Б.П. Роль Касодекса 50 мг и 150 мг в терапии поздних стадий РПЖ. — М., 2001. — 24 с.
42. Матвеев Б.П., Комарова Л.Е., Бухаркин Б.В. и др. Итоги 5-летнего скрининга РПЖ // Урология. — 2003. —№ 1. — С. 6-10.
43. Матвеев Б.П. и др. Зомета в лечении больных распространенным РПЖ // Современная онкология. —2004. — Т. 6, № 3. — С. 3-7.
44. Медведев В.Л. Диагностическое значение сывороточного и тканевого ПСА при РПЖ // Военномедицинский журнал. — 2004. — № 2. — С. 50-54.
45. Назаренко Г.И., Даренков С.П., Хитрова А.Н. и др. Технология расширенной трансперинеальной пункционной биопсии ПЖ под УЗИ-контролем. Аспекты безопасности процедуры и качества забора биопсийного материала // Ультразвуковая и функциональная диагностика. — 2004. — № 2. — С. 20-26.
46. Назаренко Г.И. и др. Дифференциальная диагностика РПЖ и простатита методами лабораторной и комплексной лучевой диагностики // Ультразвуковая и функциональная диагностика. — 2005. — № 2. — С. 14-30.
47. Николаев А.А. и др. Иммунохимический контроль химиотерапии РПЖ // Урология. — 2000. — № 3. — С. 41-43.
48. Новиков И.Ф., Александров В.П. Арьемов В.В. ТУРвапоризация РПЖ. Эндоскопическая электрохирургия в урологии. — СПб., 2001. — С. 62-68.
49. Носов А.К. и др. Формирование группы больных РПЖ с высоким риском развития рецидива после радикальной простатэктомии // Амбулаторная хирургия. —2006. — № 2(22). — С. 44-49.
50. Ощенков В.Н., Сивков А.В. Первый опыт применения интерстициальной лучевой терапии 125І при локализованном РПЖ / Мат-лы Х Российского съезда урологов. Москва 1–3 октября 2002 г. — С. 372-377.
51. Переверзев А.С., Коган М.И. Рак простаты. — Харьков: Факт, 2004. — 231 с.
52. Петров С.Б., Ракул С.А., Елоев Р.А., Рагимов И.Г. Значение скрининговых исследований в диагностике РПЖ // Амбулаторная хирургия. Стационарозамещающие технологии. — 2003. — № 4(12). — С. 12-14.
53. Петров С.Б. и др. Радикальная простатэктомия // Вестник хирургии. — 2005. — Т. 164, № 6. — С. 78-81.
54. Петров С.Б. и др. Качество жизни пациентов после позадилонной радикальной простатэктомии по поводу РПЖ // Урология. — 2006. — № 1. — С. 25-27.
55. Пушкарь Д.Ю. Диагностические возможности биопсии простаты // Урология. — 2002. — № 6. — С. 46-51.
56. Пушкарь Д.Ю., Говоров А.В., Бормотин А.В. Скрининг РПЖ // Урология. — 2003. — № 1. — С. 10-15.
57. Пушкарь Д.Ю., Бормотин А.В. Уточнение стадии РПЖ после радикальной простатэктомии // Урология.— 2003. — № 3. — С. 11-15.
58. Пушкарь Д.Ю., Говоров А.В., Бормотин А.В. и др. Современные возможности диагностики и лечения ранних стадий РПЖ // Медицинская помощь. — 2004. — №2. — С. 28-34.
59. Пушкарь Д.Ю. и др. Влияние ультразвуковой визуализации простаты одновременно в сагиттальной и поперечной проекциях при трансректальной биопсии на выявляемость РПЖ // Урология. — 2005. — № 6. — С. 13-15.
60. Резников А.Г., Чайковская Л.В. Побочное действие гормональных средств лечения РПЖ // Современные проблемы токсикологии. — 2003. — № 2. — С. 4-7.
61. Русаков И.Г., Алексеев Б.Я. Гормонотерапия генерализованного РПЖ // Онкология (заметки клинициста) РПЖ. — С. 8-13.
62. Сивков А.В., Аполихин О.И. Рак предстательной железы / Мат-лы Х Российского съезда урологов. Москва 1–3 октября 2002 г. — С. 351-371.
63. Сивков А.В. и др. Результаты длительного применения агониста гонадотропин-рилизинггормона бусерелина-депо у больных РПЖ // Consilium Medicum. — 2002. — Т. 7, № 7. — С. 591-595.
64. Хитрова А.Н. Дифференциальная диагностика рака и ДГПЖ средствами лучевой визуализации: варианты, сложные для ультразвуковой интерпретации// Ультразвуковая и функциональная диагностика. —2005. — № 2. — С. 32-38.
65. Хомерики Г.Г., Даренков С.П., Осмоловский Е.О. и др. Применение низкомолекулярных гепаринов в профилактике и лечении тромботических осложнений после радикальной простатэктомии // Урология. —2004. — № 3. — С. 30-32.
66. Чехонин В.П., Григорьев М.Э., Жирков Ю.А. Простатический специфический мембранный антиген и его роль в диагностике РПЖ // Вопросы медиц. химии. —2002. — Т. 48, вып. 1. — С. 31-41.
67. Шатов А.В., Огнерубов Н.А. МРТ в диагностике клинически локализованного РПЖ // Урология. —2004. — № 3. — С. 25-29.
68. Шахов Е.В. и соавт. Значение простатической кислой фосфатазы в дифференциальной диагностике и в контроле за лечением рака предстательной железы // Казанский мед. журнал. — 1989. — № 5. — С. 343-345.
69. Шевчишина Л.С., Маковей Н.Ф. Простатспецифический антиген в сыворотке крови больных с доброкачественными и злокачественными опухолями предстательной железы // Лабораторная диагностика. — 2003. — № 2. — С. 16-19.
70. Щербина О.В. и др. РПЖ и качество жизни пациентов // Здоровье мужчины. — 2005. — № 4. — С. 138-141.
71. Щербина О.В. и др. Опухолевые маркеры в диагностике рака предстательной железы и мониторинге больных // Здоровье мужчины. — 2006. — № 1. — С.138-142.
72. Щербина О.В. и др. Роль ПСА в диагностике РПЖ// Лабораторная диагностика. — 2006. — № 1(35). — С.21-26.
73. Хеллерштедт Б.А., Пинта Дж. Гормональная терапия РПЖ на современном этапе // Здоровье мужчины. — 2003. — № 1. — С. 105-116.
74. Стайнек Г., Хельгесен Ф., Адольфссон Я. и др. Когда обеспечивается лучшее качество жизни — после радикальной простатэктомии или при выжидательной тактике // Международный мед. журнал. — 2003. — Т. 6,№ 2. — С. 115-121.
75. Оу Дж., Джон В., Колберг В. и др. Принятая в настоящее время тактика наблюдения за больными после радикальной простатэктомии: данные опроса урологов — членов американской урологической ассоциации // Международный мед. журнал. — 2000. — №3. — С. 250-254.
76. Iversen P. и др. Сравнительный анализ результатов монотерапии бикалютамидом и кастрации у больных неметастатическим местно-распространенном РПЖ при сроке наблюдения 6,3 года // Онкоурология. — 2006. — Спецвып. 2. — С.4-10.
77. Кабо Ж., Тостесон Т. и др. Максимальная андрогенная блокада при распространенном РПЖ: метаанализ опубликованных контролируемых рандомизированных исследований применения нестероидных андрогенов // Онкология (заметки клинициста) РПЖ. — С. 1-8.
78. Кульпа Я. Простат-специфический антиген в биохимической диагностике больных РПЖ // Лабораторная диагностика. — 2003. — № 2. — С. 12-16.
79. Mongiat-Artus P., Teillac P. Роль агонистов лютеинизирующего гормона релизинг-гормона (ЛГРГ) и гормональной терапии в лечении РПЖ // Здоровье мужчины. — 2006. — № 3. — С. 5-17.
80. Sarosdy M.F. и др. Улучшает ли выживаемость длительная максимальная андрогенная блокада по сравнению с краткосрочной? // Онкоурология. — 2006. — Спецвып. 2. — С . 29-33.
81. Shellhammer P.F. и др . Клинические преимущества бикалютамида по сравнению с флютамидом в составе максимальной андрогенной блокады у больных распространенны РПЖ: окончательные результаты двойного слепого рандомизированного многоцентрового исследования // Онкоурология. — 2006. — Спецвып. 2. — С. 21-29.







Комментировать