Описание клинического случая из практики.
О. Воробьева, доктор медицинских наук, профессор I МГМУ им. И.М. Сеченова.
Чаще всего в практике современного врача-невролога встречаются пациенты с болевым синдромом в спине. Для выбора тактики терапии необходимо всесторонне собрать анамнез, определить характер боли и учесть предыдущий опыт назначения медикаментозных средств. Несмотря на наличие перманентных дегенеративно-дистрофических изменений позвоночника, боли в спине, как правило, характеризуются рецидивирующим течением, а факторы, вызывающие обострения, не всегда очевидны и не ограничены лишь наличием костносуставной дисфункции. В связи с этим актуальна комплексная оценка взаимоотношений структурно-функциональных изменений. Тактика ведения пациента с радикулопатией должна быть направлена на предотвращение хронизации боли.
Приведем наблюдение.
Пациентка З., 47 лет, медицинская сестра, работает в реанимационном отделении. Возникавшие в последние 5 лет эпизоды боли в шейном отделе позвоночника связывала со своей профессиональной деятельностью. В качестве обезболивания самостоятельно использовала аппликации геля, содержащего нестероидные противовоспалительные препараты (НПВП), на мышцы шеи и плечевого пояса. Боль разрешалась в течение 10–14 дней. В период болевого эпизода продолжала работать, стараясь избегать значительных физических нагрузок. Текущий болевой синдром появился остро (после попытки переместить больного с каталки на кровать): мгновенно возникла боль непривычной интенсивности в шее и левом плече. Неврологический осмотр, проведенный на следующий день, выявил снижение глубокого рефлекса с бицепса и гипостезию по латеральной поверхности левого плеча. Магнитно-резонансная томография (МРТ) шейного отдела позвоночника выявила компрессию корешка С5 в суженном межпозвоночном отверстии за счет костных разрастаний (остеофиты).
На фоне обезболивающей терапии (кетопрофен, затем – трамадол, диазепам) в течение 3 нед интенсивность болевого синдрома уменьшилась, однако сохранялась гипостезия по латеральной поверхности левого плеча. Пациентка попыталась вернуться к привычной деятельности, но профессиональные физические усилия вызывали нестерпимую боль. Она продолжала принимать обезболивающие препараты, существенно уменьшила физическую активность, что привело к уменьшению болевого синдрома. Спустя 6 мес пациентку продолжали беспокоить боли в шее, распространяющиеся по наружной поверхности плеча; периодическое их усиление ограничивало движения в левой руке. Появилась тенденция прижимать левую руку к торсу, щадить руку при выполнении бытовых обязанностей и избегать каких-либо прикосновений к руке.
При осмотре невролог выявил болезненность и напряжение трапециевидной и дельтовидной мышц слева с активными триггерными точками, гипостезию и аллодинию по наружной поверхности плеча. Состояние больной расценено как хронический болевой синдром на шейном уровне, обусловленный радикулопатией С5, осложненной миофасциальным синдромом.
История пациентки З. типична для многих больных, страдающих от боли в спине. У людей, профессиональная деятельность которых связана со значительной физической нагрузкой, эпизоды острой боли – обычное явление. Однако клиническое течение последнего болевого эпизода предполагает более тяжелое состояние, чем обычная скелетно-мышечная боль. Характеристики боли, ее хронизация и сопутствующие симптомы (очаговые неврологические знаки), морфологические изменения, выявленные при МРТ, свидетельствуют о компрессии корешка С5.
Принимая во внимание характер боли у пациента, следует учитывать, что острые эпизоды имеют благоприятный прогноз и иногда разрешаются самостоятельно. Пациентов с персистирующей или флуктуирующей болью, длящейся более 3 мес, рассматривают как лиц, страдающих хронической болью в спине. Именно хронический рецидивирующий болевой синдром наносит значительный урон пациенту, его семье, обществу в целом. Среди различных категорий боли в спине наиболее часто хронизации подвергаются радикулярные боли. Поэтому чрезвычайно важно на ранних этапах диагностировать радикулярную боль и применить адекватные методы обезболивания, что позволяет предотвратить персистирование боли. При благоприятном течении и адекватном обезболивании радикулярные боли разрешаются в течение 6–8 нед. В то же время боль, ассоциированная с радикулопатией, – наиболее частая причина стойкой утраты трудоспособности.
Факторы, способствующие формированию радикулярной боли.
Традиционно считается, что причиной радикулярной боли является повреждение нервных волокон спинномозгового корешка. Различные структуры позвоночного столба могут приводить к его компрессии. Наиболее частая причина компрессии корешка – остеофиты, грыжи межпозвонковых дисков и спинальный стеноз. За микротравматизацию корешков на шейном уровне в основном ответственны остеофиты и артрозы унковертебральных сочленений. Гораздо реже на шейном уровне встречается патология дисков. Частое вовлечение в патологический процесс шейных корешков С6 и С7 объясняется особенностями биомеханики шейного отдела позвоночника. Вследствие биомеханики шеи наибольшая нагрузка приходится на нижнешейные диски, что влечет за собой более быстрое их изнашивание. Поражение шейных корешков С3 и С4 встречается крайне редко. Напротив, радикулопатия на поясничном уровне чаще обусловлена грыжей межпозвонковых дисков. Чаще всего грыжа локализуется на уровне L4–L5 и L5–S1, что приводит к радикулопатии L5 (60%) и S1 (30%). У пожилых людей люмбальная радикулопатия может быть обусловлена остеофитами, при этом нередки радикулопатии L4 и L3.
Грыжи межпозвонковых дисков и остеофиты развиваются при дегенеративном процессе в позвоночном столбе, включающем дистрофические и функциональные изменения в тканях опорно-двигательного аппарата (дуго-отростчатые суставы, межпозвонковые диски, фасции, мышцы, сухожилия, связки) с возможным вовлечением смежных структур.
В состав межпозвонкового диска входят коллаген, протеогликаны и немногочисленные фиброхондроциты. В процессе физиологического старения фиброхондроциты диска могут снижать продукцию протеогликанов. Последствием этого процесса являются утрата воды пульпозным ядром, деформация диска и надрывы волокон фиброзного кольца. Разрывы фиброзного кольца облегчают образование грыжевого выпячивания материала диска под воздействием обычной аксиальной нагрузки. Альтернативное значительное биомеханическое воздействие на здоровый диск может привести к выталкиванию пульпозного ядра и катастрофическому повреждению волокон фиброзного кольца [1].
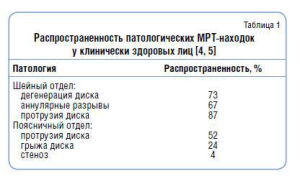
Грыжа диска обычно возникает у лиц среднего возраста [1, 2]. Именно в этом возрасте внутридисковое давление еще довольно высокое, что облегчает проникновение пульпозного ядра между поврежденными волокнами фиброзного кольца. У пожилых людей радикулопатия чаще вызвана сдавлением корешка остеофитом, гипертрофированными суставными фасетками, желтой связкой. Многие исследования демонстрируют, что грыжи межпозвонковых дисков, протрузии, аннулярные разрывы довольно часты у клинически здоровых лиц. Показано, что в общей популяции асимптомные протрузии и грыжи межпозвонковых дисков встречаются более чем в 50% случаев (табл. 1).
Истинная распространенность симптоматических грыж диска остается спорной, поскольку нет единого взгляда на дефиницию симптоматической грыжи. Мнения о том, можно ли классифицировать гружу диска как симптоматическую, если у пациента имеется верифицированная грыжа диска, сопровождающаяся компрессией корешка, и боль в поясничной области, которая не соответствует характеристикам радикулопатии, разноречивы. Более того, болевой синдром, даже отвечающий всем характеристикам радикулярной боли не всегда коррелирует с МРТ-находками. Тщательно спланированные исследования показали, что более чем у 2/3 пациентов с унилатеральным люмбальным радикулярным болевым синдромом не обнаруживается соответствия между клиническим уровнем поражения и МРТ-находками. Помимо этого, на клинически асимптомной стороне у 33% пациентов были обнаружены МРТ-изменения, а у 23% имелась асимптомная компрессия корешка [6]. Эти расхождения чрезвычайно затрудняют решение вопроса об оперативном вмешательстве. Протрузия фрагмента диска за пределы фиброзного кольца может стать причиной компрессии нервного корешка.
Наиболее часто (35–75%) фрагменты люмбальных грыж перемещаются в вентральное и антелатеральное пространство [3]. Радикулярная боль является результатом проникновения дискового материала в спинальный канал и давления на спинномозговой корешок. Боль, ассоциированная с люмбальной радикулопатией, появляется в результате комбинации ишемии и воспаления. Воспаление является результатом локального давления и выделения биологических воспалительных агентов из поврежденного диска [2]. В результате нервные волокна корешков могут становиться более сенсибилизированными к давлению. Радикулярная боль часто сопровождается формированием вторичного миофасциального синдрома, который, как правило, играет довольно значимую самостоятельную роль в поддержании болевого синдрома и его модификации. В приведенном клиническом примере развитие миофасциального синдрома способствовало ограничению двигательных возможностей больной. Пациенты с миофасциальной болью постепенно приобретают привычку избегать мышечной активности.
Патогенетически болевой синдром при радикулопатии носит смешанный характер, включающий ноцицептивный и нейропатический компоненты. Ноцицептивный механизм связан с раздражением болевых рецепторов в наружных слоях поврежденного диска и окружающих его тканях, в том числе в спазмированных мышцах. Нейропатический компонент болевого синдрома связан с повреждением волокон корешка компрессией, интерневральным отеком, ишемией и воспалением. Повреждению подвергается как миелиновая оболочка волокна (демиелинизация), так и собственно волокно (аксональная дегенерация) [7].
Доказано участие в формировании боли ионных каналов мембран нервных волокон. Именно благодаря ионным каналам поврежденного нервного волокна генерируются и проводятся эктопические (спонтанные) разряды, воспринимаемые мозгом как чувство боли. Образование новых патологических синаптических связей (спрутинг-феномен) афферентных аксональных терминалей в заднем роге спинного мозга приводит к ошибочному восприятию неболевой информации как болевой (клинический феномен аллодинии) – еще один из возможных патологических механизмов.
Установлено, что симпатическая вегетативная нервная система может участвовать в формировании нейропатической боли. Симпатические постганглионарные волокна образуют новые связи, благодаря чему происходит обмен информацией между симпатическими и соматосенсорными афферентами, и активация симпатических постганглионарных волокон приводит к возбуждению ноцицепторов. Рассмотренные нейропластические изменения, участвующие в поддержании нейропатической боли, предположительно индуцируются изменениями в нейротрансмиссии. Действительно, на животных моделях показаны редукция количества ГАМК-содержащих нейронов в спинном мозге и повышение глютаматергической нейротрансмиссии.
Заболеваемость.
Чрезвычайно сложно оценить точные эпидемиологические данные о распространенности радикулопатии [8]. Вызывает затруднение также выявление целевой популяции с повышенным риском формирования симптоматических грыж. Считается, что мужчины несколько чаще страдают от радикулопатии, чем женщины. Кроме того, пик заболеваемости у мужчин опережает показатель в женской популяции приблизительно на 10 лет. По данным отдельных исследований, ежегодная заболеваемость цервикальной радикулопатией составляет 83 на 100 тыс. населения [9]. В 70% случаев причиной радикулопатии является спондилез или протрузия диска. У 15% пациентов удается установить в анамнезе чрезмерные физические нагрузки или травму. Значительно чаще встречается люмбальная радикулопатия. Заболеваемость составляет 7%, при этом 4% связано с грыжей диска и 3% – со стенозом спинно-мозгового канала. В целом радикулярные боли составляют 10–15% среди всех мышечно-скелетных болей в спине.
Клиническая картина.
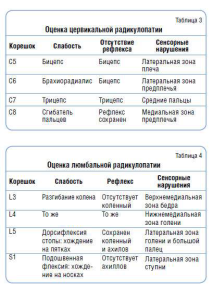
Совокупность симптомов люмбальной радикулопатии может включать ощущение онемения и слабости в зоне иннервации корешка, но чаще изменения проявляются исключительно болью в ноге. Эта закономерность в приоритете болевой симптоматики сохраняется и при радикулопатии на шейном уровне (табл. 2).
В отличие от неспецифической боли в спине, для которой типична билатеральная локализация, боль, ассоциированная с радикулопатией, как правило, унилатеральная. Болевой синдром начинается остро или подостро. Но может развиваться внезапно – после резкого неподготовленного движения, подъема тяжести (как в описанном клиническом случае) или падения. Боль бывает стреляющей или пронизывающей, иногда становится постоянной, высокой интенсивности. Как правило, боль иррадиирует по задней поверхности ноги, спускаясь ниже колена в случае радикулопатии L5 и S1 (ишиас), реже локализуется в бедре или паху – в случае радикулопатии L2, L3 и L4.
Чихание, кашель, нагрузка на позвоночник обычно усиливают боль. Типично наличие симптомов натяжения, и прежде всего симптома Ласега. Позитивный тест Ласега высокосенситивен (90%), но обладает умеренной специфичностью (26%) в диагностике грыжи диска. Напротив, перекрестный тест Ласега более специфичен (88%), но менее сенситивен (29%). Чтобы определить, какой корешок страдает и какова степень его поражения, необходимо провести неврологическое обследование. Судить об уровне поражения корешка только по иррадиации боли нельзя. Лишь сочетание боли с гипестезией в соответствующем дерматоме может служить надежным маркером топирования радикулопатии (табл. 3, 4).
Слабость мышц при дискогенных радикулопатиях обычно бывает легкой. Исключение составляет парализующий ишиас, характеризующийся выраженным парезом стопы. Развитие данного синдрома связывают с острой ишемией артерий, питающих корешки L5 или S1. В большинстве случаев парез благополучно регрессирует в течение несколько недель. Отдельного внимания заслуживает синдром каудогенной перемежающейся хромоты, характеризующийся поражением нескольких корешков спинномозговых нервов вследствие стеноза позвоночного канала. При спинальном стенозе характерно сочетание незначительной боли в покое с усилением ее при ходьбе, что иногда вынуждает пациента к остановке и отдыху. Распространяется боль также по ходу корешка от поясницы до стопы. Характерно уменьшение боли при наклоне вперед. Неврологические проявления выражены умеренно. Однако после проведения «маршевой пробы» (прохождение дистанции 500 м) можно выявить ограничение разгибания туловища, положительный симптом Ласега, рефлекторные и чувствительные нарушения, в некоторых случаях – мышечную слабость. Для пациентов с болью в спине, ассоциированной с радикулопатией, спинальным стенозом, а также при подозрении на специфическую причину боли в спине обязательно проводят нейровизуализацию (компьютерную томографию или МРТ).
Однако при интерпретации данных визуализации необходимо учитывать, что у значительной части пациентов нет соответствия между клиническим уровнем поражения и МРТ-находками.
Прогноз.
Большинство пациентов с цервикальной радикулопатией имеют благоприятный прогноз [9]. Приблизительно у 1/3 пациентов с цервикальной симптоматической радикулопатией симптомы рецидивируют. Прогноз люмбальной радикулопатии также благоприятен; подавляющее большинство пациентов с люмбальной радикулопатией выздоравливают в течение 3 мес. В большинстве случаев размеры грыжи диска и признаки компрессии корешка спонтанно уменьшаются независимо от применяемого метода лечения и возраста. Сохранение боли более 6 мес (26% цервикальной радикулопатии; 15% люмбальной радикулопатии) является предвестником сохранения боли как минимум в течение ближайших 2 лет.
Терапия.
У большинства пациентов с радикулопатией консервативное лечение оказывается высоэффективным. Конечно, прогрессирование чувствительных и моторных нарушений, а также появление синдрома конского хвоста (сенсорные нарушения в зоне гениталий, ануса или промежности в сочетании с нарушеним контроля функции тазовых органов) требует незамедлительного оперативного лечения. Большинство источников в литературе свидетельствуют о более ранней редукции боли и возможно более раннем восстановлении функции после оперативного вмешательства, но долговременные (наблюдение более 6–12 мес) результаты подтверждают идентичную эффективность обоих методов лечения [11, 12].
Несмотря на множество проведенных сравнительных проспективных исследований до сих пор не выработаны стандарты выбора метода лечения. Поэтому чаще всего выбор зависит от желания и индивидуальных запросов пациента. В связи с этим пациент должен быть информирован о возможных рисках и преимуществах оперативного лечения. Если болевой синдром у больных радикулопатией является ведущим, консервативное ведение пациентов большинством экспертов признается наиболее предпочтительным. Традиционно терапия радикулопатии в спине предполагает комплексное применение лекарственных средств и методов немедикаментозного лечения.
Иммобилизация и тракции.
Для пациентов с высокой интенсивностью боли короткий курс иммобилизации (менее 1 нед) может способствовать редукции симптомов в острую фазу. Но доказательная база полезности иммобилизации довольно низкая. Также нет доказательств, подтверждающих пользу ношения ортопедического шейного воротника. Недавние систематические обобщения показали, что механические тракции при шейной и люмбальной нейропатии не оправдали себя и не могут быть рекомендованы для использования в терапии этих состояний [13].
Фармакологическая терапия.
Использование мультимодальных (сбалансированных) путей обезболивания – важнейшая составляющая успешности лечения радикулярной боли. Адекватное обезболивание в острой фазе радикулопатии является важнейшим защитным фактором от хронизации боли. Основой консервативной терапии радикулопатии служат нестероидные противовоспалительные препараты (НПВП). Большинство экспертов рассматривают НПВП в качестве препаратов первого выбора, которые должны применяться с первых часов развития заболевания. Анальгетическая эффективность НПВП имеет выраженный дозозависимый характер, но при сравнении равнозначных дозировок различных НПВП существенно не различается. Скорость развития анальгетического эффекта зависит от способа введения препарата (при применении инъекционных форм эффект развивается быстрее) и скорости адсорбции. Использование быстродействующих форм, особенно в случае интенсивной боли, может быть весьма оправданным. Согласно современным стандартам, рекомендуется применять НПВП в минимальных дозах и кратковременными курсами. Усилить анальгетический эффект НПВП и сократить курс лечения может комбинация НПВП и миорелаксантов, особенно при боли миофасциального происхождения, часто осложняющей радикулярную боль.
При интенсивной боли или в случае недостаточного ответа на НПВП применяют трамадол (до 300 мг/сут). Среди возможных альтернативных стратегий комбинация легкий опиоид+парацетамол, обеспечивающая анальгетическую эффективность при меньших индивидуальных дозировках, может характеризоваться оптимальным соотношением риск/польза при пролонгированном купировании болевой симптоматики или у пациентов с высоким кардиоваскулярным риском.
Инъекции с кортикостероидами могут рассматриваться как метод лечения радикулярной боли. Периневральные инъекции (трансламирные, эпидуральные трансфораминальные или селективная блокада корешка) должны проводиться только после МРТ-подтверждения клинического топического диагноза. Осложнения крайне редки и составляют <1%. Введение кортикостероидов вызывает редукцию боли, но нет четких доказательств их влияния на отдаленный исход радикулопатии [14]. В то же время отдельные проспективные рандомизированные исследования демонстрируют отсутствие каких-либо различий между группой, леченной стероидными инъекциями, и контрольной [15].
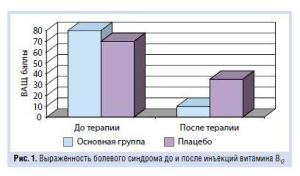
Терапия высокими дозами витаминов группы В способствует повышению эффективности консервативной терапии радикулопатии. Отдельные рандомизированные плацебоконтролируемые исследования подтверждают эффективность цианокобаламина (витамина В12) у пациентов с радикулярной болью (G. Mauro, University of Palermo, 2000). На рис. 1 показано, что у пациентов основной группы, получавших 1000 мкг В12 в виде ежедневных внутримышечных инъекций, через 2 нед отмечалось достоверное по сравнению с группой плацебо (p<0,0001) снижение выраженности болевого синдрома по субъективной визуальной аналоговой шкале.
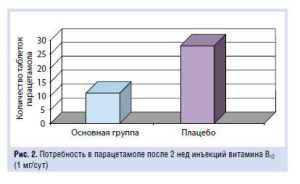
Кроме того, по окончании 2-недельного курса у пациентов, получавших цианокобаламин, потребность в парацетамоле была существенно ниже, чем в группе плацебо (рис. 2).
Таким образом, основу нейропротективной терапии при радикулопатии составляют нейротропные витамины группы В. Доказано влияние высоких доз витаминов группы B на регенерацию поврежденных нервов. Цианокобаламин, входящий в состав инъекций Мильгаммы® (Вёрваг Фарма, Германия), способствует ремиелинизации через активацию трансметилирования благодаря влиянию на синтез фосфолипидов и протеинов миелиновых оболочек периферических нервов. Одновременное применение тиамина, пиридоксина и цианокобаламина влияет на стимуляцию аксоплазматической части транспорта структурных элементов мембраны или миелиновой оболочки, например холина. Возможно, тиамин (В1) посредством усиления энергообеспечения в форме АТФ поддерживает аксоплазматический транспорт, в то время как пиридоксин (В6) участвует в синтезе транспортных белков, а цианокобаламин обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Доказано, что способствующие регенерации свойства тиамина, пиридоксина и цианокобаламина основаны на фармакологических эффектах, характерных для высоких доз этих витаминов и не зависящих от их дефицита.
Наряду с описанными выше эффектами тиамину и пиридоксину может быть присуще также антиноцицептивное действие. Возможными точками приложения действия являются непосредственно болевые рецепторы и натриевые каналы поврежденных мембран чувствительных волокон. Благодаря описанным эффектам прием Мильгаммы® необходим в составе комплексной терапии при острых болях (по 1 внутримышечной инъекции – 2 мл – в течение 10 дней). Для предотвращения хронизации радикулярных болей прием Мильгаммы® композитум продолжают в течение 1 мес (по 1 драже 3 раза в день). Заслуживает внимание одно из российских исследований эффективности внутримышечных инъекций Мильгаммы (10-дневный курс) с последующим переходом на драже Мильгаммы композитум, проведенное у пациентов с верифицированной дискогенной радикулопатией [16]. В соответствии со шкалой нейропатической боли на фоне комбинированной терапии достоверно уменьшились такие характеристики боли, как интенсивность и острота, улучшилась переносимость боли.
Значительный и умеренный эффект на фоне введения Мильгаммы® отмечен у 66% пациентов, в контрольной группе – у 34% (р<0,05). Спустя 3 мес болевой синдром отсутствовал или был минимальным у 63% больных основной и у 50% – контрольной группы (р<0,05). Полученные результаты свидетельствуют о том, что комплекс витаминов группы В может потенцировать обезболивающий эффект НПВП и способствовать более быстрому и стойкому регрессу болевого синдрома.
Таким образом, курсовое назначение Мильгаммы и Мильгаммы® композитум может способствовать редукции нейропатического компонента боли не только в краткосрочной, но и в долгосрочной перспективе. Кроме того, при лечении острой радикулярной боли комбинация витаминов группы В с НПВП более эффективна и безопасна, чем монотерапия НПВП. Антидепрессанты не только нивелируют сопутствующую депрессию, но и обладают собственно анальгетическим эффектом, активируя антиноцицептивные системы. Основным показанием для назначения антидепрессантов является хроническая радикулярная боль или подозрение на хронизацию боли.
Патогенетически наиболее оправданно использовать для лечения болевых симптомов антидепрессанты, воздействующие на обе нейромедиаторные системы (серотонинергическую и норадренергическую). Действительно, трициклические антидепрессанты (ТЦА), в частности амитриптилин, блокирующие обратный захват серотонина и норадреналина, обладают некоторыми потенциальными возможностями по сравнению с селективными антидепрессантами. ТЦА успешнее воздействуют на болевые симптомы и приводят к более полноценной ремиссии сопутствующей боли депрессии.
Новый класс антидепрессантов – антидепрессанты двойного действия, блокирующие обратный захват серотонина и норадреналина, обладают высокой эффективностью и более благоприятным спектром побочных эффектов, чем ТЦА. Однако эффективность этих препаратов в отношении боли в спине пока не оценена рандомизированными исследованиями. Большинство антиконвульсантов эффективны в купировании нейропатической боли, реализуя свой эффект в основном на уровне ноцицептивных систем. Наибольшей эффективностью с позиции доказательной медицины обладают карбамазепин, габапептин, прегабалин. Габагамма (габапентин) в дозе 1800–2400 мг/сут можно использовать в острый период боли при доминировании нейропатического компонента, а также при хронической радикулярной боли.
Физическая активность.
Необходимо рекомендовать больному как можно быстрее возвращаться к привычной дневной активности. Положительное воздействие в этом плане оказывает лечебная физкультура (ЛФК). Эффективная защита против мышечной боли – избегать позного напряжения, ежедневно заниматься ЛФК, владеть аутогенной тренировкой с умением расслаблять мышцы. Необходимо побуждать пациента к позитивному изменению жизненного стиля: избегать антифизиологических поз, рационально оборудовать рабочее место, прекратить курение, контролировать массу тела, заниматься ЛФК, ежегодно проходить курсы массажа, владеть аутогенной тренировкой с умением релаксировать мышцы.
Литература:
1. Bono C., Wisneski R., Garfin S. Lumbar disc herniations. In: Herkowitz HN, Garfin SR, Eismont FJ, Bell GR, Balderston RA, editors // The Spine. 5th ed. Philadelphia, PA: Saunders, 2006.
2. Anderson P., McCormick P., Angevine P. Randomized controlled trials of the treatment of lumbar disk herniation:1983–2007 // J. Am. Acad. Orthop. Surg. – 2008; 16: 566–573.
3. Kuzeyli K., Cakir E., Usul H. et al. Posterior epidural migration of lumbar disk fragments: report of three cases // Spine. – 2003; 28 (3): E64–E67.
4. Boden S., Davis D., Dina T. et al. Abnormal magnetic resonance scans of the lumbar spine in asymptomatic subjects. A prospective investigation // J. Bone Joint Surg. – 1990; 72: 403–408.
5. Siivola S., Levoska S., Ilkko E. et al. MRI changes of cervical spine in asymptomatic and symptomatic young adults // Eur. Spine J. – 2002; 11: 358–363.
6. Van Rijn J., Klemetso N., Reitsma J. et al. Symptomatic and asymptomatic abnormalities in patients with lumbosacral radicular syndrome: Clinical examination compared with MRI // Clin. Neurol. Neurosurg. – 2006; 108(6): 553–557.
7. Baron R., Binder A. How neuropathic is sciatica? The mixed pain concept // Orthopade. – 2004; 33: 568–575.
8. Tarulli A., Raynor E. Lumbosacral radiculopathy // Neurol. Clin. – 2007; 25 (2): 387–405.
9. Radhakrishnan K., Litchy W., O’Fallon W. et al. Epidemiology of cervical radiculopathy. A population-based study from Rochester, Minnesota, 1976 through 1990 // Brain. – 1994; 117 (2): 325–335.
10. Henderson C., Hennessy R., Shuey H. et al. Posterior-lateral foramenectomy as an exclusive operative technique for cervical radiculopathy: a review of 846 consecutively operated cases // Neurosurgery. – 1983; 13:504–512.
11. Anderson P., McCormick P., Angevine P. Randomized controlled trials of the treatment of lumbar disk herniation:1983–2007 // J. Am. Acad. Orthop. Surg. – 2008; 16: 566–573.
12. Atlas S., Keller R., Wu Y. et al. Long-term outcomes of surgical and nonsurgical management of sciatica secondary to a lumbar disc herniation: 10 year results from the Maine Lumbar Spine Study // Spine. – 2005; 30:927–935.
13. Graham N., Gross A., Goldsmith C. et al. Mechanical traction for neck pain with or without radiculopathy // Cochrane Database Sys Rev. – 2008; (3): CD006408.
14. Carragee E., Hurwitz E., Cheng I. et al. Treatment of neck pain: injections and surgical interventions: results of the Bone and Joint Decade 2000–2010 Task Force on Neck Pain and Its Associated Disorders // Spine. – 2008; 33(4): 153–169.
15. Anderberg L., Annertz M., Persson L. et al. Transforaminal steroid injections for the treatment of cervical radiculopathy: a prospective and randomised study // Eur. Spine J. – 2007; 16 (3): 321–328.
16. Левин О.С., Мосейкин И.А. Комплекс витаминов группы В в лечении дискогенной пояснично-крестцовой радикулопатии // Журн. неврол. и психиатр. им. С.С. Корсакова. – 2009; 109 (10): 30–35.




Комментировать