Источники железа. Терапия железодефицитных состояний.
Н. А. Коровина, доктор медицинских наук, профессор И. Н. Захарова, доктор медицинских наук, профессор А. Л. Заплатников, доктор медицинских наук, доцент Н. Е. Малова, кандидат медицинских наук РМАПО, Москва
Основными источниками железа, необходимого ребенку, являются экзогенное железо, поступающее с пищей, и эндогенное железо, пополняемое из его запасов в организме. Ежедневная физиологическая потребность ребенка в железе составляет 0,5-1,2 мг/сут. Наиболее полно обеспечивает эту потребность поступающее с пищей алиментарное железо.
Целями терапии железодефицитных состояний являются устранение дефицита железа (ДЖ) и восстановление его запасов в организме. Ранее бытовало мнение, что в легких случаях дефицит железа можно ликвидировать с помощью диетотерапии. Однако в настоящее время имеются убедительные данные, свидетельствующие о том, что устранение дефицита железа в организме с помощью только диетической коррекции невозможно, в связи с ограниченным всасыванием железа из пищевых продуктов. Известно, что, даже при сбалансированном рационе питания и обогащении диеты продуктами с высоким содержанием железа, всасывается не более 1,8-2 мг железа в сутки. В то же время из современных солевых двухвалентных препаратов железа его усваивается в 20 раз больше.
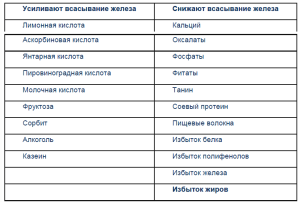
При выборе пищевого рациона, как одного из компонентов профилактики и терапии железодефицитной анемии (ЖДА), следует учитывать не столько содержание железа в том или ином пищевом продукте, сколько степень его всасывания, зависящая от формы, в которой железо представлено. Всасывание железа происходит преимущественно в тощей кишке. Механизмы всасывания железа зависят от типа, присутствующего в продуктах железа: негемового и гемового. Самое большое количество гемового железа содержится в мясных продуктах. Гемовое железо активно захватывается и всасывается слизистой кишечника в неизмененном виде. Процессы абсорбции гемового железа в кишечнике не зависят от кислотности среды и ингибирующих пищевых факторов. Напротив, всасывание негемового железа из злаков, фруктов и овощей значительно снижается в присутствии оксалатов, фитатов, фосфатов, танина и других ингибиторов ферроабсорбции [1]. Коэффициент абсорбции железа из говяжьего мяса (гемовое железо) составляет 17–22% , а для негемового железа из фруктов, овощей не более 2-3% (табл. 1).
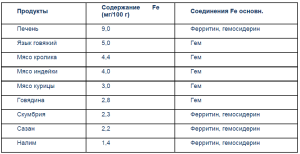
Установлено, что из продуктов животного происхождения железо также значительно интенсивнее усваивается из гема, чем из негемовых ферропротеинов (ферритин, гемосидерин). Так, несмотря на то, что в печени суммарное содержание железа высокое, усвояемость железа из нее ниже, так как в печени железо содержится преимущественно в виде гемосидерина и ферритина, а в мясных продуктах в виде гема (табл. 2).
Необходимо отметить, что добавление мяса, печени, рыбы к растительным блюдам облегчает всасывание негемового железа, содержащегося в продуктах растительного происхождения (C. Martinez-Torres et al., 1970; N. Colman, 1974; М. Layrisse, 1975). Так, при вегетарианском рационе усваивается не более 1 -7% имеющегося в этих пищевых продуктах железа (C. V. Moore, 1974).
Биодоступность железа из злаковых, бобовых, клубневых, овощей и фруктов значительно ниже, чем из гемовых соединений, и во многом зависит от преобладания в рационе факторов, ингибирующих либо потенцирующих кишечную ферроабсорбцию (табл. 3).
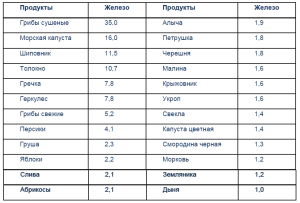
Несмотря на высокое содержание железа в некоторых продуктах растительного происхождения (табл. 4), они не в состоянии обеспечить растущий детский организм.
Вот почему рекомендации, которые часто дают больным железодефицитной анемией, употреблять в пищу в больших количествах фруктовые соки, яблоки, гранаты, гречневую крупу и другие продукты с целью восполнения дефицита железа не могут считаться оправданными. Полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность в железе, но не устранить его дефицит.
Естественной профилактикой ЖДА у детей первых месяцев жизни является исключительно грудное вскармливание хотя бы до 6 месяцев жизни (WHО). Как известно, к моменту удвоения массы тела ребенка (5-6 месяцев) в организме ребенка истощаются антенатальные запасы железа. С этого периода организм ребенка полностью зависит от количества железа, поступающего с пищей. При выборе продуктов для восполнения железа необходимо учитывать не только суммарное его количество, но и качественную форму его соединений [2, 3, 4].
По данным многих исследователей, в настоящее время у 60 -75% детей разного возраста в рационе питания преобладают либо мучные и молочные блюда, либо вегетарианская пища. Большинство детей нерегулярно употребляют мясо, что является фактором риска развития алиментарно-зависимых состояний [5, 6, 7, 8, 9]. В исследовании K. F. Michaelsen et al. (1995) было выявлено, что дети, имеющие быстрые темпы роста, находящиеся на раннем искусственном вскармливании с поздним введением мясного прикорма (позже 8 месяцев), входят в группу риска по развитию ЖДА [10]. В последние годы зарубежные и российские ученые доказали, что раннее использование неадаптированных молочных продуктов, в первую очередь цельного молока и кефира, способствует развитию дефицита железа в организме ребенка за счет возникновения микродиапедезных кишечных кровотечений [11, 12, 13, 14, 15, 16, 17, 18, 19].
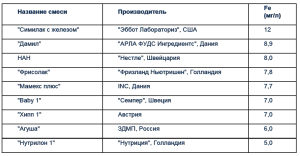
С начала 70-х гг. в США и странах Европы стали широко использовать молочные смеси, обогащенные железом. Появились молочные смеси, содержащие 12 мг/л сульфата железа («Симилак с железом», «Эббот», США). Исследователи обратили внимание на то, что употребление смесей, обогащенных железом, способствовало снижению частоты развития железодефицитной анемии у детей первого года жизни. При искусственном вскармливании целесообразно использовать подобные обогащенные железом смеси у детей, относящихся к группе риска по развитию железодефицитной анемии (недоношенные, маловесные дети, двойни, тройни), а также во втором полугодии жизни ребенка, что является высокоэффективным методом профилактики ДЖ. Эти смеси целесообразно применять у доношенных детей начиная с 3-4-го месяца жизни, а у недоношенных со 2го месяца (табл. 5). В странах Европы содержание железа в молочных смесях для детей первого полугодия жизни колеблется от 5 до 10 мг/л, а содержание железа в «последующих» молочных смесях возрастает до 10–14 мг/л.
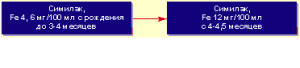
Эффективным методом профилактики дефицита железа у детей первого года жизни, на наш взгляд, является ступенчатый подход к использованию смесей, обогащенных железом (рис. 1).
Рисунок 1. Ступенчатый подход к ферропрофилактике ЖДА с помощью диеты
Например, смесь «Симилак» с содержанием железа 4,6 мг/100 мл рекомендуется с рождения до 3-4 месяцев жизни ребенка а в более старшем возрасте назначается обогащенная микроэлементом смесь «Симилак с железом», концентрация которого увеличивается до 12 мг/л.
Среди врачей-педиатров распространено мнение, что смеси, обогащенные железом, часто вызывают желудочно-кишечные расстройства колики, запоры, диарею, срыгивания, изменение окраски стула у детей первых месяцев жизни. Oski (1980) в исследовании с контрольной группой и Nelson и соавт. (1988) в перекрестном двойном слепом исследовании изучали эффективность и переносимость смесей с высоким и низким содержанием железа [20, 21]. В обоих случаях не было выявлено различий в частоте возникновения таких симптомов, как беспокойство, колики, срыгивание, повышенное газообразование у детей, получавших обогащенную железом смесь в сравнении с контрольной группой. Nelson и соавт. (1988) отметили, что при употреблении смеси, обогащенной железом, чаще встречается темноокрашенный стул [21].
В последние годы появились сведения, что при применении у детей с функциональными нарушениями желудочно-кишечного тракта в течение длительного времени лечебных молочных смесей с большим содержанием пищевых волокон загустителей типа галактоманана, крахмала возможен дефицит железа, кальция. Избыточное содержание пищевых волокон способствует адсорбции железа и выведению его с калом.
Включение в питание детей продуктов прикорма, обогащенных железом (фруктовые соки, фруктовые и овощные пюре, инстантные каши), заметно повышает количество железа, поступающего с пищей в организм ребенка [22]. Для профилактики железодефицитной анемии чрезвычайно важно своевременное введение мясного прикорма. В последнее время особое внимание уделяется введению в рацион питания ребенка мясорастительных продуктов прикорма.
Согласно рекомендациям Американской академии педиатрии, профилактику железодефицитной анемии у детей необходимо начинать с 4–6 месяцев [23]. Назначаются препараты железа в профилактической дозе 1–2 мг на 1 кг массы в сутки.
Таким образом, диетотерапия при железодефицитной анемии не является основным компонентом лечения, но обеспечивает эффективность проводимой терапии. В то же время сбалансированная по содержанию железа диета один из факторов профилактики сидеропенических состояний, о чем необходимо информировать родителей.
Основной задачей терапии сидеропенической анемии является устранение дефицита железа в организме. Адекватное лечение ЖДА возможно только при назначении лекарственных железосодержащих препаратов. Выбору препарата для коррекции сидеропении придается особое значение, поскольку длительность лечения может составлять от нескольких недель до нескольких месяцев. При этом важны не только действенность лечения, но и отсутствие побочных эффектов и осложнений, а также приверженность к проводимой терапии, особенно в педиатрической практике [24].
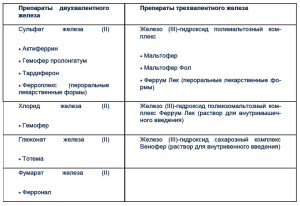
В настоящее время все препараты железа разделяют на две группы [25, 26]: ионные железосодержащие препараты (солевые) и неионные соединения, к которым относятся лекарственные средства, представленные гидроксид-полимальтозным комплексом трехвалентного железа (табл. 6).
Современная классификация основана на различии механизмов всасывания железа из ионных и неионных соединений. Всасывание железа из ионных соединений происходит преимущественно в двухвалентной форме. Активность всасывания железа из препаратов, содержащих соли трехвалентного железа, жестко лимитируется определенным уровнем pН желудочного сока (при высокой кислотности желудочного сока образуются труднорастворимые гидроксиды железа). Вследствие этого наиболее часто используются двухвалентные солевые препараты железа, обладающие хорошей растворимостью, высокой диссоциационной способностью. Попадая в желудочно-кишечный тракт, соединения двухвалентного железа проникают в мукозные клетки слизистой кишечника (проходят «слизистый барьер»), а затем в кровяное русло посредством механизма пассивной диффузии. В кровяном русле происходит процесс восстановления двухвалентного железа в трехвалентную форму с участием ферроксидазы-I и соединения с трансферрином и ферритином. Образуется пул депонированного железа, которое при необходимости используется в синтезе гемоглобина, миоглобина, других железосодержащих соединений.
По данным ряда авторов, терапия солевыми препаратами железа, например сульфатом железа, вызывает побочные реакции у 10–40% пациентов [27, 28, 29, 30]. Многочисленные исследования показали, что частота побочных эффектов зависит от дозы вводимого препарата [31]. Чаще всего нежелательные симптомы в виде диареи или запора наблюдаются со стороны желудочно-кишечного тракта (ЖКТ). Симптомы дисфункции верхних отделов ЖКТ обычно проявляются в течение часа после приема препарата и могут протекать как в легкой (тошнота, дискомфорт в эпигастрии), так и в тяжелой форме с болью в животе или рвотой. Нередко ферротерапия солевыми препаратами железа сопровождается неопасными, но достаточно неприятными побочными эффектами, такими, как появление металлического привкуса во рту в течение первых дней лечения, потемнение зубной эмали и десен.
Результаты клинических исследований свидетельствуют о том, что темные пятна на зубах у детей, получающих сульфат железа, появляются достаточно часто (до 30% случаев). В то же время побочные воздействия при использовании капель актиферрина у детей раннего возраста, по данным М. К. Соболевой (1998), выявляются всего примерно в 4% случаев. У 3% пациентов начало ферротерапии сопровождалось усилением срыгиваний, беспокойством, разжижением и учащением стула, а у 1% больных отмечалось окрашивание эмали зубов.
Хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию железа [29]. В связи с этим солевые препараты железа рекомендуют назначать за 1 ч до приема пищи.
Риск развития нежелательных эффектов при лечении ЖДА солевыми препаратами железа определяет необходимость разработки методов их применения с учетом не только выраженности дефицита железа в организме, но и индивидуальной переносимости ребенком препарата.
Заместительная терапия дефицита железа с помощью солевых препаратов железа может быть признана эффективной. По нашим данным, применение солевого препарата железа гемофер в дозе 3 мг на кг массы в сутки не сопровождается побочными явлениями со стороны желудочно-кишечного тракта, хотя мы наблюдали некоторое изменение окраски стула, что характерно для всех «солевых» препаратов железа. На фоне проводимой терапии в обеих группах отмечена заметная положительная динамика клинических проявлений сидеропении. Выявленные при первичном осмотре очаги облысения к концу курса реабилитации определялись в 4 -6 раз реже. Заметно уменьшился симптом мышечной гипотонии у пациентов обеих групп, что свидетельствует об эффективности ферротерапии.
Как показали наши наблюдения, приверженность к лечению железодефицитных состояний у детей раннего возраста хлоридом железа препаратом гемофер в форме капель составила 94%, благодаря применению методики постепенного наращивания терапевтической дозы, т. е. «ступенчатой» терапии. Лечение солевым препаратом железа необходимо начинать с 1/4 от рассчитанной терапевтической дозы с последующим постепенным достижением полной дозы в течение 7 дней.
Результаты клинического испытания гемофера продемонстрировали его высокую эффективность [32].
К новым эффективным и безопасным лекарственным средствам для коррекции ЖДС относятся препараты, представляющие собой неионные соединения железа на основе гидроксида-полимальтозного комплекса трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином [33]. Абсорбция железа в виде гидроксида-полимальтозного комплекса (ГПК) обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. При этом железо переносится через щеточную каемку мембраны на белке-переносчике и высвобождается для связывания с трансферрином и ферритином, в блоке с которыми депонируется и используется организмом по мере необходимости. Физиологические процессы саморегуляции полностью исключают возможность передозировки и отравления.
Как показали исследования, проведенные P. Geisser и A. Mueller (1987), при насыщении организма железом его резорбция прекращается по принципу обратной связи. Неионная структура ГПК обеспечивает его стабильность и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, т. е. прооксидантные реакции [28, 33].
Данные, полученные во время клинических исследований Fe (III)-гидроксид полимальтозного комплекса (феррум Лек, мальтофер), свидетельствуют о низкой частоте побочных эффектов по сравнению с препаратами простых солей железа. Только в редких случаях отмечается чувство переполнения желудка, давления в эпигастрии, тошнота, диарея или запор. По данным разных авторов, приверженность к лечению препаратами Fe (III)ГПК составляет 97,6-98%. Показано, что препараты Fe (III)-ГПК переносятся значительно лучше, чем солевые препараты железа (сульфат железа, фумарат железа), что подтверждается меньшей частотой побочных эффектов со стороны желудочно-кишечного тракта, хотя значительной разницы в эффективности ферротерапии между группами выявлено не было [27].
Эти наблюдения согласуются с данными, полученными российскими авторами. Так, согласно М. К. Соболевой (2001), из побочных эффектов у детей раннего возраста, принимающих препарат Fe (III)-ГПК, только в 10% случаев отмечалась склонность к запорам на фоне лечения, приверженность к лечению составила 100%. Результаты работы Т. В. Казюковой и соавт. (2000) также продемонстрировали высокую эффективность Fe (III)ГПК: у всех детей в течение от 4 до 9 недель нормализовались уровни гемоглобина и ферритина. Авторы ни в одном случае не наблюдали каких-либо нежелательных реакций, а приверженность к терапии составила 98,6%.
Наши исследования показывают, что использование препарата феррум Лек (сироп) у детей раннего возраста с ЖДС практически не вызывает побочных эффектов. Клиническая эффективность терапии данным препаратом составила 95%.
Исследования фармакокинетики Fe (III)-ГПК показали отсутствие взаимодействия с компонентами пищи и лекарственными препаратами, что позволяет использовать препараты данной группы во время еды [31, 32].
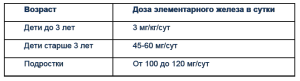
После выбора железосодержащего препарата и способа его применения необходимо определить ежедневную суточную дозу лекарственного средства и кратность приема. Суточные терапевтические дозы пероральных солевых препаратов железа при лечении ЖДА у детей предложены экспертами ВОЗ (WHO, 1989) (табл. 7).
Рекомендуемые дозы двухвалентного железа, приведенные в таблице 7, рассчитаны на основании того, что всасывается лишь 10 -15% поступающего в организм железа[26].
Препараты Fe (III) ГПК могут использоваться у детей с ЖДА раннего возраста в терапевтической дозе 5 мг/кг/сут.
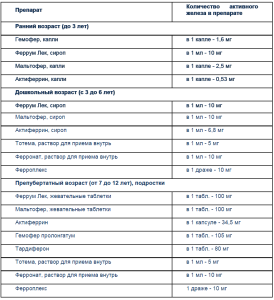
Детям раннего возраста предпочтительно назначать железосодержащие препараты, выпускаемые в форме капель, сиропа: гемофер (капли), феррум Лек (сироп), мальтофер (капли, сироп), актиферрин (капли, сироп).
Подросткам лучше всего назначать препараты железа типа феррум Лек (жевательные таблетки в дозе 100 мг), которые хорошо переносятся больными (табл. 8).
Терапевтический эффект при пероральном приеме железа проявляется постепенно.
Вначале отмечается клиническое улучшение, и лишь спустя некоторое время происходит нормализация гемоглобина. Первым положительным клиническим признаком, возникающим при лечении препаратами железа, является исчезновение или уменьшение мышечной слабости. Последнее обусловлено тем, что железо входит в состав ферментов, участвующих в сокращении миофибрилл. На 10–12-й день от начала лечения повышается содержание ретикулоцитов в периферической крови. Повышение гемоглобина может быть постепенным либо скачкообразным. Чаще уровень гемоглобина начинает подниматься на 3-4-й неделе от начала терапии. Как показали многочисленные исследования, исчезновение клинических проявлений заболевания отмечается к 1-2 месяцам терапии, а преодоление тканевой сидеропении от 3 до 6 месяцев лечения. Суточная доза элементарного железа после нормализации уровня гемоглобина должна соответствовать 1/2 терапевтической дозы. Раннее прекращение лечения препаратами железа, как правило, приводит к рецидивам ЖДА [3].
По нашим данным, восстановление уровня гемоглобина при легкой и средней степени ЖДА достигается к 4-й неделе терапии феррум Лек, а нормализация уровня ферритина сыворотки крови к 8–12-й неделе терапии. Детям с латентным дефицитом железа препарат в дозе 2,5 мг/кг/сут назначался в течение 4 -8 недель [32]. Общая длительность ферротерапии препаратом полимальтозного комплекса в группе обследованных детей составила 12 -20 недель. При терапии ЖДА солевым препаратом гемофер в течение 6 -10 недель у всех детей нормализовались уровни гемоглобина и ферритина, что свидетельствует не только о ликвидации ЖДА, но и о восстановлении «запасов» железа. Длительность основного курса лечения гемофером (в полной дозе) составила 6 недель при анемии легкой степени, 8 недель при анемии средней степени и 10 недель при анемии тяжелой степени. Продолжительность профилактического приема гемофера в дозе 1,5 мг/кг/сут с целью создания депо железа в организме составила 4 -6 недель. Общий курс приема солевого препарата достигал 10 -18 недель [32].
При латентном дефиците железа все препараты железа используются в половинной терапевтической дозе (т. е. для солевого препарата железа профилактическая доза составляет 1,5 мг/кг массы, для препаратов Fe (III)-ГПК 2,5 мг/кг массы в сутки).
Таким образом, учитывая длительность проведения ферротерапии, выбор препарата для коррекции сидеропении у детей раннего возраста требует особого внимания. Главными требованиями, предъявляемыми к препаратам железа для приема внутрь, используемым в детской практике, являются:
хорошая биодоступность; высокая безопасность; приятный вкус;
наличие нескольких лекарственных форм, удобных для пациентов всех возрастов;
комплаентность [2, 24].
Этим критериям в наибольшей степени отвечают современные препараты солевого железа (гемофер) и Fe (III)-гидроксида полимальтозного комплекса (феррум Лек, мальтофер) [24, 27, 31, 32].
Таблица 1. Абсорбция железа из пищевых продуктов
| Продукт | Коэффициент абсорбции железа (%) |
| Рис | 1 |
| Фасоль | 2-3 |
| Шпинат | 1 |
| Фрукты | 2-3 |
| Яйцо | 2-3 |
| Рыба | 9-11 |
| Печень | 12-16 |
| Телятина | 22 |
Таблица 2. Содержание железа в продуктах животного происхождения (А. А. Покровский, 1976; И. М. Воронцов, 1980; Л. И. Идельсон, 1985)
Таблица 5. Содержание железа в молочных смесях для вскармливания здорового ребенка от 0 до 6 месяцев
Таблица 6. Современные препараты железа для лечения и профилактики ЖДА













Комментировать