Пароксизмальные судорожные состояния как одна из актуальных проблем современной педиатрии. Решение вопросов ранней и точной синдромологической диагностики и целенаправленной (адресной) терапии. Проблемы лечения в педиатрической практике.
М.И. Медведев, ГБОУ ВПО Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздравсоцразвития России, Москва
Пароксизмальные судорожные состояния (как эпилептического, так и неэпилептического) генеза являются одной из актуальных проблем современной педиатрии. Они составляют от 1 до 7% в популяции детского населения, хотя собственно различные формы эпилептической болезни (различные формы эпилепсии, эпилептические синдромы) наблюдаются в 0,5-0,75% [1-4]. Эпилепсии и неэпилептические пароксизмальные состояния — приоритетная проблема именно педиатрии, так как дебют эпилепсии почти в 70% всех случаев приходится на возраст до 12 лет, а такие уникальные пароксизмальные реакции мозга, как неонатальные судороги (НС), инфантильные спазмы, фебрильные судороги (ФС), аффективно-респираторные приступы (АРП) наблюдаются в достаточно ограниченном возрастном диапазоне от 1 до 5 лет [2, 4, 5]. Судорожные приступы и другие пароксизмальные состояния, особенно в раннем возрасте, отличаются значительным полиморфизмом клинических проявлений. За многими неясными пароксизмами, такими как абдоминальные колики, парасомнии и диссомнии, гиперкинезы, ацетонемические рвоты и др., могут скрываться эпилептические приступы, в основе которых лежат различные органические изменения головного мозга [2, 4]. При своевременно недиагностированной и нелеченной эпилепсии в раннем возрасте достаточно быстро у ребенка развиваются нарушения внимания, поведения, памяти, речи, что приводит к выраженным задержкам психического развития и в конечном итоге способствует социальной дезадаптации этих детей [2, 6]. Это определяет актуальность изучения проблемы эпилепсии и ее ранних форм.
Для успешного решения данной проблемы необходимым является решение вопросов ранней и точной синдромологической диагностики и целенаправленной (адресной) терапии [7]. Прогресс в нейрофармакологии, синтезирование новых высокоэффективных антиконвульсантных препаратов (АКП) позволили отнести эпилепсию в настоящее время к курабельным заболеваниям. Согласно современным данным ведущих международных противоэпилептических центров, стойкий терапевтический эффект достигается у 80-85% больных с различными формами эпилепсии [4, 7, 8].
В то же время в педиатрической практике сложилась сложная ситуация, как в области диагностики, так и лечения эпилепсии, особенно ее ранних форм. Точная статистика эпилепсии в детском возрасте в нашей стране отсутствует. Диагностика как эпилептических приступов, так и отдельных форм эпилепсии, а также неэпилептических пароксизмальных состояний часто не отвечает современным международным принципам классификации типов приступов и форм эпилепсии [1, 2, 4]. Очень часто такие неэпилептические пароксизмальные феномены, как снохождение, ночные страхи, энурез, АРП, мигренозные пароксизмы, конверсионные припадки и др., расцениваются как эпилептические, и пациенты длительно получают необоснованную противоэпилептическую терапию. В то же время некоторые формы эпилепсии раннего возраста (инфантильные спазмы, абсанс-эпилепсия, миоклонические формы эпилепсии и др.) не расцениваются как проявления эпилептической болезни и соответственно не назначается антиконвульсантная терапия.
Особенно актуальной является точная диагностика и своевременная адекватная терапия судорог в периоде новорожденности. Это обусловлено тем, что НС отличаются клиническим полиморфизмом, особенно у преждевременно рожденных новорожденных, у которых судороги часто проявляются в виде атипичных, стертых пароксизмов, так называемых судорожных эквивалентов, которые своевременно достаточно часто не диагностируются [9-11]. По мнению известного специалиста в области перинатальной медицины J. Volpe, «судороги у новорожденных или неонатальные судороги — самое первое и наиболее значимое проявление церебральной дисфункции» [11].
НС — пароксизмальные состояния у новорожденных, проявляющиеся генерализованными или локальными мышечными сокращениями, вегетативно-висцеральными нарушениями, а также имитацией безусловных двигательных автоматизмов, сопровождающиеся специфическими изменениями на электроэнцефалограмме (ЭЭГ) в приступный период по типу пик-волны или медленно-волновой активности [9]. НС являются одним из основных неврологических синдромов периода новорожденности. Частота НС среди новорожденных, по данным литературы, составляет 1,1-16 больных на 1000 детей [4, 10-12]. Установлена обратно пропорциональная зависимость между степенью зрелости новорожденных и частотой возникновения судорог. Для недоношенных детей (32-36 нед гестации) частота НС составляет 1,6-8%, а для новорожденных с экстремально низкой массой тела при рождении (ЭНМТ) (меньше 31 нед гестации) — около 20%. НС наблюдаются в 1,5-2 раза чаще у мальчиков [10, 11].
НС — полиэтиологический клинический синдром, отражающий ранние церебральные нарушения. В большинстве случаев (более 90%) судороги являются симптоматическими, и только около 10% НС — наследственно детерминированы (идиопатические НС). Согласно Международной классификации эпилепсии (1989) [1], НС отнесены к возрастзависимым судорожным состояниям, однако идиопатические НС верифицируются как формы наследственно обусловленных (семейных) эпилепсий, дебютирующих в неонатальном периоде. Кроме того, следует выделять симптоматические формы эпилепсии и эпилептических синдромов, манифестирующих в периоде новорожденности. НС имеют широкий спектр клинических проявлений, которые следует учитывать при постановке диагноза и проведении дифференциального диагноза. В последние годы расширились диагностические возможности не только регистрации судорог у новорожденных (видео-ЭЭГ, ЭЭГ-картирование), но и установления причин, детерминирующих возникновение приступов, а также выявления структурных изменений в головном мозге с помощью нейровизуализирующих методов — нейросонографии (НСГ), компьютерной томографии (КТ), магнитнорезонансной томографии (МРТ). Основа диагноза НС, как особого синдрома периода новорожденности, имеющего специфические клинические проявления, определяется еще целым комплексом критериев, таких как гестационный возраст ребенка, анамнестические данные, в первую очередь — особенности внутриутробного развития, характер течения периода ранней неонатальной адаптации и др. В связи с этим в основе диагноза особую значимость не только для невролога, но и для неонатолога приобретают знания об особенностях нервно-психического развития и соматического статуса новорожденных различных сроков гестации, в том числе и рожденных преждевременно с низкой массой тела и особенно с ЭНМТ. Современные подходы к оценке НС позволяют выделять формы приступов с учетом особенностей морфофункциональной зрелости ЦНС новорожденного ребенка. Часто применяемый термин судороги не вполне отражает характер приступов, так как понятие «судороги» ассоциируется с моторными (двигатальными) приступами, а у новорожденных достаточно много парокизмальных проявлений бессудорожного типа, так называемых фрагментарных (атипичных, абортивных) приступов. Современная Международная классификация НС (2002) основывается на верификации клинических проявлений пароксизмов у новорожденных с выделением особого типа электроэнцефалографически позитивных приступов, протекающих без клинической реализации [11-13]. Согласно классификации [11], у новорожденных выделяют следующие типы приступов:
- Тонические судороги:
а) фокальные;
б) генерализованные;
- Клонические судороги:
а) фокальные;
б) мультифокальные;
в) генерализованные (билатеральные);
- Фрагментарные (атипичные, абортивные, стертые) судороги (судорожные эквиваленты):
а) моторные;
б) офтальмические;
в) апноэ;
- Миоклонические судороги:
а) фокальные;
б) генерализованные;
- Электроэнцефалографически-позитивные НС (отсутствуют клинические проявления судорог при наличии специфической судорожной активности на ЭЭГ).
Вместе с тем на сегодняшний день необходимо не только констатировать наличие НС, но и определить их причину, тактику лечения и прогноз.
В неонатальном периоде у новорожденного существует целый ряд состояний, которые следует дифференцировать с различными вариантами НС. Часто используемый неонатологами в практической работе термин «судорожная готовность» у новорожденных прежде всего основан на клинических проявлениях высокой нервнорефлекторной возбудимости (беспокойное поведение, раздраженный крик, тремор различной амплитуды, вздрагивания на внешние раздражители). Особенно часто за судороги принимают крупноразмашистый тремор, появляющийся при вызывании асимметрично-шейно-тонического рефлекса и симметричного шейного тонического рефлекса. Тремор при этих позициях носит рефлекторный функциональный характер и обусловлен реакцией красных ядер — так называемый «рубральный тремор». При изменении положения ребенка или пассивном сгибании конечностей рубральный тремор, в отличие от клонических и миоклонических судорог, сразу прекращается.
Следующим двигательным феноменом является тоническое напряжение мышц-разгибателей шеи, туловища, конечностей, появляющееся при внутричерепной гипертензии, различных внутричерепных кровоизлияниях, раздражении мозговых оболочек. Данное мышечное напряжение также всегда причинно-обусловлено и индуцируется внешними раздражителями. Косвенным отличительным признаком является сила мышечного напряжения — ригидность при тонических судорогах является выраженной, не уменьшающейся на внешние воздействия, в то время как тоническое напряжение мышц несудорожного генеза уменьшается или усиливается при изменении положения ребенка (реакция вестибулярного аппарата).
Среди офтальмологических бессудорожных феноменов у новорожденных выявляются различные виды: нистагм, фиксированный взор, девиация глазных яблок, симптом Греффе, опсоклонус. Все офтальмологические феномены обычно причинно-обусловлены и возникают при вестибулярных нагрузках. Они не сопровождаются нарушением ритма дыхания и общими двигательными стереотипными реакциями. Офтальмологические судороги спонтанны, непроизвольны, возникают в покое, сопровождаются приступами апноэ, вегетативной реакцией, двигательными стереотипиями. Опсоклонус — феномен танцующих глаз — проявляется в виде стремительных подергиваний глазных яблок в разные стороны, усиливающихся при звуковом раздражении. Опсоклонус обычно наблюдается при неонатальных формах дегенеративных заболеваний ЦНС.
К атипичным судорогам новорожденных относят также эпилептические апноэ, которые следует дифференцировать от апноэ дыхательного генеза. При эпилептических апноэ частота сердечных сокращений стабильна, и приступ может сочетаться с вегетативными феноменами, пароксизмами транзиторной мышечной гипотонии или гипертонуса, а также миоклониями глазных яблок или век.
К доброкачественным пароксизмальным состояниям неонатального периода относят доброкачественный неонатальный миоклонус сна, который дебютирует на 1-й неделе жизни. Клинически проявляется миоклоническими сокращениями обычно рук (двусторонними, синхронными) по типу «взмаха крыльев», ЭЭГ в приступный период соответствует возрасту без патологических изменений.
Гиперэксплексия — наследственное заболевание неэпилептического характера, проявляющееся высокой двигательной реактивностью, возникающей только на провокацию (даже незначительными раздражителями). Обычно чаще на слуховой, тактильный или световой раздражитель у новорожденного возникают резкое тоническое напряжение мышц-разгибателей, переразгибание головы, застывание взора длительностью несколько секунд. Психомоторное развитие этих детей не страдает, в мозге не выявляется каких-либо структурных изменений, ЭЭГ также не выявляет патологических изменений. Причина заболевания — наследственно обусловленная высокая реактивность подкорковых образований в мозге новорожденного (бугры четверохолмия) на любой сенсорный стимул [11].
При диагностике судорог необходимо учитывать наличие определенных пароксизмальных состояний у новорожденного ребенка, которые не относят к судорожным феноменам и не требуют специфического лечения. Объективность и точность диагностики определяется не только глубоким анализом клинических показателей, но и обязательной оценкой данных, полученных при использовании современных методов исследования ЦНС, включая ЭЭГ-мониторинг, НСГ, КТ, МРТ. Комплексный подход к диагностике позволяет не только провести постановку правильного диагноза и подбор терапии, но и определяет возможность прогнозирования дальнейшего нервно-психического развития детей с НС.
Таким образом, НС отличаются многообразием клинических форм, сложностью диагностики и дифференциальной диагностики, кроме того, являются серьезным фактором риска для нарушений психомоторного развития ребенка, особенно эпилепсии и детского церебрального паралича. Это определяет необходимость ранних превентивных мер, направленных на пре- и перинатальную защиту головного мозга плода, и в первую очередь необходима разработка комплекса защитных мероприятий совместно с акушерами для борьбы с гипоксией плода. Вторым необходимым условием является стандартизация неотложных терапевтических мероприятий для купирования НС. Проспективное наблюдение за детьми, перенесшими в период новорожденности судороги, целесообразно проводить в условиях специализированных отделений или кабинетов катамнеза, организованных при перинатальных центрах или многопрофильных больницах, специализирующихся в области неонатологии и неврологии раннего детского возраста. Кроме того, выявление тех или иных нарушений в нервно-психическом развитии данной группы детей должно проводиться совместно с психологами, дефектологами, логопедами, что позволит при необходимости начать проведение ранней психологопедагогической и/ или медикаментозной коррекции. Раннее выявление НС в условиях родильных домов, отделений патологии новорожденных позволяет не только своевременно установить их причину и начать неотложную терапию, но и в значительной степени предупредить развитие грубой патологии ЦНС в более поздние возрастные периоды с формированием тяжелой психоневрологической патологии вплоть до тяжелой инвалидизации. Это определяет необходимость своевременного назначения антиконвульсантной терапии [9, 12-15].
В возрастном диапазоне от 1 года до 5 лет у детей могут возникать так называемые специфические возрастзависимые пароксизмы — ФС и АРП. Среди ФС выделяют доброкачественные простые или типичные ФС и атипичные сложные ФС, которые относят к проявлению парциальной эпилепсии. Типичные ФС возникают на фоне высокой температуры тела, обычно превышающей 38,5 0С, проявляются нарушением сознания, кратковременными моторными генерализованными сокращениями — клоническими или тоническими, обычно длительностью до 5 мин. Никаких специфических эпилептиформных изменений на ЭЭГ обычно не выявляется, развитие детей не нарушается. Симптоматическое лечение проводится только в момент ФС и заключается во введении литической антипиретической смеси (анальгин, новокаин и антигистаминный препарат), а также в парентеральном введении реланиума (или его аналогов). В других странах предпочтительным является ректальное введение специальных свечей с бензодиазепинами [4, 8, 14]. Длительное лечение АКП при простых ФС не проводится. В то же время простые ФС необходимо дифференцировать со сложными или атипичными ФС, которые проявляются при невысокой субфебрильной температуре тела, могут иметь парциальный (очаговый характер) и длительность более 5 мин. При проведении ЭЭГ-мониторинга, как в приступный, так и в межприступный период, выявляются специфические эпилептиформные изменения обычно очагового характера. Данные приступы должны расцениваться как эпилептические и лечение необходимо проводить как при парциальной эпилепсии [7, 8]. Во всех случаях фебрилитета и судорожных состояний, а также при любых нарушениях сознания у ребенка необходимо проводить дифференциальный диагноз с энцефалитическими реакциями, энцефалитом, а также с фебрильно-провоцируемыми вагусными синкопальными состояниями [4].
АРП вообще не относятся к эпилептическим состояниям в связи с тем, что приступ обусловлен не болезнью головного мозга, а высокой чувствительностью мышц глотки и гортани к избытку кислорода. Так как АРП обычно наблюдаются у эмоционально лабильных, возбудимых детей, у которых при крике и плаче наступает гипероксигенация крови, приводящая к спазму мышц глотки гортани, обусловливающего острую асфиксию и кратковременную потерю сознания. В то же время потеряв сознание, у ребенка наступают мышечная релаксация и восстановление сознания. Обычно никаких судорожных эпизодов не происходит. Нервно-психическое развитие детей не нарушается. Специального лечения не требуется. Более того, некоторые противосудорожные препараты, в частности барбитураты, могут усугублять приступы [4, 16, 17].
Проблема лечения, в том числе дифференцированного, также актуальна для педиатрической практики. В настоящее время основной принцип лечения больных эпилепсией и особенно ее ранних форм, начиная с НС, должен быть сформулирован следующим образом: «максимум терапевтической эффективности и минимум побочных эффектов», что особенно актуально у новорожденных и в раннем детском возрасте. В табл. 1 представлены основные препараты, применяемые в лечении судорог и эпилепсии у детей в России.
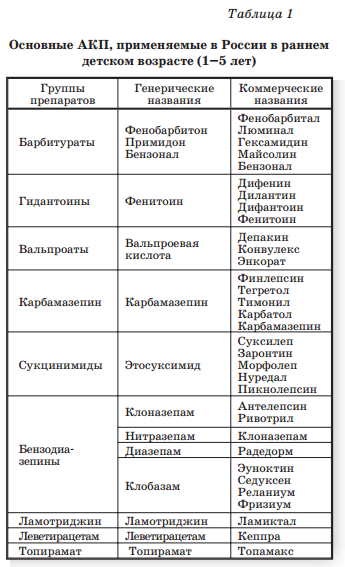
В основе действия всех АКП лежат следующие механизмы:
1) потенциирование тормозных влияний (повышение активности ГАМК-эргической системы);
2) торможение возбуждающих механизмов (снижение глутаматэргической активности);
3) торможение и инактивация чрезмерных нейрональных разрядов.
Терапевтический эффект применяемых АКП реализуется через блокаду следующих патогенетических путей эпилептической активности:
1) барбитураты активируют ГАМК-зависимые хлоридные каналы, тормозят прохождение ионов натрия и высвобождение возбуждающих нейромедиаторов;
2) гидантоины угнетают длительную залповую активность нейронов, тормозят транспорт через потенциалзависимые натриевые каналы и вызывают пресинаптическое торможение нейромедиаторов;
3) вальпроаты усиливают торможение распада ГАМК и инактивируют возбуждающие нейромедиаторы (особенно глутамат);
4) карбамазепины блокируют длительную залповую активность нейронов и транспорт через потенциалзависимые натриевые каналы и усиливают пресинаптическое торможение высвобождения нейромедиаторов;
5) сукцинимиды снижают низкопороговые потоки кальция;
6) ламотриджин угнетает длительную залповую активность нейронов и транспорт через потенциалзависимые натриевые каналы, по сравнению с карбамазепином и гидантоинами избирательно тормозит высвобождение глутамата.
Правильная систематизация приступов, определение их как эпилептических или неэпилептических (транзиторных), точный синдромологический диагноз формы эпилепсии определяют необходимость, стратегию и тактику специфического противоэпилептического лечения [7, 8, 14, 17, 18]. Это принципиально именно для педиатрической практики, так как вред от необоснованного и неадекватного противоэпилептического лечения на растущий детский организм и особенно на развивающийся мозг может быть более значимым, чем вред, оказываемый сами приступами [7, 16]. Современный этап лечения эпилепсии характеризуется качественно новым подходом — разработаны международные общепринятые стандарты, которые необходимо соблюдать для эффективной терапии приступов [7, 8]. Только ориентируясь на четкие критерии диагностики, возможно проводить эффективное противоэпилептическое лечение и не ухудшать качество жизни больного ребенка. Особенно осторожно нужно подбирать препараты у новорожденных, так как многие из них могут потенциировать угнетение ЦНС, вызывают подавление работы дыхательного центра и сердечно-сосудстой системы [11, 15]. Лечение эпилептических приступов должно начинаться только после установления точного синдромологического диагноза эпилепсии и ее формы [7]. Использование таких терминов, как «судорожная готовность», предэпилепсия, эпилептическая готовность являются некорректным и совершенно не отражает сущности патологического состояния, проявляющегося приступами [14]. Следует помнить, что пароксизмальные состояния наблюдаются и при неэпилептических расстройствах у детей (мигрень, сомнамбулизм, ночные страхи, обморочные состояния и др.), которые требуют совершенно других терапевтических подходов. В периоде новорожденности дифференциальная диагностика судорог чрезвычайно сложна, в связи с чем часто ошибочно тремор и другие двигательные феномены принимаются за судороги, а атипичные приступы — нет [9, 12, 13]. Все это приводит к неадекватности проведения лечения. АКП применяются только в лечении эпилептических припадков и недопустимо назначение их при других пароксизмальных расстройствах неэпилептической природы. Однократный приступ не может явиться поводом для немедленного назначения АКП. В силу определенных особенностей детского мозга приступ может быть обусловлен высокой температурой тела, метаболическими нарушениями, нейроинфекцией и не быть связанным с эпилепсией. При повторных непровоцируемых эпилептических приступах и подтверждении диагноза эпилепсии назначаются АКП. Абсолютно недопустимым является превентивное «профилактическое лечение» «судорожной готовности» АКП из-за высокой их токсичности. Подбор АКП проводится четко с учетом типа приступов и формы эпилепсии [4, 7, 8, 14]. Препараты назначаются, используя принцип монотерапии. Недопустимым является одномоментное назначение ребенку сразу нескольких АКП в малых дозах. Принцип политерапии правомочен только при резистентных полиморфных эпилептических приступах и только постепенно включая АКП. Препараты при лечении эпилептических приступов назначают в начальной терапевтической малой дозе с постепенным увеличением ее до достижения клинической ремиссии или появления побочных эффектов (ПЭ). В табл. 2 представлен выбор АКП в зависимости от типа судорожного или эпилептического приступа.

Лечение необходимо начинать с базового препарата для данного типа припадка и формы эпилепсии. Стартовая доза АКП составляет примерно 1/4 от средней терапевтической. Хорошая переносимость препарата позволяет увеличить дозу до 3/4 от средней терапевтической в течение 2-3 недель. При недостаточном терапевтическом эффекте и отсутствии ПЭ дозу повышают до среднетерапевтической. При отсутствии эффекта от терапевтической дозы в течение 4 недель проводится дальнейшее повышение дозы до получения положительного терапевтического эффекта или появления ПЭ. При неэффективности назначенного АКП или появлении серьезных ПЭ необходимо заменить препарат другим, применяемым в лечении данного типа приступов и формы эпилепсии. Замена барбитуратов и бензодиазепинов проводится постепенно за 3-4 недели и более длительно, так как более быстрая отмена приводит к развитию синдрома отмены. Замена других АКП может проводиться более быстро — за 1-2 недели и даже одномоментно (в стационарных условиях). Эффективность препарата может быть оценена только не ранее чем через 4 недели от момента начала его приема. Целесообразность выбора АКП зависит от типа припадков, что особенно актуально в педиатрической практике, когда еще может не сформироваться устойчивая патологическая эпилептическая активность в мозге и только идет формирование эпилепсии. При генерализованных приступах препаратами первого выбора являются препараты вальпроевой кислоты (депакин, конвулекс, энкорат и др.) в начальной дозе 10-15 мг/кг веса в сутки с постепенным повышением дозы до появления клинической ремиссии или развития ПЭ. При резистентных эпилептических приступах при ранних детских формах эпилепсии (инфантильные спазмы, синдром Леннокса-Гасто, миоклонически-астатической эпилепсии и др.) доза вальпроатов может достигать 100 мг/кг/сут и более (согласно зарегистрированной инструкции по применению возможно увеличение дозы препарата при тщательном контроле за состоянием больного, если эпилепсия не поддается контролю при использовании среднесуточных доз) [8, 14, 17, 18]. Самым серьезным ПЭ при применении вальпроатов является токсическая гепатопатия с развитием острой печеночной недостаточности [14, 20]. Для младенческих форм эпилепсии наиболее удобным является применение препаратов в сиропе или растворе для питья. Среди вальпроатов наибольшее применение в раннем возрасте имеет Депакин-сироп и Депакин-хроносфера в виде гранул пролонгированного действия фирмы «Sanofi» (Франция). Сироп может назначаться новорожденным в начальной дозе 10 мг/кг массы тела в 2 приема с последующим титрованием дозы до 30 мг/кг/сут, гранулы пролонгированного действия — с 6 месяцев в дозе 20-30 мг/кг массы. Несмотря на синтезирование новых АКП, в педиатрической эпилептологии вальпроаты остаются базовыми препаратами в лечении практически всех форм ранних эпилепсических синдромов. Однако врачу-педиатру следует помнить, что при лечении вальпроатами или их комбинацией с другими АКП возможно развитие нежелательных явлений в организме ребенка — желудочно-кишечных расстройств, повышение в крови уровня печеночных ферментов (гепатотоксический эффект), тромбоцитопения, ряд метаболических эффектов — гипонатриемия, гиперглицинемия, снижение уровня эндогенного карнитина, гипераммониемия. В практике для возможного предотвращения нежелательных явлений рекомендуется комбинировать лечение вальпроатами с применением препаратов левокарнитина [15, 21, 22]. Левокарнитин (Элькар) в настоящее время считается одним из основных препаратов, корре-гирующих возможные нежелательные явления, в том числе токсические при передозировке препаратов. Левокарнитин (Элькар) улучшает белковый и жировой обмен, снижает образование токсических продуктов, уменьшает уровень лак-татацидоза, оказывает анаболическое и энерго-коррегирующее действие на организм ребенка. В раннем возрасте при лечении вальпроатами рекомендуется назначение Элькара в дозе 0,1 г (5 капель) с кратностью 2-3 раза в сутки во время еды. Продолжительность курса лечения может варьировать от 2-3 недель до 4 месяцев [15, 16].
При парциальных приступах препаратами выбора являются как вальпроаты, так и карбамазепины (финлепсин, тегретол, тимонил) в начальной дозе 15 мг/кг/сут с постепенным увеличением до 25-30 мг/кг. Серьезными ПЭ являются нейротоксические реакции (головная боль, атаксия, диплопия) [7, 8, 14]. В раннем детском возрасте наиболее удобным для приема является сироп Тегретола. Производные барбитуровой кислоты (фенобарбитал, фенобарбитон, гексамидин, примидон и др.), а также гидантоины (дифенин, дифантоин, фенитоин) в настоящее время являются препаратами первого ряда при лечении только НС и их положительная эффективность у новорожденных составляет около 70%. Сукцинимиды (суксилеп, пикнолепсин, заронтин) применяются только в лечении абсансов и могут провоцировать генерализованные (моторные — клонические, тонико-клонические и тонические) судороги. В настоящее время в качестве монотерапии сукцинимиды не применяются, они назначаются только в качестве дополнительного препарата [8]. Бензодиазепины (диазепам, радедорм, антелепсин и др.) не являются препаратами первого ряда в лечении любых типов приступов и имеют ограниченное применение [4, 8, 14]. Данные препараты используют для купирования острых состояний — ФС, эпилептического статуса. При купировании судорожного статуса бензодиазепинами у новорожденных и детей раннего возраста следует учитывать опасность остановки дыхания и сердечной деятельности [5, 10-12]. Последние годы ознаменовались синтезированием и внедрением в клиническую практику новых АКП, в основе противосудорожного действия которых лежат патогенетические механизмы — повышение уровня ГАМК и блокирование натриевых каналов в эпилептических нейронах. К препаратам нового поколения относят вигабатрин (сабрил), габапентин, ламотриджин (ламиктал), топирамат (топамакс), леветирацетам (кеппра). В РФ апробированы и разрешены к применению в раннем возрасте ламиктал — наиболее эффективный в лечении абсансов и миоклонических приступов (возможны побочные реакции — кожная сыпь, синдром Стивенса-Джонсона, токсический эпидермальный некролиз, бронхообструкция, повышенная возбудимость или вялость, сонливость или бессоница, редко гиперкинезы — тремор рук, тики, а также развитие почечной недостаточности, аггравация приступов, волчаночно-подобный синдром, снижение аппетита, тошнота, рвота); Кеппра (леветирацетам), применяемый в качестве дополнительной терапии при парциальных и вторично генерализованных припадках после 4 лет [7, 8, 23]. При всех других формах эпилепсии препарат разрешен с 12 лет. Терапевтическая доза составляет 20 мг/кг массы на 2 приема в сутки. Возможны побочные эффекты — вялость, сонливость или бессоница, повышенная возбудимость, нервозность, раздражительность, агрессия, психозы, депрессии и суицидальное поведение, редко гиперкинезы, а также снижение аппетита, тошнота, рвота, диарея, кожная сыпь, тромбоцитопения, атаксия. В литературе имеются данные о применении леветирацетама (форма выпуска — раствор для питья, 1 мл=100 мг) при лечении фармакорезистентных судорог у новорожденных [10]. Топамакс (топирамат) применяют с 2 лет при генерализованных и парциальных припадках, в том числе при такой тяжелой форме эпилептической энцефалопатии, как синдром Леннокса-Гасто, но только в качестве дополнительного лечения. Начальная доза составляет 5-9 мг/кг массы в сутки, средняя терапевтическая доза — 30 мг/кг массы в сутки [8]. Возможны побочные эффекты — вялость, сонливость, реже повышение возбудимости, боли в животе, дефицит массы тела, ортостатическая гипотензия, нефролитиаз, почечно-канальцевый ацидоз, гипертермия, когнитивный дефицит — нарушение памяти и внимания, эпизоды агрессии, психозы, нарушения сексуальных функций.
Длительность проведения противосудорожного лечения всегда определяется индивидуально. При достижении стойкой клинической ремиссии (от 2 до 5 лет) возможно проведение отмены АКП. Отмена препаратов проводится либо постепенно, либо одномоментно. Врач определяет тактику отмены индивидуально в каждом конкретном случае. Важным критерием отмены АКП является не только прекращение приступов, улучшение общего состояния и особенно нервно-психического развития, но и нормализация показателей ЭЭГ [4, 8, 12-14].
Таким образом, судороги у детей могут возникать при различных состояниях, не имеющих эпилептической природы и отражающих лишь реакцию детского мозга на провоцирующий фактор. Судороги также возникают и при различных формах эпилепсии, являющейся хроническим заболеванием головного мозга ребенка. Однако при эпилепсиях раннего детского возраста могут часто наблюдаться и бессудорожные пароксизмы (абсансы, атонические и акинетические, вегетативно-висцеральные и др.). Судороги у детей в раннем возрасте — это еще не эпилепсия, а эпилепсия — это не только судороги. Принципиально важным, особенно для детей раннего возраста, является выяснение причины развития припадка и лишь только после этого можно приступать к подбору АКП. Эффективность лечения как неэпилептических судорог, так и эпилептических приступов зависит от правильного «адресного» назначения АКП и подбора его дозы. Своевременно назначенная адекватная терапия помогает не только купированию припадков, но и способствует улучшению психомоторного развития детей раннего возраста, нервная система которых развивается особенно интенсивно именно в первые 5 лет жизни. Проспективное наблюдение за детьми, у которых наблюдались судорожные и эпилептические приступы, указывает на необходимость комплексного подхода в лечении выявляемых нарушений психоречевого и моторного развития, которые часто наблюдаются особенно в раннем возрасте — в частности, рационального применения ноотропных препаратов и других методов терапии.

На правах рекламы
Ознакомьтесь с инструкцией
Литература
- Неонатология: Национальное руководство. Под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2007: 848 с.
- Бадалян Л.О., Медведев М.И. Неонатальные судороги. Ж. невропатол. и психиатр. 1991; 10 (1): 30-34.
- Строганова ТА, Дегтярева М.Г., Володин Н.Н. Электроэнцефалография в неонатологии. Под ред. Н.Н. Володина. М.: ГЭОТАР-МЕД, 2005: 450 с.
- Бадалян Л.О., Медведев М.И., Ильина Е.С. и др. Синдром Веста при туберозном склерозе. Ж. невропатол. и психиатр. 1995; 15 (6): 89-92.
- Бурд Г.С. Международная классификация эпилепсии и основные направления ее лечения. Ж. невропатол. и психиатр. 1995; 15 (3): 4-13.
- Володин Н.Н., Медведев М.И., Суворова Н.Д. и др. Отдаленные наблюдения за детьми с неонатальными судорогами. Рос. вестн. перинатологии и педиатрии. 2002; 47 (2): 13-16.
- Темин ПА., Никанорова М.Ю. Эпилепсии и судорожные синдромы у детей. М.: Медицина, 1999: 653 с.
- Banerjee PN, Filippi D, Clen Hauser W. The descriptive epidemiology of epilepsy. A review. Epilepsy Res. 2009; 85 (1): 31-45.
- Hitiris N, Mohauraj R, Norrie J, et al. Predictors of farmacoresistant epilepsy. Epilepsy Res. 2007; 75 (2-3): 192-196.
- Bialer MJ, Johannssen SI, KupferbergHJ, et al. Progress report on new antiepileptic drugs: 8 Eilat Conference. Epilepsy Res. 2007; 73 (1): 1-52.
- Wheless JW, Clarke DF, Arzimoglou A, Carpenter D. Treatment of pediatric epilepsy — European expert opinion. Epileptic Disord. 2007; 9 (4): 353-412.
- Tonnekaboni SH, Ghazavi P, Karimzadeh F, Mahvelati M. Efficiacy of levetiracetam in children with refractory epilepsy as add-on trial . Epilepsy Res. 2010; 90 (3): 273-277.
- Guerini R, Parmeggiani L. Use of antiepileptic drugs in children. J. Child. Psychol. Psychiatry. 2006; 47 (2): 115-126.
- Levin L, Verhelst H, Cenlemans B, De Meirleir L. Treatment and long term outcome in West syndrome. Europ. J. Epilepsy. 2010; 19 (3): 159-164.
- Студеникин В.М., Турсунхужаева С.Ш., Пак ЛА, Шелковский В.И. Левокарнитин (Элькар) в эпилептологии и нейропедиатрии. Эффективная фармакотерапия. Спец. Вып. «Педиатрия». 2011; 6: 16-19.
- Брин И.Л. Элькар в педиатрической практике. Педиатрия. 2006; 3: 51-57.
- Perlman JM. Neurology: neonatology questions and Controversies. Saunders, Philadel-phia, 2008: 288 р.
- Aicardi J. Diseases of the Neurvous System in Childhood. Cambridge University Press, 1998: 1100 p.
- Dreifuss F, Santilli N, Langer D, еt al. Valproic acid hepatic fatalities. Neurol. 1987; 37: 379-385.
- Dulac O. Choice of antiepileptic drug in childhood. Epilepsia. 1995; 36: 23-25.
- Hauser W. The prevalence and incidence of convulsive disoders in children. Epilepsia. 1997; 35 (Suppl. 2): 1-6.
- Epileptic syndromes in infancy, childhood and adolescents. Eds. Roger J, Bureau M, Dravet C, еt al. John Libbey, London, 1992: 418 p.
- Wallace S. Treating children and adolescents with epilepsy. Europ. J. Neurol. 1995; 3 (Suppl. A): 47-51.
- Volpe J. Neurology of Newborn. 8 Ed. Saunders, Philadelphia, 2008: 1094 p.













Комментировать