Аспекты проблемы дисбактериозов у детей на современном этапе. Бактериальные препараты на основе живых микроорганизмов. Новые пробиотики на основе штаммов бактерий с заданными свойствами — «Бактисубтил» и «Энтерожермина». Собственные данные по оценке эффективности «Энтерожермины» для профилактики диареи у детей раннего возраста с рецидивирующим течением обструктивного бронхита.
Харченко О.Ф., Гродненский государственный медицинский университет
Резюме. Освещены различные аспекты проблемы дисбактериозов у детей на современном этапе. Дисбактериоз характеризуется изменением качественного и/или количественного состава микрофлоры определенного биотопа, миграцией различных ее представителей в несвойственные биотопы и сопровождается у части больных клиническими симптомами. Коррекция выявленных нарушений проводится поэтапно, с включением в схему лечения пробиотиков. Бактериальные препараты на основе живых микроорганизмов не всегда оказывают ожидаемый клинический эффект. Поэтому относительно недавно были созданы принципиально новые пробиотики на основе штаммов бактерий с заданными свойствами, в частности «Бактисубтил» и «Энтерожермина». Представлены собственные данные по оценке эффективности «Энтерожермины» для профилактики диареи у детей раннего возраста с рецидивирующим течением обструктивного бронхита.
Ключевые слова: дети, дисбактериоз, пробиотики, бактисубтил, энтерожермина.
Summary. Presents different aspects of the problem of children’s dysbiosis at present time. Dysbiosis is characterized by the change of the number and/or quality of microflora composition of definite biotope and by the migration of different its’ representatives to the alien habitat and is followed by clinical symptoms (in some cases). The correction of the identified disorders is carried out in stages by using prebiotics during the cure. The bacterial medicines (on the basis of live microorganisms) don’t have the expected effect sometimes. That is why there have been created fundamentally new probiotics on the basis of bacterial strains with the specified properties such as “Bactisubtil” and “Enterogermina”.The article presents data on the assessment of “Enterogermina” for prevention of diarrhea of early aged children suffering from recurrent obstructive bronchitis.
Keywords: children, probiotics, dysbiosis, bactisubtil, enterogermina.
Проблема дисбактериоза вышла далеко за пределы больничных палат, став актуальной для всех отраслей мировой медицины. Опубликовано огромное количество работ, посвященных изучению микробиоценоза кишечника у здоровых и больных людей, в которых доказано, что количественные и качественные изменения микробного пейзажа кишечника сопутствуют многим патологическим состояниям. C одной стороны, это диктует необходимость патогенетического лечения основного заболевания, с другой – необходимость на определенном этапе стимулировать механизмы восстановления микробиоты. Ввиду того что общность микроорганизмов кишечника человека рассматривается современной наукой как эволюционно сложившаяся и саморегулирующаяся система, чувствительная к различным эндои экзогенным влияниям, вмешательство врача должно быть минимальным и максимально щадящим.
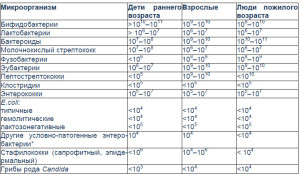
Масса нормальной (индигенной, резидентной) микрофлоры кишечника взрослого человека составляет более 2,5 кг, в симбиозе с ним существует 1014 (сто биллионов) клеток микроорганизмов, что в 100 раз больше количества собственных клеток человека [6, 13]. С помощью молекулярногенетических технологий подсчитано, что общий геном бактерий желудочно-кишечного тракта cостоит приблизительно из 400 000 генов, что в 12 раз больше генома человека. Микробный пейзаж слизистой оболочки тонкой и толстой кишки формируется 15–20 ассоциациями доминирующих анаэробных, факультативных анаэробных и аэробных бактерий [6]. Содержание микробов, их видовой состав и соотношение меняется по ходу пищеварительной трубки и зависит от рН среды обитания, концентрации кислорода в ней, т.е. имеется «этажность» заселения бактерий по вертикали. Эубиотическое состояние желудка здоровых людей определяется низким значением рН, которое служит основным рост-лимитирующим фактором патогенной флоры. В желудке преобладают аэробы: лактобациллы, стрептококки, микрококки, хеликобактер, дрожжеподобные грибы.
Тонкая кишка – транзитная зона между желудком с низким содержанием бактерий (до 103 КОЕ/г) и толстой кишкой. В двенадцатиперстной кишке количество бактерий составляет не более 104–105 КОЕ/г. Видовой состав представлен лактои бифидобактериями, энтерококками. С приемом пищи численность бактерий может значительно увеличиваться, но в короткий срок их количество возвращается к исходному уровню. В дистальном отделе подвздошной кишки количество микробов возрастает до 106–107 КОЕ/г химуса. Основными механизмами, препятствующими размножению микробов в тонкой кишке, являются антибактериальное действие желчи, кишечная перистальтика, выделение в просвет кишки из ее стенки иммуноглобулинов, наличие баугиниевой заслонки.
В толстой кишке количество микроорганизмов составляет 1010–1013 КОЕ/г фекалий. Преобладают анаэробные виды бактерии (90–95%): бифидобактерии, бактероиды, вейонеллы, пептострептококки, клостридии. Оставшиеся 5–10% микрофлоры толстого кишечника представлены аэробами: кишечной палочкой, лактобациллами, лактозонегативными энтеробактериями (протей, энтеробактер, цитробактер, серрации), фекальными стрептококками, стафилококками, дрожжеподобными грибами.
Облигатная микрофлора толстой кишки представлена следующими видами. Большая часть популяции – это бифидобактерии, которые составляют основную часть пристеночной и просветной микрофлоры. Доминирующее положение в микробном пейзаже кишечника у здоровых новорожденных детей, находящихся на естественном вскармливании, бифидофлора начинает занимать к 5–20-му дню после рождения. Среди различных видов бифидобактерий у детей на грудном вскармливании преобладают Bifidobacterium bifidum.
Лактофлора заселяет организм новорожденного ребенка в раннем постнатальном периоде, в процессе жизнедеятельности вступает в сложные взаимодействия с другими микроорганизмами, в результате чего подавляются гнилостные и гноеродные условно-патогенные микроорганизмы, в первую очередь протей, а также возбудители острых кишечных инфекций. В процессе метаболизма лактобациллы образуют молочную кислоту (результат гомоферментативного молочнокислого брожения), перекись водорода, продуцируют лизоцим, вещества с антибиотической активностью (реутерин, плантарицин, лактоцидин, лактолин).
Эшерихии в кишечнике ребенка появляются в первые дни после рождения в количестве 107–108 КОЕ/г фекалий и сохраняются на этом уровне на протяжении всей жизни. Эшерихии способствуют гидролизу лактозы; участвуют в продукции витаминов, в первую очередь витамина К, группы В; вырабатывают колицины – антибиотикоподобные вещества, тормозящие рост энтеропатогенных кишечных палочек.
Бактероиды – анаэробные неспорообразующие микроорганизмы. Заселение кишечника бактероидами происходит постепенно. Они обычно не регистрируются в бактерийных картах фекалий детей первого полугодия жизни; у детей в возрасте от 7 месяцев до 2 лет содержание бактероидов не превышает 108 КОЕ/г. Роль бактероидов до конца не выяснена, но установлено, что они участвуют в пищеварении, в процессах липидного обмена, расщепляют желчные кислоты.
Таблица 1. Качественный и количественный состав микрофлоры толстой кишки у здоровых людей (КОЕ на 1 г фекалий, Г. В. Римарчук, Н.И. Урсова, 2006)
Облигатная микрофлора кишечника образует различные биоценотические и метаболические ниши на поверхности, в толще слизистой оболочки и на поверхности пищевых остатков. В соответствии с этим выделяют пристеночную (мукозальную) и полостную микрофлору. Пристеночная микрофлора относительно стабильна и представлена бифидобактериями и бактероидами, которые непосредственно прикреплены к мембране эпителиоцитов, далее следуют факультативные анаэробы (лактобациллы), за ними – аэробы. Все эти микроорганизмы заключены в полисахаридно-муциновый матрикс и образуют биопленку, покрывающую слизистую оболочку кишечника. Пристеночная микрофлора подавляет рост условно-патогенных и патогенных микробов, которые конкурируют с ней за питательные субстраты и препятствует их проникновению во внутреннюю среду организма. Бактерии биопленки в сотни раз устойчивее к воздействию неблагоприятных факторов, чем микроорганизмы, обитающие в просвете кишечника.
Состав нормофлоры кишечника имеет возрастные особенности (табл.1), что важно учитывать при оценке количественных показателей микрофлоры человека в норме и при патологии [8].
Функции нормальной микрофлоры кишечника:
– обеспечение колонизационной резистентности слизистой оболочки кишечника;
– поддержание адекватного функционирования эпителиального барьера кишечника;
– участие в пищеварении (расщепление сложных, непереваренных в тонком кишечнике полисахаридов, солей желчных кислот);
– становление местного и системного иммунитета.
Интестинальная микрофлора, в частности лактои бифидобактерии, является частью генерации иммунокомпетентных клеток и поддерживает гомеостаз иммунной системы. У новорожденных имеет место Тh2-предоминированный профиль цитокинов, что указывает на преимущественно гуморальный тип иммунитета, который ассоциируется с продукцией антител. Постнатальная колонизация, а затем и бактериальный стимул ведут к сбалансированному Тh1/Тh2 иммунному ответу, характерному для зрелых клеток [5, 11]. Своеобразными стимуляторами антигенонаивных Т-клеток служат антигенпрезентирующие дендритные клетки (DС), которые широко колонизируют желудочнокишечный тракт. DС-клетки контролируют баланс между Тh1-клеточным и Тh2-гуморальным типами иммунного ответа, что обусловлено продукцией Тh1-зависимого цитокина – интерлейкина (IL) -12 и костимулирующих молекул СD80 и СD86. Оказалось, что ключевую позицию в механизме иммунного ответа занимают именно лактобактерии, которые способны вариабельно вызывать продукцию таких цитокинов, как IL-12 и фактор некроза опухолей (ТNF-?)-альфа, а также в меньшей степени – IL-6 и IL-10. Это указывает на то, что лактобациллы могут дифференцированно определять, какому типу иммунного ответа (Th1, Th2 или Th3) способствуют дендритные клетки. Известно, что IL-12 и IL-10 опосредуют оппозитные иммунорегуляторные эффекты: IL-12 как Th1-направленный цитокин вызывает продукцию интерферона-гамма (IFN?) Tи NK-клетками, а IL-10 как противовоспалительный цитокин супрессирует продукцию IL-12 и соответственно IFN?, поэтому и участвует в Th2 и Th3типах ответа. Для большинства видов лактобактерий характерна индукция синтеза IL-6, причем наряду с этим эффектом отмечается усиление синтеза IgA в желудочно-кишечном тракте и усиление дифференцировки В-клеток в плазматические. Слизь, содержащая sIgA, защищает слизистую оболочку пищеварительного тракта от деградации макромолекул, физической и химической агрессии, бактериальных токсинов, паразитов. Образно можно сказать, что sIgA выполняет роль «главного чистильщика» слизистой оболочки желудочно-кишечного тракта. В свою очередь, IL-6 способен также направлять созревание «наивных» CD4-T-клеток в Th2-клетки-эффекторы. Клиническое значение этих данных состоит в том, что колонизация кишечника новорожденного бактериями с заданными свойствами может быть важным фактором, направляющим Th2-ответ незрелой иммунной системы к установлению баланса Th1/Th 2 [4, 14].
Дисбактериоз не является заболеванием и не входит в Международную классификацию болезней (МКБ-10). Термин «кишечный дисбактериоз» был введен в клиническую практику A. Nissle в 1916 г. Тогда к дисбактериозу относили случаи бродильной и гнилостной диспепсии. В настоящее время под дисбактериозом понимают клинико-лабораторный синдром, который возникает при целом ряде заболеваний и клинических ситуаций, характеризуется изменением качественного и/или количественного состава микрофлоры определенного биотопа, миграцией различных ее представителей в несвойственные биотопы, метаболическими нарушениями, сопровождающимися у части больных клиническими симптомами [1]. По разным данным, дисбактериоз кишечника встречается у 70–90% населения разных возрастных групп.
Биологическое равновесие нормофлоры легко нарушается при наличии экзогенных и эндогенных факторов, а именно:
1. У новорожденных:
– бактериальный вагиноз и мастит у матери;
– позднее прикладывание к груди;
– физиологическая незрелость моторной функции кишечника;
– наличие малых гнойных инфекций;
– синдром мальабсорбции;
– первичный иммунодефицит.
2. У детей грудного и раннего возраста:
– неблагоприятное течение периода новорожденности (в анамнезе);
– раннее искусственное вскармливание (особенно неадаптированными смесями);
– частые острые респираторно-вирусные инфекции (дети из группы ЧБД);
– рахит, анемии, белково-энергетическая недостаточность;
– атопический дерматит.
3. У детей дошкольного и раннего школьного возраста:
– пребывание в закрытых коллективах;
– частые острые респираторно-вирусные инфекции;
– аллергические заболевания.
4. У подростков:
– частые острые респираторно-вирусные инфекции;
– аллергические заболевания;
– наркомания.
5. Вне зависимости от возраста
– несбалансированное питание;
– лечение антибактериальными препаратами, длительное применение НПВС, глюкокортикоидов, лучевая терапия;
– загрязнение окружающей среды (воздух, почва, вода) промышленными отходами;
– чрезмерная физическая нагрузка;
– хронические стрессовые ситуации.
Дисбактериоз кишечника, возникший на первом году жизни, часто приводит к раннему дебюту дисфункций билиарного тракта, хроническим заболеваниям желудка и 12-перстной кишки, колиту, атопическому дерматиту, бронхиальной астме.
Диагностика дисбактериоза кишечника
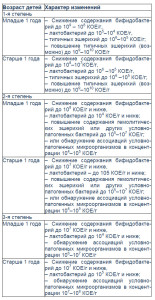
Лабораторная диагностика дисбактериоза кишечника предусматривает копрологический, биохимический анализ кишечного содержимого, культуральное исследование соскоба слизистой оболочки кишечника, анализ кала на флору, применение дыхательного теста и анализ кала на дисбактериоз. Однако чаще всего диагноз «дисбактериоз кишечника» устанавливают на основе микробиологического исследования. Учитывая значимость микробиологических изменений при дисбактериозе, рекомендуется выделять степени выраженности микробиологических нарушений (табл. 2).
Таблица 2. Степень выраженности микробиологических нарушений при дисбактериозе кишечника у детей (В.М. Бондаренко, Т.В. Мацулевич, 2007)
Копрологическое исследование проводится для уточнения функционального состояния желудка, кишечника и поджелудочной железы.
Биохимическое исследование кишечного содержимого предусматривает определение в кале щелочной фосфатазы, энтерокиназы, фруктозы и лактозы. Наличие щелочной фосфатазы, энтерокиназы, увеличение уровней фруктозы и лактозы являются маркѐрами дисбактериоза.
Культуральное исследование соскоба слизистой оболочки позволяет с высокой степенью точности идентифицировать микроорганизмы, изучить морфологические и биологические свойства бактерий.
Дыхательный тест. Положительный 14С-ксилозный дыхательный тест регистрируется при избыточном росте микрофлоры и/или ее появлении в тонкой кишке.
Исследование кала на дисбактериоз следует назначать только при наличии показаний [7], к которым относятся:
– отягощенный антенатальный анамнез (осложненное течение беременности и родов у матери);
– нарушения в организации вскармливания и питания (позднее прикладывание к груди, ранний перевод на искусственное вскармливание)
– имеющаяся и предшествующая патология (внутриутробные инфекции, частые острые респираторные и кишечные инфекции, хроническая патология ЛОР-органов, аллергические болезни, гнойничковые поражения кожи, лимфаденопатия, рецидивирующие грибковые заболевания;
– сниженные прибавки массы тела;
– изменение характера стула ( энтерический или энтероколитический);
– результаты копрологического исследования, свидетельствующие о нарушении пищеварительной, ферментовыделительной, всасывательной, двигательной функций кишечника.
Тактически правильно корректировать дисбиотические нарушения в толстом кишечнике поэтапно [10]:
1-й этап – лечение острого или хронического заболевания, лежащего в основе нарушений кишечной флоры, проведение этиологического и патогенетического лечения, что не всегда удается сделать в полном объеме;
2-й этап – функциональное питание и/или селективная деконтаминация;
3-й этап – применение биологических препаратов на основе представителей микробной флоры человека (пробиотиков).
Функциональное питание – это оптимизация микробной экологии пищеварительного тракта с помощью употребления в повседневном рационе продуктов питания естественного происхождения, содержащих живые лактои бифидобактерии (кисломолочные продукты) и бифидогенные факторы [16].
Наибольшее количество пребиотических веществ содержится в укропе, кураге, клубнике, малине, пшеничных и овсяных отрубях, сушеном шиповнике, чесноке, клюкве, смородине, черноплодной рябине, ежевике. Помимо пребиотического действия пищевые волокна обладают высокой осмотической активностью, стимулируя тем самым моторику толстой кишки, и высокой адсорбирующей способностью [3].
Селективная деконтаминация осуществляется путем назначения антибактериальных препаратов или применением бактериофагов. Выбор способа деконтаминации зависит от степени дисбактериоза, знаний и опыта педиатра. В Беларуси зарегистрированы несколько видов бактериофагов (стафилококковый, колипротейный). Исходя из собственного опыта, считаем, что такие препараты, как интести-бактериофаг, комбинированный пиобактериофаг, поливалентный пиобактериофаг, бактериофаг Pseudomonas aeroginosa достойно заняли бы свою нишу в лечении данной патологии. Однако эти препараты на основе бактериофагов имеют некоторые недостатки:
– формирование быстрой фагорезистентности штаммов;
– синтез антифаговых антител, что не всегда позволяется проводить повторный курс;
– неприятный вкус;
– высокая стоимость курсовой терапии.
Пробиотики – это живые организмы и/или вещества микробного или иного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма хозяина через оптимизацию его микробиологического статуса [9]. Изучено и получено большое количество микроорганизмов, однако еще в 2003 г. E. Lebenthal и Y. Lebenthal доказали, что в состав бактерийных препаратов могут входить лишь отдельные штаммы, отвечающие определенным требованиям:
– отсутствие патогенной активности;
– резистентность в отношении желудочного, билиарного, панкреатического секретов;
– сохранение стабильности состава и жизнеспособности в течение всего срока хранения препарата;
– вводимые в организм человека штаммы не должны угнетать индигенную кишечную микрофлору;
– иметь генетический паспорт и доказательство генетической стабильности.
В общих чертах профилактический и лечебный механизмы действия пробиотиков сводятся:
– к продукции антимикробных субстанций (бактериоцины, лизоцим, проглютамат) и конкурентному взаимодействию с патогенными и условно-патогенными микроорганизмами;
– синтезу цитопротективных веществ (аргинин, глютамин, полиамины);
– снижению рН в просвете толстого кишечника;
– стимуляции иммунного ответа (синтез sIgA, IgG, Il-4, Il-10, усиление фагоцитоза);
– стимуляции секреции муцина;
– подавлению эпителиальной адгезии и транслокации патогенов;
– стимуляции апоптоза.
Бактерийные препараты на белорусском фармацевтическом рынке представлены различными формами монои поликомпонентных пробиотиков, синбиотиками (сочетание прои пребиотика), самоэлиминирующимися пробиотиками-антагонистами.
Выбор препарата для коррекции дисбиотических нарушений – сложная задача для врача-педиатра.
Несмотря на широкое использование, бактериальные препараты на основе живых микроорганизмов не всегда оказывают ожидаемый клинический эффект. Это связано, в первую очередь, с разрушением и быстрой элиминацией вводимых в агрессивную среду микроорганизмов из-за высокой толерантности иммунной системы к собственной микрофлоре [2]. Поэтому относительно недавно были синтезированы принципиально новые пробиотики на основе штаммов с заданными свойствами. Лечебное действие этих препаратов обусловлено выраженными конкурентными свойствами против широкого спектра патогенных и условно-патогенных бактерий. В нашей стране хорошо зарекомендовал себя пробиотик-антагонист на основе культуры Bacillus cereus IP5832 («Бактисубтил», Sanofi-Aventis»). Данная культура синтезирована в Пастеровском институте, в состав индигенной кишечной флоры не входит. Споры являются кислотоустойчивыми, т.е. проходя желудок, не теряют своих свойств и, попадая в кишечник, превращаются в вегетативные формы. Бактерицидные свойства препарата обусловлены способностью Bacillus cereus вырабатывать вещества, обладающие антагонистическим действием по отношению к В. proteus, E. coli и Staf. аureus. Вегетативные формы сенной палочки выделяют бактериолитические ферменты, что вызывает ацидификацию кишечной среды, препятствует процессу гниения и избыточному газообразованию. Данный штамм бактерии не персистирует в кишечнике и полностью выводится из организма в течение 48 часов. Максимально выраженные конкурентные свойства по сравнению с пробиотиками на основе компонентов нормальной микрофлоры позволяют рекомендовать данный препарат в качестве средства выбора при диареях неясного генеза.
Логическим, а теперь уже можно совершенно определенно сказать – и достойным, продолжением линейки лекарственных препаратов этой же фармацевтической фирмы стало появление несколько лет назад на белорусском рынке нового бактериального препарата на основе Bacillus clausii – «Энтерожермина». В. clausii – грамположительная, аэробная, спорообразующая, факультативная, палочковидная бактерия, максимально устойчивая к действию желудочного сока и химиопрепаратов. В состав пробиотика «Энтерожермина» входит 4 штамма спорообразующей Bacillus clausii (2 млрд. спор), которые выделяют антибактериальные вещества, активные против грамположительных бактерий, особенно в отношении Staphyloccocus aureus, Enterococcus faecium и Clostridium difdicile.
В качестве вспомогательного вещества используется очищенная вода, что делает возможным применение препарата у пациентов с аллергической патологией. Препарат не противопоказан к приему во время беременности и кормления грудью. Препарат выпускается в удобной жидкой форме, обладает хорошими органолептическими качествами. К другим преимуществам «Энтерожермины» относится возможность применения уже с 3-недельного возраста, хорошая комплаентность (1 раз в сутки), высокая полирезистентность к антибиотикам (пенициллины, цефалоспорины, тетрациклины, макролиды, аминогликозиды, линкозамиды, фторированные хинолоны, хлорамфениколы).
Недавно опубликованы результаты шести рандомизированных исследований, посвященных применению различных пробиотиков для профилактики и лечения антибиотико-ассоциированной диареи [11]. В метаанализ были включены 766 пациентов (376 – основная группа, 390 – контрольная). Большинство исследований подтвердили укорочение продолжительности диареи при применении пробиотиков примерно на 28–30 часов. Наиболее эффективными оказались по мере убывания: B. clausii, L. rhamnosus (L GG), Saccharomyces boulardii, B. bifidum, Streptococcus faecium SF68, Streptococcus termophilus.
Итальянские ученые в ходе двойного, слепого, рандомизированного, плацебо-контролируемого исследования оценили влияние бактериотерапии с использованием B.clausii на частоту и характер побочных явлений со стороны желудочно-кишечного тракта, которые обычно возникают при антихеликобактерной терапии [15]. Было убедительно продемонстрировано, что при применении пробиотика «Энтерожермина» во время и после стандартной 10-дневной антихеликобактерной терапии у пациентов отмечалась достоверно более низкая частота возникновения таких побочных явлений, как диарея, тошнота, боли в эпигастрии в сравнении с группой плацебо.
G. Ciprandi и соавт. изучили потенциальное влияние B.clausii на профиль цитокинов (IL-1, 3, 4, 6, 8,10, 12, IFN?, трансформирующий фактор роста TGF-?, TNF-?) у детей-аллергиков, страдающих рецидивирующими респираторными инфекциями [12]. Было установлено, что применение «Энтерожермины» при респираторных инфекциях у детей-аллергиков ведет к нормализации соотношения Th2/Th1, стимулирует активность Th1, что подтверждается повышенным уровнем IFN? в смывах из носовой полости. Кроме того, стимуляция активности Th1 обусловливает снижение выработки IL-4 (этот цитокин способен нарушать функцию эпителиального барьера кишечника). В то же время IL-10 и TGF-? могут уменьшить пагубное влияние IL-4 на эпителий. Доказано, что применение B.clausii стимулирует активность Т-регулирующих клеток (Tr1), что сопровождается как раз и повышением уровней IL-10 и TGF-? [12]. Таким образом, подтверждено модулирующее действие B.clausii на функциональную активность иммунной системы.
Учитывая глобальную роль облигатной кишечной микрофлоры для сохранения здоровья ребенка, и, в первую очередь, для обеспечения адекватного функционирования иммунной системы (что доказано в многочисленных исследованиях), чрезвычайно важно использовать современные программы лечения и оздоровления детей с дисбактериозом кишечника. Комплексный подход должен учитывать анамнез (антенатальный и ранний постнатальный), перенесенные заболевания, характер вскармливания и питания, особенности преморбидного фона, перенесенные острые и хронические болезни, в том числе органов пищеварения, аллергическую патологию, наличие признаков иммунологической недостаточности.
В связи с этим мы провели исследование, целью которого явилась оценка эффективности препарата «Энтерожермина» для профилактики диареи у детей раннего возраста с рецидивами обструктивного бронхита.
Дизайн исследования. Всего обследовано 58 детей (17 (29,3%) мальчиков и 41 (70,7%)девочка) в возрасте от 6 месяцев до 3 лет с рецидивирующим обструктивным бронхитом. Все пациенты обследованы по единому протоколу с информированным согласием родителей. На момент госпитализации в пульмонологическое отделение Гродненской областной детской клинической больницы у 23 (39,7%) детей это был третий эпизод бронхиальной обструкции на протяжении предшествующего года, у 31 (53,4%) ребенка – четвертый эпизод и у 4 (6,9%) детей – пятый.
Методы обследования включали тщательное изучение анамнестических данных, общеклинические анализы крови и мочи, рентгенографию органов грудной клетки для исключения пневмонии, УЗИ органов брюшной полости и почек, по показаниям – УЗИ сердца, исследование крови методом ПЦР на ДНК основных вирусных респираторных патогенов. Бактериологическое исследование кала проведено на 1-й, 30-й и 45-й дни наблюдения, причем 28 детям анализ выполнен трехкратно, 53 детям – двукратно и 5 детям – однократно, поскольку родители отказались от дальнейшего наблюдения и повторных обследований. Степень тяжести дисбактериоза определяли по классификации В.М. Бондаренко и Т.В. Мацулевич (2007).
Все больные получали базисную терапию, включающую??-лактамные антибиотики (полусинтетические пенициллины, цефалоспорины II и III поколений), ингаляционные ?-адреномиметики, теофиллины по схеме step-down, гипосенсибилизирующие и противокашлевые препараты. До госпитализации в стационар амбулаторно 34 (58,6%) ребенка в течение 2–5 дней получали антибиотики:
8 детей – амоксициллин внутрь, 16 детей – амоксициллина клавуланат внутрь, 10 детей – цефуроксим внутрь. Всем детям дополнительно в схему лечения на 2–3-й день госпитализации включали пробиотик-антагонист «Энтерожермина» по 5 мл (1 флакон) 1 раз в день в течение 10 дней. До поступления в стационар в течение предшествующего месяца все включенные в исследование пациенты пробиотиков не получали. Средняя продолжительность пребывания в стационаре составила 16±1,3 койко-дня. Для дальнейшего наблюдения и проведения анализа кала на дисбактериоз дети активно вызывались в поликлиники по месту жительства. Для расчетов использован статистический пакет прикладных программ «Statistica 6,0» для операционной системы Windows XP.
Результаты исследования. Наиболее типичные жалобы пациентов: малопродуктивный сухой длительный кашель, даже на фоне мукоактивной терапии (92%), затяжное течение ринита (52%), длительный субфебрилитет (31%), ухудшение аппетита (88%), дистанционные хрипы (86%), затрудненное дыхание (98%).
В анамнезе были выявлены следующие факторы риска:
– наследственная отягощенность по аллергическим заболеваниям – у 43 детей (74,1%). В том числе по линии матери – 24 чел. (55,8%), по линии отца – 13 детей (30,2%), по обеим линиям – 6 (14%);
– ранний перевод на искусственное вскармливание – 30 пациентов (51,7%);
– перенесенный или впервые констатированный во время госпитализации рахит – у 17 детей (29,3%);
– анемия легкой степени – у 22 детей (37,9%), средней степени тяжести – у 5 детей (8,6%).
Анализ клинической картины заболевания: 39 детей (67,2%) страдают атопическим дерматитом, основным триггером которого является аллергия к белкам коровьего молока (у 3 пациентов причинно-значимый фактор установить не удалось); у 26 пациентов (44,8%) были выявлены фенотипические признаки соединительнотканных дисплазий в виде малых аномалий развития сердца (аномально расположенные хорды, аневризмы межпредсердной перегородки, короткие трабекулярные мышцы), почек (пиелоэктазии), желчного пузыря (аномалии формы). Следует отметить, что у каждого третьего ребенка (31,5%) отмечалась длительно сохраняющаяся ускоренная СОЭ, вплоть до выписки из стационара.
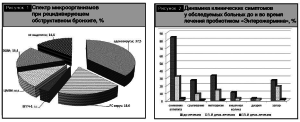
Спектр микроорганизмов, выделенных у детей с рецидивирующим бронхообструктивным синдромом: аденовирусы – 37,5%, вирус РС – 18,6%, ЭБВИ – 15,4, ЦМВИ – 10,8, ВПГЧ-1 – 3,1%. У 14,6 обследованных детей этих микроорганизмов не выделено (рис. 1).
Эффективность превентивной терапии по развитию диареи оценивали по динамике клинических симптомов, изменениям внутрипросветной микрофлоры толстого кишечника. На фоне применения «Энтерожермины» уже на 5-й день лечения отмечена существенная положительная динамика клинических симптомов, а к 15-му дню лечения – практически их полное отсутствие (рис. 2).
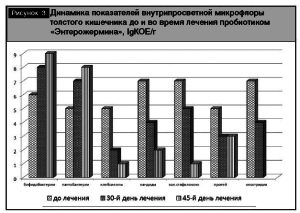
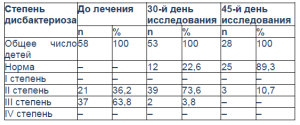
После получения результатов анализа кала пациенты были распределены на группы в зависимости от степени тяжести дисбактериоза кишечника (табл. 3). Полная нормализация кишечной микрофлоры отмечена у 22,6% детей на 30-й день исследования и у 89,3% обследованных – на 45-й день. На 45-й день исследования только у трех пациентов сохранялась вторая степень дисбактериоза.
Таблица 3. Степень тяжести дисбактериоза у обследуемых больных
Динамика показателей бактериологического анализа кала до лечения и на этапах наблюдения приведена на рис. 3.
Ни у одного из числа обследуемых при втором и третьем осмотрах не отмечено возобновления клинических проявлений функциональных нарушений со стороны желудочно-кишечного тракта, свидетельствующих о нарушении кишечного биоценоза.
Выводы:
1. Факторами риска развития рецидивов бронхообструктивного синдрома у детей раннего возраста являются наследственная отягощенность по аллергическим заболеваниям, особенно со стороны матери, ранний перевод на искусственное вскармливание, сопутствующие заболевания (рахит, анемия).
2. У 67,2% детей выявлены клинические признаки атопического дерматита как проявления пищевой аллергии на белок коровьего молока.
3. Наиболее часто у данной категории детей в разгар заболевания выделяются аденои герпесвирусы.
4. Включение в комплексную терапию самоэлиминирующегося пробиотика-антагониста «Энтерожермина» позволяет быстрее и более эффективно ликвидировать клинические симптомы функциональных нарушений со стороны желудочно-кишечного тракта.
5. «Энтерожермина» является высокоэффективным средством для профилактики диареи у детей, получающих антибиотики, и коррекции нарушений микробиоценоза толстого кишечника. Препарат хорошо переносится, нежелательных побочных реакций нами не зафиксировано.
Л И Т Е Р А Т У Р А
1. Андреева И.В. Потенциальные возможности применения пробиотиков в клинической практике //Клиническая микробиология и антимикробная химиотерапия. – 2006. – №8. – С.151–172.
2. Белоусова, Е.А., Никитина Н.В., Мишуровская Т.С., Златкина, А.Р. // Справочник поликлинического врача. – M., 2005. – Т.4.
3. Гриневич В.Б., Захаренко С.М., Сас Е.И. // Лечащий врач. – 2008. – №10. – С.18–21.
4. Кешишян Е.С., Бердникова Е.К. // Практика педиатра. – 2013. – №2. – С.51–54.
5. Коровина Н.А., Малиновская В.В., Захарова И.Н. и др. // М-лы XIII конгресса детских гастроэнтерологов России. – М., 2006 – С.63–64.
6. Копаев Ю.А., Соколов А.Л. Дисбактериоз кишечника: микробиологические, иммунологические и клинические аспекты микроэкологических нарушений у детей. – М., 2003. – 148 с.
7. Скворцов В.В. // Лечащий врач. – 2008. – №2. – С.33–36.
8. Урсова Н.И. Нарушения микрофлоры и дисфункции билиарного тракта у детей. – М., 2005. – 168с.
9. Урсова Н.И. // Лечащий врач. – 2008. – №1. – С.19–22.
10. Феклисова Л.В. // Тез. докл. науч.-практ. семинара «Индивидуальные подходы к проблеме дисбактериоза». – М., 2003. – С.3–7.
11. Хромова С.С., Кафарская Л.И., Ефимов Б.А. // Вопр. детской диетологии. – 2006. – №1. – С.15–18.
12.Сiprandi G., Tosca M.A. // Ital. J. Paed. Allergy Immunol. – 2007. – №2. – P.49–57.
13. Fons M., Gomez A., Karjalainen T. // Microbial. Ecol. Health. Dis. Suppl. – 2000. – №2. – P.240–246.
14. Kekkonen R. Immunomodulatory effect of probiotic bacteria in healthy aduets. – Helsinki, 2008. –122 p.
15. Nista E.C., Candelli M., Cazzato I.A., Zocco M.A. // Aliment. Pharmacol.T her. – 2007. – Vol.20. –P.1181–1188.
16. Walker J.A., Sandhu B.K. et al. //J. Pediatr. Gastroenterol. – 1997. – Vol.24. – P.619–621.
Медицинские новости. – 2013. – №6. – С. 50-56.








Комментировать