Место клапанных поражений сердца в общей структуре хронической сердечной недостаточности. Ревматизм – эпидемиология и диагностика. Критерии диагностики ревматической лихорадки и ревматических поражений сердца. Диагностика и оценка степени выраженности приобретенных пороков сердца. Аортальная недостаточность. Аортальный стеноз. Митральная недостаточность и митральный стеноз.
А.И. ДЯДЫК, А.Э. БАГРИЙ, О.В. САМОЙЛОВА, Л.С. ХОЛОПОВ, К.Р. ТЮРКЯН, А.В. ОНИЩЕНКО, С.Р. ЗБОРОВСКИЙ, Кафедра внутренних болезней и общей практики — семейной медицины Донецкого национального медицинского университета им. М. Горького
Место клапанных поражений сердца в общей структуре хронической сердечной недостаточности
Пороки клапанного аппарата сердца занимают важное место в группе неишемических причин развития хронической сердечной недостаточности (ХСН). Данные, касающиеся удельного веса клапанных поражений в общей этиологической структуре ХСН, различны. Анализ 31 исследования, выполненный J.R. Teerlink et al., показал, что заболевания клапанного аппарата сердца в 4 % случаев обусловливали развитие ХСН. Согласно результатам Hillingdon Study, в котором использовались неинвазивные методы диагностики, клапанные поражения служили причиной симптомов ХСН в 7 % случаев. В одном из крупнейших популяционных исследований — Framingham Heart Study у 9 % мужчин и 16 % женщин этиологическим фактором ХСН выступали пороки клапанного аппарата сердца. В недавно опубликованном крупном исследовании, проводившемся в Великобритании с 1994 по 2001 год, среди 963 пациентов, обратившихся к врачу по поводу симптомов ХСН и имевших нормальные показатели систолической функции ЛЖ, в 5,4 % случаев причиной развития этих симптомов явились поражения клапанного аппарата сердца различной степени тяжести. В то же время, по данным проспективного наблюдения A. Valera-Roman et al., у 229 больных, госпитализированных в клинику в период с 1991 по 1994 год, ХСН ассоциировалась с наличием пороков сердца в 23,5 % случаев. Недостаточность митрального клапана (МК) и аортальный стеноз являются наиболее частыми причинами развития ХСН у больных с клапанными пороками сердца.
Более подробно нами охарактеризованы вопросы диагностики и лечения таких приобретенных пороков сердца: хронической аортальной недостаточности, аортального стеноза, хронической митральной недостаточности и митрального стеноза. При подготовке материала, касающегося перечисленных выше клапанных поражений, широко использованы Рекомендации Американской ассоциации кардиологов и Европейского общества кардиологов по ведению больных с пороками сердца, 2006-2007 (далее — ААК/ЕОК, 2006-2007).
Ревматизм (ревматическая лихорадка — РЛ)
Ревматизм определяется (C. Flig-ner et al., 1999; ВОЗ, 2004) как заболевание иммунной природы, характеризующееся воспалительными процессами в сердце, суставах, коже и других органах, ассоциирующееся с тон- зиллофарингитом, который вызван р-гемолитическим стрептококком группы А.
Эпидемиология. Стрептококки группы А &руо- genes) — одни из серологических представителей Р-гемолитических стрептококков — подразделяются на более чем 130 различных М-типов. Установлена этиопа- тогенетическая связь стрептококков группы А (при наличии стрептококкового фарингита) с РЛ (в отличие от стрептококков групп В, С, D, G). В эндемических вспышках РЛ (США, Западная Европа в 80-90 гг. ХХ века) выявлялись высоковирулентные штаммы стрептококков группы А.
Распространенность РЛ в западных странах составляет 1 : 100 000; в развивающихся странах она значительно выше и достигает 70-150 : 100 000 (C. Otto, 1999; ВОЗ, 2004). В развивающихся странах частота госпитализаций по поводу ревматических пороков сердца составляет до 5-10 % от общего количества госпитализаций. Пик заболеваемости РЛ приходится на возраст 5-15 лет. Заболеваемость стрептококковым фарингитом характеризуется существенной вариабельностью (страна, возраст, время года и др.). Наиболее часто среди причин РЛ представлены М-серотипы 1, 3, 5, 6, 18, 19, 24 р-гемолитических стрептококков.
Диагностика. Ниже представлены предложенные экспертами ВОЗ (2002-2003 гг.) критерии диагностики РЛ и ревматических поражений сердца (базирующиеся на пересмотренных критериях Джонса). По мнению этих специалистов, а также сотрудников комитета по РЛ и эндокардиту Американской ассоциации сердца (2002 г.), сейчас:
- нет аргументированных данных для кардинального пересмотра критериев Джонса;
- отсутствует золотой стандарт диагностики РЛ;
- нет ни одного специфического лабораторного теста, патогномоничного для острой РЛ или ее рецидива;
- эхокардиография может служить дополнительным методом подтверждения клинических данных РЛ, позволяя оценить размеры камер, функцию желудочков, степень вальвулярной регургитации и состояние клапанных структур;
- данные эхокардиографии не могут быть использованы в качестве больших или малых критериев для установления диагноза острой РЛ при отсутствии клинических симптомов.
Критерии диагностики РЛ и ревматических поражений сердца (адаптировано, ВОЗ 2002-2003 гг.)
Большие признаки:
- кардит;
- полиартрит;
- хорея;
- кольцевидная эритема;
- подкожные узелки.
Малые признаки:
- клинические (лихорадка, полиартралгия);
- лабораторные (повышенные острофазовые реакции (СОЭ, лейкоцитоз)).
Дополнительные доказательства предшествующей стрептококковой инфекции в течение последних 45 дней:
- удлинение интервала PQ на ЭКГ;
- повышенные или нарастающие значения антистрептолизина-О или других стрептококковых антител;
- положительная культура посева из глотки или
- экспресс-тест на наличие антигена к стрептококку группы А;
- недавно перенесенная скар-латина.
Диагностические категории:
- Первичный эпизод ревматической лихорадки (критерии: два больших или один большой и два малых признака + дополнительные доказательства предшествующей инфекции стрептококками группы А).
- Повторная атака ревматической лихорадки у пациента без установленного ревматического поражения сердца (критерии: два больших или один большой и два малых признака плюс доказательства предшествующей инфекции стрептококками группы А).
- Повторная атака ревматической лихорадки у пациента с установленным ревматическим поражением сердца (критерии: два малых признака плюс доказательства предшествующей инфекции стрептококками группы А).
Лечение и профилактика острой РЛ (ВОЗ, 2004). Больные с острой РЛ должны быть госпитализированы. Следует проводить антибактериальную терапию (независимо от возможного отрицательного результата культуры глотки). При этом необходимо иметь в виду, что это лечение не изменяет частоту, тяжесть и продолжительность кардита. У больных с РЛ могут также использоваться аспирин, другие нестероидные противовоспалительные препараты, глюкокортикоиды (дозировки, комбинации и продолжительность применения этих классов препаратов определяются в соответствии с индивидуальными особенностями больного). Перечисленные классы препаратов не изменяют частоту и тяжесть ревматического поражения сердца.
Первичная профилактика РЛ включает диагностику и лечение стрептококкового тонзиллофарингита (в лечении используются бициллин, амоксициллин, эритромицин). Вторичная профилактика РЛ проводится с использованием бициллина или эритромицина, ее продолжительность должна составлять:
- для больных, имевших РЛ с кардитом при наличии поражений клапанного аппарата сердца, — более 10 лет до 40-летнего возраста;
- имевших РЛ с кардитом без поражений клапанного аппарата сердца, — 10 лет;
- имевших РЛ без кардита, — 5 лет до 21-летнего возраста.
Диагностика и оценка степени выраженности приобретенных пороков сердца
Подходы к диагностике и оценке степени выраженности приобретенных пороков сердца (адаптировано из рекомендаций экспертов ААК/ЕОК, 2006-2007)
- Беседа с пациентом (жалобы, анамнез, переносимость физической нагрузки, выполнение рекомендаций по профилактике инфекционного эндокардита и ревматической лихорадки, при хроническом приеме пероральных антикоагулянтов — оценка кровоточивости, возможных тромбоэмболических проявлений).
- Объективное исследование. Аускультация сердца — наиболее широко используемый и эффективный метод выявления поражений клапанного аппарата сердца. Оценка динамики мелодии сердца (в том числе у больных с протезами клапанов).
- Электрокардиография.
- Рентгенография органов грудной клетки.
- Эхокардиография — основной метод диагностики поражений клапанов сердца, оценки степени их выраженности, определения прогноза:
- Оценка степени тяжести стенотических пороков должна включать определение площади отверстия клапана и таких параметров потока крови на клапане, как средний градиент давления или максимальная скорость потока.
- Оценка клапанной регургитации должна включать определение таких количественных доппле- рографических индексов, как площадь эффективного регургитационного отверстия (effective regurgitant orifice area), объем регургитации (regurgitant volume) и фракция регургитации (regurgitant fraction). Эти показатели более точны по сравнению с параметрами оценки размера ре- гургитирующего потока с помощью цветного допплеровского исследования.
- Для оценки степени выраженности поражений клапанного аппарата следует использовать сочетание различных эхокардиографических подходов. Также необходимо учитывать структурные особенности клапанов, механизмы развития клапанных поражений, данные клинической картины.
- Необходимо выполнять исследования всех клапанов, а также восходящей аорты.
- Следует оценивать показатели структуры и функции левого желудочка (они особенно важны для прогнозирования у больных с аортальной и митральной регургитацией). Обычно используется индексация размеров ЛЖ на площадь поверхности тела.
- Чреспищеводная эхокардиография используется при недостаточно высоком качестве трансторакальных изображений, а также при подозрении на наличие тромбозов, дисфункций протезов, инфекционного эндокардита. Применяется также интраоперативно для мониторирования результатов пластики клапанов.
- Электрокардиографические пробы с физической нагрузкой могут быть использованы для оценки степени риска у полностью бессимптомных больных с аортальным стенозом. Они также применяются для определения допустимого уровня физической активности (в том числе при занятиях спортом).
- Коронарная ангиография широко используется для выявления сопутствующих коронарных поражений при планировании хирургических вмешательств на клапанах. Коронарная ангиография может не выполняться у молодых больных без факторов риска, а также в тех случаях, когда риск ее проведения превышает возможную пользу, например при остром расслоении аорты, наличии крупных вегетаций перед входом в коронарные артерии, при окклюзирующем тромбозе протезов с нестабильной гемодинамикой.
- Катетеризация сердца с измерением уровней давления в полостях сердца и крупных сосудах резервируется для ситуаций, когда имеется несоответствие между клиническими данными и данными неинвазивных исследований.
Аортальная недостаточность
Аортальная недостаточность (АН) рассматривается как несостоятельность аортального клапана (АК), проявляющаяся развитием обратного потока крови из аорты в ЛЖ в ходе диастолы. В зависимости от скорости возникновения несостоятельности АК выделяют острую и хроническую АН, которые существенно различаются по механизмам развития, характеру и особенностям гемодинамических нарушений, клиническим проявлениям и тактике лечения.
Острая АН
Этиология. Острая АН возникает при быстро развившемся нарушении целостности одной или нескольких створок АК. При инфекционном эндокардите могут развиваться либо поражение створки АК, приводящее к ее перфорации, либо абсцесс кольца АК, что влечет за собой отрыв целой створки. Также инфекционный эндокардит может стать причиной острой несостоятельности протезированного клапана. Описываются различные механизмы развития такой АН, в том числе и механическое препятствие закрытию искусственного клапана в виде вегетаций.
При наличии расслоения восходящего отдела аорты может сформироваться гематома в media аорты, распространяющаяся на АК, при этом возможно изменение расположения одной или нескольких створок АК, которые начинают пролабировать в полость ЛЖ, вследствие чего развивается несостоятельность АК.
Рядом авторов описываются случаи «спонтанной» острой АН при некоторых системных заболеваниях соединительной ткани, в частности при системной красной волчанке (фибриноидный некроз створки с развитием «стерильной» перфорации), болезни Уиппла, гигантоклеточном аортите, артериите Такаясу, анкилозирующем спондилите. Вследствие миксоматозной дегенерации АК может возникать выворачивание или пролапс его створок, например, у пациентов с синдромом Марфана.
Нарушение целостности клапана также может наблюдаться при травмах: обычно это падение с большой высоты, промышленные или транспортные аварии или катастрофы, сопровождающиеся массовым поражением различных внутренних органов.
Тактика ведения. Пациентам с острой АН показана госпитализация в отделение интенсивной терапии с последующим хирургическим лечением. Из медикаментозных средств (используемых в качестве временной меры) препаратами выбора при острой АН являются ва- зодилататоры (нитропруссид натрия, нитраты, ингибиторы АПФ), обычно применяемые в комбинации с петлевыми диуретиками.
Хроническая АН
Эпидемиология. В общей популяции частота регургитации через АК различной степени выраженности составляет от 8 до 33 %. Одними из наиболее репрезентативных представляются опубликованные в 1999 г. данные Фре- мингемского исследования о проспективном обследовании 1696 мужчин и 1893 женщин с помощью цветного допплеровского картирования. В этом исследовании хроническая АН (ХАН) была отмечена у 13 % мужчин и 8,5 % женщин. Наиболее часто имела место ХАН минимальной степени выраженности, частота ее составляла от 1,1 до 14,6 % в различных половых и возрастных группах обследованных. Умеренная и выраженная ХАН выявлялась значительно реже, составляя от 0,3 до 2,3 %. Обращает на себя внимание отчетливая зависимость частоты и степени выраженности ХАН от возраста обследованных. Так, умеренная и тяжелая ХАН среди лиц в возрасте до 39 лет не была отмечена ни в одном из случаев, в то время как среди лиц старше 60 лет она выявлялась в 0,6-2,3 % наблюдений.
Этиология. Развитие ХАН может быть обусловлено поражением створок АК, изменениями стенок корня аорты и аортального кольца, а также некоторыми другими причинами.
Особенности клинической картины. Симптомы ХСН являются наиболее частыми симптомами, развивающимися у пациентов с ХАН. Это обычно происходит в отсутствие какой-либо симптоматики в течение десятилетий. Сначала пациент может отмечать лишь некоторое снижение толерантности к физической нагрузке, затем возникает одышка при физической активности — эти явления могут существовать в течение нескольких лет без заметного увеличения тяжести состояния. Затем развиваются признаки более тяжелой ХСН, в том числе ортопноэ и пароксизмальная ночная одышка. Последняя более часто встречается и более выражена при ХАН сифилитической этиологии.
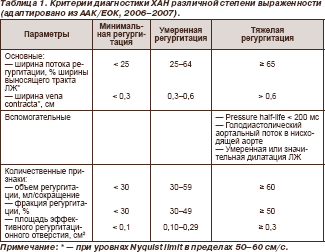
Диагностика (см. Подходы к диагностике и оценке степени выраженности приобретенных пороков сердца). Ведущим инструментальным методом диагностики ХАН является эхокардиографическое исследование. В табл. 1. представлены эхокардиографические критерии диагностики ХАН различной степени выраженности.
Показания к хирургическому лечению. При острой АН проведение оперативного вмешательства является необходимым; оно должно быть ургентным во всех случаях, когда у больного имеются симптомы гемо- динамической нестабильности. Показания к оперативному лечению при ХАН представлены ниже. Хирургическое лечение предусматривает обычно протезирование АК, а при наличии сопутствующей аневризмы аорты — также протезирование восходящей аорты с реимплантацией коронарных артерий.
Показания к хирургическому лечению при ХАН (адаптировано из ААК/ЕОК, 2006-2007)1
Тяжелая ХАН (см. табл. 1):
- При наличии клинических проявлений (одышка, стенокардия, ХСН И-М функциональных классов) (класс I, уровень доказательств В).
- При отсутствии клинических проявлений, если фракция изгнания ЛЖ в покое < 50 % (класс I, уровень доказательств В).
- Больным, которым одновременно проводятся аортокоронарное шунтирование или хирургические вмешательства на аорте или на других клапанах (класс
- уровень доказательств С).
- При отсутствии клинических проявлений у больных с фракцией изгнания ЛЖ в покое > 50 %, если имеется значительная дилатация ЛЖ (класс 11а, уровень доказательств С):
а) конечно-диастолический размер ЛЖ > 70 мм или
б) конечно-систолический размер ЛЖ > 50 мм (или > 25 мм/м2 площади поверхности тела).
Независимо от тяжести ХАН:
- Больным с поражениями корня аорты, если максимальный диаметр корня аорты составляет:
а) > 45 мм у больных с синдромом Марфана (класс I, уровень доказательств С);
б) > 50 мм у больных с двустворчатым аортальным клапаном (класс На, уровень доказательств С);
в) > 55 мм для других больных (класс На, уровень доказательств С).
Медикаментозное лечение (ААК/ ЕОК, 2006-2007). У больных с острой АН при тяжелых гемодинамических нарушениях для стабилизации состояния перед проведением оперативного лечения могут использоваться нитро- пруссид и негликозидные инотропные препараты (допамин и добутамин).
У лиц с тяжелой ХАН при наличии клинических проявлений ХСН в случаях противопоказаний к проведению хирургического лечения, а также при сохраняющейся в послеоперационном периоде систолической дисфункции ЛЖ препаратами выбора являются ингибиторы АПФ. Развитие клинических симптомов ХСН при ХАН может быть показанием для применения сердечных гликози- дов и диуретиков. Бессимптомным больным с ХАН при повышенных уровнях АД показано проведение антиги- пертензивной терапии с использованием вазодилатато- ров, таких как ингибиторы АПФ и дигидропиридиновые блокаторы кальциевых каналов. До настоящего времени не установлена способность вазодилататоров замедлять прогрессирование ХАН у бессимптомных больных, имеющих нормальные уровни АД.
Для лиц с синдромом Марфана показано, что Р-адреноблокаторы способны замедлять прогрессирование дилатации аорты; препараты этой группы должны поэтому назначаться таким больным как до, так и после оперативного лечения. В то же время следует иметь в виду, что при наличии тяжелой ХАН у таких больных использование р-адреноблокаторов требует особой осторожности вследствие того, что увеличение продолжительности диастолы может приводить к увеличению объема регургитации. Р-адреноблокаторы могут использоваться у больных с синдромом Марфана, имеющих снижение систолической функции ЛЖ (в том числе тяжелое). Представлены данные о том, что у больных с синдромом Марфана замедлять прогрессирование дилатации аорты способны также ингибиторы АПФ.
Профилактика инфекционного эндокардита требуется всем пациентам с ХАН.
Основные принципы антибактериальной профилактики инфекционного эндокардита у больных с приобретенными пороками сердца (адаптировано из Рекомендаций по диагностике, лечению и профилактике инфекционного эндокардита Европейского общества кардиологов, 2004)
Показания:
- наличие клапанных протезов2;
- наличие приобретенных пороков сердца;
- пролапс митрального клапана с регургитацией на клапане или со значительным утолщением створок;
- перенесенный ранее инфекционный эндокардит;
- гипертрофическая кардиомиопатия.
Диагностические или лечебные процедуры, сопряженные с риском развития бактериемии:
- бронхоскопия;
- цистоскопия при инфекции мочевой системы;
- биопсия органов мочевой системы/предстательной железы;
- стоматологические процедуры с повреждением слизистой;
- тонзиллэктомия;
- инструментальные вмешательства при билиарной обструкции;
- трансуретральная резекция предстательной железы;
- литотрипсия;
- дилатация пищевода;
- гинекологические процедуры при наличии инфекции.
Профилактические антибактериальные режимы:
- при стоматологических, респираторных и эзофа- геальных процедурах:
- при отсутствии аллергии на пенициллин:
а) амоксициллин 2,0 г внутрь за 1 ч до процедуры;
б) если невозможен прием внутрь: амоксициллин 2,0 г внутривенно за 0,5-1 ч до процедуры;
- при аллергии на пенициллин: клиндамицин 600 мг, или азитромицин 500 мг, или кларитромицин 500 мг внутрь за 1 ч до процедуры;
- при процедурах на желудочно-кишечном тракте или мочеполовых органах:
- при отсутствии аллергии на пенициллин:
а) группа особенно высокого риска: амок- сициллин 2,0 г внутривенно + гентамицинЗ
- мг/кг внутривенно за 0,5-1 ч до процедуры, через 6 часов — еще 1,0 г амоксицилли- на внутрь;
б) группа умеренного риска: амоксициллин 2,0 г внутривенно за 0,5-1 ч до процедуры или амоксициллин 2,0 г внутрь за 1 ч до процедуры;
- при аллергии на пенициллин:
а) группа особенно высокого риска: ванкоми- цин4 1,0 г за 1-2 ч до процедуры + гентамицин
- мг/кг внутривенно или внутримышечно;
б) группа умеренного риска: ванкомицин 1,0 г за 1-2 ч до процедуры без гентамицина.
Длительное наблюдение. В соответствии с мнением экспертов обсуждаемых международных Рекомендаций (2006-2007), пациенты с незначительной или умеренной выраженностью ХАН должны осматриваться врачом ежегодно; эхокардиографическое исследование у них следует повторять 1 раз в 2 года. Все больные с тяжелой ХАН, имеющие сохранные уровни фракции изгнания ЛЖ, должны быть осмотрены повторно с выполнением эхокардиографического исследования через 6 месяцев после выявления ХАН. Если за этот период отмечены значимые изменения размеров ЛЖ или уровней фракции изгнания ЛЖ либо значения этих параметров близки к тем, которые представлены выше (см. Показания к хирургическому лечению при ХАН) в качестве критериев для поведения оперативного лечения, то дальнейшее наблюдение следует осуществлять с частотой 1 раз в 6 месяцев; если же этих особенностей нет, то осмотры и эхокардиографическое исследование проводятся ежегодно.
У больных с дилатацией корня аорты, особенно у лиц с синдромом Марфана и у имеющих двустворчатый аортальный клапан, эхокардиографическое исследование необходимо производить не менее 1 раза в год или чаще, если уже имеется отчетливое расширение аорты.
Аортальный стеноз
Аортальный стеноз представляет собой фиксированную обструкцию изгнанию крови из ЛЖ в аорту. В зависимости от анатомического расположения выделяют обструкцию на уровне створок аортального клапана (клапанный аортальный стеноз), над клапаном аорты (надклапанный аортальный стеноз) и ниже створок клапана, в выносящем тракте ЛЖ (подклапанный, или суба- ортальный, стеноз).
Этиология. Клапанный аортальный стеноз (АС) наиболее часто развивается в результате ревматического поражения эндокарда АК со «спаянием» его комис- сур. В ряде случаев развитие АС связано с врожденным дефектом структуры АК (двустворчатый, четырехстворчатый, одностворчатый клапан) с последующей кальцификацией и склерозированием клапанных структур. Важное место среди причин АС отводится «дегенеративным» изменениям аппарата АК с его склерозированием/кальцификацией, развивающимся чаще в пожилом и старческом возрасте. Другие причины АС включают поражение АК при системной красной волчанке (эндокардит Либмана — Сакса), ревматоидном артрите, инфекционном эндокардите, гиперлипопротеинеми- ях, метаболических и ферментативных нарушениях (болезнь Уиппла, мукополисахаридозы, болезнь Фабри).
Клинические проявления и прогноз. Развитие гемодинамически значимого АС независимо от этиологии обычно происходит в течение длительного времени (годы). В связи с этим, а также в связи с развитием компенсаторных механизмов, способных многие годы поддерживать адекватные потребностям организма значения минутного объема, АС может длительно протекать бессимптомно . И если такой пациент не подвергается в течение бессимптомного периода обследованию, то впервые наличие АС устанавливается при обращении к врачу по поводу клинических проявлений порока, ведущими из которых являются стенокардия, синко- пальные состояния и ХСН . Развитие описанных проявлений АС является неблагоприятным прогностическим моментом. Выживаемость больных существенно снижается, если механически не устраняется сужение: после развития ангинального синдрома приблизительно 50 % больных умирают в течение 5 лет; после развития син- копальных состояний около 50 % больных умирают в течение 3 лет; и после развития ХСН приблизительно 50 % больных умирают в течение 2 лет. В недавних исследованиях показано, что после начала клинических проявлений АС, если механически не устраняется аортальное сужение, около 75 % больных умирают в течение 3 лет.
Диагностика (см. также Подходы к диагностике и оценке степени выраженности приобретенных пороков сердца). Далее показаны особенности эхокардиографической диагностики АС.
Эхокардиографическая диагностика АС (адаптировано из ААК/ЕОК, 2006-2007)
- Эхокардиография является ключевым методом диагностики АС, определения степени кальцификации структур АК, установления размеров и функции ЛЖ, толщины его стенок, сопутствующих клапанных поражений. Данные эхокардиографии обеспечивают получение важной прогностической информации при АС.
- АС считают тяжелым при площади отверстия < 1,0 см2 (или < 0,6 см2 /м2 площади поверхности тела); умеренным — при площади отверстия в пределах 1,0-1,5 см2 (или в пределах 0,6-0,9 см2 /м2 площади поверхности тела).
- Трансвальвулярный градиент давления существенно зависит от уровней пред- и постнагрузки ЛЖ, и вследствие этого его оценка может давать менее точную информацию. Однако при тяжелом АС средний градиент давления на АК (в обычных условиях) > 50 мм рт.ст., при умеренном — в пределах 30-50 мм рт.ст. Скорость потока крови на АК при тяжелом АС составляет > 4 м/с, при умеренном — в пределах 3-4 м/с.
- В случае выраженного снижения систолической функции ЛЖ у больных с тяжелым АС могут определяться относительно небольшие (< 40 мм рт.ст.) уровни градиента давления на АК (низкопотоковый низкоградиентный вариант — low-flow, low-gradient).
- При градиенте давления на АК < 40 мм рт.ст. выявление небольшой площади отверстия не всегда позволяет с определенностью констатировать наличие тяжелого АС, поскольку при небольшом/умеренном сужении отверстия клапан может просто не полностью открываться, создавая ситуацию функционально малой площади отверстия — псевдотяжелого АС (functionallysmallvalvearea — pseudosevereAS). Для выявления таких ситуаций может использоваться низкодозовая добу- таминовая стресс-эхокардиография (при истинно тяжелом АС не происходит значимого увеличения площади отверстия — менее чем на 0,2 см2, но существенно возрастает градиент на АК — до более чем 50 мм рт.ст.; при псевдотяжелом АС отчетливо увеличивается площадь отверстия, но градиент возрастает незначительно).
Показания к хирургическому лечению при АС
представлены ниже. Так, все больные с тяжелым АС, имеющие такие клинические проявления, как одышка, стенокардия, головокружения и синкопальные состояния, являются кандидатами для раннего оперативного лечения. Эксперты США и Европы (2006-2007) указывают, что оперативное лечение таких больных должно проводиться практически независимо от уровней фракции изгнания ЛЖ у них. С учетом значительного улучшения прогноза после оперативной коррекции АС в подобных случаях эксперты также считают, что такое лечение следует проводить и у лиц преклонного возраста (> 80 и даже > 90 лет); они отмечают, что возраст сам по себе не должен рассматриваться в качестве противопоказания для хирургического вмешательства; решение о таком лечении должно приниматься индивидуально с учетом желания больного и его сопутствующих кардиальных и некардиальных особенностей (коморбидного фона).
Несколько менее однозначны подходы к выбору оперативного лечения у бессимптомных больных с тяжелым АС, а также у больных с низкопотоковым низкоградиентным (low-flow, low-gradient) АС (при значимом снижении фракции изгнания ЛЖ и уровнях градиента давления на АК < 40 мм рт.ст.) (см. Эхокардиографическая диагностика АС. Показания к протезированию АК у больных с АС).
Оперативное лечение АС предусматривает, как правило, протезирование АК . Баллонная вальвулопластика может быть использована лишь в некоторых ситуациях:
- в качестве подготовительного подхода к протезированию у гемодинамически нестабильных больных (имеющих из-за этой нестабильности высокий операционный риск) (класс 11Ь, уровень доказательств С);
- в качестве временной меры у больных с тяжелым АС с клиническими проявлениями (одышкой, стенокардией, головокружениями и синкопальными состояниями), требующими ургентного некардиального хирургического вмешательства (класс 11Ь, уровень доказательств С);
- в качестве паллиативной меры в некоторых случаях, когда протезирование противопоказано из-за тяжелого коморбидного фона (класс 11Ь, уровень доказательств С).
Отдельного рассмотрения заслуживает сочетание тяжелого АС и гемодинамически значимого коронарного поражения. В таких ситуациях обычно выполняется протезирование АК в сочетании с аортокоронарным шунтированием. Данные о применении чрескожной транслюминальной коронарной ангиопластики у таких больных пока недостаточны, и этот подход резервируется в настоящее время для больных с острым коронарным синдромом (имеющих высокий операционный риск), а также для больных с нетяжелым АС. Наличие диффузных коронарных поражений, препятствующих проведению аортокоронарного шунтирования, не должно рассматриваться как противопоказание для протезирования АК у больных с тяжелым АС.
При наличии сопутствующих поражений корня аорты и восходящей аорты (например, у больных с двустворчатым АК) может выполняться протезирование восходящей аорты (показания те же, что рассмотрены выше для ситуаций с ХАН — см. Показания к хирургическому лечению при ХАН).
Высокие уровни давления в ЛЖ, связанные с АС, могут способствовать развитию/усугублению сопутствующей митральной регургитации. В отсутствие структурных нарушений створок митрального клапана (отрыва; значительного пролапса; выраженных изменений, связанных с ревматическим поражением или с инфекционным эндокардитом), дилатации фиброзного кольца митрального клапана, выраженной дилатации ЛЖ таким больным обычно не требуется оперативное вмешательство на митральном клапане; их митральная регургита- ция часто значительно уменьшается после протезирования АК.
Показания к протезированию АК у больных с АС (адаптировано из ААК/ЕОК, 2006-2007)
- Больные с тяжелым АС при наличии следующих симптомов: одышка, стенокардия, головокружения, синкопальные состояния (класс I, уровень доказательств В).
- Больные с тяжелым (класс I, уровень доказательств С) или умеренным АС (класс 11а, уровень доказательств С), которым одновременно проводятся аортокоронарное шунтирование, или оперативные вмешательства на аорте, или оперативные вмешательства на других клапанах.
- Бессимптомные больные с тяжелым АС при уровне фракции изгнания ЛЖ < 50 %, если нет другой причины для снижения фракции изгнания ЛЖ (класс I, уровень доказательств С).
- Бессимптомные больные с тяжелым АС, у которых при проведении теста с физической нагрузкой отмечаются:
- одышка, стенокардия, головокружения, синкопальные состояния (класс I, уровень доказательств С);
- снижение АД по сравнению с его исходным уровнем (класс На, уровень доказательств С);
- желудочковые аритмии высоких градаций (класс ИЬ, уровень доказательств С).
- Бессимптомные больные с тяжелым АС и умеренной/тяжелой кальцификацией АК, если темп увеличения пиковой скорости потока на АК составляет > 0,3 м/с в год (класс На, уровень доказательств С).
- АС с низким градиентом давления на АК (< 40 мм рт.ст.) при наличии систолической дисфункции ЛЖ, если есть значимый сократительный резерв ЛЖ (класс На, уровень доказательств С) или если нет такого резерва (класс ИЬ, уровень доказательств С)5.
- Бессимптомные больные с тяжелым АС и выраженной гипертрофией ЛЖ (толщина миокарда ЛЖ > 15 мм), если последняя не сязана с наличием артериальной гипертензии (класс ИЬ, уровень доказательств С).
Медикаментозное лечение (ААК/ЕОК, 2006-2007). У больных с кальцифицирующим дегенеративным АС в настоящее время пока недостаточно данных в пользу обязательного назначения таких групп препаратов, как ингибиторы АПФ и статины. Хотя несколько ретроспективных исследований позволяли предположить благоприятный эффект этих групп препаратов, единственное рандомизированное контролируемое исследование со ста- тином у таких больных не показало благоприятного влияния на прогноз. В случае наличия сопутствующей ИБС могут быть использованы и статины, и ингибиторы АПФ.
Наличие у больных с АС сопутствующей артериальной гипертензии требует адекватного антигипертензив- ного лечения; следует обращать внимание на осторожность при его проведении с тем, чтобы тщательно избегать развития эпизодов гипотензии (которые могут приводить к снижению сердечного выброса).
Важным является удержание синусового ритма (с учетом особой значимости предсердного вклада в наполнение ЛЖ в условиях выраженной гипертрофии ЛЖ и существенного нарушения диастолической функции ЛЖ, что обычно имеет место при АС).
Больные с АС, имеющие такие клинические проявления, как одышка, стенокардия, головокружения, синкопальные состояния, как уже отмечалось, нуждаются в протезировании АК. В настоящее время нет данных о том, что какой-либо вариант медикаментозного лечения может отсрочить необходимость в проведении хирургического вмешательства.
Независимо от этиологии АС, когда имеют место симптомы ХСН (а у больного есть противопоказания к оперативному лечению), могут быть использованы ди- гоксин, диуретики, ингибиторы АПФ (или АРАН). Назначения в-адреноблокаторов у больных с АС при наличии симптомов ХСН следует избегать. При развитии симптомов отека легких в некоторых случаях может быть использован нитропруссид.
Профилактика инфекционного эндокардита требуется всем больным с АС.
Длительное наблюдение. С учетом широкой вариабельности темпов прогрессирования АС больные должны быть информированы о важности регулярного врачебного контроля, а также о необходимости немедленного обсуждения с врачом появляющихся жалоб на одышку, боль в грудной клетке, головокружения, потерю сознания. Частота визитов к врачу зависит от особенностей больного в начале наблюдения.
Когда у больного с АС имеет место кальцификация структур Ак по выраженности от умеренной до значительной, а пиковая скорость потока на АК превышает 4 м/с, осмотры врача с повторными эхокардиографическими исследованиями должны выполняться каждые 6 месяцев. Если пиковая скорость потока на АК значимо увеличивается в процессе наблюдения (более чем на 3 м/с за год) или имеются другие данные об отчетливом прогрессировании гемодинамических нарушений, то рекомендуется проведение хирургического лечения. Когда подобных изменений не происходит, то наблюдение продолжают, осмотры врача проводятся 1 раз в 6 месяцев, эхокардиографические исследования — 1 раз в 6-12 месяцев.
При отсутствии умеренной/значительной кальцификации структур АК и при уровнях скорости потока на АК < 4 м/с в начале наблюдения осмотры врача и выполнение эхокардиографического исследования могут быть ежегодными (при необходимости, с учетом индивидуальных особенностей больного — более частыми).
Митральная недостаточность
Митральная недостаточность (МН) определяется как несостоятельность митрального клапана (МК), проявляющаяся развитием обратного потока крови из ЛЖ в левое предсердие в период систолы. В зависимости от скорости возникновения выделяют острую и хроническую МН.
Острая МН
Этиология. Острая неишемическая МН может развиваться при быстром возникновении несостоятельности МК в результате: перфорации или отрыва створки клапана при инфекционном эндокардите; разрыве мик- соматозно измененной хорды или створки при их мик- соматозной дегенерации; ятрогенных вмешательств (при выполнении катетеризации, биопсии, операции).
Основной причиной острой ишемической МН является полный или частичный разрыв папиллярной мышцы вследствие ее инфарцирования. Более часто разрыв папиллярной мышцы имеет место при инфаркте миокарда задней стенки ЛЖ. Инфарцирование задней папиллярной мышцы развивается чаще, чем передней, что связывают с анатомически менее значительным объемом кровоснабжения первой из них в сравнении со второй. Разрыв папиллярной мышцы при остром инфаркте миокарда обычно наблюдается в сроки 2-5 дней от начала инфаркта.
Острая ишемическая МН может развиваться и при отсутствии явного разрыва папиллярных мышц. Ее возникновение в этих случаях связывают с остро возникающими при ишемии миокарда диссинергией сокращения ЛЖ, асимметричной дилатацией фиброзного кольца и со связанным с этими факторами нарушением расположения папиллярных мышц. Определенную роль в развитии такого варианта острой МН отводят дисфункции папиллярных мышц в результате их ишемизации.
Тактика ведения. При развитии острой выраженной МН показано проведение хирургического лечения (с предпочтительным выполнением клапансохраняю- щих вмешательств). На этапе подготовки к операции с целью уменьшения остро возникшей гипертензии в системе малого круга крово-обращения могут быть использованы артериальные вазодилататоры (нитропрус- сид натрия); при тяжелой системной гипотензии — ин- трааортальная баллонная контрпульсация.
Хроническая МН (ХМН)
Этиология. Выделяют ХМН, связанную с первичным поражением клапанных структур (органическую), и ХМН, обусловленную изменениями геометрии ЛЖ (функциональную, или относительную). Рассмотрим каждый из этих вариантов.
- Органическая ХМН с поражением створок МК может быть следствием: ревматизма (до 40 % случаев); инфекционного эндокардита (стадия склерозирования); дегенеративных поражений МК (пролапс МК, а также изменения МК при синдромах врожденной патологии соединительной ткани — Марфана, Элерса — Данлоса, несовершенного остеогенеза, при поликистозе почек); системных заболеваний соединительной ткани (ревматоидного артрита, системной красной волчанки, анки- лозирующего спондилита), болезней накопления (эндомиокардиального фиброза, карциноидного синдрома, гиперэозинофильного синдрома), инфильтративных заболеваний (амилоидоза, саркоидоза).
- Органическая ХМН с поражением хорд и папиллярных мышц может быть связана с их миксоматозной дегенерацией (при синдромах Марфана, Элерса — Данлоса и др., при пролапсе МК), с ревматизмом, хронической ишемической болезнью сердца.
- Функциональная ХМН (относительная) обусловлена изменениями геометрии ЛЖ. Ее основные причины: хроническая ИБС с развитием значительной ди- латации ЛЖ — ишемическая кардиомиопатия, постин- фарктная аневризма ЛЖ, дилатационная кардиомиопатия, миокардит с выраженной дилатацией ЛЖ.
Клинические проявления. Больные с минимальной и умеренной ХМН обычно бессимптомны. При тяжелой ХМН клинические проявления также могут отсутствовать в течение длительного времени. В последующем ухудшается переносимость физических нагрузок из-за появления слабости (обусловленной снижением эффективного сердечного выброса) и одышки (сначала умеренной); эти симптомы на начальных этапах достаточно быстро устраняются в покое. В части случаев могут быть представлены выраженная одышка при нагрузке, пароксизмальная ночная одышка, отек легких, кровохарканье. Возникновение этих тяжелых проявлений может быть спровоцировано эпизодом фибрилляции/ трепетания предсердий, быстрым увеличением степени МН (например, при разрыве хорды МК), развитием инфекционного эндокардита, появлением новых нарушений систолической и/или диастолической функции ЛЖ.
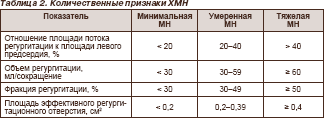
Диагностика (см. также Подходы к диагностике и оценке степени выраженности приобретенных пороков сердца). Как и при других рассмотренных выше приобретенных пороках сердца, в диагностике ХМН центральное место занимает эхокардиографическое исследование. Ниже представлены эхокардиографические критерии диагностики ХМН различной степени выраженности. Эхокардиографическое исследование используется для дифференциальной диагностики органической ХМН (с нарушениями створок МК) с ишемической ХМН (связанной с нарушением работы субвальвулярного аппарата МК — хорд и папиллярных мышц) и с функциональной (вторичной к значительной дилатации ЛЖ, например при дилатационной кардиомиопатии). Следует обратить внимание на то, что экспертами (ААК/ЕОК, 2006-2007) при ишемической ХМН предложены более низкие границы для определения тяжелой степени ре- гургитации, чем указано ниже. Наличие тяжелой ишемической ХМН устанавливается при уровнях площади эффективного регургитационного отверстия более 0,2 см2 и объема регургитации более 30 мл. Для больных с ишемической ХМН особую важность приобретает выполнение коронарной ангиографии, которая позволяет оценить возможность одновременного с вмешательством на МК выполнения процедур реваскуляризации.
Критерии диагностики ХМН различной степени выраженности (адаптировано из ААК/ЕОК, 20062007) Тяжелая ХМН Основные параметры:
- Ширина vena contracta > 0,7 см при наличии большого центрально расположенного потока митральной регургитации (площадью > 40 % площади левого предсердия) либо пристеночно расположенного потока любого размера, swirlingв левое предсердиеб.
- Большая конвергенция потока7.
- Обратный систолический поток в легочных венах.
- Отчетливый отрыв створки или разрыв папиллярной мышцы.
Вспомогательные параметры:
- Плотный треугольный (при использовании постоянно-волновой допплерографии) поток митральной регургитации.
- Доминирующая волна Е в приносящем тракте ЛЖ (E> 1,2 м/с)8.
- Увеличение размеров ЛЖ и левого предсердия9 (особенно если не снижена систолическая функция ЛЖ).
Показания к хирургическому лечению. Больным с острой МН, имеющим клинические проявления (одышку, отек легких), необходимо проведение ургентного оперативного лечения. Для больных с ХМН ниже представлены показания к хирургическому лечению. Обращаем внимание на то, что при уровнях фракции изгнания < 30 % оперативное вмешательство может улучшить симптомы, но его влияние на прогноз остается не- уточненным; поэтому решение в таких случаях принимается с учетом ответа на медикаментозную терапию, коморбидного фона и вероятности успеха органосохраняющей операции.
Среди вариантов хирургического лечения у больных с тяжелой органической, а также с ишемической ХМН предпочтительными считают органосохраняющие операции (они показывают лучший непосредственный и отдаленный прогноз в сравнении с протезированием МК).
Показания к хирургическому лечению ХМН (адаптировано из ААК/ЕОК, 2006-2007) Тяжелая органическая ХМН (вследствие поражения створок МК):
- Больные с наличием клинических проявлений (слабость, одышка, пароксизмальная ночная одышка) при уровнях фракции изгнания ЛЖ > 30% и значениях конечно-систолического размера ЛЖ < 55 мм (класс I, уровень доказательств В).
- Бессимптомные больные с уровнем фракции изгнания ЛЖ < 60 % и/или конечно-систолическим размером ЛЖ > 45 мм10(класс I, уровень доказательств С).
- Бессимптомные больные с сохранной систолической функцией ЛЖ (с уровнем фракции изгнания ЛЖ > 60 %) при наличии фибрилляции предсердий или легочной гипертензии (если уровень давления в легочной артерии > 50 мм рт.ст.) (класс На, уровень доказательств С).
- Больные с тяжелой дисфункцией ЛЖ (с уровнем фракции изгнания ЛЖ < 30 %) и/или со значением конечно-систолического размера ЛЖ > 55 мм, рефрактерные к медикаментозной терапии, если есть высокая вероятность успеха клапаносохраняющей операции и имеется низкий коморбидный фон (класс На, уровень доказательств С).
- Бессимптомные больные с сохранной систолической функцией ЛЖ, если есть высокая вероятность успеха клапаносохраняющей операции и имеется низкий операционный риск (класс ИЬ, уровень доказательств С).
Ишемическая МН (например, при разрыве папиллярных мышц):
- Больные с тяжелой ХМН при уровнях фракции изгнания ЛЖ > 30 %, которым одновременно выполняется аортокоронарное шунтирование (класс I, уровень доказательств С).
- Больные с умеренной ХМН, которым одновременно выполняется аортокоронарное шунтирование, если выполнима клапаносохраняющая операция (класс На, уровень доказательств С).
- Больные с тяжелой ХМН при наличии клинических проявлений (слабость, одышка, пароксизмальная ночная одышка), если уровень фракции изгнания ЛЖ < 30 % и имеется возможность для проведения реваску- ляризации (класс На, уровень доказательств С).
- Больные с тяжелой ХМН, если уровень фракции изгнания ЛЖ < 30 %, нет возможности для проведения реваскуляризации, но они рефрактерны к медикаментозной терапии и имеют низкий коморбидный фон (класс ИЬ, уровень доказательств С).
Функциональная, или относительная, ХМН (вследствие выраженной дилатации ЛЖ, например, при дилатационной кардиомиопатии):
- Основний вариант оперативного вмешательства — рестриктивная аннулопластика.
- Это вмешательство не должно выполняться у крайне тяжелых больных, имеющих низкий сердечный выброс, тяжелую правожелудочковую недостаточность, значительный коморбидный фон.
Медикаментозная терапия. В случаях острой МН уменьшение давления в левых камерах сердца может быть достигнуто применением нитратов и диуретиков. При необходимости могут применяться нитропруссид (снижает преднагрузку и уменьшает фракцию регургитации), а также инотропные препараты (допамин и добутамин).
Все больные с ХМН, имеющие постоянную или пароксизмальную форму фибрилляции предсердий, тромбы в левом предсердии, перенесенные ранее эпизоды системных эмболий, должны получать пероральные антикоагулянты (варфарин) с целевыми уровнями международного нормализующего отношения в пределах 2,0-3,0.
У больных с ХМН, не имеющих клинических проявлений ХСН, в настоящее время нет оснований для использования вазодилататоров, включая ингибиторы АПФ. В то же время при развитии симптомов ХСН у лиц с ХМН (если имеются противопоказания к оперативному лечению) могут использоваться ингибиторы АПФ, диуретики, в-адреноблокаторы, спиронолактон. В некоторых случаях может быть оправданно применение сердечных гликозидов (особенно у больных с фибрилляцией/трепетанием предсердий, а также у имеющих отчетливое снижение фракции изгнания ЛЖ). Профилактика инфекционного эндокардита требуется больным с ХМН в соответствии с имеющимися рекомендациями (см. Основные принципы антибактериальной профилактики инфекционного эндокардита у больных с приобретенными пороками сердца).
Длительное наблюдение. Бессимптомные больные с умеренной ХМН при сохранной систолической функции ЛЖ требуют ежегодных визитов к врачу и выполнения эхокардиографического исследования с частотой 1 раз в год. Бессимптомные лица с тяжелой ХМН и сохранной систолической функцией ЛЖ должны осматриваться 1 раз в 6 месяцев, эхокардиографическое исследование следует повторять не реже 1 раза в год (наблюдение должно быть более частым у больных с более значительными изменениями структуры клапанов и левых камер сердца, а также у больных, имеющих отчетливые изменения клинических и эхокардиографических параметров по сравнению с предыдущим визитом). Эти больные должны быть тщательно инструктированы о необходимости быстрого обсуждения с врачом любых возникающих изменений самочувствия, которые могли бы быть связаны с ХМН.
Митральный стеноз
Митральный стеноз (МС) представляет собой обструкцию приносящего тракта ЛЖ на уровне МК.
Этиология. Основной причиной МС является ревматизм. Связь МС с ревматизмом столь постоянна, что в подавляющем большинстве случаев при выявлении МС у взрослого можно говорить о ревматической природе МС (J.S. Alpert et al., 2000), даже с учетом того, что более чем у половины таких больных в анамнезе отсутствуют эпизоды острой ревматической лихорадки. Редкие причины МС включают: врожденный стеноз (с формой МК в виде парашюта или воронки), кальцификацию фиброзного кольца МК, ревматоидный артрит, инфекционный эндокардит (при наличии выраженных вегетаций). Клинические проявления. Одышка, связанная с
повышением давления в левом предсердии и малом круге крово¬обращения, обычно демонстрирует отчетливую связь с площадью отверстия МК: при уровнях площади более 2,5 см2 одышка отсутствует; при площади в пределах 1,5–2,5 см2 она возникает при нагрузке; при значениях менее 1,5 см2 одышка присутствует в покое, может сопровождаться орто-пноэ, эпизодами пароксизмальной ночной одышки, отеком легких, кровохарканьем. При выраженном снижении сердечного выброса (развивающемся вследствие ухудшения наполнения ЛЖ) в клинической картине представлена значительная общая слабость. У больных с тяжелой гипертен-
зией в малом круге кровообращения развиваются клинические проявления правожелудочковой недостаточности (расширение вен шеи, гепатомегалия, периферические отеки). Одним из частых осложнений у больных с МС, в том числе и бессимптомных, является фибрилляция предсердий, у 56 % носящая пароксизмальный характер по данным холтеровского мониторирования. В 95 % случаев эпизоды фибрилляции предсердий не сопровождаются клиническими проявлениями.
Тромбоэмболии у пациентов с МС — наиболее серьезное осложнение, которое может стать первым проявлением заболевания более чем у 20 % пациентов, при этом в 30-40 % случаев выявляются тромбоэмболии в бассейне сосудов головного мозга. Частота тромбоэмболических осложнений увеличивается с возрастом, при наличии фибрилляции предсердий, дилатации левого предсердия и ассоциируется с более выраженным стенозом отверстия МК.
Диагностика (см. также Подходы к диагностике и оценке степени выраженности приобретенных пороков сердца). Ведущим методом оценки структурных особенностей МК при МС, а также степени выраженности сте- нозирования является эхокардиографическое исследование. Далее представлены особенности эхокардиографической диагностики МС.
Эхокардиографическая диагностика МС (адаптировано из ААК/ЕОК, 2006-2007)
- Степень выраженности стенозирования следует оценивать с использованием двух основных методов: двухмерной планиметрии и метода pressurehalf-time; эти методы дополняют друг друга при оценке площади отверстия МК. Планиметрия (при возможности ее выполнения) является методом выбора, особенно сразу после чрескожной митральной комиссуротомии.
- Измерения среднего трансваль- вулярного градиента (на основании допплеровской оценки скоростей потока через МК) в значительной степени зависят от частоты сердечных сокращений и от уровней пред- и постнагрузки; однако они могут использоваться для серийной оценки степени выраженности стенозирования, особенно у больных с синусовым ритмом.
- У больных с МС обычно не наблюдаются клинические проявления (одышка при нагрузке, пароксизмальная ночная одышка) в покое при уровнях площади отверстия МК > 1,5 см2, за исключением лиц с особенно большим размером тела.
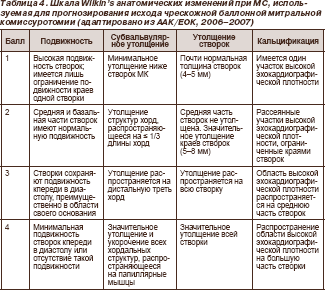
- При отборе больных для чрес-кожной митральной комиссуро- томии большое значение имеет оценка структурных особенностей МК. Для оценки его подвижности, кальцификаций, субвальвулярных деформаций и других характеристик широкое распространение получили различные шкалы (табл. 3, 4).
- Эхокардиографическое исследование используется для оценки уровней давления в легочной артерии, установления наличия сопутствующих клапанных поражений, измерения размера левого предсердия.
- Чреспищеводное эхокардиографическое исследование следует применять для выявления тромбов в левом предсердии перед выполнением чрес-кожной митральной комиссуро- томии, после перенесенных эпизодов системных эмболий, при наличии сопутствующей митральной регургитации, а также при недостаточно высоком качестве визуализации при выполнении трансторакальной эхокардиографии.
Среди вмешательств на МК доминирует чрескожная баллонная митральная комиссуротомия, показания и противопоказания к которой представлены далее. Эксперты (ААК/ЕОК, 2006-2007) указывают, что большинство больных, имеющих клинические проявления (одышку при нагрузке, пароксизмальную ночную одышку) при наличии подходящих клинико-анатомических особенностей МК должны подвергаться этому вмешательству. Для лиц с клинико-анатомическими особенностями МК, при которых успех чрескожной баллонной митральной комиссуротомии менее вероятен (см. Показания к чрескожной баллонной митральной комиссуротомии при МС с площадью отверстия < 1,5 см[1]) , а также для лиц с противопоказаниями к ее проведению (см. Противопоказания к чрес-кожной баллонной митральной комиссуротомии при МС с площадью отверстия < см2) резервируется хирургическое лечение; чаще всего это протезирование МК.
Показания к чрескожной баллонной митральной комиссуротомии при МС с площадью отверстия 1,5 < см2 (адаптировано из ААК/ЕОК, 2006-2007)
- Больные с клиническими проявлениями, имеющие клинико-анатомические особенности МК, подходящие для проведения чрескожной баллонной митральной ко- миссуротомии11 (класс I, уровень доказательств В).
- Больные с клиническими проявлениями, имеющие противопоказания к проведению оперативного лечения или при высоком риске такого лечения (класс I, уровень доказательств С).
- Как начальное лечение у больных с клиническими проявлениями при наличии подходящих для проведения чрескожной митральной комиссуротомии клинических, но не анатомических характеристик (класс 11а, уровень доказательств С).
- Бессимптомные больные, имеющие клиникоанатомические особенности, подходящие для проведения чрескожной баллонной митральной комиссу- ротомии при наличии высокого риска тромбоэмболий или высокого риска гемодинамической декомпенсации (класс 11а, уровень доказательств С):
а) с перенесенными ранее эмбо-лиями;
б) с феноменом спонтанного эхоконтраста в левом предсердии;
в) с пароксизмальной фибрилляцией предсердий;
г) с систолическим давлением в легочных венах > 50 мм рт.ст. в покое;
д) нуждающиеся в крупных некардиальных хирургических вмешательствах;
е) желающие иметь беременность.
Противопоказания к чрескожной баллонной митральной комиссуротомии при МС с площадью отверстия < 1,5 см2 (адаптировано из ААК/ЕОК, 20062007)
- Площадь отверстия МК > 1,5 см;
- наличие тромба в левом предсердии;
- митральная недостаточность более чем минимальной степени;
- кальцификация МК: тяжелая или затрагивающая две комиссуры;
- отсутствие спаяния (fusion) комиссур;
- сопутствующие тяжелое поражение аортального клапана или тяжелое комбинированное поражение трикуспидального клапана;
- сопутствующее поражение коронарных артерий, требующее проведения аортокоронарного шунтирования.
Медикаментозное лечение. Для транзиторного уменьшения степени выраженности одышки могут быть использованы диуретики и нитраты пролонгированного действия. в-адреноблокаторы и замедляющие ЧСС бло- каторы кальциевых каналов (верапамил, дилтиазем) используются для снижения частоты ритма; они могут значительно улучшать переносимость физических нагрузок путем увеличения продолжительности диастолы и тем самым увеличения времени для наполнения ЛЖ через сте- нозированное отверстие МК. Больным с МС при наличии постоянной или пароксизмальной форм фибрилляции предсердий показано проведение лечения пероральны- ми антикоагулянтами (варфарином) с целевыми уровнями международного нормализующего отношения в пределах 2,5-3,0. Пероральные антикоагулянты показаны также больным, имеющим: эпизоды системных эмболий в анамнезе; тромб в полости левого предсердия; феномен спонтанного эхоконтрастирования в левом предсердии по данным чреспищеводного эхокардиографического исследования; дилатацию левого предсердия (> 50 мм). При фибрилляции предсердий кардиоверсия с восстановлением синусового ритма (без выполнения вмешательства на МК) не является показанной у больных с тяжелым МС — после ее проведения синусовый ритм обычно не удерживается на значительный период времени. Если фибрилляция предсердий имеет небольшую давность, а левое предсердие лишь умеренно увеличено, кардиоверсия может выполняться вскоре после проведения успешного вмешательства на МК. Поддержание синусового ритма после его восстановления осуществляется с использованием противоаритмических препаратов !с или III классов.
Больным с МС показаны профилактика ИЭ (см. Основные принципы антибактериальной профилактики инфекционного эндокардита у больных с приобретенными пороками сердца) и профилактика ревматизма (ревматической лихорадки).
Длительное наблюдение. Бессимптомные больные с клинически значимым МС, которые не являются кандидатами для оперативного лечения, должны осматриваться ежегодно с выполнением эхокардиографического исследования; при меньшей степени выраженности МС возможно наблюдение с более длительными интервалами. Ведение больных после успешной чрескожной митральной комиссуротомии подобно тому, что указано выше для бессимптомных больных. При отсутствии успеха чрескожной митральной комиссуротомии требуется раннее выполнение хирургического вмешательства (при отсутствии явных противопоказаний).
5Уровень сократительного резерва ЛЖ устанавливается при выполнении низкодозового добутаминового стресс- эхокардиографического теста (этот резерв считается значимым в случае увеличения ударного объема в ходе этого теста более чем на 20 %). После оперативного лечения необходимо выполнить следующие исследования: рентгеновское органов грудной клетки, электро- и эхокардиографическое; их данные будут необходимы при последующем наблюдении за больным.
6При уровнях Nyquist limit в пределах 50-60 см/с.
7При радиусе конвергенции потока > 0,9 см для центрально расположенного потока, уровни для эксцентрично расположенных потоков могут быть выше.
“Обычно в возрасте более 50 лет или при состояниях с нарушенным расслаблением ЛЖ, в отсутствие митрального стеноза или других причин повышения давления в левом предсердии.
9При отсутствии других причин развития дилатации ЛЖ или левого предсердия, а также при отсутствии острой МН.
10Меньшие значения конечно-систолическо-го размера ЛЖ могут приниматься во внимание у лиц с небольшим размером тела. После оперативного лечения необходимо выполнить: рентгеновское исследование органов грудной клетки, электро- и эхокардиографическое исследования; их данные будут необходимы при последующем наблюдении за больным.
11Для проведения чрескожной баллонной митральной комиссуротомии необходимо отсутствие некоторых клинических (пожилой возраст, перенесенные ранее комиссуротомии, ХСН IV функционального класса, фибрилляция предсердий, тяжелая легочная гипертензия) и анатомических (> 8 баллов по шкале Wilkin’s, группа 3 по шкале Cormier, очень малая площадь отверстия МК, тяжелая трикуспидаль- ная регургитация) характеристик.
1После оперативного лечения необходимо выполнить следующие исследования: рентгеновское органов грудной клетки, электро- и эхокардиографическое; их данные будут необходимы при последующем наблюдении за больным.
[1]Группа особенно высокого риска.
Чувствительность микробной флоры к гентамицину в странах СНГ весьма низкая, следует использовать альтернативный антибиотик (возможно, амикацин).














Комментировать