Классификация и основные причины холестаза. Диетотерапия. Этиологическое лечение. Билиарная декомпрессия. Патогенетическая терапия. Лечение внепеченочных проявлений и осложнений хронического холестаза.
А. Ю. Барановский*, доктор медицинских наук, профессор К. Л. Райхельсон*, кандидат медицинских наук, доцент Н. В. Семенов*, кандидат медицинских наук, доцент Е. Г. Солоницин**, кандидат медицинских наук *ГБОУ ВПО СЗГМУ им. И. И. Мечникова Минздравсоцразвития России, **ФГБУ ГКБ № 122 им. Л. Г. Соколова ФМБА России, Санкт-Петербург
Под холестазом (cholestasis; греч. chole желчь + stasis стояние) понимают уменьшение или полное прекращение оттока желчи вследствие нарушения ее образования, экскреции и/или выведения. Патологический процесс может локализоваться на любом участке от синусоидальной мембраны гепатоцита до дуоденального сосочка.
Напомним, что формирование желчи происходит в несколько этапов:
1) захват из крови ряда ее компонентов (желчные кислоты, билирубин, холестерин и др.) на уровне базолатеральной мембраны гепатоцитов; метаболизм, а также син- тез новых составляющих и их транспорт в цитоплазме гепатоцитов;
2) выделение желчи через каналикулярную (билиарную) мембрану гепатоцитов в желчные канальцы;
3) дальнейшее формирование желчи в желчевыводящих путях, а в конечном счете, и в кишечнике [3, 7].
В функциональном отношении холестаз означает снижение канальцевого тока желчи, печеночной экскреции воды и органических анионов (билирубина, желчных кислот). При выраженном холестазе может происходить «обратное поступление» в гепатоцит (а в большинстве случаев в кровь) веществ, которые должны выделяться с желчью. В результате желчь накапливается в гепатоцитах и гипертрофированных клетках Купфера (так называемый клеточный билирубиностаз) и в расширенных каналикулах (каналикулярный билирубиностаз).
При внепеченочном холестазе желчь находится в расширенных междольковых желчных протоках (дуктулярный билирубиностаз) и паренхиме печени в виде «желчных озер». Холестаз, существующий в течение нескольких дней, вызывает потенциально обратимые ультраструктурные изменения. Персистирующий холестаз с сопутствующим воспалением и реакцией соединительной ткани ведет к необратимому холестазу, а через месяцы/годы к развитию билиарного фиброза и цирроза.
Классификация и основные причины холестаза
Различают вне- и внутрипеченочный холестаз (табл. 1).
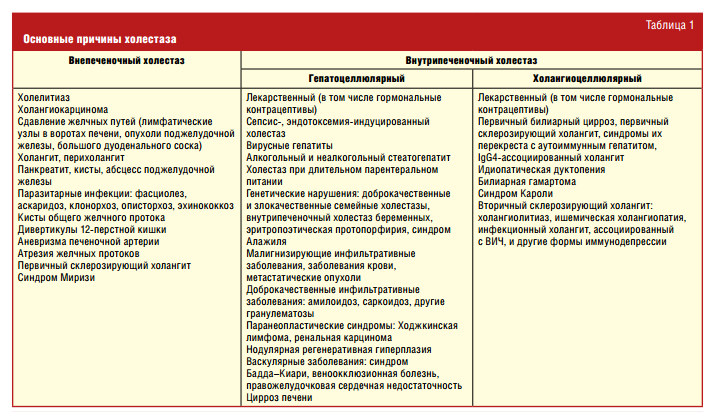
В первом случае речь идет о механической желтухе, при которой происходит обструкция и/или механическое повреждение внепеченочных желчных протоков. Внутрипеченочный холестаз обусловлен нарушением образования и транспорта желчи в гепатоцитах или повреждени- ем внутрипеченочных желчных про- токов (либо сочетанием этих механиз- мов) [6]. Внутрипеченочный холестаз подразделяется на интралобулярный холестаз, обусловленный поражени- ем гепатоцитов (гепатоцеллюлярный) и канальцев (каналикулярный), и экстралобулярный (дуктулярный), связанный с поражением внутрипеченочных желчных протоков [7].
Патогенез холестаза при механической обструкции очевиден и не требует детального рассмотрения. Что же касается внутрипеченочного холестаза, то его развитие имеет многофакторный характер. Основные его причины и механизмы развития представлены в табл. 2.
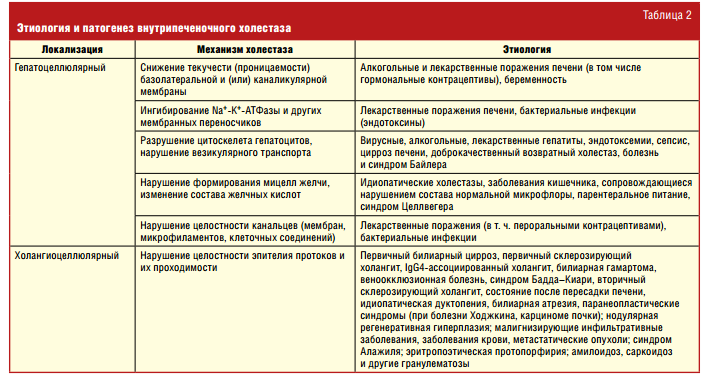
Как видно из табл. 2, патогенез внутрипеченочного холестаза носит многофакторный характер:
- нарушение функций базолатеральной, синусоидальной и каналикулярной мембран. В основе этого явления могут лежать нарушения гепатобилиарного транспорта, такие как мутации генов белков‑транспортеров и приобретенные дисфункции транспортных систем, обусловливающие нарушение каналикулярной или холангиоцеллюлярной секреции;
- изменение состава и текучести плазматических мембран гепатоцитов оказывает влияние на активность ферментов и рецепторов. Мембранная текучесть определяется соотноше- нием фосфолипидов к холестерину. Сниженная мембранная текучесть обычно связана с повышенным содержанием холестерина, что имеет место при лекарственном холестазе (эстрогены, анаболические стероиды);
- нарушение цитоскелета гепатоцитов, которые приводят к исчезновению микроворсинок на апикальной поверхности гепатоцитов, снижению сократимости каналикулярной мембраны, а также могут служить причиной повышенной проницаемости межклеточных плотных контактов и приводят к обратному току желчи в синусоиды [7]; детергентное действие желчных кислот, накопление которых приводит к повреждению клеточных мембран, накоплению цитозольного кальция, активации внутриклеточных гидролаз и некрозу гепатоцитов.
Желчные кислоты ингибируют регенерацию гепатоцитов, активизируют фиброгенез, индуцируют экспрессию антигенов класса III главного комплекса гистосовместимости, предрасполагая к развитию аутоиммунных повреждений. Кроме того, они способствуют накоплению свободных радикалов, которые, в свою очередь, запускают активацию каспаз, что в конечном итоге ведет к апоптозу клеток билиарного эпителия.
Заметим, что большинство из перечисленных выше факторов приводят к снижению активности S-аденозилметилсинтетазы, вследствие чего нарушается продукция S-адеметионина. Последнее усугубляет течения биохимических процессов в гепатоците; в гепатоцеллюлярных мембранах снижается содержание фосфолипидов, падает активность Na+-К+- АТФазы и других белков‑переносчиков, что также влияет на текучесть мембран, захват и выведение компонентов желчи. Уменьшаются клеточные запасы тиолов и сульфатов (глутатиона, таурина и др.) [1], которые являются главными детоксикационными субстанциями, а также обладают выраженным антиоксидантным эффектом. Их дефицит обусловливает, в конечном итоге, цитолиз гепатоцитов при холестазе любого генеза [8].
Клинические проявления холестаза однотипны и не зависят от этиологии и механизмов его развития. Они обусловлены следующими факторами:
1) уменьшением количества или отсутствие желчи в кишечнике;
2) избыточным поступлением элементов желчи в кровь;
3) воздействием компонентов желчи на печеночные клетки и канальцы.
Основным клиническим симптомом холестаза считается кожный зуд, который встречается не всегда. При сочетании холестаза с желтухой может отмечаться соответствующая окраска кожных покровов, потемнение мочи и изменение окраски кала. На коже больных кроме следов расчесов (спутников кожного зуда), можно увидеть и другие маркеры холестаза: сухость, гиперпигментацию, ксантомы и ксантелазмы. Длительно существующий холестаз, сопровождаясь стеатореей, приводит к нарушению всасывания жиров с развитием дефицита жирорастворимых витаминов, чаще всего выражающихся в развитии печеночной остеодистрофии. С формированием билиарного цирроза появляются также признаки портальной гипертензии и печеночноклеточной недостаточности.
Печеночно-клеточная недостаточность развивается в среднем через 3–5 лет от начала возникновения холестатической желтухи. При некоторых заболеваниях (таких как первичный билиарный цирроз) портальная гипертензия может опережать формирование цирроза, формируясь по пресинусоидальному механизму.
Лабораторная диагностика холестаза направлена на выявление в сыворотке крови компонентов желчи либо признаков повреждения каналикулярных мембран гепатоцитов или билиарного эпителия. Лабораторными маркерами холестаза являются:
- щелочная фосфатаза (билиарный изофермент),
- лейцинаминопептидаза,
- гамма-глютамилтранспептидаза,
- 5’-нуклеотидаза.
Также может наблюдаться повышение желчных кислот, билирубина, холестерина.
Рассмотрим основные направления терапии, оперативного лечения и немедикаментозных воздействий на холестаз и его последствия.
Диетотерапия
Дефицит солей желчных кислот в просвете кишечника диктует особенности диеты при холестазе. Наряду с адекватным потреблением белка и калорий пациентам рекомендуется ограничение жиров до 40 г/сут. При необходимости жировой компонент пищи может восполняться энтеральными смесями, содержащими среднецепочечные триглицериды, которые перевариваются и абсорбируются в кишечнике даже при условии отсутствия желчных кислот.
Стеаторея определяет необходимость обогащения пищи жирорастворимыми витаминами и кальцием (либо дополнительное назначение в виде лекарственных препаратов) [6]. Существуют рекомендации по ограничению потребления меди, поскольку она накапливается при холестазе в печени, однако они весьма спорны.
Этиологическое лечение
Этиотропная терапия разработана для ограниченного количества печеночных заболеваний, как правило, инфекционных. Если говорить о преимущественно холестатических заболеваниях, то несомненны успехи хирургических вмешательств, направленных на декомпрессию желчной системы.
Билиарная декомпрессия
Как лапароскопические, так и лапаротомные операции по-прежнему не теряют своей актуальности. Постепенно, с развитием малоинвазивных технологий, частота «больших» операций снижается. Ведь объемная операция это более серьезная травма для организма; кроме того, при эндоскопических методах сохраняется возможность для повторных, в том числе малоинвазивных вмешательств. Поэтому в большинстве случаев наши европейские и американские коллеги рассматривают эндоскопические способы лечения механической желтухи как методы первой линии. С их помощью, например, удается разрешить до 94% случаев обтурации желчных протоков, вызванных различными причинами.
В клиниках, где выполняется большое количество эндобилиарных вмешательств (по данным европейских исследований — более 40 в год), процент осложнений значительно ниже, чем в центрах, которые выполняют меньшее количество манипуляций. Выбор способа устранения обструкции желчных протоков зависит от причины, вызвавшей желтуху.
Принципиально можно выделить следующие способы эндоскопического пособия:
- папиллэктомия (удаление образований большого дуоденального соска (БДС));
- рассечение стриктуры;
- удаление причины желтухи (конкремент, паразиты, стент);
- дилатация стриктуры (баллонная, бужирование);
- стентирование (пластиковыми или металлическими саморасправляющимися стентами);
- фотодинамическая терапия;
- эндоультрасонографические (ЭУС) методики (холедохостомия, вирсунгостомия, дренирование кисты, абсцесса).
Разберем возможности каждого из методов. Папиллэктомия применяется при доброкачественных образованиях БДС, вызвавших нарушение оттока из желч- ных или панкреатических протоков или имеющих высокий риск малигнизации. После удаления БДС выполняется стентирование холедоха и главного протока поджелудочной железы, для предотвращения отека устьев и развития рубцовых стенозов [13, 16].
Рассечение стриктуры применяется в случаях, когда доброкачественная неопухолевая стриктура расположена в терминальном отделе протоков, не выше интрамуральной части. Фактически выполняется эндоскопическая папиллосфиктеротомия (ЭПСТ), которая может выполняться стандартным способом, после предрассечения, или носить форму супрапапиллярной холедохотомии. В случае если не удается заканюлировать холедох непосредственно через устье, выполняется предрассечение БДС от устья, с помощью торцевого (игольчатого) папиллотома.
Данная методика является более опасной и трудновыполнимой, особенно для начинающих эндоскопистов. В ряде случаев, когда стриктура находится на уровне устья БДС или его ампулы, верхняя часть продольной складки может выбухать. В этих случаях выполняется рассечение выступающей части, без рассечения непосредственно устья БДС. Такая методика называется супрапапиллярная холедохотомия. Практически любая лечебная манипуляция на желчных протоках, особенно если планируется повторение манипуляций (например, для замены стентов), начинается с облегчения последующего доступа, то есть выполнения ЭПСТ. Иногда, чаще всего при холелитиазе, можно полностью устранить причину желтухи.
Литоэкстракция может быть выполнена с помощью достаточно большого количества эндоскопических инструментов. Если конкремент большого размера, то предварительно выполняется его литотрипсия. К более эксклюзивным методам лечения холедохолитиаза относятся лазерная литотрипсия и электрогидравлическая литотрипсия.
Эти методики применяются во время холангиоскопии. Однако в рутинной клинической практике они используются редко, из-за большой трудоемкости и высокой стоимости. Понашим данным более 96% конкрементов, даже больших размеров, могут быть извлечены эндоскопически. На сегодняшний день большой размер конкремента не является противопоказанием для выполнения эндоскопической литоэкстракции. Казуистической причиной желтухи могут стать гельминты.
Выполнение ЭПСТ, извлечение видимых крупных паразитов и дальнейшее медикаментозное лечение приводит к излечению от заболевания. Если стриктура расположена выше интрамуральной части холедоха, требуется ее расширение. Для этого в эндоскопии применяют два метода: баллонная дилатация и бужирование.
В зависимости от генеза стриктуры ее дилатация может быть окончательным или этапным методом лечения. В большинстве же случаев при доброкачественных стриктурах (стриктура холедохо-холедохеального анастомоза, билиодигестивного анастомоза, после холедохтомии, ишемические стриктуры у больных после пересадки печени) требуется несколько сеансов дилатации в тече- ние 1–2 лет. При этом между манипуляциями в область стриктуры устанавливаются временные эндобилиарные стенты для предотвращения их сужения.
При злокачественных стриктурах дилатация может быть выполнена как этап манипуляции при стентировании или фотодинамической терапии. Стентирование желчных протоков выполняется пластиковыми либо нитиноловыми стентами. Оба вида имеют свои преимущества и недостатки. Пластиковые стенты достаточно быстро в течение 2–5 месяцев забиваются густым желчным содержимым. Закупорка стентов снова приводит к нарастанию желтухи и развитию холангита. С другой стороны, эти стенты легко извлекаются и могут быть заменены на новые.
Реканализация пластиковых стентов возможна, но не целесообразна. Нитиноловые (металлические) саморасправляющиеся стенты бывают покрытые и непокрытые. Эти стенты могут функционировать значительно дольше пластиковых (до 1–2 лет), однако их извлечение и замена бывают значительно более сложной задачей. Установка саморасправляющихся стентов может быть рекомендована у пациентов с неблагоприятным прогнозом, предполагаемая продолжительность жизни которых не превышает 1 год (метастатическое поражение ворот печени, неоперабельные опухоли поджелудочной железы и желчных протоков). Еще одной отрицательной стороной нитиноловых стентов является их высокая стоимость [17, 25, 27].
Фотодинамическая терапия — метод, заключающийся во внутривенном введении фотосенсибилизатора, который избирательно накапливается в тканях опухоли. В результате объем образования уменьшается, устраняется закупорка желчных протоков. Доказана эффективность и безопасность этого метода при холангиокарциноме [18, 24]. Методика является очень трудоемкой и дорогостоящей, поэтому пока не нашла широкого применения в клинической практике в Российской Федерации. С развитием эндоскопической ультрасонографии (ЭУС) развиваются и лечебные пункционные методы, выполняемые под контролем эндоскопического ультразвука. Так, для устранения механической желтухи в литературе описаны способы холедохо- и холестомии под контролем эндоскопической ЭУС.
Метод заключается в пункции под ультразвуковым контролем расширенных желчных протоков или желчного пузыря через стенку двенадцатиперстной кишки или желудка, с последующим их стентированием. Фактически формируются билидигестивные анастомозы. Бывают ситуации, когда холедох сдавлен кистой поджелудочной желе- зы. В этом случае может быть выполнено дренирование кисты под ЭУС- контролем. Краткий обзор эндоскопических методов диагностики и лечения механической желтухи показывает значительный прогресс в этом направлении за последнее время.
Патогенетическая терапия
Урсодезоксихолевая кислота (УДХК). Единственным общепринятым препаратом для лечения большинства хронических холестатических заболеваний является УДХК.Способность лечить холестаз считается наиболее ценным свойством этого лекарственного средства. УДХК является конкурентом токсичных желчных кислот при абсорбции в тонкой кишке, а также на мембране гепатоцитов и холангиоцитов.
Считается, что положительное влияние УДХК на течение хронического холестаза прежде всего связано со снижением повреждения холангиоцитов токсичными желчными кислотами (за счет подавления их секреции и уменьшения пула путем снижения их всасывания в подвздошной кишке). Кроме того, УДХК стимулирует транспорт желчных кислот и органических анионов в гепатоцитах и холангиоцитах. Она влияет на ряд процессов, связанных с белками-транспортерами гепатоцита: их транскрипционную регуляцию; включение в апикальную мембрану; фосфорилирование и дефосфолирирование в местах действия; а также воздействует на процессы экзоцитоза (путем активации кальцийзависимой альфа-протеинкиназы) и экспрессию транспортных систем в билиарном эпителии (бикарбонатный холерез).
Собственно цитопротективное действие УДХК при холестазе определяется ее способностью, образуя двойные молекулы, взаимодействующие с липофильными мембранными структурами, встраиваться в клеточную мембрану, повышая устойчивость к токсическим воздействиям гепатоцитов, холангиоцитов и эпителиоцитов желудочно-кишечного тракта. Иммуномодулирующие свойства УДХК обусловлены преимущественно снижением пула токсичных желчных кислот, которые при холестазе индуцируют экспрессию молекул HLA I и II класса на мембранах гепатоцитов и холангиоцитов, что способствует их распознаванию с последующей деструкцией цитотокси- ческими Т-лимфоцитами.
Длительный прием УДХК угнетает экспрессию HLA- антигенов на мембранах гепатоцитов и холангиоцитов, нормализует активность цитотоксических Т-лимфоцитов, влияет на экспрессию дипептидилпептидазы-4 и образование интерлейкина-2, уменьшает повышенное содержание эозинофилов, снижает синтез иммунокомпетентного IgM в сочетании с уменьшением продукции аутоантител. Дополнительными механизмами воздействия УДХК могут служить ингибирование апоптоза холангиоцитов и гепатоцитов (влияя прежде всего на выход цитохрома С из митохондрий в цитозоль и запуск каскада каспаз) и антиоксидантные свойства, изменение метаболизма простагландинов и жирных кислот, влияние на регенерацию печени. Антифибротический эффект УДХК обусловлен снижением содержания активаторов фиброгенеза и непосредственным угнетением активности звездчатых клеток. Предполагается влияние УДХК на индукцию цитохрома CYP3A4, что должно иметь значение для метаболизма желчных кислот и многих ксенобиотиков [2, 5].
Многообразие эффектов УДХК определяет достоверное уменьшение прогрессирования фиброза при ряде заболеваний печени. Наиболее убедительно доказано положительное действие УДХК при таком истинно холестатическом заболевании, как первичный билиарный цирроз. В комбинированном анализе французских, канадских и северо-американских когорт больных при 2–4‑летнем наблюдении отмечено снижение смертности и необходимости трансплантации печени в группах с умеренным и тяжелым течением заболевания [34].
«Барселонское» исследование 192 пациентов, получавших УДХК сроком 1,5–14 лет, показало, что выживаемость у «ответчиков» на УДХК (ответ оценивался по уровню снижения щелочной фосфатазы) была выше предсказанной по прогностической модели Мейо и соответствовала популяционной [33].
Доза УДХК 13–15 мг/кг/сут при большинстве холестатических заболеваний имеет преимущество по биохимическому ответу и стоимости в сравнении с низкими и высокими дозами [10]. Исключением является муковисцидоз, где рекомендуются дозы 20–30 мг/кг/сут [19].
При первичном склерозирующем холангите рекомендуемые дозы не определены. Имеются данные о положительном влиянии УДХК на лекарственный холестаз, в том числе обусловленный одним из наиболее часто вызывающих гепатотоксичность препаратов — амоксициллином/клавунатом [28].
Европейская ассоциация по изучению болезней печени (EASL, 2009) при лечении холестатических заболеваний рекомендует обязательное назначение УДХК в качестве базисной терапии при ряде болезней печени: первичном билиарном циррозе, первичном склерозирующем холангите, муковисцидозе, прогрессирующем фамильном холестазе 3‑го типа (PFIC 3), внутрипеченочном холестазе беременных и обсуждает ее назначение при лекарственном холестазе и доброкачественном семейном холестазе.
На сегодня оригинальный препарат УДХК — Урсо (Япония) в России отсутствует. В этой ситуации при выборе генерических препаратов, широко представленных на отечественном фармацевтическом рынке, следует руководствоваться прежде всего соотношением «цена/качество».
Появившийся в последние годы отечественный препарат УДХК Урдокса по нашим клиническим впечатлениям не уступает ранее зарегистрированным в нашей стране генерическим формам. S-аденозил-L-метионин (SAMe) также применяется при ряде заболеваний печени в качестве антихолестатического средства. Его участие в процессах сульфатирования, в т.ч. желчных кислот и таурина, приводит к уменьшению пула токсичных свободных желчных кислот, что улучшает выведение их из гепатоцита и способствует их элиминации почками.
Участие в синтезе структурных белков и фосфолипидов обеспечивает стабилизацию мембран клеток и митохондрий и тем самым улучшает функционирования транспортных систем. Имеются экспериментальные данные о том, что SAMe уменьшает апоптоз, индуцированный желчными кислотами, хотя и в меньшей степени, чем УДХК [12].
Эффективность SAMe была показана у пациентов с хроническим холестазом различного генеза [20, 21]. В рандомизированных клинических исследованиях он продемонстрировал способ- ность увеличивать продолжительность жизни пациентов с алкогольным циррозом печени [30].
EASL (2009) обсуждает его назначение при внутрипеченочном холестазе беременных в качестве препарата второй линии. В экспериментальных работах SAMe предотвращал холестаз, вызванный эстрогенами. В рандомизированном исследовании [32], включавшем 72 пациента с псориазом, показана возможность SAMe профилактировать гепатотоксичное действие циклоспорина А, который ингибирует транспорт желчных кислот и редуцирует билиарный глутатион.
Антидепрессивный эффект SAMe определяется повышением уровня серотонина, что может сближать его по эффектам с применяющимся при холестаз-индуцированном кожном зуде сертралином.
Глюкокортикостероиды (ГКС) снижают уровень билирубина при печеночно-клеточной желтухе (преднизолоновая проба), но не оказывают влияния собственно на холестаз. Их назначение может уменьшать такие симптомы, как кожный зуд. В то же время прием ГКС приводит к резкому снижению минеральной плотности костной ткани, увеличивая риск развития остеопороза, а также повышает риск развития других неблагоприятных явлений. Поэтому ГКС рекомендуются при ограниченном числе холестатических заболеваний, где иммуносупрессия оказывает основное патогенетическое воз- действие (IgG4‑холангиопатия, аутоиммунный гепатит).
Агонисты ядерных рецепторов. В 2011 году объявлено об успехе II фазы клинического исследования препарата нового класса — обетихолевой кислоты (Obeticholic Acid or INT- 747), являющейся агонистом фарнесоидных Х-рецепторов (Farnesoid X receptor (FXR)). Монотерапия этим препаратом у 59 пациентов с первичным билиарным циррозом в течение 12 недель приводила к значительному снижению щелочной фосфатазы в сравнении с плацебо. Это наиболее вероятный кандидат на место нового эффективного препарата в лечении первичного билиарного цирроза.
Трансплантация печени остается единственным методом лечения пациентов при прогрессирующем течении заболевания и развитии печеночной декомпенсации либо малигнизации. На более ранних стадиях хронических холестатических заболеваний в качестве показаний для включения в лист ожидания могут рассматриваться инвалидизирующая слабость, резистентный кожный зуд, тяжелый остеопороз.
Лечение внепеченочных проявлений
Основными внепеченочными проявлениями холестаза являются утомляемость и кожный зуд.
Лечение кожного зуда. Европейская и Американская ассоциации по изучению болезней печени единодушны в выборе препаратов для лечения холестатического кожного зуда [19, 29].
I линия: секвестранты желчных кислот (холестирамин — 4 г 4 раза/сут).
II линия: рифампицин (150–300 мг/сут с возможным повышением дозы до 600 мг/сут).
III линия: пероральные антагонисты опиатов (налтрексон 50 мг/сут).
IV линия: сертралин (75–100 мг/сут).
В рекомендациях EASL особо отмечено, что при неэффективности указанных препаратов могут быть использованы экспериментальные методы лечения и обсуждаться вопрос о ранней трансплантации печени. Секвестранты желчных кислот (холестирамин) используются многие десятилетия, хотя, как для большинства «старых» препаратов, достойная доказательная база по их применению отсутствует.
В Российской Федерации холестирамин, к сожалению, последние годы отсутствует. Рифампицин является индуктором Х-рецепторов прегнана, регулирующих биосинтез, детоксикацию и транспортировку токсичных желчных кислот, поэтому при холестазе рифампицин, возможно, оказывает не только симптоматический, но и патогенетический эффект. Эффективность рифампицина сохраняется и при длительном приме- нении (2 года) [11].
Случаи гепатотоксичности рифампицина при холестатических заболеваниях печени относительно редки [11]. Тем не менее, его назначение требует обязательного биохимического контроля показателей печени [28]. Пероральные антагонисты опиатов (Налтрексон), вероятно, действуют на зуд за счет снижения опиоидергической нейротрансмиссии, а селективный ингибитор обратного захвата серотонина Сертралин предположительно влияет на перцепцию зуда [15].
Антигистаминные препараты, фенобарбитураты и ондансетрон больше не рекомендуются для лечения холестатического зуда в связи с низкой эффективностью и побочными эффектами. К другим возможным методам купирования зуда относятся экстракорпоральные методики: альбуминовый диализ, плазмафарез.
Физиотерапия: ультрафиолетовое облучение по 9–12 минут ежедневно в некоторых случаях позволяет уменьшить кожный зуд и гиперпигментацию [6]. Утомляемость, усиливающаяся с прогрессией заболевания, является одной из важных проблем при ряде холестатических заболеваний. Для ее лечения пока не существует специфической терапии.
С целью уменьшения утомляемости EASL рекомендует лечение сопутствующих состояний (гипотиреоз, анемия, диабет, депрессия), исключение факторов, способствующих автономной дисфункции и нарушениям сна (избыточное назначения гипотензивных препаратов, вечернее употребление кофеина), использование методов психологической поддержки [19]. Перспективным представляется использование модафинила (аналептика, исходно разработанного для лечения нарколепсии), использованного в пилотных исследованиях для лечения утомляемости при первичном билиарном циррозе [23].
Лечение осложнений хронического холестаза
Специфическим осложнением хронических холестатических заболеваний являются дефицит жирорастворимых витаминов и остеопороз.
Остеопороз. Профилактика остеопороза подразумевает прежде всего исключе- ние дополнительных факторов риска его развития (курение, низкую физическую активность и т.п.), гормонозаместительная постменопаузальных женщин. Традиционно при хроническом холестазе рекомендуется постоянное применение препаратов кальция (1000–1200 мг/сут) и витамина D (400–800 МЕ/сут), хотя эффективность этого не доказана EASL [19].
При выраженных костных болях может быть эффективно курсовое парентеральное введение глюконата кальция в дозе 15 мг/кг сутки [6]. При развитии выраженного остеопороза, а тем более спонтанных переломов рекомендуются бифосфонаты, прежде всего Алендронат, по эффективности которого имеется достаточная доказательная база [37]. Имеются данные и по применению парентеральных бифосфонатов. Данные по применению флуорида натрия и селективного модулятора эстрогеновых рецепторов ралоксифена при гепатогенном остеопорозе ограничены и противоречивы.
Дефицит жирорастворимых витаминов. Назначение витамина D рассматривается прежде всего как профилактика остеопороза. Пероральное применение витаминов A, E и К рекомендуется, как правило, при клинически выраженной стеаторее либо при снижении их концентраций в крови [19]. Парентеральные формы витамина K назначаются для профилактики кровотечений (например, при проведении инвазивных процедур на фоне холестаза) [19]. В заключение скажем, что глубокое понимание механизмов развития холестаза и выявление его причин могут слу- жить ключом в терапевтической и/или хирургической тактике ведения подобной категории пациентов.
На правах рекламы
Ознакомьтесь с инструкцией
Литература
- Ивашкин В.Т., Буеверов А.О. Аутоиммунные заболевания печени в практике клинициста. М.: Вести, 2001. 102 с.
- Надинская М.Ю. Исследование применения урсодеоксихолевой кислоты в гепатологии с позиции медицины, основанной на научных доказательствах // Consilium Medicum. 2003. V. 5. № 6. С. 318–322.
- Подымова С.Д. Болезни печени. М.: Медицина, 1998. 704 с.
- Подымова С.Д. Внутрипеченочный холестаз: патогенез и лечение с современных пози- ций // Consilium Medicum. 2004. 6 (2). С. 3–6.
- Потяженко М.М., Невойт А.В. Сервисная гепатопротекторная терапия урсодезоксихоле- вой кислотой // Здоров’я України, 2007. № 18. С. 68–71.
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практич. рук.: Пер. с англ. Под ред. З.Г.Апросиной, Н.А.Мухина. М.: ГЭОТАР-медицина, 1999. 864 с.
- Яковенко Э.П. Нарушение желчеобразования и методы их коррекции // Consilium Medicum. 2002. Экстравыпуск. С. 3–5.
- Яковенко Э.П., Григорьев П.Я., Агафонова Н.А., Яковенко А.В. Внутрипеченочный холестаз — от патогенеза к лечению // Практ. врач. 1998. № 13. С. 20–23.
- Anderson J.M. Leaky + Sunetion and Cholestas: a tight correlation // Gastroenterology. 1996. V. 110. P. 1662–1665.
- Angulo P., Dickson E.R., Therneau T.M. et al. Comparison of three doses of ursodeoxycholic acid in the treatment of primary biliary cirrhosis: a randomized trial // J.Hepatol. 1999. V. 30. № 5. P. 830–835.
- Bachs L., Pares A., Elena M. et al. Effects of longterm rifampicin administration in primary biliary cirrhosis // Gastroenterology. 1992. V. 102, № 6. P. 2077–2088.
- Benz C.Angermuller S., Kloters-Plachky P., Sauer P., Stremmel W., Stiehl A. Effect of S-adenosylmethionine versus tauroursodeoxycholic acid on bile acid-induced apoptosis and cytolysis in rat hepatocytes // Eur. J.Clin. Invest. 1998. V. 28 (7). P. 577–583.
- Boix J., Zuniga V. L., de Vega Moreno V., Domenech E., Gassull M.A. Endoscopic resection of ampullary tumors: 12‑year review of 21 cases // Surg. Endosc. 2009. V. 23. P. 45–49.
- Bianci G., Bugianesi E., Ronchi M. et al. Glutation kinetics in normal man and in patients with liver cirrhosis // J.Hepatol. 1997. V. 26 (3). P. 606–613.
- Browning J., Combes B., Mayo M.J. Long-term efficacy of sertraline as a treatment for cholestatic pruritus in patients with primary biliary cirrhosis // Am. J.Gastroenterol. 2003. V. 98. P. 2736–2741.
- Cheng C., Sherman S., Fogel E.L., McHenry L., Watkins J.L., Fukushima T., Howard T.J., Lazzell-Pannell L., Lehman G.A.L. Endoscopic snare papillectomy for tumors of the duodenal papillae // Gastrointest. Endosc. 2004. V. 60. P. 757–764.
- Davids P.H., Groen A.K., Rauws E.A. et al. Randomised trial of self-expanding metal stents versus polyethylene stents for distal malignant biliary obstruction // Lancet. 1992. V. 340. P. 1488.
- Dumoulin F.L., Gerhardt T., Fuchs S. et al. Phase II study of photodynamic therapy and metal stent as palliative treatment for nonresectable hilar cholangiocarcinoma // Gastrointest. Endosc. 2003. V. 57. P. 860. EASL. Clinical Practice Guidelines: Management of cholestatic liver diseases // Journal of Hepatology. 2009. V. 5. P. 237–267.
- Fiorelli G. S-Adenosylmethionine in the treatment of intragepatic cholestasis of chronic liver disease: a field trial // Current Therapeutic Research. 1999. V. 60 (6). P. 335–348.
- Frezza M., Surrenti C., Manzillo G., Fiaccadori F., Bortolini M., Di Padova C. Oral S-adenosylmethionine in the symptomatic treatment of intrahepatic cholestasis. A doubleblind, placebo-controlled study // Gastroenterology. 1990. V. 99 (1). P. 211–215.
- Fumex F., Coumaros D., Napoleon B. et al. Similar performance but higher cholecystitis rate with covered biliary stents: results from a prospective multicenter evaluation // Endoscopy. 2006. V. 38. P. 787.
- Ian Gan S., de Jongh M., Kapla M.M. Modafinil in the treatment of debilitating fatigue in primary biliary cirrhosis: a clinical experience // Dig. Dis. Sci. 2009. V. 54 (10). P. 2242–2246.
- Harewood G.C., Baron T.H., Rumalla A. et al. Pilot study to assess patient outcomes following endoscopic application of photodynamic therapy for advanced cholangiocarcinoma // J.Gastroenterol. Hepatol. 2005. V. 20. P. 415.
- Hintze R.E., Abou-Rebyeh H., Adler A. et al. Magnetic resonance cholangiopancreatographyguided unilateral endoscopic stent placement for Klatskin tumors // Gastrointest. Endosc. 2001. V. 53. P. 40.
- Isayama H., Komatsu Y., Tsujino T. et al. A prospective randomised study of «covered» versus «uncovered» diamond stents for the management of distal malignant biliary obstruction // Gut. 2004. V. 53. P. 729.
- Kaassis M., Boyer J., Dumas R. et al. Plastic or metal stents for malignant stricture of the common bile duct? Results of a randomized prospective study // Gastrointest. Endosc. 2003. V. 57. P. 178.
- Katsinelos P., Vasiliadis T., Xiarchos P. et al. Ursodeoxycholic acid for the treatment of amoxicillin-clavulanate potassium-induced intrahepatic cholestasis: report of two cases // Eur. J.Gastroenterol. Hepatol. 2000. V. 12. P. 365–368.
- Lindor K.D., Gershwin M.E., Poupon R. et al. Primary Biliary Cirrhosis // Hepatology. 2009. V. 50 (1). P. 291–308.
- Mato J.M., Camara J., de Fernandez P. J., Caballeria L., Coll S., Caballero A. et al. S-adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial // J.Hepatol. 1999. V. 30. P. 1081–1089.
- Nam Q.N., Kenneth F.B., Janak N.S. Cholangioscopy and pancreatoscopy // Gastrointestinal Endoscopy. 2009. V. 70 (6).
- Neri S., Signorelli S.S., Ierna D., Mauceri B., Abate G., Bordonaro F., Cilio D., Malaguarnera M. Role of Ademetionine (S-Adenosylmethionine) in cyclosporin-induced cholestasis // Clinical Drug Investigation. 2002. V. 22. P. 191–195.
- Pares A., Caballerial L., Rodes J. et al. Long-term effects of ursodeoxycholic acid in primary biliary cirrhosis: results of a double-blind controlled multicentric trial // J.Hepatol. 2000. V. 32 (4). P. 561–566.
- Poupon R.E., Lindor K.D., Cauch-Dudek K. et al. Combined analysis of randomized controlled trials of ursodeoxycholic acid in primary biliary cirrhosis // Gastroenterology. 1997. V. 113 (3). P. 884–890.
- Prince M. I., Burt A.D., Jones D.E. Hepatitis and liver dysfunction with rifampicin therapy for pruritus in primary biliary cirrhosis // Gut. 2002. V. 50 (3). P. 436–439.
- Terg R., Coronel E., Sorda J. et al. Efficacy and safety of oral naltrexone treatment for pruritus of cholestasis, a crossover, double blind, placebocontrolled study // J.Hepatol. 2002. V.
- (6). P. 717–722. 37. Zein C.O., Jorgensen R.A., Clarke B., Wenger D.E., Keach J.C., Angulo P., Lindor K.D. Alendronate improves bone mineral density in primary biliary cirrhosis: a randomized placebocontrolled trial // J.Hepatol. 2000. V. 32. P. 561–566.







Комментировать