Оценка эффективности эрадикации Helicobacter pylori при проведении терапии первого ряда на фоне приема глюкозаминилмурамилдипептида (Ликопид, ЗАО «Пептек», Россия).
М.Р. Конорев, Витебский государственный медицинский университет, Беларусь
Резюме
Цель исследования. Оценка эффективности эрадикации Helicobacter pylori при проведении терапии первого ряда на фоне приема глюкозаминилмурамилдипептида (Ликопид, ЗАО «Пептек», Россия).
Материалы и методы. Эрадикационную терапию провели у 128 пациентов (84 мужчины и 34 женщины; средний возраст 44,1±13,5 года) с язвой луковицы двенадцатиперстной кишки (АПК), ассоциированной с H. pylori. Выявление H. pylori в слизистой оболочке желудка и АПК осуществляли морфологическим методом и быстрым уреазным тестом до лечения и через 6—8 нед после его окончания и отмены всех лекарственных средств. Участки желудочной метаплазии в АПК выявляли с помощью окраски ШИК — альциановым синим. Пациентов разделили на 4 группы согласно протоколам лечения: омепразол 0,04 г/сут, кларитромицин 1 г/сут, амоксициллин 2 г/сут в течение 7 дней (ОКА7; n=33) и 14 дней (ОКА14; n=34); омепразол 0,04 г/сут, кларитромицин 1 г/сут, амоксициллин 2 г/сут в течение 7 дней, глюкозаминилмурамилдипептид (ликопид) 0,001 г/сут (ОКА7Л1; n=34) и 0,01 г/сут (ОКА7Л10; n=27) в течение 10 дней. Результаты. Частота эрадикации H. pylori по данным анализа по намерению лечить ITT (intention-to-treat) и в соответствии с протоколом PP (per protocol): ОКА7 — 81,8 и 87,1%, ОКА14 — 82,4 и 93,3%, ОКА7Л1 — 88,2 и 93,8%, ОКА7Л10 — 88,9 и 96% соответственно. Частота развития побочных эффектов: ОКА7 — 6,1%, ОКА14 — 17,6% (прекратили лечение 5,9%), ОКА7Л1 — 5,9%, ОКА7Л10 — 7,4%. Стоимость схем лечения: ОКА7 — 32 доллара США, ОКА14 — 64 доллара США, ОКА7Л1 — 40 долларов США, ОКА7Л10 — 67 долларов США. Прием глюкозаминилмурамилдипептида (ликопид) 0,001 г/сут при 7-дневной трехкомпонентной антихеликобактерной терапии повышал эрадикацию H. pylori на 6,4% (ITT) и 6,7% (PP), без увеличения частоты побочных эффектов.
Заключение. У инфицированных H. pylori пациентов с язвой луковицы АПК глюкозаминилмурамилдипептид (ликопид) в дозе 0,001 г/сут целесообразно назначать при проведении 7-дневной эрадикационной терапии первого ряда в качестве альтернативы 14-дневной схеме лечения.
Ключевые слова: язва луковицы двенадцатиперстной кишки, H. pylori, эрадикация, глюкозаминилмурамилдипептид, ликопид.
АХБТ — антихеликобактерная терапия
БУТ — быстрый уреазный тест
ГМДП — глюкозаминилмурамилдипептид
ДИ — доверительный интервал
ДПК — двенадцатиперстная кишка
ЖМ — желудочная метаплазия
ЗНЛ — зависимость от назначенного лечения
ЗРПЛ — зависимость от реально полученного лечения
ИЛ — интерлейкины
ЛС — лекарственные средства
МИ — морфологическое исследование
ММ — морфологический метод
ПЭ — побочные эффекты
ПЭО — повторное эндоскопическое обследование
СО — слизистая оболочка
СОЖ — СО желудка
PRR — рецепторы, распознающие образ.
Helicobacter pylori — возбудитель наиболее распространенной хронической бактериальной инфекции у человека, колонизирующий приблизительно 50—60% населения земного шара [1—4]. Доказана роль Н. pylori в патогенезе хронического гастрита (70—80% случаев) и дуоденита (23— 84%), язвы желудка (70—87%) и двенадцатиперстной кишки — ДПК (персистенция Н. pylori в желудке — 95—99% случаев, в ДПК — 60—95% случаев), MALT-лимфомы желудка (100%) [5—11]. Н. pylori вырабатывает в большом количестве фермент уреазу, которая превращает мочевину в аммиак и СО2 [12, 13]. Аммиак нейтрализует соляную кислоту желудочного сока, создает местное защелачивание, активирует продуцирующие гастрин клетки (G-клетки), что приводит к непрерывной секреции соляной кислоты париетальными клетками желудка [14]. В неблагоприятных условиях Н. pylori приобретают кокковидную форму и утрачивают способность к репродукции в результате снижения активности ферментов, в частности уреазы [15]. Персистенция Н. pylori на поверхности слизистой оболочки (СО) с желудочным эпителием вызывает регуляторный дисбаланс в Т-системе иммунитета [16, 17]. Регуляторный дисбаланс проявляется незавершенностью клеточных и стимуляцией гуморальных механизмов иммунитета c развитием иммунного ответа Тh2-типа [16—19]. Н. pylori стимулирует иммунную систему макроорганизма с выработкой антител (преимущественно классов IgG и IgA) к бактериальным антигенам [20, 21]. Н. pylori подавляет клеточный иммунный ответ организма человека и снижает активность фагоцитов путем повреждения ионами аммония фагосомальных мембран [22]. Многочисленные антигены Н. pylori стимулируют желудочный эпителий, который начинает вырабатывать различные цитокины (интерлейкины — ИЛ-8, ИЛ-12, лейкотриены) инициируя, таким образом, воспалительную реакцию в пределах СО [23]. ИЛ-8 и ИЛ-12, лейкотриены и продукты активации комплемента — мощные хемоаттрактанты для нейтрофилов и лимфоцитов, которые усиливают воспалительную реакцию [24]. Важную роль в развитии локального иммунного ответа на Н. pylori в СО желудка (СОЖ) играют Т-хелперы, цитотоксические Т-лимфоциты и натуральные Т-киллеры [25]. Установлено, что защита СО против Н. pylori после интраназальной или интрагастральной иммунизации может быть связана с иммунным ответом Th1-типа и выработкой цитокинов, в частности γ-интерферона [26, 27].
В связи с изложенным возникает вопрос о возможности использования иммуномодуляторов (иммунокорректоров) для проведения эрадикационной терапии у Н. pylori-позитивных пациентов и предупреждения персистенции бактерии на СО с желудочным эпителием.
Одним из новых синтетических лекарственных средств (ЛС), обладающих иммунокорригирующими свойствами, является ликопид [28]. Действующее начало ликопида — N-ацетилглюкозаминил-N-ацетилмурамилдипептид (ГМДП — глюкозаминилмурамилдипептид) — основной полный повторяющийся структурный фрагмент клеточной стенки практически всех известных бактерий. ГМДП выделен из клеточной стенки Lactobacillus bulgaricus, которую пытаются использовать в схемах антихеликобактерной терапии (АХБТ) как антагонист Н. pylori. Согласно положениям IV Маастрихтского консенсуса (2012 г.) по контролю инфекции Н. pylori (положение 12), определенные про- и пребиотики (в частности Lactobacilli) демонстрируют обнадеживающие результаты в качестве адъювантной терапии для снижения частоты развития побочных эффектов (ПЭ) при проведении эрадикации Н. pylori [29]. ГМДП — минимальный биологически активный фрагмент ассоциированных с патогенами молекулярных образов, общих для многих видов микроорганизмов, — распознается рецепторами, распознающими образ (PRR), в частности рецепторами NOD2. Ликопид относится к третьему поколению иммунотропных ЛС бактериального происхождения, представляющих собой минимальные биологически активные фрагменты, строго специфичные для различных PRR. Это агонист рецепторов NOD2 неспецифической (иннатной или врожденной) иммунной системы [30, 31]. Активация рецепторов NOD2 вызывает преимущественную стимуляцию фагоцитов с продукцией провоспалительных цитокинов (ИЛ-1, ИЛ-6, фактор некроза опухоли), которые способствуют активации лимфоцитов, изменению проницаемости сосудов и дальнейшему развитию защитной реакции. Кроме того, ликопид усиливает пролиферацию Т-лимфоцитов (поляризация ответа Th2→Th1) и неспецифическую для антигена активацию иммунитета. В предыдущем исследовании нами установлено, что после 1—2 нед приема ликопида в дозе 0,01 г/сут в течение 10 дней происходит усиление лимфоцитарной инфильтрации СОЖ в областях персистенции Н. pylori. Через 6—8 нед после начала приема ликопида в указанной дозе отмечается уменьшение степени обсемененности Н. pylori со снижением выработки уреазы бактериями и уменьшением активности воспалительного процесса или исчезновение бактерии с СО желудка. Цель исследования — в определении процента эрадикации Н. pylori при проведении антихеликобактерной терапии (АХБТ) первого ряда на фоне приема иммуномодулятора ликопида в дозе 0,01 г/сут и 0,001 г/сут.
Материалы и методы
Проведено проспективное рандомизированное сравнительное исследование. Группы пациентов были сформированы с 2000 г. по 2012 г. Эрадикационную терапию провели у 128 пациентов с обусловленной Н. pylori язвой луковицы ДПК. Отбор пациентов проводили рандомизированным методом случайных чисел (равномерное распределение) соответственно из 909 пациентов, имеющих неосложненную язву луковицы ДПК [32]. Критерии включения в группу: наличие язвенного дефекта, состояние после язвенного рубца и/или рубцово-язвенной деформации луковицы ДПК без признаков стеноза при эндоскопическом исследовании на момент осмотра, отсутствие осложнений дуоденальной язвы (кровотечение, перфорация, пенетрация, пилоробульбарный стеноз) по данным анамнеза, гистологическое исследование СОЖ и ДПК с использованием Хьюстонской модификации Сиднейской классификации хронического гастрита.
Закончили исследование к июню 2012 г. 118 пациентов (84 мужчины и 34 женщины). Средний возраст пациентов составлял 44,1+13,5 года (18—65 лет). Из общей группы исключены 10 (7,8%) больных в связи с прекращением лечения из-за развития ПЭ (n=2) и отказом от повторного эндоскопического обследования (ПЭО) с диагностикой Н. pylori (n=8). Полнота отслеживания результатов составила 92,2% (при 95% доверительном интервале — ДИ — от 87,5 до 96,9%).
В ходе исследования все пациенты (n=128) были разделены на 4 группы согласно протоколам лечения: ОКА7 — омепразол 0,04 г/ сут, кларитромицин 1 г/сут, амоксициллин 2 г/сут, длительность приема 7 дней (1-я группа; и=33), ОКА7Л1 — омепразол 0,04 г/сут, кларитромицин 1 г/сут, амоксициллин 2 г/сут, длительность приема 7 дней, ликопид 0,001 г/сут, длительность приема 10 дней (2-я группа; и=34), ОКА7Л10 — омепразол 0,04 г/сут, кларитромицин 1 г/сут, амоксициллин 2 г/сут, длительность приема 7 дней, ликопид 0,01 г/сут, длительность приема 10 дней (3-я группа; и=27), ОКА14 — омепразол 0,04 г/сут, кларитромицин 1 г/сут, амоксициллин 2,0 г/сут, длительность приема 14 дней (4-я группа; и=34).
Эндоскопическую оценку состояния СОЖ и ДПК проводили визуально в соответствии с эндоскопическим разделом Сиднейской классификации [33]. Наличие рубцово-язвенной деформации луковицы ДПК без признаков стеноза определяли визуально во время эндоскопического исследования по наличию язвенного дефекта СО или рубца и отклонению от нормальной (овальной или округлой) формы просвета ДПК без его сужения (стеноза) [34].
Гистологические срезы окрашивали по Романовскому— Гимзе, гематоксилином и эозином по общепринятым методам [12]. Для выявления участков желудочной метаплазии (ЖМ) ДПК проводили дополнительную окраску гистологических срезов СО ДПК ШИК — алциановым синим (Serva) рН 1,0 и 2,5 [8]. Оценку хронического воспаления, активности, атрофии желез проводили в соответствии с гистологическим разделом Хьюстонского пересмотра Сиднейской классификации [35, 36] в модификации Л.И. Аруина и соавт. [12]. Оценку морфологических изменений СОЖ (Н. pylori, полиморфно-ядерные лейкоциты, мононуклеарные клетки, атрофия антрального и фундального отделов, кишечная метаплазия) осуществляли по визуальной аналоговой шкале [18] согласно гистологическому разделу Хьюстонской модификации Сиднейской классификации хронического гастрита [35, 36]. При гистологическом исследовании СО ДПК дополнительно учитывали уплощение энтероцитов, укорочение ворсинок, углубление и уменьшение количества крипт, метаплазию СО по желудочному типу [8]. Оценку площади распространения ЖМ при микроскопическом исследовании проводили по пятибалльной шкале: 1 балл — нет ЖМ, 2 балла — ЖМ занимает менее 5% площади СО ДПК, 3 балла — 5—25%, 4 балла — 25— 50% и 5 баллов — более 50% [37].
Н. pylori в желудке и ДПК выявляли при морфологическом исследовании — МИ (окраска по Романовскому—Гимзе; оценка по стандартной визуальной аналоговой шкале [11]) и с помощью быстрого уреазного теста — БУТ (стандартные наборы Jatrox-H.p.-Test, «Rohm Pharma», Германия; ХЕЛПИЛ-тест, ООО «АМА», Россия). Присутствие Н. pylori в СОЖ и ДПК считали достоверным при положительном результате хотя бы одного из используемых методов диагностики данной инфекции, а отсутствие Н. pylori — при отрицательном результате двух используемых методов. Диагностику инфицирования Н. pylori проводили двумя методами до лечения и через 6—8 нед после окончания лечения и отмены всех ЛС.
Для оценки эффективности эрадикационной терапии выполняли анализ в зависимости от назначенного лечения — по намерению лечить — ITT (intention-to-treat) (пациенты, прошедшие рандомизацию, принявшие как минимум одну дозу препарата, но не получившие всех процедур согласно протоколу), а также анализ по протоколу PP (per protocol) (пациенты, получившие лечение в строгом соответствии с протоколом: прием назначенных ЛС в течение всего срока лечения, ПЭО с диагностикой Н. pylori).
Для обработки данных использовали стандартный пакет программ Statistica 6.0 (StatSoft, Ink. 1994—2001). Полученные результаты подчинялись нормальному распределению, что позволяло использовать t-тест. Возраст пациентов был представлен как среднее + стандартное отклонение. Различия считали достоверными при р<0,05. Качественные характеристики сравнивали с использованием х2. Для относительных частот определяли 95% ДИ. Для оценки размера выборки в группах использовали модули Basic Statistic/Tables, Difference tests (тесты расхождения между двумя средними) [38].
Результаты и обсуждение
Среди пациентов с неосложненной язвой луковицы ДПК Н. pylori в желудке диагностирован у 128 (100%), ЖМ и Н. pylori в ДПК — соответственно у 77 (60,2%; при 95% ДИ от 51,6 до 68,8%) и 43 (33,6%; при 95% ДИ от 25,3 до 41,9%).
Через 6—8 нед после проведения эрадикационной терапии, по данным МИ и БУТ, Н. pylori отсутствовал в ДПК у всех пациентов, у которых имелись участки ЖМ в СО луковицы ДПК.
Результаты оценки эффективности эрадикации Н. pylori в желудке при использовании 4 протоколов терапии приведены в таблице. Согласно результатам МИ и БУТ, при использовании классического 7-дневного протокола первого ряда — ОКА7 (n=33) по данным анализа ITT эрадикация Н. pylori в желудке получена у 81,8% (при 95% ДИ от 68,4 до 95,2%) пациентов, по данным анализа PP — у 87,1% (при 95% ДИ от 75,1 до 99,1%). Побочные эффекты (ПЭ) отмечены у 2 (6,1%; при 95% ДИ от 5,8 до 6,4%) больных: тошнота — у 1, неоформленный стул — у 1. От ПЭО отказались 2 пациента.
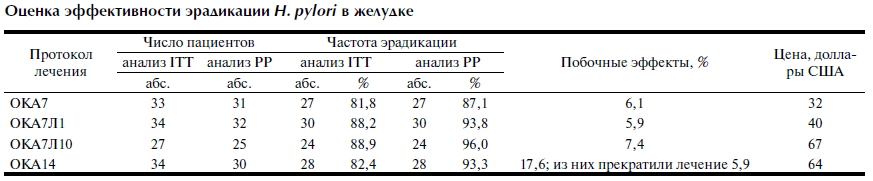
Согласно результатам ММ и БУТ, при использовании 7-дневного протокола первого ряда на фоне приема ликопида 0,001 г/сут — ОКА7Л1 (n=34) по данным анализа ITT эрадикация Н. pylori в желудке достигнута у 88,2% (при 95% ДИ от 77,1 до 99,3%) пациентов, а по данным анализа PP — у 93,8% (при 95% ДИ от 85,3 до 100%). ПЭ отмечены у 2 (5,9%; при 95% ДИ от 0,01 до 14%) больных: тошнота — у 1, неоформленный стул — у 1. От ПЭО отказались 2 пациента.
Согласно результатам ММ и БУТ, при использовании 7-дневного протокола первого ряда на фоне приема ликопида 0,01 г/сут — ОКА7Л10 (n=27) по данным анализа ITT эрадикация Н. pylori в желудке получена у 88,9% (при 95% ДИ от 76,8 до 100%) пациентов, а по данным анализа PP — у 96% (при 95% ДИ от 88,2 до 100%). ПЭ отмечены у 2 (7,4%; 95% ДИ от 0,01 до 17,5%) больных: тошнота — у 1, неоформленный стул — у 1. От ПЭО отказались 2 пациента.
Согласно результатам ММ и БУТ, при использовании классического 14-дневного протокола первого ряда — ОКА14 (n=34) по данным анализа ITT эрадикация Н. pylori в желудке получена у 82,4% (при 95% ДИ от 69,3 до 95,5%) больных, а по данным анализа PP — у 93,3% (при 95% ДИ от 84,2 до 100%). ПЭ отмечены у 6 (17,6%; 95% ДИ: 4,5—30,7%) пациентов: тошнота — у 3, неоформленный стул — у 1, выраженная диарея, приведшая к прекращению лечения, — у 2 (5,9%; при 95% ДИ от 0,01 до 14%). От ПЭО отказались 2 пациента.
Подтвердилась эффективность всех протоколов лечения. При использовании протокола лечения ОКА14 (по сравнению с ОКА7) частота эрадикации Н. pylori увеличивалась на 0,6% (по данным анализа ITT) и 6,2% (по данным анализа PP). В случае применения протокола лечения ОКА7Л1 (по сравнению с ОКА7) частота эрадикации Н. pylori увеличивалась на 6,4% (по данным анализа ITT) и 6,7% (по данным анализа PP). При использовании протокола лечения ОКА7Л10 (по сравнению с ОКА7) частота эрадикации Н. pylori увеличивалась на 7,1% (по данным анализа ITT) и 8,9% (по данным анализа PP). На фоне применения протокола лечения ОКА7Л1 (по сравнению с ОКА14) частота эрадикации Н. pylori увеличивалась на 5,8% (по данным анализа ITT) и 0,5% (по данным анализа PP). При использовании протокола лечения ОКА7Л10 (по сравнению с ОКА14) частота эрадикации Н. pylori увеличивался на 6,5% (по данным анализа ITT) и 2,7% (по данным анализа PP). У больных, получавших лечение по протоколу ОКА7Л10 (по сравнению с ОКА7Л1), частота эрадикации Н. pylori увеличивалась на 0,7% (по данным анализа ITT) и 2,2% (по данным анализа PP).
Не обнаружено статистически значимых различий между протоколами ОКА7, ОКА7Л1, ОКА7Л10 и ОКА14 (по данным анализа ITT и PP). Число больных с ПЭ в группе ОКА14 в 2—3 раза превышало аналогичные показатели в группах ОКА7, ОКА7Л1 и ОКА7Л10. Различия по частоте развития ПЭ в группе ОКА14 по сравнению с группами ОКА7, ОКА7Л1 и ОКА7Л10 оказались статистически незначимыми (соответственно х2=2,14; р=0,14 и Х2=2,27; р=0,13; х2=1,38; р=0,24).
По сравнению со схемой ОКА14 стоимость схем лечения ОКА7 и ОКА7Л1 оказалась ниже соответственно на 32 (50%) и 24 (37,5%) доллара США, а стоимость схемы лечения ОКА7Л10 — дороже на 3 (4,5%) доллара США.
Заключение
Прием ликопида в дозе 0,001 г/сут при проведении 7-дневного протокола АХБТ первого ряда повышает частоту эрадикации Н. pylori на 6,4% (по данным анализа ITT) и 6,7% (по данным анализа PP) без увеличения частоты ПЭ, но с повышением стоимости лечения на 20%.
Прием ликопида в дозе 0,01 г/сут при использовании 7-дневного протокола АХБТ первого ряда повышает частоту эрадикации Н. pylori на 7,1% (по данным анализа ITT) и 8,9% (по данным анализа PP) без увеличения частоты ПЭ, с повышением стоимости лечения на 52,2%.
Проведение 14-дневного протокола АХБТ первого ряда повышает частоту эрадикации Н. pylori на 0,6% (по данным анализа ITT) и 6,2% (по данным анализа PP) по сравнению с результатами 7-дневного протокола эрадикационной терапии с увеличением частоты ПЭ в 3 раза и стоимости лечения на 50%.
Назначение ликопида 0,001 г/сут при проведении 7-дневной АХБТ первого ряда позволяет сохранить длительность приема ЛС 7 дней без потери процента эрадикации H. pylori и без увеличения количества ПЭ с уменьшением стоимости лечения на 37,5% по сравнению с результатами классического протокола первого ряда длительностью 14 дней.
При проведении эрадикационной терапии у Н. pylori-позитивных пациентов с язвой луковицы ДПК ликопид целесообразно назначать в дозе 0,001 г/сут вместе с 7-дневной схемой эрадикационной терапии первого ряда как альтернативу удлиненной 14-дневной схемы лечения.

На правах рекламы
Ознакомьтесь с инструкцией
ЛИТЕРАТУРА
- Blaser M.J. Hypothesis: the changing relationships of Helicobacter pylori and humans: implications for health and disease. J Infect Dis 1999; 179: 1523—1530.
- Go M.F. Natural history and epidemiology of Helicobacter pylori infection. Aliment Pharmacol Ther 2002; 16 (Suppl. 1): 3—15.
- Megraud F., Brassens-Rabbe M.P., Denis F. Seroepidemiology of Campylobacter pylori infection in various populations. J Clin Microbiol 1989; 27: 1870—1873.
- Руководство по инфекционному контролю в стационаре. Пер. с англ. Под ред. Р. Венцеля, Т. Бревера, Ж.-П. Бутцлера. Смоленск: МАКМАХ 2003: 232—238.
- Ивашкин В.Т. Состояние и перспективы развития гастроэнтерологии (по материалам доклада президиума гастроэнтерологической ассоциации. Рос журн гастроэнтерол гепатол колопроктол 2001; 6: 7—14.
- Исаков В.А., Домарадский И.В. Хеликобактериоз. М: Медпрактика-М 2003.
- Конорев М.Р., Литвяков А.М., Крылов Ю.В. и др. Хронический дуоденит, связанный с Helicobacter pylori. Клин мед 1999; 11: 49—52.
- Конорев М.Р., Литвяков А.М., Крылов Ю.В., Матвеенко М.Е. Хронический дуоденит. Мн: ДокторДизайн 2003.
- Маршалко О.В., Конорев М.Р. Персистенция Helicobacter pylori в метаплазированной слизистой оболочке двенадцатиперстной кишки у пациентов с дуоденальной язвой. Гастроэнтерология Санкт-Петербурга 2004; 7: 12—13.
- Pimanov S.I., Makarenko E.V., Voropaeva A.V. et al. Prerequisites for empirical eradication therapy in patients with duodenal ulcer: Study in Belarus. Helicobacter 2003; 8: 475.
- Макаренко Е.В., Пиманов С.И., Воропаева А.В. и др. Обоснование эмпирической эрадикационной терапии у больных дуоденальными язвами. Рос журн гастроэнтерол, гепатол, колопроктол 2003; 5 Приложение №21: 35.
- Аруин Л.И., Григорьев П.Я., Исаков В.А., Яковенко Э.П. Хронический гастрит. Амстердам 1993: 3—362.
- Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. М: Триада-Х 1998: 13—496.
- Graham D.Y., Opekun A., Lew G.M. Ablation of exaggragated meal-stimulated gastrin release in duodenal ulcer patients after clearence of Helicobacter pylori infection. Am J Gastroenterol 1990; 85: 394—398.
- Бондаренко В.М., Нижевич А.А., Мавзютов А.Р., Габидуллин З.Г. Гастродуоденальная патология, ассоциированная с Helicobacter pylori. Журн микробиол 1995; 2: 110—112.
- Fan X.G., Yakoob J., Fan X.J., KelingP.W. Enchanced T-helper 2 Lymphocyte responses: immune mechanism of Helicobacter pylori infection. Ir J Med Sci 1996; 165 (1): 37—39.
- Beigier-Bompadre M., Moos V., Belogolova E. et al. Modulation of the CD4+ T-cell response by Helicobacter pylori depends on known virulence factors and bacterial cholesterol and cholesterol a-glucoside content. J Infect Dis 2011; 204 (9): 1339—1348.
- Kido M., Tanaka J., Aoki N. et al. Helicobacter pylori promotes the production of thymic stromal lymphopoietin by gastric epithelial cells and induces dendritic cell-mediated inflammatory Th2 responses. Infect Immun 2010; 78 (1): 108—114.
- Конорев М.Р., Коневалова Н.Ю. Современные представления об иммунной системе ассоциированной со слизистой оболочкой кишечника. Иммунопатол, аллергол, инфектол 2010; 2: 40—46.
- Rathbone B.J., Wyatt J.I., Worsley B.W. et al. Systemic and local antibody responses to gastric Campylobacter pyloridis in non-ulcer dyspepsia. Gut 1986; 27: 642—647.
- Perez-Perez G.I., Dworkin B.M., Chodos J.E. et al. Campylobacter pyloriantibodies in humans. Ann Intern Med 1988; 109: 11—17.
- Dunn B., Cohen H., Blaser M.J. Helicobacter pylori. Clin Microbiol Rev 1997; 10 (4): 720—741.
- Karttunen R.A., Karttunen T.J., Yousfi M.M. et al. Expression of mRNA for interferon-gamma, interleukin-10, and interleukin-12 (p40) in normal gastric mucosa and in mucosa infected with Heli-cobacter pylori. Scand J Gastroenterol 1997; 32: 22—27.
- Versalovic J. Helicobacter pylori: Pathology and Diagnostic Stratedies. Am J Clin Pathol 2003; 119 (3): 403—412.
- Micu G., Staniceanu F., Zurac S. et al. The influence of Helicobacter pylori presence on the immunophenotype of inflammatory infiltrate in gastric diseases. Rom J Intern Med 2011; 49 (1): 45—54.
- Garhart C.A., Heinzel F.P., Czinn S.J. et al. Vaccine-induced reduction of Helicobacter pylori colonization in mice is interleukin-12 dependent but gamma interferon and inducible nitric oxide synthase independent. Infect Immun 2003; 71: 910—921.
- Becher D., Deutscher M.E., Simpfendorfer K.R. et al. Local recall responses in the stomach involving reduced regulation and expanded help mediate vaccine-induced protection against Helico-bacter pylori in mice. Eur J Immunol 2010; 40 (10): 2778—2790.
- Пинегин Б.В., Андронова Т.М. Некоторые теоретические и практические вопросы клинического применения иммуно-модулятора ликопида. Иммунология 1998; 4: 60—63.
- Malfertheiner P., MegraudF., OMorain C.A. et al. Management of Helicobacter pylori infection — the Maastricht-IV / Florence Consensus Report. Gut 2012; 61: 646—664.
- Козлов И.Г. Лекарственные воздействия через рецепторы врожденного иммунитета. М 2005: 1 — 16.
- Конорев М.Р. Влияние ликопида на персистенцию Helicobacter pylori в слизистой оболочке желудка больных с хроническими гастритами. Иммунопатол, аллергол, инфектол 2004; 2: 33—34.
- Box G.E., Hunter W.G., Hunter J.S. Statistics for Experimenters: An introduction to design, data analysis, and model building. New York: John Wiley and Sons 1978.
- Tytgat G.N. The Sydney system, endoscopic division: endoscopic appearance in gastritis. J Gastroenterol Hepatol 1991; 6 (3): 223—234.
- Англо-русский медицинский энциклопедический словарь. М: Гэотар Медицина 2000: 166—595.
- Price A.B. The Sydney system: Histological division. J Gastroenterol Hepatol 1991; 6 (3): 209—222.
- Dixon M., Genta R.M., Yardley J.H. et al. Classification and grading of gastritis. Am J Surg Pathol 1996; 20: 1161 — 1181.
- Chang C., Pan S., Lien Gi. et al. Investigation of the extent of gastric metaplasia in the duodenal bulb by using methylene blue staining. J Gastroenterol Hepatol 2001; 16 (7): 729—739.
- Betty R. Essential medical statistics. 2nd ed. Kirkwood and Jonathan A. C. Sterne: Blackwell Science Ltd. 2003: 414—425.









Комментировать