С.Ю. Калинченко, д. мед. н., профессор; С.С. Апетов, к. мед. н.
Российский университет дружбы народов им. П. Лумумбы, кафедра клинической андрологии, Москва
Сексуальное здоровье женщин, несмотря на свою важность, долгое время игнорировалось клиницистами и учеными. Несмотря на то, что андрогены являются универсальными гормонами, ответственными за формирование и поддержание полового влечения как у мужчин, так и у женщин, научные исследования в большей мере сосредоточивались на их роли в здоровье мужчин. Дело в том, что выработка андрогенов у мужчин происходит намного интенсивнее, чем у женщин, поэтому влияние гипоандрогении у мужчин можно оценить более объективно. Данные о влиянии снижения уровня андрогенов у женщин скудны; большинство исследований о роли андрогенов у женщин сосредоточены на гипер андрогенных состояниях, таких как синдром поликистозных яичников (СПЯ). Более того, на основании факта повышения уровня андрогенов при СПЯ андрогенам у женщин незаслуженно приписывают целый спектр негативных метаболических эффектов, на самом деле обусловленных гипер инсулинемией, наблюдающейся при данном синдроме. В последнее время появились многочисленные исследования женских сексуальных расстройств, и конкретно – дефицита андрогенов у женщин, в которых сообщается, что снижение андрогенов действительно имеет место у женщин, особенно после операций оофорэктомии, что отмечаются сексуальные дисфункции, связанные с дефицитом андрогенов, и что андрогенная терапия эффективно восстанавливает многие сексуальные нарушения, происходящие в результате снижения андрогенов, в том числе улучшает нарушенное сексуальное желание и сексуальное возбуждение и не оказывает негативных метаболических эффектов.
В данной статье рассмотрены аспекты безопасности применения андрогенов у женщин в климактерическом периоде.
В последние десятилетия отмечено увеличение средней продолжительности жизни женщин в развитых странах, что вызывает большой интерес к проблемам здоровья и качества жизни пациенток в климактерическом периоде. Клинические проявления, возникающие вследствие дефицита половых гормонов, ощущают большинство женщин данной возрастной группы, в связи с чем своевременное лечение климактерического синдрома является актуальной проблемой.
Климактерические нарушения имеют вариабельную клиническую картину. В.П. Сметник (1996) выделяет 3 группы менопаузальных расстройств в зависимости от времени их возникновения:
- Ранние менопаузальные расстройства: вегетососудистые (приливы, гипергидроз, головные боли, артериальная гипертензия) и психоэмоциональные (раздражительность, депрессия, нарушения сна, снижение либидо) нарушения.
- Средневременные расстройства: атрофические изменения в нижнем урогенитальном тракте (вульвовагиниты, уретриты).
- Поздние обменные нарушения: системный остеопороз и сердечнососудистые нарушения.
Заместительная гормонотерапия эстрогенами и комбинированными эстроген-гестагенными препаратами широко распространена в лечении климактерического синдрома, однако, наряду с положительным, она может оказывать и отрицательное воздействие, в частности на систему гемостаза, молочные железы и эндометрий. Так, по данным NHS (Nurses Heathcare Study, 1985–2000), отмечается повышение риска развития инсульта на фоне применения комбинированных препаратов заместительной гормональной терапии (ЗГТ) на 40 % по сравнению с пациентками, не получавшими ЗГТ. Также в этом исследовании был показан дозозависимый эффект конъюгированных эстрогенов, дозы которых в 0,625 и 1,25 мг достоверно повышали риск инсультов.
По данным А.Д. Макацария и В.О. Бицадзе (2003), в условиях атеросклеротического повреждения коронарных сосудов ЗГТ не оказывает кардиопротективного эффекта, повышает риск развития венозной тромбоэмболии в 3,5–4 ра за, влияет на систему гемостаза аналогично комбинированным оральным контрацептивам (КОК), что с учетом возраста пациенток, принимающих ЗГТ, и наличия у них сопутствующих заболеваний делает риск развития тромбозов выше, чем у молодых пациенток, принимающих КОК.
Помимо абсолютных противопоказаний для применения ЗГТ, имеется ряд достаточно широких относительных противопоказаний, таких как миома матки, эндометриоз, гиперпластические процессы женских репродуктивных органов, фиброзно-кистозная мастопатия и др., суживающих круг пациенток, которым может быть назначена ЗГТ эстрогенами и эстрогенгестагенными препаратами. Все это заставляет искать альтернативные подходы к выбору препаратов для терапии климактерического синдрома. Одним из таких подходов может быть андрогенотерапия.
Применение андрогенов с целью облечения вазомоторных симптомов у женщин в постменопаузе впервые было описано Mocquot и Moricard в 1936 г. Наибольшее распространение в гинекологической практике андрогены получили в 40–60-е гг. ХХ века,
однако применяемые в то время препараты на основе мелилтестостерона и тестостеронапропионата часто приводили к вирилизации, в связи с чем андрогенотерапия не получила широкого распространения, несмотря на клиническую эффективность. Ученые из Североамериканского общества по менопаузе (NAMS, 2007) определили, что женщины в постменопаузе с сексуальными расстройствами, принимающие орально или парентерально тестостерон или эстрогензаместительную терапию, отмечали положительное влияние на сексуальную функцию, в частности на либидо, однако не было получено убедительных данных в пользу того, что тестостерон положительно влияет на такие показатели, как плотность костной ткани, пропорции тела и другие менопаузальные симптомы. Появление новых фармакологических форм тестостерона вновь делает актуальным вопрос о применении андрогенов в качестве препаратов ЗГТ.
Материалы и методы исследования
С целью определения безопасности и эффективности применения тестостерона-ундеканоата (Андриол, Organon) как препарата для монотерапии климактерических расстройств у женщин в пре- и постменопаузальном периоде, имеющих относительные противопоказания для эстрогенгестагенной ЗГТ, нами было обследовано 14 пациенток в возрасте от 42 до 56 лет. Длительность наблюдения составила 6 ме сяцев. Пациентки, участвующие в исследовании, не принимали препаратов, влияющих на углеводный и жировой обмен, и не применяли ЗГТ в течение последнего года. По возрасту больные распределились следующим образом: в возрасте 40–45 лет 2 пациентки, от 46 до 50 лет – 4, от 51 года до 55 лет – 5 больных и старше 56 лет– 3.
Характер сопутствующей гинекологической патологии представлен в таблице 1.
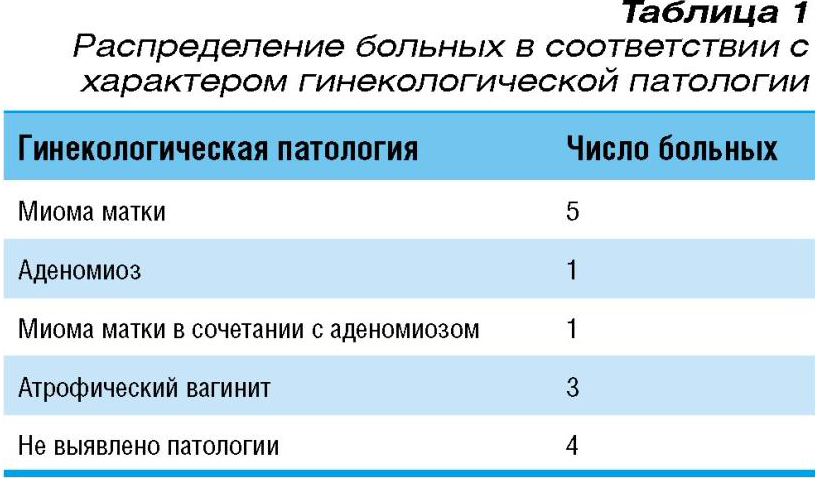
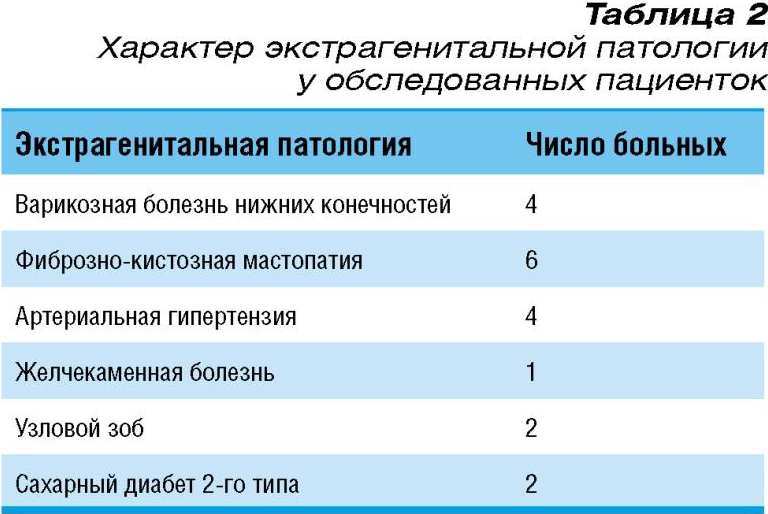
При изучении гинекологического анамнеза было выявлено, что нормальный характер менструаций сохранился у 4 пациенток, нерегулярные менструации – у 3, отсутствие менструаций было отмечено у5 больных, еще 2 пациентки перенесли ранее гистерэктомию (одна – с билатеральной овариоэктомией) по поводу миомы матки. У больных с отсутствием менструаций длительность менопаузы варьировала от 2 до 6 лет и в среднем составила 3,8 года.
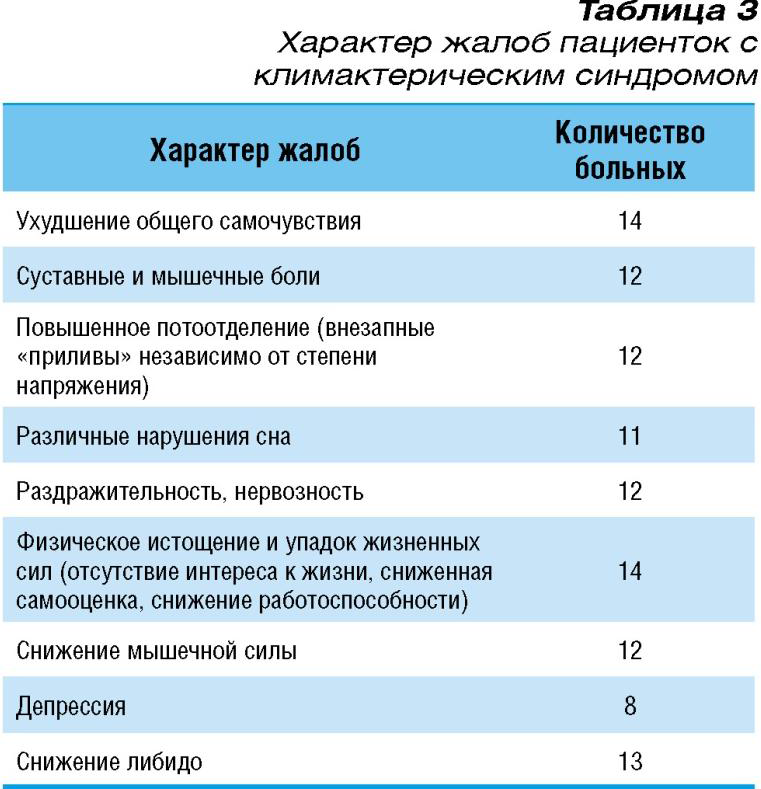
Показанием для назначения тестостерона-ундеканоата явились следующие жалобы, представленные в таблице 3.
Следует отметить, что у всех пациенток жалобы носили сочетанный характер. Оценку выраженности жалоб проводили на основании модифицированного опросника Aging Male Simptoms по Heinemann, применяющегося для оценки дефицита тестостерна у мужчин, с оценочной шкалой, позволяющей клинически выявить наличие дефицита половых гормонов и включающего оценку психологического статуса больного.
Перед началом терапии все больные проходили лабораторно-инструментальное обследование, включающее УЗИ органов малого таза, щитовидной и молочных желез, цитологическое исследование мазков-отпечатков, коагулограмму и биохимическое исследование крови, включающее определение общего холестерина, триглицеридов, липопротеинов высокой и низкой плотности. У пациенток с длительностью постменопаузы свыше 2 лет также измерялась минеральная плотность костной ткани (МПКТ) бедренной и лучевой костей. Наличие метаболического синдрома (МС) оценивали по критериям Международной диабетической ассоциации (2005), по которым МС понимают как наличие предиабета или диабета, абдоминальное ожирение, неблагоприятный липидный профиль и гипертензию. Критерием центрального ожирения рекомендовано считать окружность талии более 94 см у мужчин и 80 см у женщин. Повышение триглицеридов до 1,7 ммоль/л и 150 мг/дл, повышение кровяного давления, по крайней мере, до 130/85 мм рт. ст.; тощаковая гипергликемия (более 5,6 ммоль/л (100 мг/дл) или нарушение толерантности к глюкозе. Окружность талии свыше 80 см была у 7 пациенток.
Все пациентки получали тестостерона-ундеканоат в дозировке 80 мг/сут. (по 40 мг 2 раза в день) в течение 6 месяцев в непрерывном режиме. Контрольное исследование жалоб, антропометрических показателей, коагулограммы, гормонального и биохимического статуса проводилось через 3 и 6 месяцев от начала лечения.
Результаты и их обсуждение
Через 3 месяца после начала лечения отмечена позитивная динамика жалоб до их полного исчезновения на: ухудшение общего самочувствия – 8 пациенток из 14, суставные и мышечные боли – 7 из 12, повышенное потоотделение (внезапные «приливы» независимо от степени напряжения) – 6 из 12, различные нарушения сна – 5 из 11, раздражительность, нервозность – 8 из 12, физическое истощение и упадок жизненных сил (отсутствие интереса к жизни, сниженная самооценка, снижение работоспособности) – 9 из 14, снижение мышечной силы – 7 из 12, депрессию – 4 из 8, снижение либидо – у 8 из 13 больных. Отсутствие клинического эффекта по всем вышеперечисленным параметрам было отмечено у 2 больных, у одной пациентки отмечалось ухудшение имевшихся симптомов. Это были пациентки в пременопаузе с метаболическим синдромом.
Через 6 месяцев после начала лечения отмечена позитивная динамика жалоб до их полного исчезновения на: ухудшение общего самочувствия – у 4 пациенток из 6, суставные и мышечные боли – 3 из 5, повышенное потоотделение (внезапные «приливы» независимо от степени напряжения) – 4 из 6, различные нарушения сна – 4 из 6, раздражительность, нервозность – 3 из 4, физическое истощение и упадок жизненных сил (отсутствие интереса к жизни, сниженная самооценка, снижение работоспособности) – 3 из 5, снижение мышечной силы – 5 из 5, депрессию – 2 из 4, снижение либидо – у 3 из 5 больных. Таким образом, полного исчезновения всех вышеперечисленных жалоб у обследованных больных не произошло, однако наблюдалась их выраженная позитивная динамика. Также следует отметить, что побочного вирилизирующего действия андриола (рост волос в андрогензависимых зонах, огрубение голоса, гипертрофия клитора и др.) не было отмечено ни у одной пациентки.
Анализ состояния антропометрических показателей через 3 месяца от начала терапии выявил повышение массы тела на 4 кг у 1 пациентки из 7 с нормальной массой тела, при этом окружность талии у нее уменьшилась на 3 см, и увеличение веса на 3 кг у 1 больной с метаболическим синдромом. У остальных 12 пациенток масса тела осталась прежней, при этом окружность талии уменьшилась на 3–
7 см у каждой второй больной.
Результаты лабораторных исследований представлены в таблицах 4 и 5.
Как следует из данных таблицы 4, у 12 из 14 пациенток до начала терапии показатели системы гемостаза были в пределах нормы, у 1 пациента имелся сдвиг в сторону гипо- и еще у 1 – в сторону гиперкоагуляции. Через 3 и 6 месяцев от начала лечения у пациенток с нормальными показателями гемостаза изменений в сторону гиперкоагуляции отмечено не было. У пациентки с гиперкоагуляцией через 3 месяца после начала приема Андриола отмечено, что показатели гемостаза по-прежнему изменены в сторону гиперкоагуляции, однако дальнейшей динамики в этом направлении отмечено не было и через 6 месяцев. У пациентки с гипокоагуляцией показатели системы гемостаза пришли в норму через 3 месяца и оставались без динамики к 6 ме сяцам от начала терапии.
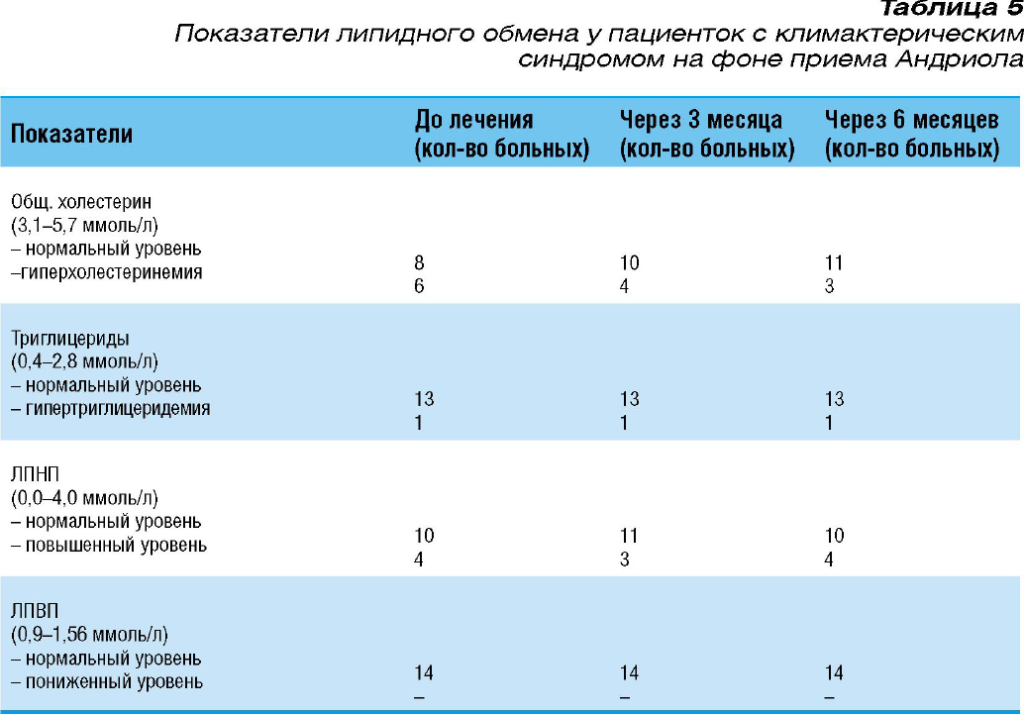
Из данных таблицы 5 видно, что прием низких доз Андрогенов не привел к гиперхолестеринемии и гипертриглицеридемии, а также к снижению уровня липопротеинов высокой плотности.
Результаты лабораторных исследований представлены в таблицах 4 и 5.
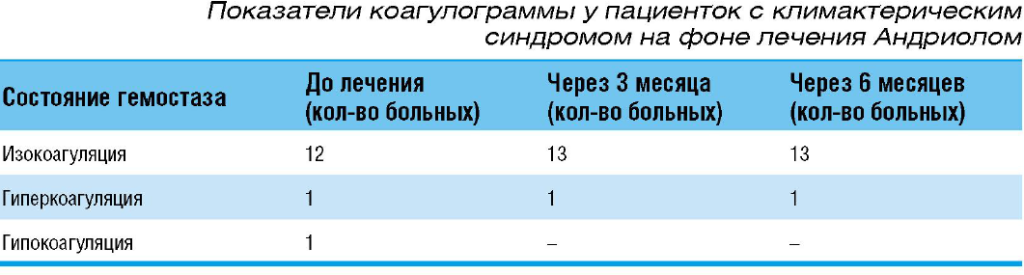
Как следует из данных таблицы 4, у 12 из 14 пациенток до начала терапии показатели системы гемостаза были в пределах нормы, у 1 пациента имелся сдвиг в сторону гипо- и еще у 1 – в сторону гиперкоагуляции. Через 3 и 6 месяцев от начала лечения у пациенток с нормальными показателями гемостаза изменений в сторону гиперкоагуляции отмечено не было. У пациентки с гиперкоагуляцией через 3 месяца после начала приема Андриола отмечено, что показатели гемостаза по-прежнему изменены в сторону гиперкоагуляции, однако дальнейшей динамики в этом направлении отмечено не было и через 6 месяцев. У пациентки с гипокоагуляцией показатели системы гемостаза пришли в норму через 3 месяца и оставались без динамики к 6 месяцам от начала терапии.
Из данных таблицы 5 видно, что прием низких доз Андрогенов не привел к гиперхолестеринемии и гипертриглицеридемии, а также к снижению уровня липопротеинов высокой плотности.
Выводы
Секреция всех половых гормонов (эстрогенов, прогестерона и тестостерона) яичниками в период пре- и постменопаузы значительно снижается. Кроме того, увеличение с возрастом концентрации глобулина, связывающего половые гормоны, еще более снижает биологически активную фракцию этих гормонов. Часто используемое разделение половых гормонов на мужские и женские носит условный характер, т.к. эстрогены и тестостерон вырабатываются как у мужчин, так и у женщин, но в разных количествах, а прогестерон является прогормоном для синтеза тестостерона у мужчин. Следовательно, половые гормоны у обоих полов имеют скорее количественное, нежели качественное различие. Мы считаем, что возрастной дефицит андрогенов у женщин, клинически проявляемый снижением вплоть до полного отсутствия полового влечения, абдоминальным ожирением, уменьшением мышечной массы и силы, можно рассматривать как состояние «женской андропаузы», что требует соответствующей коррекции.
Как показало наше исследование, тестостерона ундеканоат (Андриол) эффективен и безопасен в качестве препарата для монотерапии климактерического синдрома в течение 6 месяцев у пациенток с нормальным индексом массы тела. Более длительное применение андриола, безопасность и эффективность его назначения у пациенток, особенно с избыточной массой тела, нуждается в дальнейшем изучении.














Комментировать