Обзор литературы по теме. Этиологические причины невынашивания беременности. Ретроспективные исследования последних лет и их результаты. Оценка роли гипергомоцистеинемии в развитии осложнений течения беременности у женщин с репродуктивными потерями в анамнезе на фоне экстрагенитальной патологии, а также изучение корреляции степени выраженности тех или иных осложнений с уровнем гомоцистеина и определенными соматическими нозологиями. Результаты проведенных собственных исследований.
С.И.Жук,С.Б.Чечуга, Винницкий национальный медицинский университет им. Н.И. Пирогова
Введение
Несмотря на значительные достижения и определенные успехи в вопросах диагностики и лечения преждевременного прерывания беременности, сегодня проблема невынашивания остается наиболее актуальной в акушерстве. Частота данной патологии не имеет тенденции к снижению, в связи с чем возникает необходимость разработки новых методов ее прогнозирования, профилактики, диагностики и коррекции. Исследования по- следних лет показали, что в основе многих видов акушерской патологии лежит развитие генерализованных микроангиопатий и тромбофилий, связанных с гипергомоцистеинеми- ей. Клиническим проявлением этого патологического состояния могут быть раннее начало и/или тяжелое течение гестоза, фетоплацентарная недостаточность, отслойка плацен- ты, задержка развития плода, его внутриутробная гибель. В свою очередь, не утратила актуальности проблема экстрагенитальных заболеваний в патогенезе невынашивания беременности, которые имеют немаловажное значение для матери и плода и могут осложнять течение гестационного периода.
Несмотря на многочисленные исследования, посвященные изучению этиологии и патоге- неза преждевременного прерывания беременности, частота этой патологии остается вы- сокой и колеблется в пределах 10–25% от их общего числа зарегистрированных случаев[6]. Согласно обобщенным данным литературы, 15–20% клинически диагностированных беременностей заканчивается спонтанным прерыванием, при этом на І триместр прихо- дится до 78–80% случаев, а угрозой выкидыша осложняется течение беременности почти у 40% женщин [4]. Диагностика и лечение этой патологии затруднительна, так как в большинстве случаев невозможно определить факторы, препятствующие нормальному течению беременности.
Этиологические причины невынашивания беременности разнообразны. Среди них можно выделить:
— хромосомные нарушения, которые наследуются от родителей или возникают de novo (чаще транслокации, реже — инверсии хромосом);
— гормональные нарушения — первичная НЛФ, гиперандрогения, сахарный диабет 1-го и 2-го типа, заболевания щитовидной железы, которые могут приводить к формированию НЛФ;
— инфекционные заболевания, чаще обуславливающие прерывание беременности на более поздних сроках;
— аутоиммунные факторы (повышенные уровни антител к кардиолипину и другим фосфолипидам, гликопротеидам, нативной и денатурированной ДНК, факторам щитовидной железы);
— аллоиммунные факторы, при которых причиной невынашивания беременности является соотношение антигенов тканевой совместимости у супружеской пары;
— анатомические изменения половых органов (пороки развития, внутриматочные сине- хии, истмико-цервикальная недостаточность, генитальный инфантилизм и т. д.);
— тромбофилические факторы (наследственные и приобретенные).
Ретроспективные исследования последних лет показали достаточно большую распространенность среди женщин, страдающих привычным невынашиванием беременности, генерализованных микроангиопатий и тромбофилий, связанных с иммунными нарушениями, гипергомоцистеинемией, наследственным дефектам гемостаза [1]. По данным мировой литературы, роль тромбофилии в структуре причин невынашивания беременности составляет от 40 до 75%.
В современных публикациях значительная роль в патогенезе микроциркуляторных и тромботических осложнений в акушерстве отводится гипергомоцистеинемии [3]. Гомоцистеин — это серосодержащая аминокислота, образующаяся в процессе обмена метионина и цистеина. Получаемый с пищей в составе белка метионин метаболизируется с образо- ванием S-аденозилгомоцистеин, который в результате гидролиза превращается в гомо- цистеин. В процессе метаболизма гомоцистеина важную роль играют витамины В6, В12 и фолиевая кислота. Гомоцистеин обладает выраженным токсическим действием на клет- ку. В случае появления избытка гомоцистеина в организме, он начинает накапливаться в крови и оказывать повреждающее действие на эндотелий сосудов, что значительно повышает риск развития тромбозов. Кроме того, высокие уровни гомоцистеина усиливают агрегацию тромбоцитов вследствие снижения синтеза эндотелием релаксирующего фактора и NO, индукции тканевого фактора и стимуляции пролиферации гладкомышечных клеток.
Причиной возникновения гипергомоцистеинемии может служить как врожденный, так и приобретенный дефицит факторов его метаболизма. Различают генетическую форму гипергомоцистеинемии, связанную с мутацией гена фермента метилентетрагидрофолат- редуктазы (MTHFR) в положении 677 (замена аминокислоты С на Т) и приобретенную форму, связанную с дефицитом витаминов В12, В6, фолиевой кислоты или с некоторыми системными заболеваниями (коллагенозы, ревматоидный артрит) [5].
Нормальное содержание гомоцистеина в плазме крови составляет 5–15 мкмоль/л. Гипергомоцистеинемией считается превышение показателя более 100 мкмоль/л, что, как правило, сопровождается гомоцистеинурией. Средний (31–100 мкмоль/л) и легкий (15–30 мкмоль/л) уровни гипергомоцистеинемии не сопровождаются выделением гомоцистеина с мочой. При беременности концентрация гомоцистеина в норме снижается приблизите- льно на 50% от допустимого уровня в период между І и ІІ триместрами беременности и возвращается к норме на 2–4-й день послеродового периода.
Возникающие вследствие гипергомоцистеинемии микротромбообразования и нарушения микроциркуляции приводят к целому ряду акушерских осложнений. Нарушение плацентации и фетоплацентарного кровообращения могут быть причиной репродуктив- ной недостаточности: невынашивание беременности и бесплодия в результате дефектов имплантации зародыша. На более поздних стадиях беременности гипергомоцистеинемия является причиной развития хронической фетоплацентарной недостаточности и хронической внутриутробной гипоксии плода. Это приводит к рождению детей с низкой массой тела и снижению функциональных резервов всех жизнеобеспечивающих систем новоро- жденного и развитию целого ряда осложнений периода новорожденности. Гипергомоцис- теинемия может быть одной из причин развития генерализованной микроангиопатии во второй половине беременности, проявляющейся в виде позднего гестоза. Для гипергомо- цистеинемии характерно развитие тяжелых, часто неуправляемых состояний, которые могут требовать досрочного прерывания беременности по медицинским показаниям.
Гомоцистеин, свободно проходя через плаценту, может оказывать тератогенное и фетотоксическое действие. Доказано, что гипергомоцистеинемия является одной из при- чин анэнцефалии и spina bifida.
Однако данный вид тромбофилии может быть не только причиной, но и спутником акушерских осложнений. Предполагается, что в некоторых случаях проблемы могут быть связаны не только с высоким уровнем гомоцистеина, но и с теми состояниями, которые являются причиной развития гипергомоцистеинемии, а именно, сопутствующая экстрагенитальная патология.
Сегодня значение экстрагенитальной патологии в акушерстве не уменьшается, что связано с неуклонным ростом частоты выявления в связи с ухудшением здоровья и уве- личением удельного веса беременных возрастом 35 лет и старше. Помимо этого, некото- рые тяжелые экстрагенитальные заболевания становятся причиной материнской смерт- ности, ведут к значительному росту перинатальных потерь, а также повышают частоту возникновения осложнений беременности, родов, послеродового периода.
Функционирование ряда органов и систем женского организма во время беременности протекает на грани с патологией, причем имеются «критические сроки», когда легко наступает срыв, декомпенсация той или иной системы или органов. Такой эффект может быть связан как с иммунной перестройкой реактивности женского организма в сторону су- прессии, так и изменением нейроэндокринной регуляции. К общим принципам патогенеза, присущим практически всем или очень многим экстрагенитальным патологиям, относят активизацию свободно-радикальных процессов, вплоть до возникновения оксидативного стресса, нарушение структурно-функциональных свойств мембран, эндотелиальную ди- сфункцию. Именно оксидативный стресс при различных соматических болезнях оказыва- ет влияние на метаболизм гомоцистеина, в результате чего повышается концентрация последнего на фоне избыточного окисления и истощения плазменных антиоксидантов [2].
В настоящее время важная роль в патогенезе сосудистых заболеваний, а именно, артериальной гипертензии, отводится циркулирующим в крови факторам воспаления и прокоагулянтам, к которым относится и повышенный уровень гомоцистеина. Некоторые авторы сообщают о сочетании гипергомоцистеинемии и гипотиреоза (именно повышени- ем уровня гомоцистеина можно объяснить большую распространенность сосудистых по- ражений при данной патологии) [7]. Повышение содержания гомоцистеина в крови проис- ходит также при нарушении функции почек, при этом отмечается его положительная кор- реляция с концентрацией креатинина в крови.
Поэтому решение вопросов прогнозирования, профилактики и лечения экстрагени- тальных заболеваний остается актуальной проблемой современного акушерства, так как одним из осложнений, ухудшающих течение беременности у женщин данной категории, является развитие преэклампсии [1].
Во многих случаях каждый из перечисленных этиопатогенетических факторов в от- дельности может не сопровождаться патологическим течением беременности. Однако их сочетание приводит к значительному снижению адаптационных способностей организма женщины к условиям гестации и может стать своего рода «триггером» в каскаде патоло- гических реакций развития генерализованной микроангиопатии и тромбофилии. Отсюда вероятен высокий риск нарушений плацентации и, как следствие этого, развитие привыч- ного невынашивания, плацентарной недостаточности, ВЗРП, позднего гестоза, состояний, угрожающих по отслойке плаценты, акушерским кровотечениям, внутриутробной гибели плода [7].
Цель исследования — оценка роли гипергомоцистеинемии в развитии осложнений течения беременности у женщин с репродуктивными потерями в анамнезе на фоне экстрагенитальной патологии, а также изучение корреляции степени выраженности тех или иных осложнений с уровнем гомоцистеина и определенными соматическими нозология- ми.
Материал и методы исследования
Для решения поставленных задач было проведено комплексное динамическое обследование 218 женщин с привычным невынашиванием (2 и более выкидышей или заме- рших беременностей в анамнезе в термине гестации 8–12 недель) в возрасте 19–35 лет, а также 40 женщин с неотягощенным акушерским и соматическим анамнезом, которые составили контрольную группу. Исследование проводилось на базе городской клиничес- кой больницы «Центр матери и ребенка» г. Винницы и Центра планирования семьи обла- стной клинической больницы им. Н.И. Пирогова. Все женщины основной группы имели факторы риска перинатальных потерь, связанных с тромбофили ческими нарушениями, установленные на основании данных анамнеза и особенностей течения предыдущих беременностей. Из исследования были исключены женщины с хромосомными аберрация- ми, анатомическими дефектами, эндокринными нарушениями и аутоиммунными заболе- ваниями. У всех женщин тщательно изучался анамнез, проводились общепринятые клинико-лабораторные исследования, определение гормонального статуса и инструмента- льные обследования. Определение уровня гомоцистеина в плазме венозной крови про- водили иммуноферментным методом с использованием наборов фирмы «Аbbort» (США). Также всем беременным для оценки состояния и развития плода в динамике проводи- лось УЗИ, КТГ, допплерометрическое обследование маточно-плацентарного и плодового кровотока.
Результаты исследований и их обсуждение
В результате проведенных исследований у 187 (86%) женщин из 218 обследованных с привычным невынашиванием был выявлен тромбофилический маркер осложнения те- чения беременности в виде гипергомоцистеинемии. Все участницы исследования были разделены на 3 группы: 120 пациенток имели различную экстрагенитальную патологию и составили I (основную) группу для выявления взаимосвязи осложнений течения беремен- ности на фоне соматических заболеваний и уровня гомоцистеина; во II группу (сравнения) вошло 67 женщин с диагностированной гипергомоцистеинемией и отсутствием экстраге- нитальной патологии; III (контрольную) группу представили 40 женщин с неотягощенным акушерским и соматическим анамнезом.
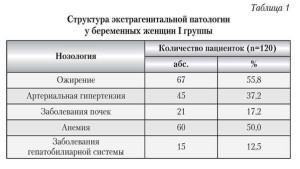
Структура экстрагенитальной патологии в I группе была представлена нарушением жирового обмена в виде ожирения I–II степени у 67 (55,8%) пациенток, артериальной ги- пертензией — у 45 (37,2%) женщин до наступления данной беременности, заболеваний почек — у 21 (17,2%) и гепатобилиарной системы — у 15 (12,5%), анемии беременных легкой степени — у (50,3%). У многих женщин этой группы было отмечено сочетание не- скольких экстрагенитальных заболеваний (табл. 1).
С.И.Жук,С.Б.Чечуга, Винницкий национальный медицинский университет им. Н.И. Пирогова
Введение
Несмотря на значительные достижения и определенные успехи в вопросах диагностики и лечения преждевременного прерывания беременности, сегодня проблема невы- нашивания остается наиболее актуальной в акушерстве. Частота данной патологии не имеет тенденции к снижению, в свя-зи с чем возникает необходимость разработки новых методов ее прогнозирования, профилактики, диагностики и коррекции. Исследования по- следних лет показали, что в основе многих видов аку-шерской патологии лежит развитие генерализованных микроангиопатий и тромбофилий, связанных с гипергомоцистеинеми- ей. Клиническим проявлением этого патологического состояния могут быть раннее нача- ло и/или тяжелое течение гестоза, фетоплацентарная недостаточность, отслойка плацен- ты, задержка развития плода, его внутриутробная гибель. В свою очередь, не утратила актуальности проблема экстрагенитальных заболеваний в патогенезе невынашивания беременно-сти, которые имеют немаловажное значение для матери и плода и могут ос- ложнять течение гестационного периода.
Несмотря на многочисленные исследования, посвященные изучению этиологии и патогенеза преждевременного прерывания беременности, частота этой патологии остае- тся высокой и колеблется в пределах 10–25% от их общего числа зарегистрированных случаев [6]. Согласно обобщенным данным литературы, 15–20% клинически диагности- рованных беременностей заканчивается спон-танным прерыванием, при этом на І три- местр приходится до 78–80% случаев, а угрозой выкидыша осложняется течение бере- менности почти у 40% женщин [4]. Диагностика и лечение этой патологии затруднительна, так как в большинстве случаев невозможно определить факторы, препятст-вующие нор- мальному течению беременности.
Этиологические причины невынашивания беременности разнообразны. Среди них можно выделить:
— хромосомные нарушения, которые наследуются от родителей или возникают de novo (чаще транслокации, реже — инверсии хромосом);
— гормональные нарушения — первичная НЛФ, гиперандрогения, сахарный диабет 1-го и 2-го типа, заболевания щитовидной железы, которые могут приводить к формированию НЛФ;
— инфекционные заболевания, чаще обуславливающие прерывание беременности на более поздних сроках;
— аутоиммунные факторы (повышенные уровни антител к кардиолипину и другим фос- фолипидам, гликопротеидам, нативной и денатурированной ДНК, факторам щитовидной железы);
— аллоиммунные факторы, при которых причиной невынашивания беременности являет- ся соот-ношение антигенов тканевой совместимости у супружеской пары;
— анатомические изменения половых органов (пороки развития, внутриматочные сине- хии, истми-ко-цервикальная недостаточность, генитальный инфантилизм и т. д.);
— тромбофилические факторы (наследственные и приобретенные).
Ретроспективные исследования последних лет показали достаточно большую распространенность среди женщин, страдающих привычным невынашиванием беременности, генерализованных микроангиопатий и тромбофилий, связанных с иммунными нарушениями, гипергомоцистеинемией, наследственным дефектам гемостаза [1]. По данным миро- вой литературы, роль тромбофилии в структуре причин невынашивания беременности составляет от 40 до 75%.
В современных публикациях значительная роль в патогенезе микроциркуляторных и тромботических осложнений в акушерстве отводится гипергомоцистеинемии [3]. Гомоцистеин — это серосодержащая аминокислота, образующаяся в процессе обмена метионина и цистеина. Получаемый с пищей в составе белка метионин метаболизируется с образованием S-аденозил¬гомоцистеин, который в результате гидролиза превращается в гомоцистеин. В процессе мета¬болизма гомоцистеи-на важную роль играют витамины В6, В12 и фолиевая кислота. Гомоцистеин обладает выражен-ным токсическим действием на клетку. В случае появления избытка гомоцистеина в организме, он начинает накапли- ваться в крови и оказывать повреждающее действие на эндотелий сосудов, что значительно повышает риск развития тромбозов. Кроме того, высокие уровни гомоцистеина усиливают агрегацию тромбоцитов вследствие снижения синтеза эндотелием релаксирующего фактора и NO, индукции тканевого фактора и стимуляции пролиферации гладко- мышечных клеток.
Причиной возникновения гипергомоцистеинемии может служить как врожденный, так и приобре-тенный дефицит факторов его метаболизма. Различают генетическую форму гипергомо-цистеинемии, связанную с мутацией гена фермента метилентетрагидрофолат- редуктазы (MTHFR) в положении 677 (замена аминокислоты С на Т) и приобретенную форму, связанную с дефицитом витаминов В12, В6, фолиевой кислоты или с некоторыми системными заболеваниями (коллагено-зы, ревматоидный артрит) [5].
Нормальное содержание гомоцистеина в плазме крови составляет 5–15 мкмоль/л. Гипергомоцис-теинемией считается превышение показателя более 100 мкмоль/л, что, как правило, сопровождае-тся гомоцистеинурией. Средний (31–100 мкмоль/л) и легкий (15–30 мкмоль/л) уровни гипергомоци-стеинемии не сопровождаются выделением гомоцистеина
с мочой. При беременности концентра-ция гомоцистеина в норме снижается приблизите- льно на 50% от допустимого уровня в период между І и ІІ триместрами беременности и возвращается к норме на 2–4-й день послеродового периода.
Возникающие вследствие гипергомоцистеинемии микротромбообразования и нарушения микроциркуляции приводят к целому ряду акушерских осложнений. Нарушение плацентации и фетоплаце-нтарного кровообращения могут быть причиной репродуктивной недостаточности: невынашивание беременности и бесплодия в результате дефектов имплантации зародыша. На более поздних ста-диях беременности гипергомоцистеинемия является причиной развития хронической фетоплацен-тарной недостаточности и хронической внутриутробной гипоксии плода. Это приводит к рождению детей с низкой массой тела и снижению функциональных резервов всех жизнеобеспечивающих систем новорожденного и развитию целого ряда осложнений периода новорожденности. Гиперго- моцистеинемия может быть одной из причин развития генерализованной микроангиопа- тии во вто-рой половине беременности, проявляющейся в виде позднего гестоза. Для ги- пергомоцистеинемии характерно развитие тяжелых, часто неуправляемых состояний, ко- торые могут требовать досроч-ного прерывания беременности по медицинским показаниям. Гомоцистеин, свободно проходя через плаценту, может оказывать тератогенное и фетотоксичес-кое действие. Доказано, что гипергомоцистеинемия является одной из причин анэнцефалии и spina bifida.
Однако данный вид тромбофилии может быть не только причиной, но и спутником акушерских осложнений. Предполагается, что в некоторых случаях проблемы могут быть связаны не только с высоким уровнем гомоцистеина, но и с теми состояниями, которые являются причиной развития гипергомоцистеинемии, а именно, сопутствующая экстрагенитальная патология.
Сегодня значение экстрагенитальной патологии в акушерстве не уменьшается, что связано с неук-лонным ростом частоты выявления в связи с ухудшением здоровья и уве- личением удельного веса беременных возрастом 35 лет и старше. Помимо этого, некото- рые тяжелые экстрагенитальные заболевания становятся причиной материнской смерт- ности, ведут к значительному росту перина-тальных потерь, а также повышают частоту возникновения осложнений беременности, родов, послеродового периода.
Функционирование ряда органов и систем женского организма во время беременности протекает на грани с патологией, причем имеются «критические сроки», когда легко наступает срыв, декомпенсация той или иной системы или органов. Такой эффект может быть связан как с иммунной перестройкой реактивности женского организма в сторону су- прессии, так и изменением нейроэн-докринной регуляции. К общим принципам патогенеза, присущим практически всем или очень мно-гим экстрагенитальным патологиям, отно- сят активизацию свободно-радикальных процессов, вплоть до возникновения оксидатив- ного стресса, нарушение структурно-функциональных свойств мембран, эндотелиальную дисфункцию. Именно оксидативный стресс при различных соматических болезнях оказы- вает влияние на метаболизм гомоцистеина, в результате чего повышается кон-центрация последнего на фоне избыточного окисления и истощения плазменных антиоксидантов [2].
В настоящее время важная роль в патогенезе сосудистых заболеваний, а именно, артериальной гипертензии, отводится циркулирующим в крови факторам воспаления и прокоагулянтам, к которым относится и повышенный уровень гомоцистеина. Некоторые авторы сообщают о сочетании гипергомоцистеинемии и гипотиреоза (именно повышени- ем уровня гомоцистеина можно объяснить большую распространенность сосудистых поражений при данной патологии) [7]. Повышение содержания гомоцистеина в крови происходит также при нарушении функции почек, при этом от-мечается его положительная ко- рреляция с концентрацией креатинина в крови.
Поэтому решение вопросов прогнозирования, профилактики и лечения экстрагени- тальных заболе-ваний остается актуальной проблемой современного акушерства, так как одним из осложнений, ухудшающих течение беременности у женщин данной категории, является развитие преэклампсии [1].
Во многих случаях каждый из перечисленных этиопатогенетических факторов в от- дельности мо-жет не сопровождаться патологическим течением беременности. Однако их сочетание приводит к значительному снижению адаптационных способностей организма женщины к условиям гестации и может стать своего рода «триггером» в каскаде патологических реакций развития генерализо-ванной микроангиопатии и тромбофилии. Отсюда вероятен высокий риск нарушений плацентации и, как следствие этого, развитие привычного невынашивания, плацентарной недостаточности, ВЗРП, позднего гестоза, состояний, угрожающих по отслойке плаценты, акушерским кровотечени-ям, внутриутробной гибели плода [7].
Цель исследования — оценка роли гипергомоцистеинемии в развитии осложнений течения бере-менности у женщин с репродуктивными потерями в анамнезе на фоне экстрагенитальной патоло-гии, а также изучение корреляции степени выраженности тех или иных осложнений с уровнем го-моцистеина и определенными соматическими нозологиями.
Материал и методы исследования
Для решения поставленных задач было проведено комплексное динамическое об- следование 218 женщин с привычным невынашиванием (2 и более выкидышей или замерших беременностей в анамнезе в термине гестации 8–12 недель) в возрасте 19–35 лет, а также 40 женщин с неотягощенным акушерским и соматическим анамнезом, которые составили контрольную группу. Иссле-дование проводилось на базе городской клиничес- кой больницы «Центр матери и ребенка» г. Вин-ницы и Центра планирования семьи областной клинической больницы им. Н.И. Пирогова. Все же-нщины основной группы имели факторы риска перинатальных потерь, связанных с тромбофили ческими нарушениями, установленные на основании данных анамнеза и особенностей течения предыдущих бе- ременностей. Из исследования были исключены женщины с хромосомными абер- рациями, анатомическими дефектами, эндокринными нарушениями и аутоиммунными за- болева-ниями. У всех женщин тщательно изучался анамнез, проводились общепринятые клинико-лабораторные исследования, определение гормонального статуса и инструмен- тальные обследо-вания. Определение уровня гомоцистеина в плазме венозной крови проводили иммунофермент-ным методом с использованием наборов фирмы «Аbbort» (США). Также всем беременным для оценки состояния и развития плода в динамике про- водилось УЗИ, КТГ, допплерометрическое об-следование маточно-плацентарного и плодового кровотока.
Результаты исследований и их обсуждение
В результате проведенных исследований у 187 (86%) женщин из 218 обследованных с привычным невынашиванием был выявлен тромбофилический маркер осложнения течения беременности в виде гипергомоцистеинемии. Все участницы исследования были разделены на 3 группы: 120 па-циенток имели различную экстрагенитальную патологию и составили I (основную) группу для выя-вления взаимосвязи осложнений течения бере- менности на фоне соматических заболеваний и уровня гомоцистеина; во II группу (сравнения) вошло 67 женщин с диагностированной гипергомо-цистеинемией и отсутствием экстрагенитальной патологии; III (контрольную) группу представили 40 женщин с неотягощенным акушерским и соматическим анамнезом.
Структура экстрагенитальной патологии в I группе была представлена нарушением
жирового об-мена в виде ожирения I–II степени у 67 (55,8%) пациенток, артериальной ги- пертензией — у 45 (37,2%) женщин до наступления данной беременности, заболеваний почек — у 21 (17,2%) и гепа-тобилиарной системы — у 15 (12,5%), анемии беременных легкой степени — у (50,3%). У многих женщин этой группы было отмечено сочетание не- скольких экстрагенитальных заболеваний (табл. 1).
Определение уровня гомоцистеина у обследованных женщин выявило следующую закономерность: содержание гомоцистеина у беременных I группы составило 48,5±0,7 мкмоль/л (р<0,05), что соответствовало среднему уровню гипергомоцистеинемии, во II группе количество гомоцистеина в плазме венозной крови соответствовал легкому повы- шению уровня — 24,3±0,6 мкмоль/л (р<0,005), в контрольной группе определялась нор- мальная концентрация гомоцистеина — 12,7±0,6 мкмоль/л (р<0,05) (рис. 1).
Показатели концентрации гомоцистеина у женщин I группы с различными экстраге- нитальными забо-леваниями соответствовали среднему уровню гипергомоцистеинемии и составляли при артериа-льной гипертензии 52,6±0,8 мкмоль/л, при нарушении жирового обмена — 43,7±0,7 мкмоль/л, при патологии почек — 32,4±0,7 мкмоль/л и гепатобилиарной системы — 35,2±0,6 мкмоль/л, при сомати-ческих нозологиях на фоне анемии — 38,2±0,7 мкмоль/л (р<0,05) (рис. 2).
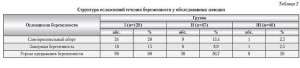
При анализе течения беременности у женщин I группы самопроизвольное прерывание беременности в различные сроки произошло у 24 (20%) пациенток, замирание в ран- них сроках — у 18 (15%), угрозой выкидыша осложнялось течение беременности у 96 (80%) женщин. Во II и III группах само-аборты были отмечены у 9 (13,4%) и 1 (2,5%) пациенток, замершая беременность — у 6 (8,9%) и 1 (2,5%), клиника угрозы прерывания — у 38 (56,7%) и 8 (20%) женщин соответственно. Структура различных осложнений беременности в группах исследования представлена в табл. 2.
Таким образом, в связи с репродуктивными потерями в основной группе под наблюдением оста-лось 78 пациенток, в группе сравнения — 52, в контрольной — 38, а в целом — 168 беременных женщин.
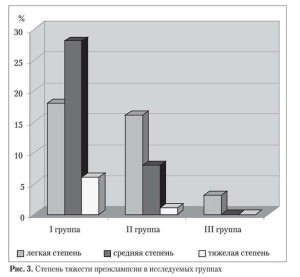
По мере прогрессирования беременности у 80 (48%) женщин диагностировано развитие преэклампсии в разных сроках и степенях тяжести: 52 (61,5%) случая — в І группе, 25 (48%) — во ІІ и 3 (7,8%) — в ІІІ.
В І группе у 28 (53,8%) беременных наблюдалась преэклампсия средней степени тяжести, у 18 (34,6%) — легкая форма, у 6 (11,5%) — тяжелой степени (три из них были досрочно родоразрешены в связи с неэффективностью медикаментозной терапии, причем в одном случае имела место преждевременная отслойка нормально расположенной плаценты). Во ІІ группе преэклампсию легкой степени выявили у 16 (64%) пациенток, средней степени — у 8 (32%), 1 женщина была госпитализирована по поводу преэклампсии тяжелой степени, однако успешно медикаментозно скорректирована, что позволило пролонгировать беременность. В контрольной группе лишь 3 женщины имели легкую степень преэклампсии (рис. 3).
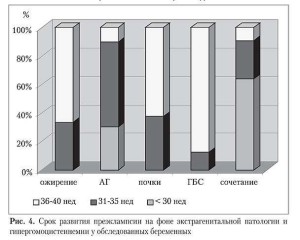
При анализе течения преэклампсии у женщин с различной экстрагенитальной патологией прослеживалась следующая закономерность: наиболее тяжелое течение данного осложнения гестационного периода, а именно, преэклампсия средней и тяжелой степе- ни, наблюдалась у беременных с артериальной гипертензией и сочетанной соматической патологией на фоне анемии. Гестоз сред-ней степени тяжести был диагностирован у 9 (32%) пациенток с артериальной гипертензией и у 13 (46,4%) — с различным сочетанием экстрагенитальной патологии, преэклампсия тяжелой степени наблюдалась у 2 (33,3%) и 3 (50%) женщин соответственно. У беременных с соматическими забо-леваниями отме- чалось более раннее развитие преэклампсии (28–35 недель гестации). При патологии почек, гепатобилиарной системы и нарушении жирового обмена преэклампсия отмеча- лась преимущественно на поздних сроках (36–40 недель) на фоне более легкого ее течения (табл. 3, рис. 4).
Таким образом, проведенное исследование показало, что в патогенезе невынашивания и осложненного течения беременности, а также различной экстрагенитальной патологии одним из основных этиологических факторов является гипергомоцистеинемия. Особенно это касается сердечно_сосудистых заболеваний, где важную роль играет по- вышенный уровень в крови беременных гомоцистеина, который оказывает прямое токсическое действие на стенку сосудов, приводит к усилению перикисного окисления липидов, увеличению образования свободных радикалов, стиму-лирует пролиферацию гладкомышечных клеток, приводит к активации тромбоцитов, увеличению синтеза тромбоксана А2, нарушениям фибринолиза, что вызывает развитие гиперкоагуляции. По-вышенное содержание гомоцистеина в крови при патологии почек объясняется возникновением окислительного стресса, который в последствии приводит к избыточному окислению через миело-оксидазный путь с образованием пере кисных соединений липидов и гомоцистеина, параллельно происходит истощение плазменных антиоксидантов. В ряде случаев гипер- гомоцистеинемия соче-тается с нарушением жирового обмена и инсулинорезистентнос- тью, что связано со способностью гомоцистеина повреждать структуру и функцию мито- хондрий, а также с влиянием на экспрессию митохондриальных генов у больных с ожире- нием и инсулинорезистентностью. Метаболизм гомо-цистеина тесно связан с обменом фолатов, вследствие чего нередко развивается анемия, которая осложняет течение гес- тационного периода у пациенток с гипергомоцистеинемией.
Выводы
Невынашивание беременности представляет собой полиэтиологический синдром, в развитии и реализации которого принимают участие важнейшие системы организма матери и плода. Данная патология обусловлена рядом причин, которые могут действовать либо одновременно, либо при-соединяться по мере прогрессирования беременности.
Анализируя полученные в ходе исследования данные, можно сделать вывод, что одним из основных этиопатогентических факторов невынашивания беременности является генерализованная микроангиопатия и тромбофилия на фоне гипергомоцистеинемии. Сочетание повышенного уровня гомоцистеина и различных экстрагенитальных заболева- ний осложняет течение беременности, повышает риск репродуктивных потерь, плацента- рной недостаточности, задержки внутриутробно-го развития плода, позднего гестоза, что может быть связано с этиологическим влиянием гиперго-моцистеинемии на возникнове- ние различных соматических патологий. В свою очередь, имеющиеся экстрагенитальные патологии усугубляют микротромбообразование и нарушение микроцирку-ляции на фоне повышенной концентрации гомоцистеина. Таким образом, женщины с перинатальными потерями, связанными с тромбофилическими нарушениями, имеющие различную экстра- генитальную патологию, формируют группу повышенного риска относительно невынашивания беременности и требуют поиска эффективных способов профилактики и коррекции возможных осложнений гестационного периода.
ЛИТЕРАТУРА
1. Баранова Е.И., Большакова О.О. Клиническое значение гомоцистеинемии (обзор лите- ратуры) // Consilium medicum. — 2004. — Т. 10 (№1).
2. Кашежева А.З., Ефимов В.С. Гипергомоцистеинемия в патогенезе заболеваний коро- нарных со-судов // Кардиология. Хирургия. — 2007. —№ 11 (52).
3. Макацария А.Д., Бицадзе В.О. Вопросы патогенза тромбофилии и тромбозов у бере- менных с потерями плода в анамнезе // Акушерство и гинекол. — 1999.
4. Невынашивание беременности: проблемы и тактика лечения / Чайка В.К., Демина Т.Н., Коло-мийцева А.Г. и др. — Севастополь: Вебер, 2001.
5. Полиморфизм генов фолатного обмена и болезни человека / Фетисова И.Н., А.С., Доб- ролюбов Липин М.А. и др. // Вестн. новых мед. технол. — 2007. — Т. 10 (№1).
6. Сенчук А.Я., Венцковский Б.М., Моложанов И.А. Наследственные и приобретенные тромбофи-лии в акушерско_гинекологической практике. — К., 2003.
7. Тарханова И.Ю. Влияние гомоцистеина на сосудисто-тромбоцитар_ный и плазменный гемостаз у больных артериальной гипертензией: Автореф. дис. … канд. мед. наук. — Уфа, 2007. — 32 с.










Комментировать