Респираторные заболевания и их бактериальная этиология. Антибиотикотерапия при ОРВИ. Выбор антибиотика.
Белорусской медицинской академии последипломного образования
Жерносек В.Ф.
Около 10-15% острых респираторных заболеваний имеют бактериальную этиологию [22]. Первичную бактериальную этиологию как основное заболевание, а не осложнение острой респираторной вирусной инфекции (ОРВИ) могут иметь тонзиллиты/тонзиллофарингиты, назофарингиты стрептококковой, микоплазменной и хламидийной этиологии, синуситы, пневмония, отдельные случаи бронхита, редко встречающиеся эпиглоттиты.
При выборе показаний для назначения антибиотика ребенку с симптомами острого респираторного заболевания, необходимо ориентироваться на характер общих нарушений, отдельных синдромов и респираторных симптомов (табл. 1).
Таблица 1. [17] 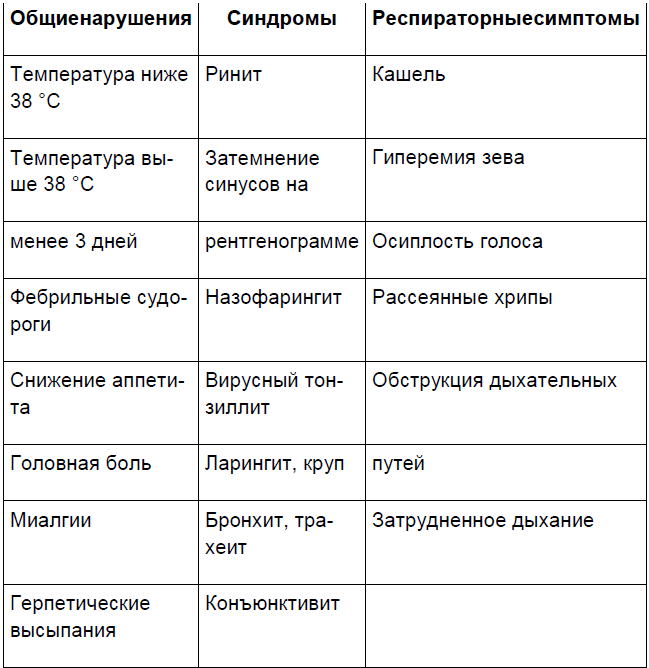
При неосложненном течении острой респираторной вирусной инфекции антибиотики могут быть показаны: при рецидивирующем отите в анамнезе; неблагоприятном преморбидном фоне (тяжелой гипотрофии, рахите, пороках развития) у ребенка в возрасте до 6 мес.; наличии клинических признаков иммунодефицитного состояния.
Антибиотикотерапия при ОРВИ обязательна при наличии явных бактериальных очагов: гноетечении из уха, гноетечении из глаз, паратонзиллярном абсцессе, флюктуации лимфоузла, отеке лица (орбиты, шеи), физикальных признаках пневмонии.
Системная антибиотикотерапия детям с острым респираторным заболеванием также показанапри наличии гнойных осложнений (гнойный синусит, гнойный лимфаденит, паратонзиллярный абсцесс, нисходящий ларинготрахеит); стрептококкового (группы А) тонзиллита; анаэробной ангины; острого среднего отита; бактериального синусита (при сохранении клинических и рентгенологических изменений в пазухах через 10?14 дней от начала ОРВИ); респираторного микоплазмоза и хламидиоза (бронхит, атипичная пневмония); бактериальной пневмонии.
Помимо явных бактериальных очагов инфекции антибактериальная терапия может быть начата при выявлении подозрительных симптомов, до уточнения диагноза (табл. 2). После уточнения диагноза показания для дальнейшей антибактериальной терапии пересматриваются.
Таблица 2. [17] 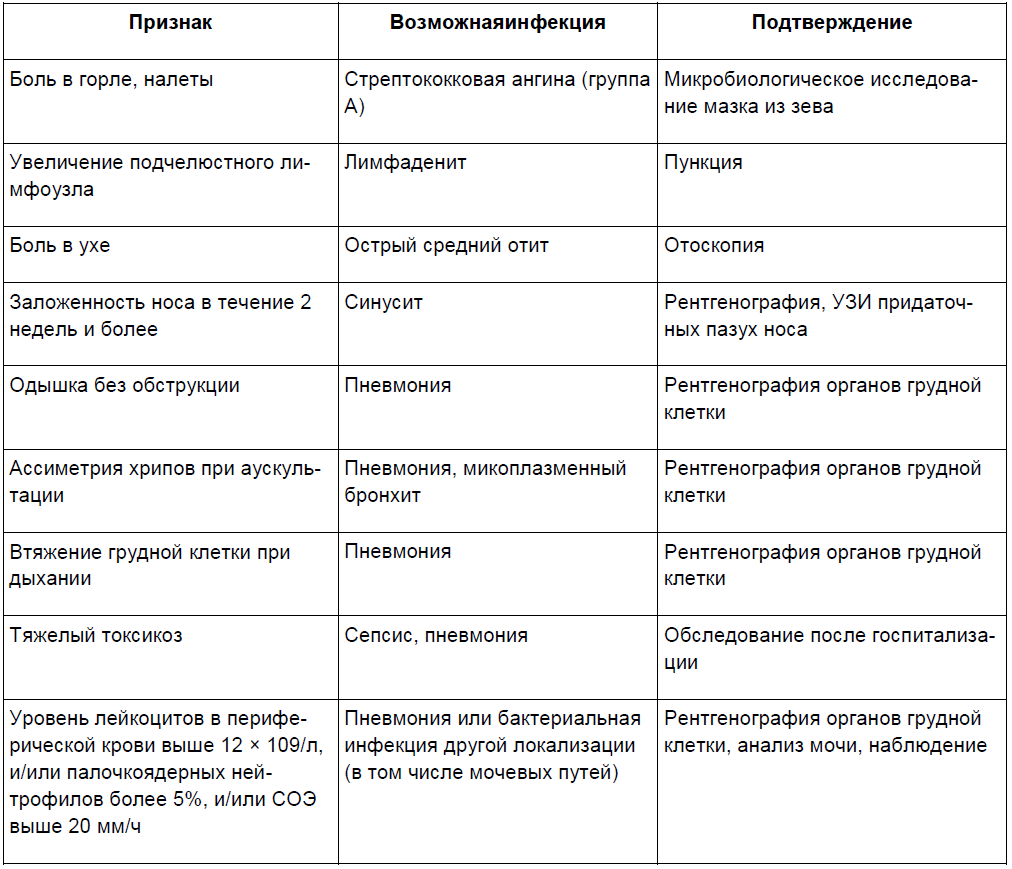
Этиология бактериальных заболеваний, сопутствующих острой респираторной вирусной инфекции, и бактериальных инфекций нижних и верхних дыхательных путей является определяющей в выборе стартовой антибактериальной терапии.
Основными возбудителями острых внебольничных бактериальных заболеваний верхних и нижних дыхательных путей у детей являются Streptococcuspneumoniae, Haemophilusinfluenzae, Moraxellacatarrhalis, Streptococcuspyogenes, Chlamydophilapneumoniae, Mycoplasmapneumoniae, в раннем возрасте ± Chlamydiatrachomatis. При остром бактериальном синусите лидируютStreptococcuspneumoniae, Haemophilusinfluenzae и Moraxellacatarrhalis, реже регистрируются как причина Streptococcuspyogenes, Staphylococcusaureus и анаэробы. В отличие от острых хронические синуситы имеют полимикробную этиологию, большую роль в их развитии играют анаэробы. Этиологическая структура острых отитов практически не отличается от спектра возбудителей острых синуситов: Streptococcuspneumoniae, Haemophilusinfluenzae, Moraxellacatarrhalis.Развитие острого стрептококкового тонзиллита/тонзиллофарингита обусловлено Streptococcuspyogenes[11, 30]. Спектр возбудителей внебольничных пневмоний у детей зависит от возраста и варианта течения болезни (табл. 3).
Таблица 3. [10] 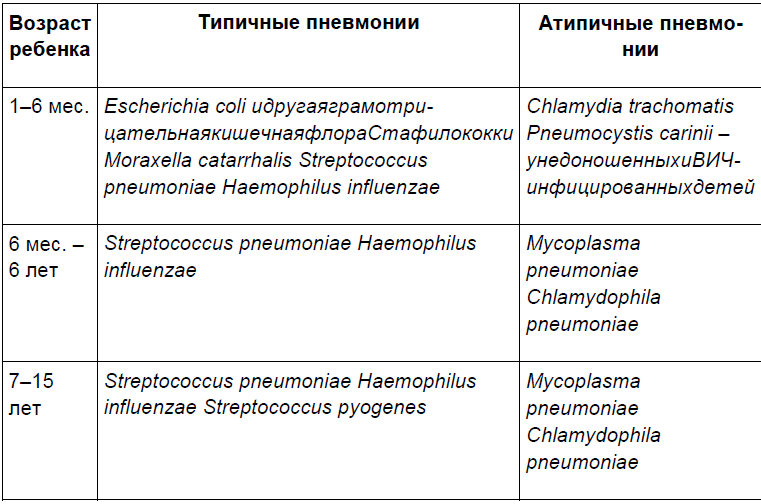
В основе лечения бактериальных инфекций дыхательных путей лежит антибиотикотерапия. Задача терапии во многом облегчалась бы при наличии «идеального¬ антибиотика. «Идеальный¬ антибиотик должен обладать следующими свойствами: иметь активность в отношении ключевых возбудителей; создавать оптимальные концентрации в очаге инфекции для подавления возбудителей и профилактики развития резистентности; обладать клинической и бактериологической эффективностью, доказанной в контролируемых клинических исследованиях; характеризоваться хорошим профилем безопасности и удобством применения; отличаться оптимальным соотношением стоимости/эффективности.
Выбор антибиотика в педиатрической практике также определяется следующими особенностями [21]: общим правилом выбора антибиотика у детей является назначение как наиболее эффективного, так и максимально безопасного препарата; предпочтение отдается препаратам для приема внутрь, а также имеющим детские лекарственные формы; при назначении антибиотиков необходимо оценивать функциональное состояние почек и печени, в зависимости от их характеристик проводить коррекцию возрастной дозы.
Кроме того, при выборе стартового антибиотика для лечения заболеваний органов дыхания следует учитывать ряд факторов. Имеет значение нозологическая форма инфекционно-воспалительного процесса, степень чувствительности возбудителя к антимикробным средствам, активность лекарственного препарата в отношении конкретного возбудителя. Необходимо также принимать во внимание возможность достижения терапевтической концентрации антибиотика в поврежденных органах и тканях.
Анализ чувствительности основным возбудителей бактериальных инфекций дыхательных путей к антибиотикам имеет важное значение для рациональной антибактериальной терапии.
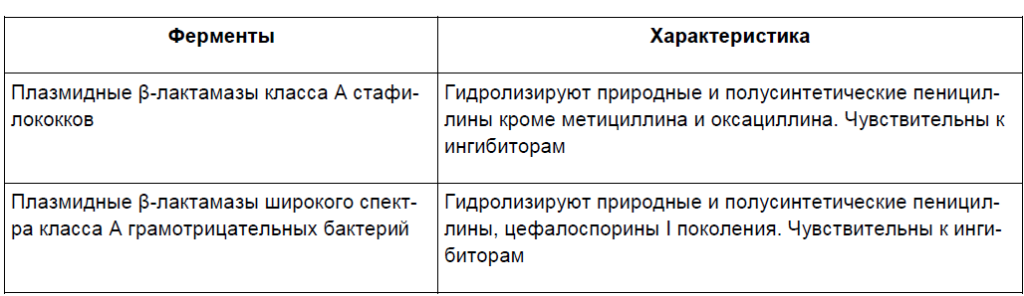
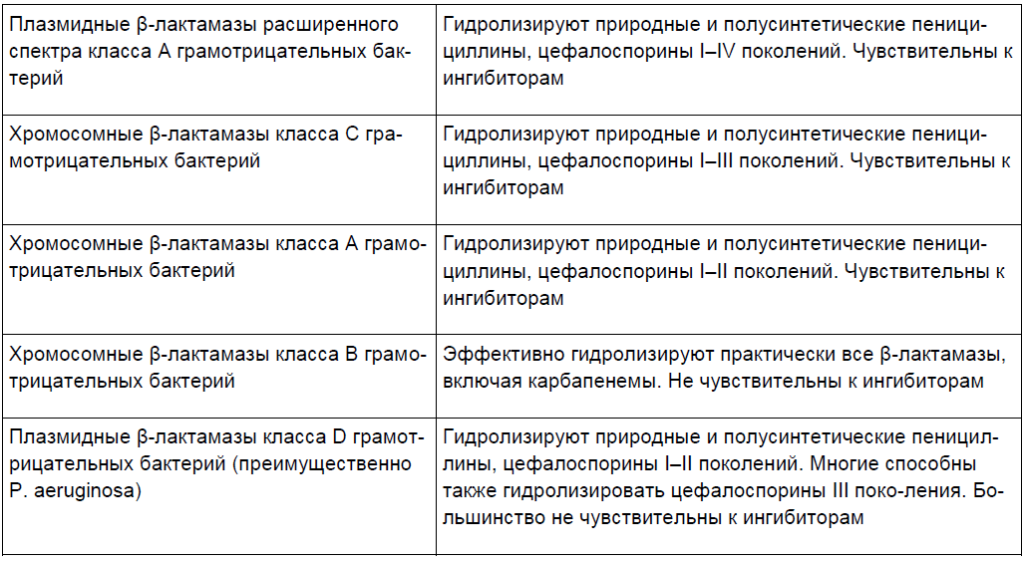
Проблемой антибиотикотерапии является резистентность микроорганизмов к антибиотикам. Она может быть природной и приобретенной. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется. Формирование приобретенной резистентности во всех случаях обусловлено генетически. В ее основе лежит приобретение новой генетической информации или изменение уровня экспрессии собственных генов. Выделены следующие биохимические механизмы устойчивости бактерий к антибиотикам: модификация мишени действия, инактивация антибиотика, активное выведение антибиотика из микробной клетки (эффлюкс), нарушение проницаемости внешних структур микробной клетки, формирование метаболического «шунта¬. При лечении нетяжелых бактериальных инфекций чаще всего в клинической практике используются бета-лактамные антибиотики. Наиболее частой причиной устойчивости микроорганизмов к бета-лактамным антибиотикам является их ферментативная инактивация в результате гидролиза одной из связей бета-лактамного кольца ферментами бета-лактамазами. Описано более 200 ферментов микроорганизмов, которые могут разрушать бета-лактамное кольцо. Они различаются между собой по трем основным свойствам. Первое ± субстратный профиль. Он определяет способность к преимущественному гидролизу тех или иных бета-лактамов: пенициллинов или цефалоспоринов, тех и других в равной степени. Второе свойство ± различие по локализации кодирующих генов: плазмидная или хромосомная. Этот признак определяет эпидемиологические особенности резистентности. При плазмидной локализации наблюдается быстрое внутри-и межвидовое распространение резистентности. При хромосомной же локализации генов наблюдается распространение резистентного клона. Этот процесс более медленный. Третье свойство ± чувствительность к определенным ингибиторам бета-лактамаз: клавулановая кислота, сульбактам, тазабактам. Выделяют бета-лактамазы 4 классов. Бета-лактамазы классов A, C и D относят к ферментам «серинового¬ типа, в активном центре которых находится аминокислота серин. Ферменты класса D относят к металлоэнзимам, в качестве кофермента в них присутствует атом цинка. Характеристика наиболее распространенных бета-лактамаз представлена в табл. 4 [16].
Таблица 4. [16]
Препаратами выбора в лечении внебольничных инфекций дыхательных путей при типичной их этиологии считаются препараты из группы аминопенициллинов [30]. Каково же состояние резистентности основных патогенов, вызывающих внегоспитальные инфекции дыхательных путей к аминопенициллинам и каковы пути преодоления их резистентности к антибиотикам этой группы?В «Декларации по борьбе с антимикробной резистентностью¬, принятой на Всемирном дне резистентности 16 сентября 2000 г., антимикробные препараты рассматриваются как невосстановимые ресурсы, и подчеркивается, что антибиотики ± это социальные препараты. Резистентность к антибиотикам создается человеком, и только человек может решить эту проблему [7]. Учитывая рост резистентности патогенной микрофлоры к антибиотикам, Всемирная организация здравоохранения в 2001 г. приняла «Глобальную стратегию ВОЗ по сдерживанию устойчивости к противомикробным препаратам¬, которая предусматривает реализацию комплекса мер по предупреждению роста антибиотикорезистентности [6].
В «Европейских рекомендациях по надзору за антимикробной резистентностью¬ указывается на необходимость мониторинга в амбулаторных условиях за антибиотикоустойчивостью Streptococcuspneumonia, Streptococcuspyogenes, Haemophilusinfluenzae, Moraxellacatarrhalisи других возбудителей, способных вызывать внебольничные инфекции дыхательных путей [26].
Исследование антимикробной резистентности Streptococcuspneumonia в России в рамках проекта ПеГАС-I показало, что 9% штаммов пневмококков invitro нечувствительны к пенициллину. От 4 до 6% штаммов пневмококка умеренно резистентны или резистентны к различным макролитам, 33% ± к котримаксозолу, 23% ± к тетрациклину, по 2% ± к цефотаксиму и цефепиму. В то же время 99,5% штаммов пневмококков в России чувствительны к амоксициллину и амоксициллину/клавуланату [13]. В динамике с 1999±2003 по 2004±2005 гг. в России в рамках проектов ПеГАС-I и ПеГАС-II продемонстрирована тенденция к росту резистентности Streptococcuspneumoniaк основным антибактериальным препаратам [14]. В то же время чувствительность выделенных в России штаммов Streptococcuspneumonia на основании расчетных фармакокинетических/фармакодинамических пограничных концентраций к амоксициллину и амоксициллину/клавуланату составила 100% [8].
Частота продукции бета-лактамаз основными респираторными патогенами колеблется в широких пределах. Она зависит от частоты применения аминопенициллинов в клинической практике. В странах, где начинают реже назначать аминопенициллины, частота продукции бета-лактамаз респираторными патогенами имеет тенденцию к снижению. Так, по данным обзора публикаций по антибиотикорезистентности [12], частота продукции бета-лактамаз H. influenzaе составляет от 1 до 59%, а M. catarrhalis ± от 61 до100%. Чувствительность выделенных в России штаммов H. influenzaе на основании расчетных фармакокинетических/фармакодинамических пограничных концентраций к амоксициллину составляет 95,5%, а к амоксициллин/клавуланату ± 100% [8].
Важным условием эффективности антимикробной терапии и профилактики рецидивов болезней является полная эрадикация возбудителя. Доказано, что защищенные аминопенициллины (амоксициллин/клавуланат) соответствуют всем условиям, необходимым для эрадикации возбудителей респираторных инфекций [2]. Исследователи высказываются в пользу назначения высоких доз антибиотиков, что не только способствует повышению эффективности антибактериальной терапии, но и дальнейшем может предотвратить рост бактериальной резистентности на популяционном уровне[27].
Streptococcuspyogenes чувствителен к бета-лактамным антибиотикам. К комбинации амоксициллин/клавуланат высокочувствительны анаэробы (бактероиды, пептострептококки) [3, 4].
Таким образом, назначение ингибиторзащищенного пенициллина амоксициллин/клавуланата позволяет преодолеть резистентность большин-ства возбудителей острых внебольничных инфекций дыхательных путей к аминопенициллинам и природным пенициллинам.
Комбинация амоксициллина и клавулановой кислоты является наиболее удачной из всех ингибиторзащищенных аминопенициллинов. Она сочетает положительные свойства амоксициллина (высокую биодоступность при пероральном приеме, отсутствие влияния приема пищи на абсорбцию из желудочно-кишечного тракта, более высокую концентрацию в мокроте по сравнению с ампициллином) и широкий спектр антибактериальной активности, обусловленный ингибированием бета-лактамаз (табл. 5). На основе этой комбинации создан препарат Аугментин, рекомендуемый для стартовой терапии большинства острых респираторных инфекций бактериальной этиологии у детей [24, 30].
Таблица 5. [15] 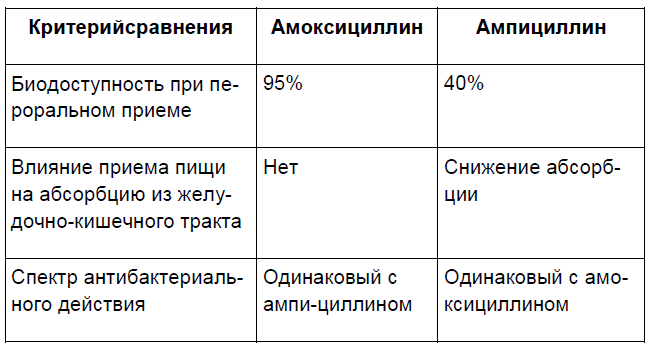

Производятся лекарственные формы Аугментина для трехкратного и двукратного применения (Аугментин 2). Они отличаются по содержанию амоксициллина и клавулановой кислоты. Препарат для двукратного применения (Аугментин 2) назначают из расчета 45 мг/кг массы в сутки по амоксициллину. В препарате Агментина для двукратного применения уменьшена доза клавулановой кислоты. Дело в том, что клавулановая кислота, которая применяется в защищенных пенициллинах, способна у некоторых больных вызывать диарею. Уменьшение количества клавулановой кислоты не снижает эффективность препарата, повышая его переносимость [25, 27, 28].
Форма Аугментина для двукратного применения имеет ряд преимуществ. Хорошо известно, что упрощение схемы терапии, в том числе за счет уменьшения кратности приема препарата, приводит к повышению комплаентности пациентов (соблюдение режима дозирования, выраженное в % от предписанной дозы) и, как следствие, к повышению эффективности терапии [28]. Показано, что комплаентность пациентов выше при использовании аминопенициллинов для двукратного применения. Например, при назначении амоксициллина/клавуланата 2 раза в сутки комплаентность составляет 89,5%, а при использовании формы для трехкратного применения ² 85,4% (p < 0,0001) [25, 27]. Двукратный прием антибиотика удобен не только для самого ребенка, но и для его родителей: чаще соблюдается правильный режим дозирования, ниже вероятность пропуска приема препарата. Применение двукратных форм позволяет значительно снизить частоту побочных эффектов [25]. Так, по данным A. Hoberman и соавт. [27], при назначении амоксициллина/клавуланата в дозе 40 мг/кг/сут в 3 приема частота диареи составила 26,7%, в то время как при использовании двукратной формы в суточной дозе 45 мг/кг диарея встречалась лишь в 9,6% случаев (p < 0,0001). Применение Аугментина в начале еды также позволяет уменьшить частоту диареи. Вместе с тем убедительно доказано, что двукратный режим дозирования амоксициллин/клавуланата по эффективности не уступает приему препарата 3 раза в сутки [25, 27, 28].
К настоящему времени накоплен большой клинический опыт применения Аугментина при синуситах и тонзиллофарингитах, остром среднем отите, острых пневмониях и других респираторных инфекциях бактериальной этиологии у детей [3, 5, 9, 19, 20]. При нетяжелой бактериальной инфекции предпочтительным является оральный путь введения антибиотика. При тяжелых инфекциях или ограничениях для перорального приема (рвота) антибиотик следует вводить парентерально. Оптимальный путь введения ? внутривенный (через венозный катетер). Возможно применение ступенчатой антибактериальной терапии: несколько дней антибиотик вводят парентерально, а затем препарат назначают внутрь. Режимы дозирования Аугментина 2приведены в табл. 6.
Таблица 6.
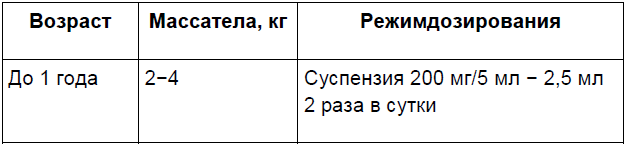
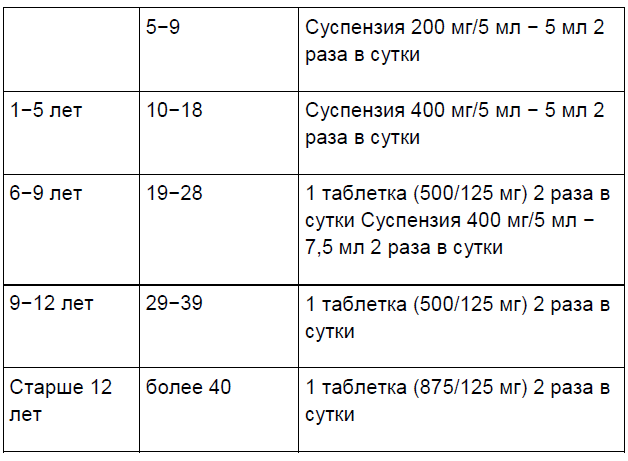
П р и м е ч а н и е: в суспензиях указано количество амоксициллина в 5 мл, в таблетках дано соотношение амоксициллина и клавулановой кислоты.
Антибиотики, рекомендуемые для стартовой и последующей терапии острых внегоспитальных респираторных инфекций бактериальной этиологии, приведены в табл. 7. Необходимо помнить, что минимальная продолжительность терапии Аугментином для обеспечения полной эрадикации патогена должна составлять не менее 7 дней.
Таблица 7.
![Алгоритм антибиотикотерапии острых бактериальных инфекций верхних и нижних дыхательных путей у детей [1, 10, 11, 18, 23, 27] Алгоритм антибиотикотерапии острых бактериальных инфекций верхних и нижних дыхательных путей у детей [1, 10, 11, 18, 23, 27]](https://medprosvita.com.ua/wp-content/uploads/2015/07/12.10-1024x394.png)
Выбор оптимального режима антибактериальной терапии респираторных инфекций и доз препарата у детей способствует повышению ее эффективности, предотвращает развитие осложнений, обеспечивает быструю эрадикацию патогена и предотвращает формирование антибиотикоустойчивости микроорганизмов.
Л И Т Е РА Т У Р А
- Антибактериальная терапия: Практ. руководство / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. ± М., 2000. ± 185 с.
- 2.Бачинская Е.Н. // Инфекции и антимикробная терапия. ± 2004. ± № 1. ± С. 35±38.
- Белобородова Н.В., Прошин В.А., Бачинская Е.Н. Алгоритмы антибиотикотерапии рецидивирующих инфекций дыхательных и мочевыводящих путей у детей: Метод. рекомендации. ± Минск, 2005. ± 17 с.
- Вильямс Д. // Антибиотики и химиотерапия. ± 1997. ± № 10.± С. 5±9.
- Геращенко Т.И. // Медицина для всех. ± 1998. ±№ 2. ± С. 28±30.
- Глобальная стратегия ВОЗ по сдерживанию устойчивости к противомикробным препаратам //http://apps.who.int/medicinedocs/documents/s16343r/s16343r.pd
- Декларации по борьбе с антимикробной резистентностью // http:// www.antibiotic.ru/index.php?doc=106
- Джекобс М. // Клин. микробиол. антимикроб. химиотер. ± 2004. ± № 1. ± С. 22±31
- Дорохова Н.Ф., Шмакова С.Г., Успенская И.А. // Антибиотики и химиотерапия. ± 2001. ±№ 3. ± С. 1±4.
- Жерносек В.Ф. Острые пневмонии у детей: Лекция. ± Минск, 2002. ± 31 с.
- Жерносек В.Ф. // Мед. новости. ± 2005. ±№ 11. ± С. 39±44.
- Зубков М.Н. // Пульмонология. ± 2007. ±№ 5. ± С. 5±13.
- Козлов Р.С., Кречикова О.И., Сивая О.В. и др. // Клин. микробиолог. антимикроб. химиотер. ± 2002. ± № 3. ± С. 267±277.
- Козлов Р.С., Сивая О.В., Шпынев К.В. и др. // Клин. микробиол. антимикроб. химиотер. ± 2006. ± №1. ± С. 36±47.
- Коровина Н., Заплатников А., Захарова И. // Справочник педиатра. ± 2005. ±№ 8. ± С. 11?38.
- Механизмы резистентности к антибактериальным препаратам // http://www.antibiotic.ru/index.php?doc=97
- Профилактика и лечение острых респираторных заболеваний у детей: Пособие для врачей) / А.А. Баранов, А.В. Горелов, Б.С. Каганов и др. ± М., 2004. ± 43 с.
- Седикин А.А., Шубич М.Н. // Consilium medicum. ± 2000. ±№ 8. ± С. 326±332.
- Середа Е.В., Котосова Л.К., Платонова М.М. // Медицина для всех. ± 1998. ± № 2. ± С. 13±17.
- Страчунский Л.С. // Медицина для всех. ± 1998. ±№ 2.± С. 22±27.
- Страчунский Л.С. // Клин. микробиол. антимикроб. химиотер. ± 2000. ± № 1. ± С. 77±87.
- Таточенко В.К. Педиатру на каждый день ? 2005: Краткий справочник по лекарственному лечению. ± М., 2005. ± 272 с.
- Туровский А.Б., Крюков А.И. // Consilium medicum. ± 2000. ± № 8. ± С. 323±326.
- Фомина И.П. // Антибиотики и химиотерапия. ± 1997. ±№ 9. ±С. 36±41. 25.BehreU., BurowH.M., QuinnP., HarrisonH.E. // Infections. ± 1997. ± Vol. 25, N 3. ± P. 163±166.
- Cornaglia G., Hryniewitcz W., Jarlier V. et al. // Clin. Microbiol. Infect. ± 2004. ± Vol. 10, N 4. ± P. 349±383.
- HobermanA., ParadiseJ.L., BurchD.J. et al. // Pediatr. Inf. Dis. J. ± 1997. ± Vol. 16, N 5. ± P. 463±470.
- Seggev J.S., Enrique R.R., Brandon M.L. et al. // Arch. Otolaryngol. Head Neck Surg. ± 1998. ± Vol. 124, N 8. ± P. 921±925.
- Sox C.M., Finkelstein J.A., Yin R. et al. // Pediatrics. ± 2008. ± Vol. 121. ± P. 674±679.
- Systemic antibiotic treatment in upper and lower respiratory tract infections: official French guidelines// Clin. Microbial. Infect. ± 2003. ± Vol. 9, N 12. ± P. 1162±1178.








Комментировать