Оригинальный взгляд на гипертензию у беременных, которая рассматривается, как следствие компенсаторной реакции в ответ на изменения при беременности системы кровообращения, фундаментальной основы жизнедеятельности всех сложных организмов.
М. Б. Охапкин, В. Н. Серов, В. О. Лопухин, Кафедра акушерства и гинекологии Ярославской государственной медицинской академии, Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
Гипертензия развивается у 7-10% всех беременных, у 4-5% — в виде преэклампсии (ПЭ). Человечество размышляет над загадкой преэклампсии с античных времён. Человек — единственное животное на планете, у которого описано данное заболевание. Две трети всех беременных с ПЭ – это молодые здоровые первобеременные женщины, тем не менее, перинатальная смертность при этом заболевании возрастает в 20 раз. Ни одна из множества теорий о происхождении ПЭ не позволила разработать надёжные методы её профилактики, т. к. они касались лишь следствий заболевания, не раскрывая его истинной причины.
В данной статье излагается оригинальный взгляд на гипертензию у беременных, которая рассматривается как следствие компенсаторной реакции в ответ на изменения при беременности системы кровообращения, фундаментальной основы жизнедеятельности всех сложных организмов.
В последнее десятилетие появились убедительные доказательства наследственной природы ПЭ. В регионах хромосом 7q36 и 2р13 найдены локусы, ответственные за семейное наследование гипертензии беременных и за развитие ПЭ (4,5). Доказано, что существуют генотипы ангиотензиногена: М (метионин)235 и Т (треонин)235. Гомозиготы с кодом Т235 при ПЭ встречаются значительно чаще: 87-92%, в сравнении с контролем: 56% (22). Обнаружено также наличие мутации в аминокислотном составе ангиотензиногена: замена лейцина на фенилаланин в позиции 10-месте его расщепления ренином. Мутация существенно меняет взаимодействие ангиотензиногена с ренином и ангиотензинпревращающим ферментом (АПФ), что может вызвать развитие ПЭ у беременных-носителей мутации (16). У беременных с ПЭ выявлено снижение концентрации и активности ангиотензина и альдостерона при неизменной общей концентрации ренина и ангиотензиногена и повышенной чувствительности к инъекционному ангиотензину (9).
В последние годы открыто существование вариантов генотипа АПФ, связанных с наличием — аллель I, или отсутствием — аллель D, в интроне 16 гена АПФ вставки из 287 нуклеотидов. У пациентов, гомозиготных по аллели D, уровень АПФ в 2 раза превышает уровень фермента у гомозигот по аллели I (12). Полиморфизм гена АПФ и ангиотензиногена слабо связан с частотой и течением хронической артериальной гипертензии (ХАГ) вне беременности (7,18,21), но может быть фактором риска развития гипертензии у беременных (28). Мета-анализом, включающим 185 работ, достоверно установлено, что распространённость вариантов генов системы ренин-ангиотензин-альдостерон (РААС) зависит от возраста и расовой принадлежности (27). При этом следует указать на отчётливую зависимость частоты ПЭ от расы: белые-3,71%, негры-3,97%, американские индейцы-4,81%, китайцы-1,44%, японцы-1,84%, жители Филлипин-2,88% (30).
Учитывая вышеизложенное, вполне логично предположить, что в основе ПЭ лежит наследственный (генетический) дефект метаболизма, определяющий особенность РААС, приводящую к недостаточной активности ангиотензина II, и, как следствие этого, к уменьшению секреции альдостерона, снижению активности симпатоадреналовой системы, повышению тонуса блуждающего нерва и уменьшению секреции антидиуретического гормона (АДГ).
Здесь уместно отметить результаты исследований отечественных авторов, касающихся активности АПФ при нормальной и осложнённой беременности. Показано, что в норме содержание фермента в плазме крови беременных постоянно нарастает к III триместру. У беременных, с развившейся впоследствии ПЭ, содержание АПФ в плазме крови во II триместре оказалось значительно ниже нормы. В то же время у беременных с ХАГ содержание АПФ было значительно выше нормы во все сроки беременности (2).
Система ренин-ангиотензин-альдостерон играет центральную роль в поддержании сосудистого тонуса и гомеостаза соли и воды. Нормальная беременность сопровождается дополнительным поступлением 500-900 ммоль хлористого натрия, обеспечивающим рост объёма плазмы, заполняющей быстро и существенно увеличивающийся объём сосудистого русла. Одновременное повышение гломерулярной фильтрации (до 50%) сопровождается огромным количеством фильтруемого натрия: до 30 000 ммоль в сутки, при минимуме выделяемого: 100-200 ммоль в сутки. Вследствие этого беременные особенно чувствительны к изменениям почечной реабсорбции натрия: при некомпенсированной почечной экскреции быстро развивается гиповолемия (23). Несостоятельность эндокринного механизма пополнения и поддержания необходимого внутрисосудистого объёма жидкости приводит к нарушению течения беременности, что выражается в ряде состояний, обычно описываемых как гестоз (ПЭ) или его осложнения (ВЗРП, преждевременные роды).
У беременных с дефектом РААС вследствие недостаточной реабсорбции натрия и воды (альдостерон, АДГ) с ростом срока гестации нарастает относительная гиповолемия. Венозная вазодилатация, развивающаяся при снижении активности симпатоадреналовой системы, снижая венозный возврат, также способствует уменьшению наполнения артериального русла, объём которого в норме составляет около 15% ОЦК. При достижении определённой критической величины гиповолемии падение давления в сосудах приводит к сокращению гладких мышц и вазоспазму или даже к окклюзии сосуда (1). Вазоспазм является причиной повреждения эндотелия сосудов, что вызывает гипераггрегацию тромбоцитов, снижение продукции простациклина сосудистой стенкой, изменение микроциркуляции и, в конечном счёте, органную недостаточность, выражающуюся протеинурией, нарушениями функций мозга и печени. Известно, что ПЭ в 50-60% случаев сопровождается гипоперфузией мозга (8), вызывающей компенсаторную реакцию дилятации его артерий (32). Отмечено, что патологические изменения в мозге, сердце, печени беременных с ПЭ напоминают таковые при гиповолемии (31), при этом снижение тканевого кровотока характерно для ранних стадий заболевания, и регистрируется задолго до его клинических проявлений (3). Риск судорожного припадка наиболее высок при ПЭ, при ХАГ с протеинурией он ниже в 8 раз, а при ХАГ без протеинурии он ниже в 17 раз (10). Это указывает, что скорее гипоперфузия органов, нежели сосудистые повреждения вследствие гипертензии определяют клиническую картину ПЭ. Относительная редкость поражения печени при ПЭ, известного как HELLP-синдром, связана с особенностью кровоснабжения этого органа из двух источников: аорты, через печёночную артерию, и воротной вены.
К органам, страдающим от гиповолемии, относится и беременная матка. Так у беременных с ВЗРП уже в ранние сроки отмечаются признаки уменьшения объёма циркулирующей крови: снижение размеров левого предсердия, концентрации натрия в крови, спадение нижней полой вены (14). Существует предположение об участии системы РААС в процессах, идущих при беременности в спиральных артериях (инвазия трофобласта в мышечный слой), т. к. в их стенке найдена экспрессия генов ренина, АПФ, рецепторов ангиотензина (25).
Нередким явлением у беременных с ПЭ является нарушение мозгового кровообращения, которое стоит на первом месте среди причин материнской смертности при этом заболевании. Известно, что астроциты мозга, мигрируя и пролиферируя у поражённого участка сосудистого русла, восстанавливают внеклеточный матрикс и, тем самым, гемато-энцефалический барьер (ГЭБ). Астроциты, лишённые ангиотензиногена, слабо восстанавливают ГЭБ, но это можно коррегировать введением ангиотензина II и IV типа (19).
Инсулин блокирует секрецию ангиотензиногена жировыми клетками (6), что, при избытке инсулина, провоцируемого контринсулярными гормонами беременности и ожирением, и наследственном дефекте метаболизма ангиотензиногена, может способствовать развитию ПЭ, при которой часто наблюдается резистентность к инсулину.
Следует заметить, что рассматриваемые процессы касаются только организма матери, т. к. несмотря на то, что компоненты РААС: mРНК проренин, ангиотензиноген, рецепторы ангиотензина, представлены в плаценте и эндотелии плода во все сроки беременности (13), признаков повреждения эндотелия сосудов плода при ПЭ не отмечается. Так продукция оксида азота фето-плацентарным комплексом, его содержание у плода не снижается, а система его синтеза функционирует в повышенном, компенсаторном режиме (17).
По нашим данным имеется отчётливая прямая зависимость содержания жидкости в организме беременных, выражаемого в виде импеданса, и длительностью светового дня (20). В средних широтах это приводит к изменению импеданса в течение года (рис. 1). Вместе с импедансом меняется и частота ПЭ. Эти изменения можно условно представить в виде гармонических колебаний, соответствующие точки которых отстоят друг от друга примерно на 20 недель. Именно к этому сроку у беременных максимально возрастает объём циркулирующей крови (ОЦК), что сопровождается ростом сердечного выброса и снижением ОПСС (24), растёт активный ренин плазмы: в 5 раз (15). Когда этот срок беременности совпадает с минимальными или снижающимися показателями импеданса, тогда частота ПЭ наиболее низка, и, соответственно, наоборот.
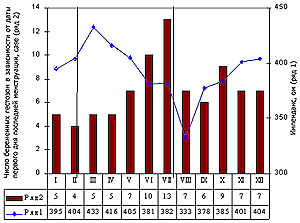
К предлагаемой концепции необходимы пояснения:
- Необходимо учесть, что степень недостаточности РААС и реакция сосудистого русла на гиповолемию является индивидуальной. Поэтому возможен гестоз без гипертензии, ведущий, ввиду нарушения МПК, к ВЗРП и недонашиванию.
- При наличии гиповолемии или клинически явного вазоспазма, повышения вязкости крови нарушается «питание» эндотелия с нарушением его функций, что приводит к снижению продукции простациклина и оксида азота, активации тромбоцитов, нарушению баланса простациклин-тромбоксан и «замыканию» порочного круга вазоспазм-эндотелий.
- Наиболее ранним проявлением нарушения органного кровотока является протеинурия.
- Несмотря на наличие и прогрессирование артериального вазоспазма сохраняется венозная вазодилятация. Относительное переполнение венозной части сосудистого русла приводит к а) сохранению низкого венозного возврата, артериальной гиповолемии, вазоспазма, б) повышению вероятности и степени отёков. При выраженной гиповолемии ПЭ не сопровождается периферическими отёками. Известно, что подобная «сухая» ПЭ сопровождается максимальным риском материнской и перинатальной смертности.
- Характерное для ПЭ клиническое проявление во второй половине беременности связано с максимальным объёмом сосудистого русла в этот её период: МПК, действие гормонов. Следует отметить, что в норме и, возможно, у женщин с ПЭ до второй половины беременности продолжается рост активности РААС (15), а вместе с этим и рост ОЦК.
- Относительная гиповолемия, развивающаяся при снижении активности РААС, в зависимости от её степени может проявляться:
- с ранних сроков беременности: до 16-18 недель. При этом снижение кровоснабжения матки приводит к нарушению инвазии трофобласта в мышечный слой спиральных артерий (в 8-10 недель и 16-18 недель) и формированию неполноценного МПК, что выражается в высоком сопротивлении кровотоку в маточных артериях (Ма). При этом растёт риск ранних проявлений симметричной формы ВЗРП и симптомов недонашивания.
- во второй половине беременности, когда процесс инвазии трофобласта в спиральные артерии завершён. При этом МПК, по данным допплерометрии кровотока в Ма, остаётся в пределах нормы, а риск ВЗРП и недонашивания существенно снижается.
- с ранних сроков беременности: до 16-18 недель. При этом снижение кровоснабжения матки приводит к нарушению инвазии трофобласта в мышечный слой спиральных артерий (в 8-10 недель и 16-18 недель) и формированию неполноценного МПК, что выражается в высоком сопротивлении кровотоку в маточных артериях (Ма). При этом растёт риск ранних проявлений симметричной формы ВЗРП и симптомов недонашивания.
- во второй половине беременности, когда процесс инвазии трофобласта в спиральные артерии завершён. При этом МПК, по данным допплерометрии кровотока в Ма, остаётся в пределах нормы, а риск ВЗРП и недонашивания существенно снижается.
- После родов у женщины с ПЭ происходит изменение гормонального статуса и редукция сосудистого русла (исчезновение МПК, спадение вен, облитерация сосудов), объём которого уже близок или соответствует ОЦК. Исчезает ишемизированный сосудистый орган: плацента — источник сосудосуживающих стимулов. Как следствие, восстанавливается венозный возврат и сердечный выброс, разрешается гипертензия, восстанавливается органный кровоток, т. е. исчезает клиника гестоза.
- Практическое отсутствие ПЭ у повторнородящих, видимо, связано с особенностью ферментов, в том числе и ферментов РААС, повышать свою активность при повторной «встрече» с субстратом. Однако, и при повторной беременности, исходно низкий объём плазмы крови приводит к развитию гипертензии (26).
- Отсутствие заболевания ПЭ среди животных можно связать с функцией прямохождения человека. При горизонтальном или наклонном положении туловища животных даже при относительной гиповолемии и венозной вазодилятации не происходит существенного уменьшения венозного возврата, что мы наблюдаем у человека, и менее выражено снижение сердечного выброса. Возможно также и то, что геном животных в части, регулирующей активность РААС, существенно отличается от генома человека.
В таблице 1 представлены исходы беременности у женщин с нормальными показателями центральной гемодинамики (ЦГД). Скрининг беременных по показателям ЦГД весьма точно выделяет группу женщин с благоприятными исходами беременности для матери и плода. Беременные с низкими показателями ЦГД нуждаются в более углублённом обследовании, возможно, в условиях стационара.
Таблица 1. Исходы беременности у женщин нормальными показателями центральной гемодинамики
| Срок беременности при обследовании | ВЗРП | Преждевременные роды (в общей популяции) | Протеинурия (более 0,3 г/л) | Гипертензия в родах | Оценка по Апгар менее 7 баллов |
| 12-16 недель | 4,3% | нет (6,7%) | нет | нет | 9,1% |
| 17-20 недель | 3,4% | нет (5,3%) | нет | 1,7% | 8% |
| 21-24 недели | 4,2% | 3,1% (8,5%) | 1% | 1% | 7,3% |
| 25-28 недель | 3,3% | 4,9% (12,7%) | нет | 1,2% | 0,5% |
| 29-32 недели | 2,8% | нет (8%) | нет | 0,9% | 0,3% |
Необходимо заметить, что клиническая картина гестоза: срок беременности более 20 недель и триада Цангенмейстера, может быть лишь его «маской», т. к. некоторые распространённые экстрагенитальные заболевания имеют тенденцию к утяжелению течения при беременности и клинически не отличаются от «чистого» гестоза (диабетическая нефропатия, гломерулонефрит). Классическим примером гипертензии является ситуация, именуемая «две почки — один зажим», где роль ишемизированной почки может играть любой орган с локальным дефектом сосудистого русла, а роль «нормальной» почки — весь организм.
Гипертензия беременных (ГБ) является частным случаем универсальной компенсаторной реакции вазоспазма, проявляющейся в особых условиях беременности. Как уже отмечено, при беременности снижается ОПСС и растёт объём сосудистого русла, что вызывает явление «обкрадывания» кровотока в поражённом органе, а редукция кровотока провоцирует реакцию вазоспазма, поддерживающего адекватный органный кровоток. При нормальных параметрах центральной гемодинамики нет признаков органной ишемии и беременность заканчивается благоприятно. Вне беременности редукция кровотока в поражённом органе не настолько существенна, чтобы вызвать общий вазоспазм. Однако, в зрелые годы эта причина имеет высокую вероятность реализации с развитием ХАГ, что и доказано статистически для женщин с ГБ.
По нашему мнению, ХАГ необходимо рассматривать как компенсаторную реакцию, направленную на поддержание адекватного кровоснабжения в зоне с редуцированным сосудистым руслом. При нормальном ОЦК и сердечном выбросе органный кровоток, как правило, не нарушен, и беременность завершается благоприятно. В отдельных случаях при выраженном нарушении кровотока в поражённом органе (например, значительная редукция гломерулярного аппарата) на фоне снижения ОПСС вследствие увеличения объёма сосудистого русла, что характерно для беременности, особенно для поздних её сроков, возможно появление признаков органной ишемии: усиление гипертензии или увеличение/появление протеинурии, т. е. клиники ПЭ.
Вполне вероятен вариант сочетания у беременной исходной гиповолемии и экстрагенитального заболевания, связанного с редукцией органного кровотока: ПЭ в «маске». Данная ситуация характерна для первобеременных с явной или скрытой экстрагенитальной патологией. Сочетание нарушения регионарного кровотока вследствие основного заболевания и гиповолемии, связанной с недостаточной активностью РААС, с высокой вероятностью приводит к ранней и тяжёлой гипертензии, сочетающейся с выраженными нарушениями органного кровотока: высокой протеинурии, признакам поражения мозга и печени, т. е. к развитию клинической картины тяжёлой ПЭ.
Исходя из вышеизложенного, можно сделать общие выводы:
- Гестоз является наследственно обусловленным заболеванием беременных, возникающим вследствие неадекватной адаптации гемодинамики матери к особым условиям беременности.
- Гестоз не является заболеванием второй половины беременности, когда чаще возникают его проявления, но возникает и развивается с началом беременности.
- Гестоз является более широким понятием, встречается чаще и оказывает большее влияние на исходы беременности, чем клиническая картина ПЭ, являющаяся конечной стадией его развития или проявлением тяжёлого экстрагенитального заболевания.
- Клиническая картина ПЭ является синдромом, вызванным органной ишемией, развивающейся вследствие либо выраженной гиповолемии, что составляет основу гестоза, либо экстрагенитального заболевания, проявляющегося или меняющего своё течение на более тяжёлое в особых гемодинамических условиях беременности.
- Клинические проявления синдрома ПЭ отличаются крайним разнообразием, что связано с генетическим полиморфизмом основной причины и частым присутствием экстрагенитальной патологии.
Лечебно-профилактические мероприятия должны быть направлены на:
- Обеспечение венозного возврата, чему способствует положение на левом боку, венотоники, мышечная активность. Известно, что умеренная физическая активность во время беременности существенно увеличивает темпы роста и массу плода и плаценты (11).
- Поддержание адекватного внутрисосудистого объёма. Этому способствует расширение питьевого режима, достаточное потребление поваренной соли. Известно, что нагрузка солью увеличивает экспрессию рецепторов ангиотензина в почках, причём больше у особей с отсутствием гена ангиотензиногена (29).
- Своевременное и бережное, преимущественно консервативное, родоразрешение.
Кроме того, следует отметить:
- Инфузионная терапия, направленная на увеличение объёма плазмы крови, не имееет решающего значения в лечении гестоза и профилактике его тяжёлого течения так как:
- должна начинаться с момента появления гиповолемии и быть постоянной, что практически невозможно;
- необходимо вводить препарат, длительно (сутками) находящийся в сосудистом русле, но такого препарата не существует;
- бессмысленна и скорее вредна у беременных с нормальными объёмными показателями ЦГД (ХАГ, гипертензия беременных);
- если она проводится после появления гипертензии, это не устраняет артериальной гиповолемии, но ведёт к перегрузке венозного русла, нарастанию отёков, повышенному риску отёка лёгких и мозга.
- Следует считать нецелесообразным:
- начинать лечение с гипотензивной терапии, ухудшающей органный кровоток. Гипотензивная терапия является профилактикой инсульта и показана лишь в ситуациях, когда САД приближается к уровню 130 мм рт. ст., угрожающему нарушением ауторегуляции мозгового кровотока
- ограничивать соль и жидкость, усугубляя гиповолемию;
- назначать мочегонные средства, особенно у беременных с клиникой преэклампсии. Исключением являются ситуации отёка мозга, лёгких и ОПН.
- значительно ограничивать мышечную активность беременной. До настоящего времени не найдено научных доказательств пользы строгого постельного режима у женщин с ПЭ.
- Препараты, влияющие на гемостаз: антитромбоцитарные средства, гепарин, не дают существенного положительного эффекта у беременных с ПЭ, т. к. процессы, на которые они воздействуют, вторичны и являются компенсаторными следствиями нарушения функции эндотелия.
Изложенный взгляд на происхождение и ведение гипертензии у беременных, хотя он и согласуется с последними достижениями современной научной мысли, безусловно не является окончательным решением этой сложной проблемы и требует дополнительного изучения и существенных уточнений. Однако, уже сегодня он открывает отчётливые перспективы научных исследований, направленных на разработку конкретных и действенных лечебно-профилактических мероприятий в отношении гестоза, позволяет внести определённые коррективы в традиционные рекомендации и принципы ведения беременных с гипертензией и клиникой ПЭ.
Источник: Портал Consilium Medicum
Список литературы
- Джонсон П. Периферическое кровообращение (пер. англ.). — Москва, 1982.
- Пестрикова Т. Ю., Блощинская И. А., Юрасова Е. А., Витько Н. Ю. // Проблемы беременности.-2001.-N3.-С.57-58.
- Anim-Nyame N., Sooranna S. R., Johnson M. R. et al. // Cardiovasc. -2001.-Vol.50.-P.603-609.
- Arngrimsson R., Hayward C., Nadaud S. et al. // Am. J. Hum. -1997.-Vol.61.-P.354-362.
- Arngrimsson R., Siguroardottir S., Frigge M. L. et al. // Hum. molecular genetics.-1999.-Vol.8.-P.1799-1805.
- Aubert J., Safonova I., Negrel R., Ailhaud G. // Biochem. biophys. res. commun.-1998.-Vol.250.-P.77-82.
- Beige J., Zilch O., Hohenbleicher H. et al. // J. Hypertens.-1997.-Vol.15.-P.503-508.
- Belfort M. A., Grunewald C., Saade G. R. et al. // Acta Obstetr. Scand.-1999.-Vol.78.-P.586-591.
- Brown M. A., Wang J., Whitworth J. A. // Clin. exp. hypertens.-1997.-Vol.19.-P.713-726.
- Burrows R. F., Burrows E. A. // Am. J. Obstetr. -1995.-Vol.173,part 1.-P.929-935.
- Clapp J. F., Kim H., Burciu B., Lopez B. // Am. J. Obstet. -2000.-Vol.183.-P. 1484-1488.
- Clarkson P., Prasad N., Macbeod C. et al. // J. Hypertens.-1997.-Vol.15.-P.995-1000.
- Cooper A. C., Robinson G., Vinson G. P. et al. // Placenta.-1999.-Vol.20.-P.467-474.
- Duvecott J. J., Cheriex E. C., Pieters F. A. et al. // Obstet. -1995.-Vol.85.-P.361-367.
- Godard C., Gaillard R., Vallotton M. B. // Nephron.-1976.-Vol.17.-353-360.
- Inoue I., Rohrwasser A., Helin C. et al. // J. Biol. -1995.-Vol.270.-P.1430-1436.
- Iorioi R. D., Marinoni E., Emiliani S., Villaccio B., Cosmi E. V. // Europ. Obstet. Gyn. reprod. biol.-1998.-Vol.76.-P.65-70.
- Jeunemaitre X., Lifton R. P., Hunt S. C. et al. // Nature Genet.-1992.-Vol.1.-P.72-75.
- Kakinuma J., Hama H., Sugiyama F. et al. // Nat. Med.-1998.-Vol.4.-P.1078-1080.
- Karpov A. U., Shmelev V. I., Okhapkin M. B. et al. // XI International conference on electrical bio-impedance.-Norvay,2001.-P.305-308.
- Kato N., Sugiyama T., Morita H. et al. // J. Hypertens.-1999.-Vol.17.-P.757-763.
- Kobshi J. // Hokkaido Igaku Zasshi.-1995.-Vol.70.-P.649-657.
- Lenfant G., Gifford R. W., Zuzpan F. P. // Am. J. Obstetr. -1990.-Vol.163.-P.1689-1712.
- Leib A., Pressman E. // The Johns Hopkins manual of gynecology and obstetrics (Ed. by Lambrow N. C., Morse A. N., Wallach E. E.).-1999.-P.112-123.
- Morgan T., Craven C., Ward K. // Hypertension-1998.-Vol.32.-P.683-687.
- Spaanderman M. E. A., Aardenburg R., Ekhart T. H. A. et al. // Europ. Obstetr. Gyn. reprod. biol.-2001.-Vol.95.-P.218-221.
- Staessen J. A., Ginocchio G., Wang J. G. et al. // J. Hypertens.-1997.-Vol.15, suppl.4.-P.196-344.
- Staessen J. A., Wang J. G., Ginicchio G. et al. // J. Hypertens.-1997.-V.15, suppl.4.-P.386.
- Tamura K., Umemura S., Sumida J. et al. // Hypertension-1998.-Vol.32.-P.223-227.
- USA national vital statistics report.-1999.-Vol.47, N18.
- Zamorski M. A., Green L. A. // Am. Physician.-1996.-Vol.53.-P.1595-1604.
- Zatic J., Aranyosi J., Mihalka L. et al. // Gynecol. Invest.-2001.-Vol.51.-P.223-227.









Комментировать