Инфекции нижних отделов половых путей. Группы риска.
С.Н. Занько
Витебский государственный медицинский университет
Инфекции нижних отделов половых путей вызываются в большинстве случаев условнопатогенными микроорганизмами (включая грибы) при появлении условий для превалирования ро- ста одного из видов, в норме колонизирующих слизистую влагалища. Несмотря на значительные успехи в диагностике и лечении урогенитальных инфекций, они продолжают занимать первые ме- ста в структуре акушерско-гинекологической за- болеваемости и смертности, кроме того, часто приводят к инфицированию плодного яйца, плода и новорожденного.
Любое нарушение вагинального микроценоза с подавлением роста Lactobacillus или изменения, способствующие подавлению их кислотообразу- ющей функции, могут привести к развитию неспе- цифического или кандидозного кольпита, бакте- риального вагиноза, общим и ведущим симптомом которых являются патологические бели.
Одним из основных барьеров на пути инфекции являются микробные ассоциации нормальной микрофлоры человека. Их роль заключается в со- здании биологической защиты от патогенных мик- роорганизмов. Нарушение баланса между пред- ставителями микробиоценозов приводит к возник- новению источника инфекции в самом организме. В то же время полное подавление нормальной микрофлоры резко снижает колонизационную ре- зистентность микроэкологических ниш и делает эти участки практически беззащитными перед лю- быми микроорганизмами.
Существование экосистемы влагалища предпола- гает наличие как в норме, так и при патологии не- скольких видов микроорганизмов, представляю- щих его биотоп. Таким образом, классический по- стулат «один микроб — одно заболевание» не находит подтверждения даже при специфических инфекциях. При бактериологическом исследова- нии выявляются полимикробные ассоциации, включающие как бактерии, так и вирусы, меняю- щиеся на протяжении жизни женщины и при ин- фекционных заболеваниях. В понимании механизмов естественного барьера для инфекционных осложнений важен термин «колонизационная ре- зистентность влагалищного биотопа». Это совокупность механизмов, поддерживающих стабильность популяционного и количественного состава компонентов нормального микробиоценоза.
Одним из наиболее сложных аспектов диагности- ки и лечения инфекций нижних отделов половых путей является полиморфизм возбудителей, ча- стое наличие микст-инфекций и их вариабель- ность. В конце прошлого столетия в списке болез- ней, передаваемых половым путем, было свыше 20 наименований [1, 5].
В последние годы активно обсуждается вопрос о целесообразности недифференцированной тера- пии у больных с подозрением на заболевания, пе- редаваемые половым путем, о способах ее про- ведения, выборе препаратов и дозы. Представля- ется рациональным при первом же обращении больных и взятии у них анализов назначать не- дифференцированную терапию, что позволяет сократить сроки не только обследования, но и до- стижения субъективного и клинического выздо- ровления. Вместе с тем, на наш взгляд, не менее важным является вопрос о предродовой недифференцированной терапии и профилакти- ке инфекционных осложнений у беременных.
Заболевания, вызванные смешанной инфекцией, имеют более длительное течение, часто рециди- вируют, при необходимости выполнения диагно- стических процедур на фоне микст-инфекции ча- ще возникают различные осложнения. При сме- шанной инфекции, особенно при хронизации про- цесса, добиться стойкого излечения довольно сложно. У 80% женщин, обращающихся в женскую консультацию с различными видами вульвоваги- нитов, цервицитов и уретритов, выявляется сме- шанная бактериально-грибково-вирусная инфек- ция. По различным данным [7], сочетание хлами- диоза и анаэробной контаминации встречается в 14 — 24%, хламидиоза и трихомониаза — в 5 —10% случаев. Микоплазменная инфекция в виде моноинфекции отмечается лишь в 12% случаев заболеваний, тогда как в ассоциации с вирусной и грибковой флорой — в 87 — 90%. Ассоциация хламидиоза и герпетической инфекции достигает 18 — 20%. Вагинальный кандидоз нередко соче- тается с хламидиозом (13 — 15%).
Возбудителем инфекционно-воспалительных за- болеваний мочеполовых органов является боль- шая группа бактерий и вирусов. Кроме агентов, входящих в состав инфекций, передаваемых по- ловым путем, наиболее значимыми являются условно-патогенные микроорганизмы. Такие стро- гие анаэробы, как бактероиды, фузобактерии, пептострептококки, эубактерии, вейлонеллы, в подавляющем большинстве случаев встречаются в ассоциациях с факультативно-анаэробными микроорганизмами, микроаэрофилами (корине- бактериями, клебсиеллами, другими энтеробакте- риями, кампилобактериями). Микробные ассоциа- ции являются поливалентными этиологическими агентами. В зависимости от количества и состава возбудителей, их доли среди других микроорга- низмов, симбиотически-антагонистических отно- шений между различными представителями мик- рофлоры, факторов вирулентности значительно варьируют патогенность, клинические проявления и чувствительность к антибиотикам каждого кон- кретного набора возбудителей.
При этом нередко обнаруживается сочетанная инфекция нижних отделов половых путей, осо- бенно у беременных женщин. Они очень уязвимы в плане проникновения и активации возбудителей хронической внутриматочной инфекции, так как при беременности отмечается тенденция к акти- вации резидентных микроорганизмов из-за сдвига баланса половых гормонов. В результате измене- ния иммунного и гормонального статусов у бере- менных во влагалище создаются благоприятные условия для роста бактериальной флоры. При бе- ременности наблюдается снижение активности фагоцитов, Т-клеток, снижение содержания анти- тел (IgA) в цервикальном канале, что приводит к нарушению системы защиты от персистирующего высокого обсеменения бактериальной микрофло- рой. Изменяется значение рН (>4,5), повышается содержание гликогена, накапливается в свобод- ном виде глюкоза. Все эти факторы способствуют тому, что у беременных в 2—4 раза чаще, чем у небеременных, развиваются вульвовагиниты [2].
Если родоразрешение происходит на фоне вульвовагинита, то отечные, воспаленные ткани про- межности и влагалища плохо поддаются растяже- нию — наблюдается высокая частота их травм (включая профилактические разрезы промежно- сти: эпизио- и перинеотомии). В послеродовом периоде нередки инфекционные осложнения: нагноение, расхождение, вторичное заживление травм влагалища и промежности. Таким образом, лечение вульвовагинитов у беременных является важным фактором профилактики инфекционных осложнений травм промежности.
Своевременная санация беременной предотвра- щает инфицирование плода, его патологические состояния. Терапия должна проводиться с учетом характера возбудителя и его чувствительности к препарату, фармакокинетики применяемых средств, срока беременности на момент лечения.
Используемые при плановом обследовании бере- менных и госпитализации для родоразрешения бактериоскопические методы изучения характера флоры цервикального канала не всегда дают адекватную информацию.
Нами выполнен сравнительный анализ результа- тов частоты инфекционных и травматических осложнений после родов у 120 женщин. Перед родоразрешением проводилось традиционное об- следование пациенток, дополнительно определя- лась степень чистоты влагалища.
При микроскопическом исследовании отделяемо- го половых путей только у 74 (62%) женщин в сро- ке беременности 37—39 недель с «хорошими» мазками была выявлена I—II степень чистоты влагалищного секрета. Высокая частота выявля- емости III степени чистоты влагалищной флоры (IV степень определялась относительно редко: 6 случаев) связана, на наш взгляд, с выраженной частотой хронических воспалительных процессов половых органов. При таком характере течения воспаления число лейкоцитов оказалось невысо- ким, и результаты бактериоскопического исследо- вания были отнесены к «хорошим» мазкам. Высо- кая частота выявляемости грибковой флоры под- тверждает тенденцию к щелочной среде у этих пациенток.
Необходимо отметить, что подавляющее боль- шинство осложнений имело место у женщин с III степенью чистоты влагалищной флоры при «хороших» мазках. Это свидетельствует о том, что используемые в повседневной практике методы обследования пациенток перед проведением внутриматочных манипуляций различного рода недостаточно информативны. Детальное обсле- дование на весь спектр инфекций, передаваемых половым путем, стоит достаточно дорого и требу- ет времени. Перед родами этого времени просто нет. В силу вышеперечисленных обстоятельств недифференцированная профилактика экономи- чески обоснована как для пациентки, так и для бюджета в целом (если осложнения требуют ле- чения в условиях стационара).
Таким образом, к различным группам риска по развитию инфекционных осложнений после родов относятся около 40 % беременных женщин в сроке 37—39 недель гестации.
Проблема выбора метода лечения очень актуаль- на. Продолжается поиск наиболее клинически эффективных и безопасных средств для профи- лактики и терапии инфекционных заболеваний половых путей у беременных. Следует подчерк- нуть, что своевременная профилактика и лечение нарушений микроценоза влагалища и кишечника способствуют формированию нормальной микро- флоры новорожденного и снижению в 2,5—4 раза частоты инфекционно-воспалительных заболева- ний у детей в первые месяцы жизни.
Выбор «идеального» противомикробного препа- рата, рекомендуемого для лечения инфекций нижних отделов урогенитального тракта у бере- менных, базируется на ряде требований: препа- рат должен обладать широким спектром дей- ствия; не должен нарушать функциональную ак- тивность лактобацилл и подавлять их биологиче- ский цикл; в состав препарата не должны входить антибиотики, вызывающие системный эффект; применение препарата должно быть возможно в различные сроки беременности без побочных эффектов для матери и плода; препарат должен отличаться хорошей переносимостью.
При невозможности проведения полного комплек- са диагностики и лечения необходима экстренная профилактика инфекционных осложнений перед родоразрешением в амбулаторных условиях.
Преобладание у женщин при воспалительных за- болеваниях во влагалище микст-инфекции (сме- шанной флоры) предполагает применение препаратов широкого спектра действия. Безусловно, предпочтительным при решении проблемы про- филактики восходящих вагинальных инфекций является местный или локальный путь использо- вания санационных препаратов. Такой путь вве- дения позволяет не только уменьшить фармако- логическую нагрузку на организм женщины, но и избежать возникновения явлений непереносимо- сти, в том числе аллергических реакций. Местное применение антисептических препаратов, эффек- тивно деконтаминирующих слизистые, необходи- мо также при невозможности быстро верифици- ровать возбудителя воспалительного процесса.
Спектр микроорганизмов, выделенных из церви- кального канала, соответствовал бактериальному спектру влагалища у каждой женщины [2]. Все бактерии относились как к патогенным, так и к условно-патогенным микроорганизмам. Подавля- ющее большинство бактерий выделено из нижней трети цервикального канала. Бактериальная об- семененность канала шейки матки резко снижа- лась по направлению к ее полости. Это свиде- тельствует о необходимости санации влагалища как источника возможного восходящего инфици- рования при родоразрешении.
Нами был проведен анализ эффективности про- филактики инфекционных осложнений средства- ми местной терапии перед родами. Для этих це- лей мы применяли препарат «Бетадин».
Бетадин представляет собой антисептик, который является комплексным соединением йода и поли- винилпирролидона — инертного синтетического полимера, выполняющего роль носителя. Все фармакологические свойства препарата связаны с действием йода. Достигая клеточной стенки, комплекс повидон-йода высвобождает свободный йод, бактерицидное действие которого на прока- риоты развивается в течение 10—60 с [9, 13]. Пролонгированный эффект бетадина хорошо кон- тролируется клинически, так как образовавшийся на тканях тонкий окрашенный слой сохраняется до тех пор, пока из соединения не высвободится весь йод. Бактерицидный, фунгицидный и прочие механизмы его действия основываются на высо- кой окислительной способности свободного иони- зированного йода. Интрацеллюлярно йод блоки- рует систему транспорта электронов в цитоплаз- матической мембране бактерий. Ферментативная активность бактериальных белков теряется в ре- зультате изменения их структуры после взаимодействия йода с аминокислотами, содержащими сульфгидрильные и гидроксигруппы.
История применения йодофоров насчитывает бо- лее 100 лет. В отличие от спиртовой настойки йо- да, которая может вызвать ожог, раствор повидон- йода отличается хорошей переносимостью и не характеризуется аллергизацией даже при дли- тельном приеме [10, 14], не вызывает отека и раздражающего действия. Комплексная молекула повидон-йода имеет большой размер, поэтому плохо проникает через биологические барьеры. Благодаря этому системные эффекты йода прак- тически не проявляются.
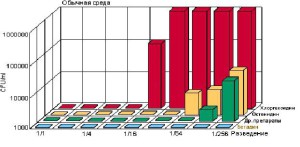
Бетадин вызывает асептический эффект даже при очень больших разведениях, в частности 1:256 (рис. 1). Поэтому его концентрации при применении могут варьировать в зависимости от чувстви- тельности пораженных тканей. Без разведения, в виде оффицинального 10% раствора бетадин применяется для обработки кожи и слизистых пе- ред инвазивными вмешательствами, родами; для обработки мелких ссадин, ожогов, пупочной ранки новорожденных с экспозицией 2 мин; при лечении гнойничковых заболеваний кожи; при асептиче- ском ведении или лечении инфицированных ран в разведении 1:2 (5% раствор). Для местного лече- ния вирусных поражений применяется концентри- рованный 10 % раствор, слизистых оболочек глаз – по 2—3 капли в разведении 1:2 —1:4 (2,5 — 5% раствор).
Рис. 1. Влияние разведения на эффективность различных антисептиков [14]. CFU — Colony Forming Unit (колониеобразующие единицы)
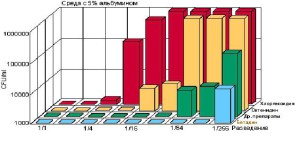
Рис. 2. Влияние разведения и 5% альбумина на эффективность различных антисептиков [14]
Физико-химические условия в ране и очаге воспаления (pH, белок, кровь, ферменты) мало влияют на действие бетадина (рис. 2).
Противомикробная активность бетадина охваты- вает весь значимый при генитальных инфекциях спектр микроорганизмов: грамотрицательные бактерии, включая Neisseria gonorroeae, кишечную палочку, грамположительные аэробные и многие анаэробные бактерии, микобактерии, различные виды грибов (вызывает спороцидный эффект), вирусы, трихомонады и Treponema pallidum (табл. 1). При этом бетадин не оказывает супрессивного влияния на лактобациллы [6, 14].
Спектр действия бетадина
| Бактериальные микроорганизмы | Небактериальные микроорганизмы |
| Грамотрицательные бактерии | Грибы |
| Aerobacter aerogenes Bacteroides spp. Citrobacter spp. Edvardsiella spp. Esсherichia spp. Haemophilus coli Herellea spp. Klebsiella spp.Mimea polymorpha | AspergillusCandidaCryptococcus neoformans Epidermophyton floccosum Microsporon audouni NocardiaPenicillum Pityrosporon ovale Saccharomyces carlsbergensis |
| Neisseria gonorrhoeae Proteus spp. Pseudomonas spp. Salmonella spp. Serratia spp.Shigella spp. | Trichophyton |
| Грамположительные бактерии | Вирусы |
| Bacillus Clostridium Corinebacterium Diplococcus pneumoniae DiphteroidesMicrococcus flavus Sarcina lutea Staphylococcus Streptococcus | Adenoviridae Paramyxovirus Rotavirus Papoviridae Coxsackie virus Poliovirus Rhinovirus HerpesviridaeRubivirus InfluenzaevirusHTLV III HIV |
| Кислоторезистентные бактерии | Простейшие |
| Mycobacterium | Entamoeba histolyticaTrichomonas vaginalis |
| Трепонемы | |
| Treponema pallidum |
Доказана высокая эффективность бетадина в местной терапии герпетических поражений слизи- стых оболочек [16]. Исследования в отношении папилломавируса, являющегося во многих случа- ях причиной дисплазии и неопластических про- цессов шейки матки, показали высокую актив- ность повидон-йода в профилактике передачи ви- русной инфекции половому партнеру [17]. Широ- кий спектр действия препарата, включающий эн- теро- и аденовирусы, вирусы герпеса, грибы рода кандида, трихомонады, позволяет использовать его в акушерско-гинекологической практике при микстинфекциях.
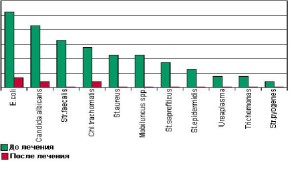
В течение многих лет различные формы бетадина используются в стационарной гинекологии. За это время накоплен большой опыт его клинического применения (рис. 3). Бетадин используют для мо- нотерапии, как правило, в виде вагинальных суп- позиториев 1 раз в сутки на протяжении 5—7 дней или проводят санацию влагалища 10% раствором.
Результаты многочисленных исследований во всем мире доказывают, что применение бетадина у жен- щин эффективно не только при амбулаторном лече- нии инфекционной патологии влагалища, но и при предоперационной профилактике осложнений ин- фекционного генеза. Препарат достоверно снижает риск развития послеоперационных осложнений, успешно помогает справляться с немотивированной гипертермией в послеоперационном периоде [11].
Опыт использования антисептиков, в частности бе- тадина, накоплен и в нашей стране. Опубликованы результаты масштабного исследования в рамках ре- гиональной программы профилактики инфекционных осложнений при внутриматочных вмешательствах. Показана высокая эффективность бетадина для предманипуляционной подготовки при внутриматочных вмешательствах лечебного и диагностического характера [3].
Рис. 3. Результаты бактериологического исследования больных до и после лечения вагинальными суппозиториями бетадина [4]
Белорусские исследователи [8] сообщают об убедительных результатах применения бетадина для лечения смешанных вагинальных инфекций у беременных в I триместре. Оценка эффективности терапии проводилась через 7—8 суток. Критерия- ми излеченности считались субъективная оценка пациентки, уменьшение влагалищных выделений и нормализация бактериоскопической картины при контрольном исследовании мазка. В группе беременных, у которых применяли бетадин, кли- ническая излеченность смешанных инфекций до- стигала 91%, что совпадает с данными литерату- ры [3, 6, 9, 12].
Авторами делается вывод о том, что топическое применение бетадина — эффективный и безопас- ный метод лечения вагинальных инфекций у бе- ременных в I триместре. Санация бетадином при- водит к эффективной эрадикации гарднерелл, кандид, сопровождается ликвидацией воспали- тельной реакции. Широкий спектр антибактери- альной, антивирусной, антифунгальной активно- сти в сочетании с отсутствием побочного влияния на эмбрион позволяет считать бетадин препаратом выбора в лечении вагинальных инфекций в I триместре беременности.
G. Gimes et al. [12] доказали отсутствие влияния повидон-йода на функцию щитовидной железы плода в I триместре и относительную безопас- ность местного применения в другие сроки, за ис- ключением случаев преждевременных родов. В своем исследовании авторы убедительно показа- ли эффективность суппозиториев бетадина в ле- чении бактериального вагиноза и грибковых ин- фекций влагалища у беременных.
Правомерен вопрос: может ли йод, абсорбиро- вавшийся со слизистой влагалища, влиять на функцию щитовидной железы плода? 80 бере- менных женщин с кольпитом получали лечение суппозиториями бетадина в течение 7 дней в сро- ке 37—40 гестационных недель с превосходным терапевтическим результатом. Уровни тиреоид- ных гормонов были измерены в сыворотке новорожденных спустя 4—5 дней после рождения, никаких отрицательных отклонений не обнаружено.
Авторы рекомендовали 7-дневное интравагиналь- ное назначение суппозиториев бетадина для профилактики внутриматочных инфекций, лече- ния смешанных (бактериальных, грибковых) вла- галищных инфекций и восстановления нормаль- ного биоценоза влагалища, так как риск гипоти- реоза у зрелых новорожденных мал. В случае не- доношенности гипотиреоз встречается чаще (независимо от лечения йодсодержащими препа- ратами), поэтому у таких новорожденных контроль уровня гормонов щитовидной желе- зы рекомендуется в любом случае.
В эти же сроки беременности для профилактики септических осложнений после операции кесаре- во сечение бетадин использовали интравагиналь- но. Наряду с хорошими результатами по сниже- нию послеоперационных осложнений различной локализации отмечено отсутствие каких-либо осложнений, связанных с использованием этого препарата, как для матери, так и для плода и но- ворожденного [15].
Анализ родового травматизма у женщин, полу- чавших предродовую санацию, позволил устано- вить, что в основной группе родовой травматизм наблюдался у 14 (17,5±4,2%) пациенток: разрывы промежности I степени — в 6 (7,5±2,9%) случаях, разрывы промежности II степени — в 2 (2,5±1,7%), разрывы влагалища — в 6 (7,5±2,9%). В то же время в группе сравнения (без предродовой сана- ции влагалища) родовой травматизм наблюдался в 16 (53,3±9,1%) случаях: разрывы промежности I степени — у 7 (23,3±7,7%), II степени — у 3 (10,0±5,5%), разрывы влагалища — у 6 (20,0±7,3%) женщин.
Темпы и характер заживления ран в послеродо- вом периоде также различались в обследованных группах. Среди родильниц основной группы с травмой промежности заживление ран первичным натяжением произошло у всех 8 пациенток, в то время как в группе сравнения у 4 женщин наблю- дали инфильтрацию, гиперемию раны промежно- сти, у 2 — частичное расхождение раны, у 2 — полное расхождение раны и заживление вторич- ным натяжением.
Проведенные исследования подтверждают высо- кую частоту травм промежности и инфекционных осложнений при заживлении ран промежности у несанированных беременных, что диктует необ- ходимость профилактики этой патологии до родо- разрешения. Бетадин оказался высокоэффектив- ным препаратом. Отсутствие влияния на нор- мальную микрофлору влагалища позволяет ши- роко использовать данное лекарственное сред- ство для подготовки к инвазивным вмешатель- ствам в акушерстве и гинекологии без риска воз- никновения дисмикробиоценоза вагинальной мик- рофлоры.
На основании проведенного исследования сфор- мулируем следующие выводы:
1. Бетадин безопасен и не противопоказан к применению у беременных и родильниц.
2. Вагинальные суппозитории бетадина практи- чески не вызывают побочных эффектов и ал- лергических реакций.
3. Высокая эффективность бетадина и отсут- ствие резистентности к препарату позволяет широко применять его в акушерскогинекологической практике для профилактики и лечения инфекционно-воспалительных заболеваний влагалища у беременных женщин и для неспецифической профилактики при проведении внутриматочных вмешательств.
4. Применение этого препарата является эффективным способом профилактики септиче- ских осложнений после родов через есте- ственные родовые пути, а также после опера- тивного родоразрешения.
5. Предродовая профилактика снижает частоту возникновения в родах травматического повреждения тканей родового канала и улучшает результаты заживления послеродовых травм.
6. Бетадин доступен по цене, является экономически обоснованным как препарат выбора для предродовой санации в амбулаторных усло- виях и в акушерских стационарах за счет сни- жения последующих затрат на лечение по- слеродовых или послеманипуляционных осложнений.
Литература
1. Адаскевич В.П. Заболевания, передаваемые половым путем. – Витебск, 1997.
2. Грищенко О.В., Яковлева Т.А., Сторчак А.В. //Репродуктивное здоровье женщины. —2005.—№ 2 (22). — С. 72—74.
3. Занько С.Н. // Мед. новости. —2005. — № 3. –С.52—59.
4. Захарова Ю.В. и др. // Актуальные вопросы современной медицины. – 1997. – Т.1. — С.406.
5. Панкратов В.Г. // Рецепт. — 2004. —№ 5. — С. 119—127.
6. Потапов В.А., Сирокваша Е.А., Рубан Н.К.,Гринченко Т.Н. // Репродуктивное здоровье женщины.— 2005. — № 1. — С.219—222.
7. Радзинский В.Е., Пиддубный М.И., Багаева Т.В. и др. // Гинекология. — 2002. — Т.4, № 2.— С.1—3.
8. Сафина М.Р., Солошкина Д.А. // Мед. новости.— 2006. — № 7. – С. 74—76.
9. Тютюник В.Л. // Фарматека. — 2005. — №2.—С.20—24.
10. Bercelman R.L., Holland B.W., Anderson R.L. // J. of Clin. Microbiology. —1982.—N 4. —P.635—39.
11. Eason А. et al. // Amer. J. of Obstetr. and Gynecol. —1997.—V.176. —P.1011—1016.
12. Gimes G., Peter F. // Acta pharmaceutica Hungarica: A Magyar Gyogyszereszeti Tarsasag folyoirata. — 1997.—V. 67, evf. 6. — P. 249—253.
13. Lacey R.W., Catto A. // Postgrad. Med. J. —1993.—V.69. — P.78—83.
14. Michel D., Zach G.A. // Dermatology. — 1997. —V.195 (Suppl. 2). — P.36—41.
15. Rossali V. S., Zurawski J. // Оbstetrics & Gynecology. —2005. —V. 105. —P. 1024—1029.
16. Simmons A. // Dermatology. —1997. —V. 195, Suppl. l2. —P.85—88.
17. Socal D.S., Hermonat P.L. // Sex. Transmis. Diseases. —1995. —V.22 (1). — P.22—24.
Медицинские новости. – 2007. – №13.
Источник: www.mednovosti.by













Комментировать